- 8. Серная кислота
- 7. Соляная кислота
- 6. Трифторметансульфоновая кислота
- 5. Фторсульфоновая кислота
- 4. Хлорная кислота
- 3. Фторированная карборановая кислота
- 2. Волшебная кислота
- 1. Фтороантимоновая кислота
- Азотная кислота
- Минеральные кислоты [1984 Штрубе В. — Пути развития химии. Том 1. От первобытных времен до промышленной революции]
- Основы технологии минеральных кислот (на примере серной)

Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Константа диссоциации кислоты (Ka): иногда известная как константа ионизации кислоты или просто кислотная константа — это количественно выраженная сила кислоты в водном растворе.
С одной стороны, когда pH или «мощность водорода» определяют уровень основности или, в этом случае, кислотность любого раствора, константа диссоциации кислоты говорит нам о концентрации ионов водорода [H +] или ионов гидрония [H3O +] в растворе.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
pKa = -log10Ka.
Чем сильнее кислота, тем ниже значения pKa.
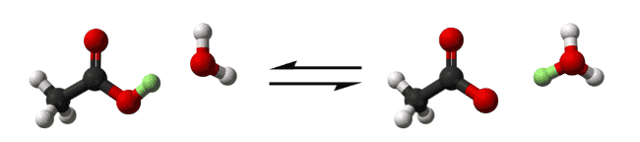 Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)
Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
Суперкислота. Суперкислота — это просто кислота с уровнем кислотности более 100% -ной серной кислоты с функцией кислотности Гаммета ниже -12. В более технических терминах его можно определить как среду, в которой химический потенциал протона выше, чем в чистой серной кислоте.
8. Серная кислота
 Серная кислота (98%) на листе бумаги
Серная кислота (98%) на листе бумаги
Химическая формула: H2SO4
pKa значение: -3
Ho значение: 12
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой.
Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка.
Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота

Химическая формула: HCl
pK A значение: -5,9
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты.
Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой.
Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
 Трифторметансульфоновая кислота
Трифторметансульфоновая кислота
Химическая формула: CF 3 SO 3 H
pK A значение: -14,7
Трифторметансульфоновая кислота, наиболее известная как трифликовая кислота, была впервые синтезирована / обнаружена Робертом Хазелдином, британским химиком, еще в 1954 году. Она известна своей замечательной химической и термической стабильностью. В то время как другие сильные кислоты, такие как азотная и хлорная кислоты, подвержены окислению, трифликовая кислота — нет.
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
5. Фторсульфоновая кислота
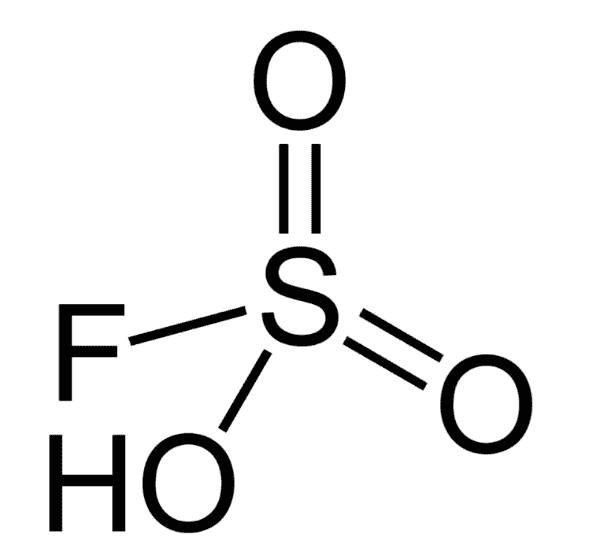
Химическая формула: HSO 3 F
H O значение: -15.1
pK A значение: -10
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный.
HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота

Химическая формула: HClO 4
pK A значение: -10, -15.2
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире.
Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
3. Фторированная карборановая кислота
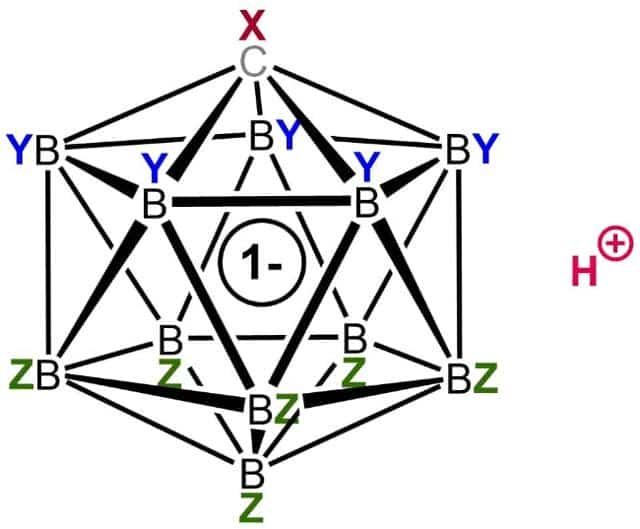 Общая структура карбоновой кислоты
Общая структура карбоновой кислоты
Химическая формула: H (CHB 11 F 11)
H o значение: -18
pK a значение: -20
Карборановые кислоты являются одной из самых сильных групп суперкислот, известных человеку, немногие из которых, как считается, имеют значение функции кислотности Гамметта, равное -18, что более чем в миллион раз выше уровня кислотности, чем чистая (100%) серная кислота.
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
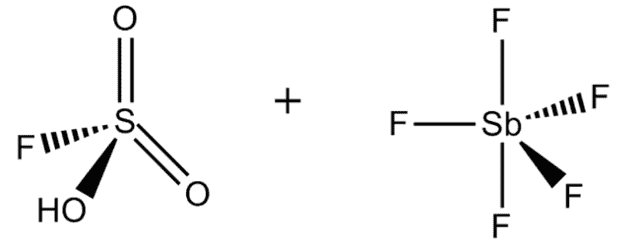
Химическая формула: FSO 3 H · SbF 5
H o значение: -23
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
1. Фтороантимоновая кислота
Химическая формула: H 2 FSbF 6
H o значение: -15 (в чистом виде), -28 (с> 50 мол.%)
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире».
Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).
Азотная кислота
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
- В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
- NH3 + O2 → (кат. Pt) NO + H2O
- KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
- Кислотные свойства
- CaO + HNO3 → Ca(NO3)2 + H2O
- HNO3 + NaOH → NaNO3 + H2O
- Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑
- Термическое разложение
- Реакции с неметаллами
- Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.
- HNO3(конц.) + C → CO2 + H2O + NO2
- HNO3(конц.) + S → H2SO4 + NO2 + H2O
- HNO3(разб.) + S → H2SO4 + NO + H2O
- HNO3(конц.) + P → H3PO4 + NO2 + H2O
- Реакции с металлами
- Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
- Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
- С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
- Al + HNO3(конц.) ⇸ (реакция не идет)
- При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
- Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте. HNO3 → (hv) NO2 + H2O + O2
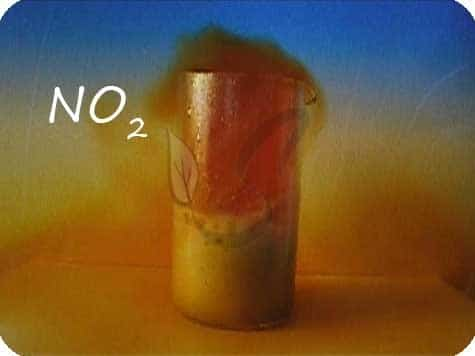
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
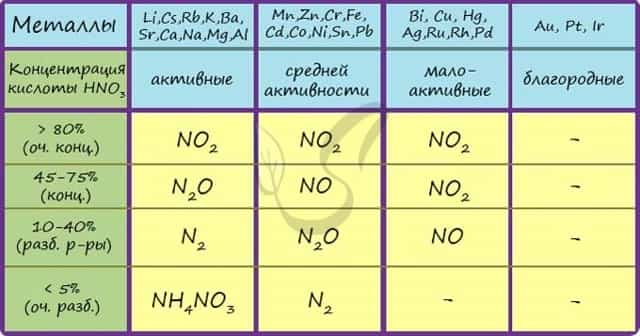
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
- Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
- Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
- В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
- MgO + HNO3 → Mg(NO3)2 + H2O
- Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O
- Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
- Реакции с металлами, основаниями и кислотами
- Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
- Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
- AgNO3 + KCl → AgCl↓ + KNO3
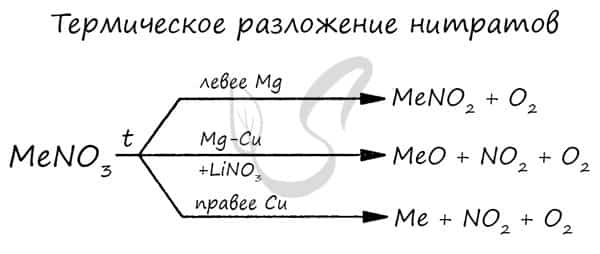
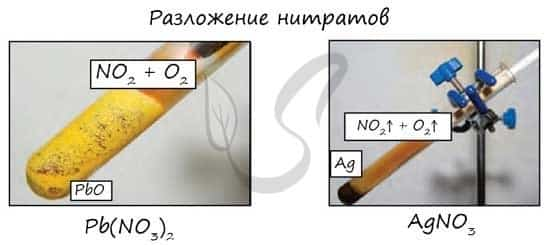
- Разложение нитратов
- Pb(NO3)2 → (t) PbO + NO2 + O2
- NaNO3 → (t) NaNO2 + O2
- Cu(NO3)2 → (t) CuO + NO2 + O2
- PtNO3 → (t) Pt + NO2 + O2
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.
Минеральные кислоты [1984 Штрубе В. — Пути развития химии. Том 1. От первобытных времен до промышленной революции]
Новости Библиотека Таблица эл-тов Биографии Карта сайтов Ссылки О сайте
Третье большое достижение химии XIII в.- получение минеральных (неорганических) кислот. Первые упоминания о серной и азотной кислотах встречаются в византийской рукописи XIII в. [13, с. 75].
Еще в древности было замечено, что при нагревании квасцов или купороса выделяются «кислые пары». Однако получение серной кислоты было впервые освоено лишь в конце XIII в. В книгах Гебера* излагается опыт получения серной и соляной кислот, а также царской водки [59].
* ()
Серная кислота долгое время применялась лишь как реактив в лабораториях, а со второй половины XVIII в. ее использовали в ремесленной практике — вначале при окраске веществ, а затем также для отбеливания. В 1744 г. саксонский горный советник Барт из Фрейберга открыл процесс сульфирования индиго* и впервые применил его для окраски шерсти.
В связи с этим спрос на серную кислоту непрерывно увеличивался и появились рациональные способы ее производства. И. X. Бернхардт и X. И. Кёлер организовали несколько сернокислотных заводов, главным образом в Саксонии. Эти предприятия поставляли серную кислоту во Франкфурт, Бремен, Нюрнберг, а также за пределы Германии. В конце XVIII в.
только в Рудных горах работало 30 сернокислотных заводов. Почти одновременно такие же заводы появились в Богемии и Гарце. Наиболее крупные предприятия, производившие серную кислоту, принадлежали фабриканту Иоганну Давиду Штарку из Пльзеня.
Штарк — опытный специалист по хлопковому волокну — впервые понял важное значение серной кислоты как вспомогательного материала при отбеливании хлопка [13, с. 140 и сл.].
* ()
 Получение серной кислоты при перегонке купороса; впервые описано и иллюстрировано Иоганном Христианом Бернхардтом
Получение серной кислоты при перегонке купороса; впервые описано и иллюстрировано Иоганном Христианом Бернхардтом
Бурное развитие текстильных фабрик в эпоху промышленной революции, осуществлявшееся благодаря созданию ткацких и прядильных станков, стало возможным лишь в связи с применением новых химических эффективных методов отбеливания и окраски тканей. Первая английская фабрика серной кислоты была создана в Ричмонде (около Лондона) д-ром Бардом в 1736 г.
На ней в 50 стеклянных сосудах изготовлялось около 200 л серной кислоты в сутки. Спустя 10 лет (в 1746 г.) Рёбук и Гарбет значительно усовершенствовали это производство: вместо стеклянных баллонов они стали применять свинцовые камеры. Фестер сообщал, что на некоторых сернокислотных заводах действовало в то время до 360 свинцовых камер. Только в Глазго и Бирмингеме в конце XVIII в.
работало уже восемь таких предприятий.
Получение серной кислоты в 1760 г. сжиганием серы в присутствии селитры. В 1800 г. стеклянные баллоны заменили свинцовыми камерами
В 1750 г. Хоум из Эдинбурга установил, что серная кислота может применяться как заменитель кислого молока для подкисления при отбеливании льняных холстов и хлопка. Применять серную кислоту было выгоднее, чем кислое молоко. Во-первых, серная кислота стоила дешевле, а во-вторых, отбеливание с помощью серной кислоты позволило сократить продолжительность процесса от 2-3 недель до 12 ч.
В отличие от серной кислоты азотная кислота значительно раньше стала применяться в ремесленной практике. Она была ценным продуктом, широко используемым в металлургии благородных металлов. В Венеции — одном из крупнейших культурных и научных центров эпохи Возрождения — азотная кислота применялась еще в XV в.
для выделения золота и серебра [60, с. 31]. Вскоре другие страны, такие, как Франция, Германия и Англия, последовали этому примеру. Это стало возможным благодаря тому, что величайшие технологи эпохи Возрождения — Бирингуччо [61], Агрикола [62] и Эркер [63] — описали способы получения азотной кислоты.
Согласно этому описанию, селитру вместе с квасцами или купоросом помещали в глиняные колбы, которые затем рядами устанавливали в печи и нагревали. «Кислые» пары конденсировались в специальных приемниках.
Подобный способ производства азотной кислоты часто применялся затем в горном деле, металлургии и при получении других химических продуктов с помощью перегонки. Однако установки для перегонки стоили в то время очень дорого, поэтому вплоть до XVIII в. их использовали для иных целей. В XVIII в.
в Голландии функционировала громадная фабрика, производившая в год примерно 20 000 фунтов азотной кислоты [64]. С 1788 г. азотная кислота наряду с другими продуктами изготовлялась и в Баварии (в местечке Марктредвитц) на химической фабрике, основанной Фикенчером.
Технология производства азотной кислоты существенно не менялась вплоть до конца XVIII в. Реторты изготовляли из стекла и металла, часто покрытого эмалью. В специальную печь помещали от 24 до 40 реторт сразу.
Различали азотную кислоту первой, второй и третьей степени крепости.
Ее применяли для различных целей: выделения благородных металлов, при окраске кошенилью, для обработки латуни, в скорняжном деле, при изготовлении головных уборов, гравировке по меди и т. п. [13, с. 144 и сл.].
До того как в XVI в. была открыта соляная кислота, царскую водку* получали, растворяя нашатырь в азотной кислоте. С помощью азотной кислоты и царской водки удавалось добиться довольно высокой степени извлечения благородных металлов из руд. Это явление алхимики использовали как «доказательство» осуществления трансмутаций.
Они объясняли повышение выхода благородных металлов тем, что в результате трансмутации якобы появляется новое вещество — серебро или золото.
Сложившаяся в эпоху Возрождения «экспериментальная философия» также придавала особое значение «крепкой водке»; некоторые химические процессы, которые осуществлялись с использованием этого соединения, подтверждали атомистические представления.
* ()
О соляной кислоте упоминали еще Либавий [65, 66] и Василий Валентин [67]. Однако первое подробное описание химических процессов получения соляной кислоты оставил лишь Глаубер [68]. Соляную кислоту получали из поваренной соли и купороса.
Хотя Глаубер писал о возможности разнообразных областей применения соляной кислоты (в частности как приправы к еде), спрос на нее долгое время был невелик. Он значительно вырос лишь после того, как химики разработали методику отбеливания тканей с помощью хлора.
Кроме этого, соляную кислоту использовали для получения желатина и клея из костей и для производства берлинской лазури.
 Агрикола (способствовал применению химии в горном деле и металлургии).*
Агрикола (способствовал применению химии в горном деле и металлургии).*
* ()
Основы технологии минеральных кислот (на примере серной)
Кислотами называются химические соединения, содержащие в своём составе атомы водорода, способные замещаться на атомы металлов. В воде большинство кислот (НА) распадается (диссоциирует) на ионы водорода (Н+) и кислотного остатка (А-).
НА Н+ + А-
По степени диссоциации в воде различают сильные, практически полностью распадающиеся на ионы (азотная, соляна, серная), средние (фосфорная, плавиковая) и слабые, практически не диссоциирующие в воде кислоты (уксусная, борная). Кислоты можно обнаружить по изменению цвета некоторых веществ – индикаторов. Например, лакмус в кислотах – красный, фенолфталиен – бесцветный, метилоранж – оранжевый.
Кислоты оказывают сильное действие на организм человека и животных, т.к. обладают водоотнимающим действием и, изменяя щелочную реакцию протоплазмы живой клетки на кислую, осаждают белки. Действие кислоты на живой организм зависит от вида и концентрации кислоты. Под действием кислот может происходить раздражение и полное разрушение тканей.
В контакте с кислотами многие металлы подвергаются коррозии. Для защиты от разрушения применяют стойкие к действию кислот металлы, сплавы, силикатные и полимерные материалы. Для эти х же целей в кислоты иногда вводят специальные вещества – ингибиторы, которые уменьшают или устраняют коррозионное действие кислоты. Различают органические и неорганические кислоты.
По масштабам производства неорганические кислоты значительно превосходят органические. Они широко применяются во многих отраслях промышленности. Среди неорганических кислот наибольшее распространение в народном хозяйстве получила серная кислота.
Серная кислота является одним из основных продуктов химической промышленности и широко применяется во многих производствах. Она принадлежит к числу сильных неорганических кислот и является самой дешёвой из них (более чем в 2 раза дешевле азотной и соляной кислот).
Основное количество серной кислоты расходуется на производство минеральных удобрений (суперфосфата, сульфата аммония, нитрофоса, нитрофоски и др.). Вторым по величине потребителем является нефтепереработка, где серная кислота расходуется для очистки нефтепродуктов.
Большие количества кислоты используются в металлургии цветных металлов, в гальванотехнике, в производстве других кислот (соляной, фосфорной, плавиковой, борной, хромовой, уксусной, лимонной и др.), для получения сульфатов металлов, простых и сложных эфиров, крахмала, сахара, для дубления кож, для снаряжения аккумуляторов и многих других целей.
В смеси с азотной кислотой серная кислота используется для нитрования органических соединений при получении взрывчатых веществ и красителей.
В технике под серной кислотой понимают любые смеси оксида серы (VI) с водой. Состав такой «серной кислоты» можно отразить формулой
x H2O + y SO3 (где x,y > 0).Если соотношение > 0 – имеют дело с водным раствором серной кислоты, если 0 – с олеумом, раствором оксида серы (VI) в серной кислоте.
Безводная серная кислота или моногидрат при 200С представляет собой маслянистую жидкость с плотностью 1820 кг/м3. Температура кристализации моногидрата +10, 450С, кипения +296,20С при атмосферном давлении.
С водой и оксидом серы (VI) серная кислота смешивается в любых соотношениях, образуя промежуточные соединения состава H2SO4*nH2O ( где n=4.2,1) и H2SO4*mSO3 (где m= 1,2).
Рассматривая химические свойства серной кислоты, следует различать поведение разбавляемой и концентрированной кислот.
Так, разбавленная кислота реагирует со всеми (за исключением свинца) металлами, стоящими в ряду активности правее водорода.
На поверхности свинца в контакте с разбавленной серной кислотой образуется плотная нерастворимая в кислоте плёнка сульфата, препятствующая дальнейшему растворению металла.
Концентрированная же серная кислота, обладая сильным окислительным действием, реагирует с металлами не непосредственно, а через промежуточную стадию образования оксида. В результате взаимодействия образуются сульфаты соответствующих металлов, оксид серы (IV) и вода.
По действием концентрированной кислоты легко (особенно при нагревании) растворяются такие металлы, стоящие в ряду активности после водорода, как медь, ртуть, серебро и другие.
В то же время железо, хром, алюминий и даже кальций не разрушаются концентрированной кислотой, т.к.
образующиеся на поверхности этих металлов оксидные плёнки имеют более плотную структуру и препятствуют непосредственному контакту металлов с кислотой. Это явление получило название пассивирования.
Концентрированная кислота и олеум отличаются высоким сродством к воде. При смешивании их с водой выделяется большое количество тепла. Сильное водоотнимающее действие серной кислоты проявляется в её способности поглощать пары воды из воздуха. На этом основано применение концентрированной серной кислоты для сушки газов.
Многие органические соединения в контакте с концентрированной серной кислотой, теряя воду, обугливаются.
Устойчивыми к действию серной кислоты являются эмали (до температуры кипения растворов любых концентраций, винипласт (до 600С при действии 80%-ной H2SO4), полиизобутилен (до 20-600С в зависимости от концентрации кислоты), полиэтилен (до 800С при действии 70%-ной кислоты), фторопласт – 4 (до 2500С). При нагревании до 4000С серная кислота практически полностью диссоциирует на воду о оксид серы (VI).
- Серную кислоту в настоящее время производят двумя способами: контактным и нитрозным, или башенным.
- В основе контактного способа лежит реакция окисления оксида серы (IV) в оксид серы (VI), протекающая на поверхности твёрдого катализатора
- 2 SO2 + O2 2SO3 + Q1
- Образовавшийся оксид серы (VI), поглощаясь водой, превращается в серную кислоту
- SO3 + H2O H2SO4 +Q2
- Сущность нитрозного способа состоит в окислении оксида серы (IV) смесью оксидов азота NO2 и N2O3 в присутствии воды. Не разбирая подробно механизма этого сложного процесса, представим его следующей схемой:
- SO2 + NO2 (N2O3) + H2O H2SO4 + NO (2NO)
Нитрозный способ по сравнению с контактным обладает рядом недостатков: во первых, он не позволяет получить серную кислоту с концентрацией больше 75%, во-вторых, получаемая кислота содержит много примесей и пригодна только для производства минеральных удобрений, наконец, производство кислоты нитрозным способом связано с выбросом в атмосферу большого количества оксидов азота, оказывающих вредное воздействие на окружающую среду. В связи с этим в нашей стране прекращено строительство сернокислых заводов, работающих по нитрозному способу, и более 90% производимой серной кислоты получают на контактных установках.
В качестве сырья для получения серной кислоты, в принципе, могут быть использованы любые вещества, содержащие серу.
Чаще других используется серный колчедан FeS2 (около 45% производимой серной кислоты), элементарная сера, отходящие газы заводов цветной металлургии и газы нефтедобычи и нефтепереработки.
В последние годы наметилась тенденция увеличения доли отходящих газов цветной металлургии и попутных газов нефтедобычи в общем балансе сырья для производства серной кислоты.
Технологический процесс производства серной кислоты контактным способом включает четыре основные стадии: обжиг серусодержащего сырья, очистка обжигового газа, контактное окисление оксида серы (IV) и абсорция оксида серы (VI).
Учитывая, что основным источником сырья для производства серной кислоты в нашей стране является серный колчедан, принципиальную схему контактного способа производства серной кислоты упрощённо можно представить следующим образом (рис.1).
- 1) обжиг серосодержащего сырья;
- 2) очистка обжигового газа от примесей;
- 3) контактное окисление оксида серы (IV) в оксид серы (VI);
- 4) поглощение оксида серы VI водой и получение серной кислоты.
- Q Пыль Примеси Q Катализатор
- Воздух
- Колчедан
- Разбавленная серная кислота
- Огарок
- Концентрированная серная кислота
- Рис. 1 Принципиальная схема производства серной кислоты
Обжиг серного колчедана, протекающий по уравнению реакции 4 FeS2 + 1102 = 2 Fe2O3 + 8SO2 + Q, является типичным гетерогенным процессом. Для его осуществления используются печи трех типов: механические полочные, печи пылевидного обжига и печи кипящего слоя (КС).
Последние являются наиболее эффективными и постепенно становятся основным видом оборудования для обжига серного колчедана.
Оптимальные условия обжига колчедана выбираются с учётом установленных экспериментально зависимостей скорости реакции, от размеров частиц обжигаемого колчедана, температуры и потока воздуха, подаваемого в печь.
На второй стадии обжиговый газ очищается от механических примесей и оксидов селена и мышьяка в скрубберах и электрофильтрах (стадия 2). Контактное окисление оксида серы (IV) в оксид серы (VI) (стадия 3) является обратимым, гетерогенно-каталитическим, экзотермическим процессом, протекающим с уменьшением газового объёма.
В реальных условиях процесс контактного окисления ведут в политермическом режиме, начиная при относительно высоких температурах и заканчивая при относительно низких температурах. В промышленности нашли распространение полочные контактные аппараты и аппараты с кипящим слоем катализатора.
Наиболее эффективными катализаторами оказались ванадиевые контактные массы, состоящие из оксида ванадаия (V), нанесённого на пористые носители.
Заключительная стадия (стадия 4) процесса осуществляется в скрубберах с насадкой, орошаемых в начале олеумом, а затем 98,3%-ной серной кислотой, имеющей наивысший коэффициент поглощения SO3. Процесс абсорции проводят при температурах 30…600С при атмосферном давлении. Качество выпускаемой в настоящее время серной кислоты регламентируется четырьмя государственными стандартами.
В таблице 2.1. приведены некоторые технические требования, предъявляемые к серной кислоте государственными стандартами 2184-77 (Кислота серная техническая), 667-73 (Кислота серная аккумуляторная), 4204-77 (Кислота серная) и 14262-78 (Кислота серная особой чистоты).
В каждом из ГОСТов подробно описываются методы, с помощью которых определяются физико-химические свойства серной кислоты.
Таблица 1. – Физико-химические свойства серной кислоты
| ГОСТ | Показатели Физико-химические свойства серной кислоты | Внешний вид | Массовая доля моногидрата,% | Массовая доля свободного окисла серы (VI), % | Массовая доля железа, %, не более | Массовая доля остатка после прокаливания, %, не более |
| 2184-77 | 1. Контактная улучшенная (высший сорт) | — | 92,5-94,0 | — | 0,007 | 0,02 |
| 2. Контактная улучшенная (1-й сорт) | — | 92,5-94,0 | — | 0,015 | 0,03 | |
| 3. Контактная техническая (1-й сорт) | — | 92,5 | — | 0,02 | 0,05 | |
| 4. Контактная техническая (2-й сорт) | — | 92,5 | — | 0,1 | — | |
| 5. Олеум улучшенный (высший сорт) | Механических примесей нет | — | 0,007 | 0,02 | ||
| 6. Олеум улучшенный (1-й сорт) | Маслянистая жидкость с опалесценцией | — | 0,01 | 0,03 | ||
| 7. Олеум технический | — | — | — | — | ||
| 8. Башенная | — | — | 0,05 | 0,3 | ||
| 9. Регенерированная | — | — | 0,2 | 0,4 | ||
| 667-73 | 10. Аккумуляторная (высший сорт) | — | 92-94 | — | 0,005 | 0,02 |
| 11. Аккумуляторная (1-й сорт) | — | 92-94 | — | 0,006 | 0,03 | |
| 12. Аккумуляторная (2-й сорт) | — | 92-94 | — | 0,012 | 0,04 | |
| 4204-77 | 13. Реактивная (ч) | — | — | — | — | — |
| 14. Реактивная (х.ч.) | — | — | — | — | — | |
| 15. Реактивная (ч.д.а.) | — | — | — | — | — | |
| 14262-78 | 16.Особой чистоты (осч 20-4) | Неотличима от дистиллированной воды в пробирке диаметром 20 мм | 93,5-95,5 | — | 2*10-6 | 5*10-4 |
| 17. Особой чистоты (осч 11-5) | 93,5-95,5 | — | 3*10-6 | 5*10-4 | ||
| 18. Особой чистоты (осч 5-5) | 93,5-95,5 | — | 1*10-5 | 5*10-4 |






