- Кремниевая (силиконовая) долина
- Основное и возбужденное состояние кремния
- Природные соединения
- Получение
- Химические свойства
- Оксид кремния IV — SiO2
- Кремниевая кислота
- Кремний — он нужен всем
- История
- Свойства
- Запасы, руды, минералы
- Сплавы, получение кремния
- Плюсы и минусы
- Применение
- Купить
- Кремний | это… Что такое Кремний?
- История
- Происхождение названия
- Нахождение в природе
- Получение
- Физические свойства
- Электрофизические свойства
- Химические свойства
- Применение
- Биологическая роль
- См. также
- Примечания
- КРЕМНИЙ
- Применение
- Свойства
- Диоксид кремния (кремниевый ангидрид)
- Кремниевые кислоты
- Силикаты (соли кремниевых кислот)
- Жидкое стекло
- Гидриды
- I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.

Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь ?

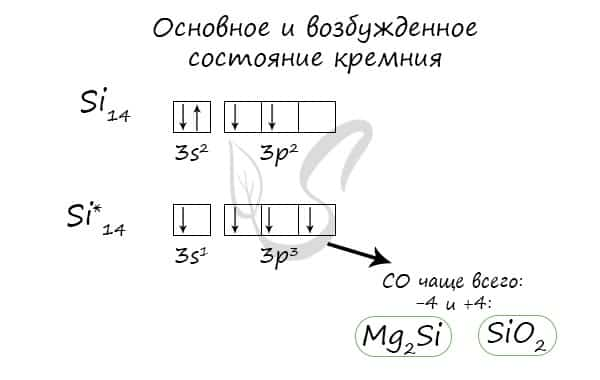
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe3+ — цитрин
- SiO2 с примесью Fe2+ и Fe3+ — аметист

Получение
- В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
- SiO2 + C → (t) Si + CO2↑
- SiO2 + Al → (t) Si+ Al2O3
- В лабораторных условиях мелкий белый песок прокаливают с магнием:
- SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
- Si + Cl2 → (t) SiCl4
- Si + C → (t) SiC
- Si + O2 → (t) SiO2
- Si + O2 → (t = 1200 °C) SiO
- Реакции с металлами
- Реакция с щелочами
При обычных условиях без нагревания кремний реагирует только со фтором. Si + F2 → SiF4 При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.

В подобных реакциях кремния проявляет свои окислительные способности. Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи. KOH + Si → K2SiO3 + H2↑
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
- Получение
- В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
- Si + O2 → SiO2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
Na2SiO3 + CH3COOH → CH3COONa + H2SiO3↓
H2SiO3 → SiO2 + H2O

Химические свойства
- Реакции с кислотами
- Реакции с основными оксидами и щелочами
- С карбонатами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью). SiO2 + HF → SiF4 + H2O
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты. MgO + SiO2 → MgSiO3 NaOH + SiO2 → Na2SiO3 + H2O 
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами. K2CO3 + SiO2 → K2SiO3 + CO2↑
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
- LiOH + SiO2 → Li2SiO3 + H2O
- Li2SiO3 + HCl → LiCl + H2SiO3↓
- Химические свойства
- Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
- H2SiO3 → H2O + SiO2

Кремний — он нужен всем
Главная › Металлы
02.09.2020
Можно перепутать кремний, химический элемент, и кремень — минерал, которым пользовались наши далекие предки.
История
В истории открытия неметалла много знаменитых имен. Ж. Гей-Люссак и Л. Тенар нашли новый элемент и выделили его в чистом виде. Берцелиус получил новый элемент хорошей чистоты и назвал его «силиций». А русский химик Гесс предложил называть новый элемент кремнием (от древне-греческого кремнос — гора).
 Поликристаллический кремний (99,9 %)
Поликристаллический кремний (99,9 %)
Свойства
Существует в двух модификациях (видах): аморфной и кристаллической.
Химические свойства элемента:
- Химически малоактивен, «оживляется» только в присутствии газообразного фтора.
- При нагреве до 400-500°С происходит реакция с кислородом, образуется SiO2, диоксид кремния.
- Карборунд (SiC), очень твердый и химически малоактивный материал получают при высокой (более 1000°С) температуре.
- При взаимодействии с металлами образует силициды. Общая формула силицидов MenSim.
| Кремний/Silicium (Si), 14 |
| [28,086][комм 1][1] а. е. м. (г/моль) |
| [Ne] 3s2 3p2; в соед. [Ne] 3s 3p3 (гибридизация) |
| 132 пм |
| 111 пм |
| 42 (+4e), 271 (−4e) пм |
| 1,90 (шкала Полинга) |
| −4, 0, +2; +4 |
| 786,0 (8,15) кДж/моль (эВ) |
| 2,33 г/см³ |
| 1414,85 °C (1688 K) |
| 2349,85 °C (2623 K) |
| 50,6 кДж/моль |
| 383 кДж/моль |
| 20,16[2] Дж/(K·моль) |
| 12,1 см³/моль |
| кубическая, алмазная |
| 5,4307 Å |
| 645 ± 5[3] K |
| (300 K) 149 Вт/(м·К) |
| 7440-21-3 |
Рекомендуем: МЕДЬ — фундамент цивилизации
Запасы, руды, минералы
Основной минерал кремния — песок. Кроме него, существуют:
- кварц;
- кварциты;
- полевые шпаты;
- силикаты;
- алюмосиликаты.
Нашего героя в земной коре очень много (до 30% по массе). После углерода это второй элемент (по распространенности на планете).

Многие кремниевые соединения являются драгоценными и полудрагоценными камнями. Это аквамарин, изумруд, топаз, аметист, яшмы и топазы.
Сплавы, получение кремния
Silicium не может образовывать сплавы, это привилегия металлов. Зато он способен растворять многие металлы. Такие соединения, силициды, используют в промышленности.
К ним относят:
- силумин;
- ферросилиций;
- сплав РС-1004;
- сплав РС 1714;
- сплав РС 4800;
- сплав РС 5406.
Способы получения кремния:
- В печах шахтного типа восстановлением SiO2 коксом (технически чистый Silicium).
- Дальнейшую очистку продукта проводят по реакции SiCl4+2H2 = Si+4HCl (восстановление тетрахлорида водородом при высокой температуре).
Сверхчистый продукт (поликремний) для производства полупроводников и солнечных элементов очищают дополнительно.
Плюсы и минусы
Достоинств у кремния предостаточно. Это:
- Доступность в добыче минералов, легкость получения продукта.
- Наш герой нетоксичен, это дает возможность использовать его в любой отрасли промышленности.
- Электро-и радиотехника не может обойтись без полупроводниковых свойств неметалла.
- Кремний способен образовывать множество полезных и разнообразных соединений.
Применение

Области применения кремния трудно перечислить:
- стекла;
- цемент;
- зажигалки;
- оптоволокно;
- керамика;
- микропроцессоры.
- В любой зубной пасте есть Е551 — аморфный диоксид кремния.
- Большинство наших домов на 20-40%% состоят из кремниевых минералов.
- Как сырье технической чистоты Silicium применяют:
- В металлургии (как присадки, как раскислители в производстве чугуна и сталей).
- В производстве силанов и кремнийорганических материалов.
- В производстве солнечных батарей.
Синтетические SiC под названием муассанита с успехом заменяют алмазы в ювелирной промышленности.
Продукцией из песка, соды и извести стеклом — пользуются миллионы людей.
Купить
На металлургическом рынке продают кремний трех видов — технический, кристаллический, механический.
| Марка (вид) кремния, цена в руб/кг | Содержание основного элемента |
| Кр00 | Не менее 99% |
| Кр0; 300 | Не менее 98, 8% |
| Кр1; от 170 | Не менее 98% |
| Кр2; 180 | Не меньше 97% |
Стоимость товара у разных производителей может быть выше или ниже — ищите, где выгоднее.
Кремний — он нужен всем Ссылка на основную публикацию 

Кремний | это… Что такое Кремний?
| 14 | Кремний |
| 3s23p2 |
Кремний — элемент главной подгруппы четвёртой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14. Обозначается символом Si (лат. Silicium).
История
В чистом виде кре́мний был выделен в 1811 году французскими учёными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Происхождение названия
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др.-греч. κρημνός — «утёс, гора».
Нахождение в природе
Содержание кремния в земной коре составляет по разным данным 27,6—29,5 % по массе. Таким образом по распространённости в земной коре кремний занимает второе место после кислорода. Концентрация в морской воде 3 мг/л[2].
Чаще всего в природе кремний встречается в виде кремнезёма — соединений на основе диоксида кремния (IV) SiO2 (около 12 % массы земной коры). Основные минералы и горные породы, образуемые диоксидом кремния — это песок (речной и кварцевый), кварц и кварциты, кремень, полевые шпаты. Вторую по распространённости в природе группу соединений кремния составляют силикаты и алюмосиликаты.
Отмечены единичные факты нахождения чистого кремния в самородном виде[3].
Получение
«Свободный кремний можно получить прокаливанием с магнием мелкого белого песка, который представляет собой диоксид кремния:
При этом образуется бурый порошок аморфного кремния.»[4]
В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в руднотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9 % (основные примеси — углерод, металлы).
Возможна дальнейшая очистка кремния от примесей.
- Очистка в лабораторных условиях может быть проведена путём предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают газообразный моносилан SiH4. Моносилан очищают ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C.
- Очистка кремния в промышленных масштабах осуществляется путём непосредственного хлорирования кремния. При этом образуются соединения состава SiCl4 и SiCl3H. Эти хлориды различными способами очищают от примесей (как правило перегонкой и диспропорционированием) и на заключительном этапе восстанавливают чистым водородом при температурах от 900 до 1100 °C.
- Разрабатываются более дешёвые, чистые и эффективные промышленные технологии очистки кремния. На 2010 г. к таковым можно отнести технологии очистки кремния с использованием фтора (вместо хлора); технологии предусматривающие дистилляцию монооксида кремния; технологии, основанные на вытравливании примесей, концентрирующихся на межкристаллитных границах.
Содержание примесей в доочищенном кремнии может быть снижено до 10−8—10−6% по массе. Более подробно вопросы получения сверхчистого кремния рассмотрены в статье Поликристаллический кремний
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым.
В России технический кремний производится «ОК Русал» на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область); доочищенный по хлоридной технологии кремний производит группа «Nitol Solar» на заводе в г. Усолье-Сибирское.
Физические свойства
Кристаллическая структура кремния.
Кристаллическая решётка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твёрдость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен для инфракрасного излучения начиная с длины волны 1,1 мкм. Собственная концентрация носителей заряда — 5,81·1015 м−3 (для температуры 300 K).
Схематическое изображение зонной структуры кремния[5]
Электрофизические свойства
Элементарный кремний в монокристаллической форме является непрямозонным полупроводником. Ширина запрещённой зоны при комнатной температуре составляет 1,12 эВ, а при Т = 0 К составляет 1,21 эВ[6]. Концентрация собственных носителей заряда в кремнии при нормальных условиях составляет порядка 1,5·1010 см−3[7].
На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нём примеси.
Для получения кристаллов кремния с дырочной проводимостью в кремний вводят атомы элементов III-й группы, таких, как бор, алюминий, галлий, индий.
Для получения кристаллов кремния с электронной проводимостью в кремний вводят атомы элементов V-й группы, таких, как фосфор, мышьяк, сурьма.
При создании электронных приборов на основе кремния задействуется преимущественно приповерхностный слой материала (до десятков микрон), поэтому качество поверхности кристалла может оказывать существенное влияние на электрофизические свойства кремния и, соответственно, на свойства готового прибора. При создании некоторых приборов используются приёмы, связанные с модификацией поверхности, например, обработка поверхности кремния различными химическими агентами.
- Диэлектрическая проницаемость: 12[1]
- Подвижность электронов: 1200—1450 см²/(В·c).
- Подвижность дырок: 500 см²/(В·c).
- Ширина запрещённой зоны 1,205-2,84·10−4·T
- Продолжительность жизни электрона: 5 нс — 10 мс
- Длина свободного пробега электрона: порядка 0,1 см
- Длина свободного пробега дырки: порядка 0,02 — 0,06 см
Все значения приведены для нормальных условий.
Химические свойства
Подобно атомам углерода, для атомов кремния является характерным состояние sp3-гибридизации орбиталей.
В связи с гибридизацией чистый кристаллический кремний образует алмазоподобную решётку, в которой кремний четырёхвалентен.
В соединениях кремний обычно также проявляет себя как четырёхвалентный элемент со степенью окисления +4 или −4. Встречаются двухвалентные соединения кремния, например, оксид кремния (II) SiO.
При нормальных условиях кремний химически малоактивен и активно реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. Такая «неактивность» кремния связана с пассивацией поверхности наноразмерным слоем диоксида кремния, немедленно образующегося в присутствии кислорода, воздуха или воды (водяных паров).
- При нагревании до температуры свыше 400—500 °C кремний реагирует с кислородом с образованием диоксида SiO2, процесс сопровождается увеличением толщины слоя диоксида на поверхности, скорость процесса окисления лимитируется диффузией атомарного кислорода сквозь плёнку диоксида.
- При нагревании до температуры свыше 400—500 °C кремний реагирует с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHalogen4 и, возможно, галогенидов более сложного состава.
- С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12.
При температурах свыше 1000С °C можно получить соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiC (карборунд), который характеризуется высокой твёрдостью и низкой химической активностью.
Карборунд широко используется как абразивный материал.
При этом, что интересно, расплав кремния (1415 °C) может длительное время контактировать с углеродом в виде крупных кусков плотноспечённого мелкозернистого графита изостатического прессования, практически не растворяя и никак не взаимодействуя с последним.
Нижележащие элементы 4-й группы (Ge, Sn, Pb) неограниченно растворимы в кремнии, как и большинство других металлов. При нагревании кремния с металлами могут образовываться силициды.
Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов).
Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C).
Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
Особо следует отметить, что с железом кремний образует эвтектическую смесь, что позволяет спекать (сплавлять) эти материалы для образования ферросилициевой керамики при температурах заметно меньших, чем температуры плавления железа и кремния.
При восстановлении SiO2 кремнием при температурах свыше 1200 °C образуется оксид кремния (II) — SiO. Этот процесс постоянно наблюдается при производстве кристаллов кремния методами Чохральского, направленной кристаллизации, потому что в них используются контейнеры из диоксида кремния, как наименее загрязняющего кремний материала.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены ещё два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Для травления кремния наиболее широко используют смесь плавиковой и азотной кислот. Некоторые специальные травители предусматривают добавку хромового ангидрида и иных веществ. При травлении кислотный травильный раствор быстро разогревается до температуры кипения, при этом скорость травления многократно возрастает.
- Si+2HNO3=SiO2+NO+NO2+H2O
- SiO2+4HF=SiF4+2H2O
- 3SiF4+3H2O=2H2SiF6+↓H2SiO3
Для травления кремния могут использоваться водные растворы щёлочей. Травление кремния в щелочных растворах начинается при температуре раствора более 60 °C.
- Si+2KOH+H2O=K2SiO3+2H2↑
- K2SiO3+2H2O↔H2SiO3+2KOH
Применение
Технический кремний находит следующие применения:
- сырьё для металлургических производств: компонент сплава (бронзы, силумин); раскислитель (при выплавке чугуна); модификатор свойств металлов или легирующий элемент (например, добавка определённого количества кремния при производстве трансформаторных сталей уменьшает коэрцитивную силу готового продукта) и т. п.;
- сырьё для производства более чистого поликристаллического кремния и очищенного металлургического кремния (в литературе «umg-Si»);
- сырьё для производства кремнийорганических материалов, силанов;
- иногда кремний технической чистоты и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях;
- для производства солнечных батарей.
Монокристалл кремния, выращенный по методу Чохральского
Cверхчистый кремний преимущественно используется для производства одиночных электронных приборов (нелинейные пассивные элементы электрических схем) и однокристальных микросхем. Чистый кремний, отходы сверхчистого кремния, очищенный металлургический кремний в виде кристаллического кремния являются основным сырьевым материалом для солнечной энергетики.
Монокристаллический кремний — помимо электроники и солнечной энергетики используется для изготовления зеркал газовых лазеров.
Соединения металлов с кремнием — силициды — являются широкоупотребляемыми в промышленности (например, электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.). Силициды ряда элементов являются важными термоэлектрическими материалами.
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, применяемый в строительстве как сиккатив, а в пиротехнике и в быту для склеивания бумаги.
Получили широкое распространение силиконовые масла и силиконы — материалы на основе кремнийорганических соединений.
Биологическая роль
Для некоторых организмов кремний является важным биогенным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки.
Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10−2% кремния, костная ткань — 17·10−4%, кровь — 3,9 мг/л.
С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны.
Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов, при обработке кремнийсодержащих материалов угловой шлифовальной машиной («болгаркой») и т. д.
Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз. Чтобы не допустить попадания в лёгкие опасной пыли, следует использовать для защиты органов дыхания респиратор.
См. также
Примечания
- ↑ 1 2 Химическая энциклопедия: в 5-ти тт. / Редкол.:Кнунянц И. Л. (гл. ред.). — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 508. — 671 с. — 100 000 экз.
- ↑ J.P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ Металлический кремний в ийолитах Горячегорского массива, Петрология обыкновенных хондритов
- ↑ Глинка Н.Л. Общая химия. — 24-е изд., испр. — Л.: Химия, 1985. — С. 492. — 702 с.
- ↑ Р Смит., Полупроводники: Пер. с англ. — М.: Мир, 1982. — 560 с, ил.
- ↑ Зи С., Физика полупроводниковых приборов: В 2-х книгах. Кн. 1. Пер. с англ. — М.: Мир, 1984. — 456 с, ил.
- ↑ Коледов Л. А. Технологии и конструкции микросхем, микропроцессоров и микросборок: Учебное пособие//2-е изд., испр. и доп. — СПб.:Издательство «Лань», 2007. — С. 200—201. — ISBN 978-5-8114-0766-8
- Самсонов. Г. В. Силициды и их использование в технике. — Киев, Изд-во АН УССР, 1959. — 204 с. с илл.
- Кремний на Webelements
- Кремний в Популярной библиотеке химических элементов
КРЕМНИЙ
Содержание статьи
КРЕМНИЙ, Si (silicium), химический элемент IVA подгруппы (C, Si, Ge, Sn и Pb) периодической системы элементов, неметалл.
Кремний в свободном виде был выделен в 1811 Ж.Гей-Люссаком и Л.Тенаром при пропускании паров фторида кремния над металлическим калием, однако он не был описан ими как элемент. Шведский химик Й.
Берцелиус в 1823 дал описание кремния, полученного им при обработке калиевой соли K2SiF6 металлическим калием при высокой температуре, однако лишь в 1854 кремний был получен в кристаллической форме А.
Девилем.
Кремний – второй по распространенности (после кислорода) элемент в земной коре, где он составляет более 25% (масс.). Встречается в природе в основном в виде песка, или кремнезема, который представляет собой диоксид кремния, и в виде силикатов (полевые шпаты M[AlSi3O8] (M = Na, K, Ba), каолинит Al4[Si4O10](OH)8, слюды).
Кремний можно получить прокаливанием измельченного песка с алюминием или магнием; в последнем случае его отделяют от образующегося MgO растворением оксида магния в соляной кислоте. Технический кремний получают в больших количествах в электрических печах путем восстановления кремнезема углем или коксом.
Полупроводниковый кремний получают восстановлением SiCl4 или SiHCl3 водородом с последующим разложением образующегося SiH4 при 400–600° С. Высокочистый кремний получают выращиванием монокристалла из расплава полупроводникового кремния по методу Чохральского или методом бестигельной зонной плавки кремниевых стержней (см. также ЗОННАЯ ПЛАВКА).
Элементный кремний получают в основном для полупроводниковой техники, в остальных случаях он используется как легирующая добавка в производстве сталей и сплавов цветных металлов (например, для получения ферросилиция FeSi, который образуется при прокаливании смеси песка, кокса и оксида железа в электрической печи и применяется как раскислитель и легирующая добавка в производстве сталей и как восстановитель в производстве ферросплавов).
Применение
Наибольшее применение кремний находит в производстве сплавов для придания прочности алюминию, меди и магнию и для получения ферросилицидов, имеющих важное значение в производстве сталей и полупроводниковой техники. Кристаллы кремния применяют в солнечных батареях и полупроводниковых устройствах – транзисторах и диодах.
Кремний служит также сырьем для производства кремнийорганических соединений, или силоксанов, получаемых в виде масел, смазок, пластмасс и синтетических каучуков. Неорганические соединения кремния используют в технологии керамики и стекла, как изоляционный материал и пьезокристаллы. См. также КРЕМНИЙОРГАНИЧЕСКИЕ ПОЛИМЕРЫ.
| СВОЙСТВА КРЕМНИЯ | |
| Атомный номер | 14 |
| Атомная масса | 28,086 |
| Изотопы | |
| стабильные | 28, 29, 30 |
| нестабильные | 25, 26, 27, 31, 32, 33 |
| Температура плавления, °С | 1410 |
| Температура кипения, °С | 2355 |
| Плотность, г/см3 | 2,33 |
| Твердость (по Моосу) | 7,0 |
| Содержание в земной коре, % (масс.) | 27,72 |
| Степени окисления | –4, +2, +4 |
Свойства
Кремний – темносерое, блестящее кристаллическое вещество, хрупкое и очень твердое, кристаллизуется в решетке алмаза. Это типичный полупроводник (проводит электричество лучше, чем изолятор типа каучука, и хуже проводника – меди).
При высокой температуре кремний весьма реакционноспособен и взаимодействует с большинством элементов, образуя силициды, например силицид магния Mg2Si, и другие соединения, например SiO2 (диоксид кремния), SiF4(тетрафторид кремния) и SiC (карбид кремния, карборунд).
Кремний растворяется в горячем растворе щелочи с выделением водорода: Si + NaOH ® Na4SiO4 + 2H2.
4 (тетрахлорид кремния) получают из SiO2 и CCl4 при высокой температуре; это бесцветная жидкость, кипящая при 58° С, легко гидролизуется, образуя хлороводородную (соляную) кислоту HCl и ортокремниевую кислоту H4SiO4 (это свойство используют для создания дымовых надписей: выделяющаяся HCl в присутствии аммиака образует белое облако хлорида аммония NH4Cl). Тетрафторид кремния SiF4 образуется при действии фтороводородной (плавиковой) кислоты на стекло:
Na2SiO3 + 6HF ® 2NaF + SiF4 + 3H2O
SiF4 гидролизуется, образуя ортокремниевую и гексафторокремниевую (H2SiF6) кислоты. H2SiF6 по силе близка к серной кислоте. Многие фторосиликаты металлов растворимы в воде (соли натрия, бария, калия, рубидия, цезия малорастворимы), поэтому HF используют для перевода минералов в раствор при выполнении анализов. Сама кислота H2SiF6 и ее соли ядовиты.
Диоксид кремния (кремниевый ангидрид)
Природный диоксид кремния встречается преимущественно в форме кварца, хотя существуют и другие минералы – кристобалит, тридимит, китит, коусит.
Кристаллический диоксид кремния широко распространен в природе в виде прозрачных бесцветных или окрашенных монокристаллов (горный хрусталь, аметист, дымчатый кварц, тридимит, кварцит, розовый кварц, агат, яшма, сердолик, кремень, опал и халцедон) и в форме обломочных пород (морской песок, гравий, галька, песчаник и конгломерат).
Окраска аметиста объясняется примесями Mn и Fe, а дымчатого кварца – органическими включениями. Опал и кремень являются слабогидратированными формами SiO2. Аморфный кремнезем встречается в диатомовых отложениях на дне морей и океанов (трепел, кизельгур); эти отложения образовались из SiO2, входившего в состав диатомовых водорослей и некоторых инфузорий.
Диатомитовая земля и трепел обнаружены в Калифорнии, Орегоне и в разных частях Европы. Ежегодно добывается до 2 млн. т SiO2 для производства абразивов, теплоизоляции, фильтрующих сред, наполнителя полимеров, красок и композиций. См. также КВАРЦ.
Кремниевые кислоты
Две оксокислоты кремния H4SiO4 (ортокремниевая) и H2SiO3 (метакремниевая, или кремниевая) существуют только в растворе и необратимо превращаются в SiO2, если выпарить воду.
Другие кремниевые кислоты получаются за счет различного количества воды в их составе: H6Si2O7 (пирокремниевая кислотаиз двух молекул ортокремниевой кислоты), H2Si2O5 и H4Si3O8 (ди- и трикремниевая кислоты из двух и соответственно трех молекул метакремниевой кислоты). Все кислоты кремния слабые.
При добавлении в раствор силиката серной кислоты образуется гель (желатинообразное вещество), при нагревании и высушивании которого остается твердый пористый продукт – силикагель, имеющий развитую поверхность и используемый как адсорбент газов, осушитель, катализатор и носитель катализаторов.
Силикаты (соли кремниевых кислот)
В тетраэдрической структуре природных силикатов атом кремния окружен четырьмя атомами кислорода; ион щелочного или щелочноземельного металла, слишком малый по сравнению с кислородными атомами, размещается в пространстве между тетраэдрами.
Иногда тетраэдры выстраиваются в протяженные цепи (например, асбест), иногда образуется слоистая структура (слюда), в других случаях формируется кольцевая структура (например, берилл). К природным силикатам относятся полевые шпаты, слюды, глины, асбест и др.
Силикаты входят в состав горных пород: гранита, гнейса, базальта, различных сланцев и т.д. Многие драгоценные камни (изумруд, топаз, аквамарин и др.) – это прозрачные кристаллы силикатов. Силикаты в большинстве своем (кроме силикатов натрия и калия) нерастворимы в воде.
Силикаты натрия и калия внешне напоминают стекло, поэтому их называют растворимым стеклом.
Жидкое стекло
– это водный раствор силиката натрия или калия. Силикат натрия получается сплавлением кварцевого песка со щелочью (NaOH) или содой (Na2CO3) или кипячением смеси кварца с NaOH под давлением. Коммерческий продукт содержит Na2SiO3 с непостоянной примесью SiO2. Растворимое стекло широко используется как наполнитель в мылах.
Некоторые моющие средства тоже содержат силикат натрия.
Жидкое стекло используют для придания влаго- и огнестойкости деревянным строениям, в технологии кислото- и огнеупорного цемента и бетона, керосинонепроницаемых штукатурок по бетону, для пропитывания тканей, для приготовления огнезащитных красок по дереву, для химического укрепления слабых грунтов.
Гидриды
Подобно углероду кремний образует ковалентные связи Si–Si и Si–H. Соединения, в которых атомы кремния соединены одинарной связью, называются силанами, а если атомы кремния соединены двойной связью, –силенами.
Подобно углеводородам эти соединения образуют цепи и кольца. SiH4 называется моносилан, Si2H6 – дисилан, Si3H8 – трисилан, Si4H10 – тетрасилан и т.д.
Соединения, в которых атомы кремния соединены через атом кислорода, называются силоксанами, а через атомы серы – силазанами. Силаны и силены могут образовывать связь с углеводородными радикалами и галогенами, например, метилдихлорсилан CH3SiHCl2.
Все силаны могут самовозгораться, образуют взрывчатые смеси с воздухом и легко реагируют с водой.См. также КЕРАМИКА ПРОМЫШЛЕННАЯ; ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ; СТЕКЛО; ПОЛУПРОВОДНИКОВЫЕ ЭЛЕКТРОННЫЕ ПРИБОРЫ.
I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
- Литий Li,
- Натрий Na,
- Калий K,
- Цезий Cs,
- Рубидий Rb
- Франций Fr
- Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
- Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Литий
- Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
- Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Na2CO3 + 2C = 2Na + 3CO
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.:
- KCl + Na = K + NaCl
- KOH + Na = K + NaOH
- В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
- Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Качественные реакции — окрашивание пламени солями щелочных металлов
Цвет пламени:
Li — карминно-красныйNa — желтыйK — фиолетовыйRb — буро-красныйCs — фиолетово-красный
С кислородом
4Li + O2 = 2Li2O
- Натрий образует пероксид:
2Na + O2 = Na2O2
- Калий образует надпероксид:
- K + O2 = KO2
- С галогенами (F, Cl, Br, I)
- Щелочные металлы образуют галогениды:
- 2Li + F2 = 2LiF
- 2Na + Cl2 = 2NaCl
- 2K + I2 = 2KI
- С водородом
- Щелочные металлы образуют гидриды:
- 2Na + H2 = 2NaH
- С серой
- Щелочные металлы образуют сульфиды:
- 2Na + S = Na2S
- С азотом
- При комнатной температуре взаимодействует только литий:
- 6Li + N2 = 2Li3N
- Остальные щелочные металлы
реагируют с азотом при
нагревании: - 6Na + N2 = 2Na3N
- С углеродом
- Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
- 2Na + 2C → Na2C2 (t = 150-200 °C)
- С фосфором
- Щелочные металлы активно
реагируют с фосфором образуя фосфиды: - 3Na + P → Na3P
- С водой
- Щелочные металлы реагируют с водой при обычных
условиях: - 2Na + 2H2O = 2NaOH + H2
- Видео Взаимодействие щелочных металлов с водой
- С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
2K + H2SO4(разб) = K2SO4 +
H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 8Na + 5H2SO4(конц) = 4Na2SO4 +
H2S + 4H2O; - с разбавленной азотной
- 8Na + 10HNO3(разб) = 8NaNO3 + NH4NO3 + 3H2O;
- с концентрированной азотной
- 8Na + 10HNO3(конц) =
8NaNO3 + N2O + 5H2O. - 2СH3COOH + 2Li → 2CH3COOOLi + H2↑
- С солями
- В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
- 3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.






