- Характерные химические свойства Be, Mg и щелочноземельных металлов
- Химические свойства щелочноземельных металлов + Be
- II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- Взаимодействие со сложными веществами
- Щелочноземельные элементы. Получение металлических кальция, стронция, бария, их физические и химические свойства. Оксиды, гидроксиды, гидриды щелочноземельных элементов. Гашеная и негашеная известь


Средняя оценка: 4.6
Всего получено оценок: 1355.
Средняя оценка: 4.6
Всего получено оценок: 1355.
Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr);
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
Рис. 1. Щелочные и щелочноземельные металлы в таблице Менделеева.
Электронная конфигурация щелочных металлов – ns1, щелочноземельных металлов – ns2. Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II.
За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях.
Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.
Щелочные металлы имеют серебристо-белый цвет с металлическим блеском. Цезий – серебристо-жёлтый металл. Это наиболее активные и мягкие металлы. Натрий, калий, рубидий, цезий режутся ножом. По мягкости напоминают воск.
 Рис. 2. Разрезание натрия ножом.
Рис. 2. Разрезание натрия ножом.
Щелочноземельные металлы имеют серый цвет. По сравнению со щелочными металлами являются более твёрдыми, плотными веществами. Ножом можно разрезать только стронций. Самый плотный металл – радий (5,5 г/см3).
Наиболее лёгкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Щелочные и щелочноземельные металлы реагируют с простыми веществами и сложными соединениями, образуя соли, оксиды, щёлочи. Основные свойства активных металлов описаны в таблице.
| Взаимодействие | Щелочные металлы | Щелочноземельные металлы |
| С кислородом |
Самовоспламеняются на воздухе. Образуют надпероксиды (RO2), кроме лития и натрия. Литий образует оксид при нагревании выше 200°C. Натрий образует смесь пероксида и оксида.
|
На воздухе быстро образуются защитные оксидные плёнки. При нагревании до 500°С самовоспламеняются.
|
| С неметаллами |
|
|
| С галогенами |
Бурно реагируют с образованием галогенидов: 2Na + Cl2→ 2NaCl |
|
| С водой |
Образуются щёлочи. Чем ниже металл расположен в группе, тем более активно протекает реакция. Литий взаимодействует спокойно, натрий горит жёлтым пламенем, калий – со вспышкой, цезий и рубидий взрываются.
|
|
| С кислотами |
Со слабыми и разбавленными кислотами реагируют с взрывом. С органическими кислотами образуют соли.
|
|
| Со щелочами | – |
Из всех металлов реагирует только бериллий: Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 |
| С оксидами | – |
Вступают в реакцию все металлы, кроме бериллия. Замещают менее активные металлы: 2Mg + ZrO2 → Zr + 2MgO |
 Рис. 3. Реакция калия с водой.
Рис. 3. Реакция калия с водой.
Щелочные и щелочноземельные металлы можно обнаружить с помощью качественной реакции. При горении металлы окрашиваются в определённый цвет. Например, натрий горит жёлтым пламенем, калий – фиолетовым, барий – светло-зелёным, кальций – тёмно-оранжевым.
Щелочные и щелочноземельные – наиболее активные металлы. Это мягкие простые вещества серого или серебристого цвета с небольшой плотностью. Литий, натрий, калий плавают на поверхности воды. Щелочноземельные металлы более твёрдые и плотные, чем щелочные. На воздухе быстро окисляются.
Щелочные металлы образуют надпероксиды и пероксиды, оксид образует только литий. Бурно реагируют с водой при комнатной температуре. С неметаллами реагируют при нагревании. Щелочноземельные металлы вступают в реакцию с оксидами, вытесняя менее активные металлы.
Со щелочами реагирует только бериллий .
Чтобы попасть сюда — пройдите тест.
- Светлана-Анатольевна Мамахай
Средняя оценка: 4.6
Всего получено оценок: 1355.
А какая ваша оценка?
Гость завершил
Тест на тему Моллюскис результатом 5/5
Гость завершил
Тест «Премудрый пескарь»с результатом 9/10
Гость завершил
Тест на тему Моллюскис результатом 3/5
Гость завершил
Тест «После бала»с результатом 8/10
Гость завершил
Тест «Ревизор»с результатом 15/17
Гость завершил
Тест Белые ночи (9 класс)с результатом 7/10
Гость завершил
Тест «Бедная Лиза»с результатом 10/11
Гость завершил
Тест на тему «Италия»с результатом 8/10
Не подошло? Напиши в х, чего не хватает!
Характерные химические свойства Be, Mg и щелочноземельных металлов
К семейству щёлочноземельных элементов относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами. «…Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей RO имеют землистый вид», — пояснял Менделеев в «Основах химии».
- •Металлы главной подгруппы II группы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами.
- • Легко отдают два валентных электрона, и во всех соединениях имеют степень окисления +2
- • Сильные восстановители
- •Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
- • К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний
- • Бериллий по большинству свойств ближе к алюминию
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства щелочноземельных металлов + Be
1. Реакция с водой.
- В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием щелочей:
- Mg + 2H 2 O – t° → Mg(OH) 2 + H 2 ↑
- Ca + 2H 2 O → Ca(OH) 2 + H 2 ↑
2. Реакция с кислородом.
- Все металлы образуют оксиды RO, барий-пероксид – BaO 2 :
- 2Mg + O 2 → 2MgO
- Ba + O 2 → BaO 2
- 3. С другими неметаллами образуют бинарные соединения:
- Be + Cl 2 → BeCl 2 (галогениды)
- Ba + S → BaS (сульфиды)
- 3Mg + N 2 → Mg 3 N 2 (нитриды)
- Ca + H 2 → CaH 2 (гидриды)
- Ca + 2C → CaC 2 (карбиды)
- 3Ba + 2P → Ba 3 P 2 (фосфиды)
- Бериллий и магний сравнительно медленно реагируют с неметаллами.
- 4. Все щелочноземельные металлы растворяются в кислотах:
- Ca + 2HCl → CaCl 2 + H 2
- Mg + H 2 SO 4 (разб.) → MgSO 4 + H 2
- 5. Бериллий растворяется в водных растворах щелочей:
- Be + 2NaOH + 2H 2 O → Na 2 [Be(OH) 4 ] + H 2
- 6. Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
- соединения кальция — кирпично-красный, стронция — карминово-красный, а бария — желтовато-зелёный.
Бериллий, также как и литий, относится к числу s-элементов. Четвертый электрон, появляющийся в атоме Be, помещается на 2s-орбитали. Энергия ионизации бериллия выше, чем у лития, из-за большего заряда ядра. В сильных основаниях он образует ион-бериллат ВеО 2- 2 . Следовательно, бериллий ‑ металл, но его соединения обладают амфотерностью. Бериллий, хотя и металл, но значительно менее электроположительный, по сравнению с литием.
Высокой энергией ионизации атома бериллий заметно отличается от остальных элементов ПА-подгруппы (магния и щелочноземельных металлов). Его химия во многом сходна с химией алюминия (диагональное сходство). Таким образом, это элемент с наличием у его соединений амфотерных качеств, среди которых преобладают все же основные.
Электронная конфигурация Mg: 1s 2 2s 2 2p 6 3s 2 по сравнению с натрием имеет одну существенную особенность: двенадцатый электрон помещается на 2s-орбитали, где уже имеется 1е — .
Ионы магния и кальция ‑ незаменимые элементы жизнедеятельности любой клетки. Их соотношение в организме должно быть строго определённым. Ионы магния участвуют в деятельности ферментов (например, карбоксилазы), кальция – в построении скелета и обмена веществ. Повышение содержания кальция улучшает усвоение пищи. Кальций возбуждает и регулирует работу сердца.
Его избыток резко усиливает деятельность сердца. Магний играет отчасти роль антагониста кальция. Введение ионов Mg 2+ под кожу вызывает наркоз без периода возбуждения, паралич мышц, нервов и сердца. Попадая в рану в форме металла, он вызывает долго незаживающие гнойные процессы. Оксид магния в лёгких вызывает так называемую литейную лихорадку.
Частый контакт поверхности кожи с его соединениями приводит к дерматитам. Самые широко используемые в медицине соли кальция: сульфат СаSO 4 и хлорид CaCL 2 . Первый используется для гипсовых повязок, а второй применяется для внутривенных вливаний и как внутреннее средство.
Он помогает бороться с отёками, воспалениями, аллергией, снимает спазмы сердечно-сосудистой системы, улучшает свертываемость крови.
Все соединения бария, кроме BaSO 4 , ядовиты. Вызывают менегоэнцефалит с поражением мозжечка, поражение гладких сердечных мышц, паралич, а в больших дозах – дегенеративные изменения печени. В малых же дозах соединения бария стимулируют деятельность костного мозга.
При введении в желудок соединений стронция наступает его расстройство, паралич, рвота; поражения по признакам сходны с поражениями от солей бария, но соли стронция менее токсичны.
Особую тревогу вызывает появление в организме радиоактивного изотопа стронция 90 Sr.
Он исключительно медленно выводится из организма, а его большой период полураспада и, следовательно, длительность действия могут служить причиной лучевой болезни.
Радий опасен для организма своим излучением и огромным периодом полураспада (Т 1/2 = 1617 лет).
Первоначально после открытия и получения солей радия в более или менее чистом виде его стали использовать довольно широко для рентгеноскопии, лечения опухолей и некоторых тяжёлых заболеваний.
Теперь с появлением других более доступных и дешевых материалов применение радия в медицине практически прекратилось. В некоторых случаях его используют для получения радона и как добавку в минеральные удобрения.
В атоме кальция завершается заполнение 4s-орбитали. Вместе с калием он образует пару s-элементов четвертого периода. Гидроксид кальция ‑ довольно сильное основание. У кальция — наименее активного из всех щелочноземельных металлов — характер связи в соединениях ионный.
По своим характеристикам стронций занимает промежуточное положение между кальцием и барием.
Свойства бария наиболее близки к свойствам щелочных металлов.
Бериллий и магний широко используют в сплавах. Бериллиевые бронзы – упругие сплавы меди с 0,5-3% бериллия; в авиационных сплавах (плотность 1,8) содержится 85-90% магния («электрон»). Бериллий отличается от остальных металлов ИИА группы – не реагирует с водородом и водой, зато растворяется в щелочах, поскольку образует амфотерный гидроксид:
- Be+H 2 O+2NaOH=Na 2 [Be(OH) 4 ]+H 2 .
- Магний активно реагирует с азотом:
- 3 Mg + N 2 = Mg 3 N 2 .
- В таблице приведена растворимость гидроксидов элементов II группы.
| Растворимость, моль/л (20 0 С) | Растворимость, г/л | |
Be(OH) 2
|
8∙10 -6
|
3,4∙10 -4
|
Традиционная техническая проблема – жесткость воды , связанная с наличием в ней ионов Mg 2+ и Ca 2+ . Из гидрокарбонатов и сульфатов на стенках нагревательных котлов и труб с горячей водой оседают карбонаты магния и кальция и сульфат кальция. Особенно мешают они работе лабораторных дистилляторов.
S-элементы в живом организме выполняют важную биологическую функцию. В таблице приведено их содержание.
Содержание S-элементов в организме человека
| Элемент | Содержание, % |
Li
|
10 -4
|
Во внеклеточной жидкости содержится в 5 раз больше ионов натрия, чем внутри клеток. Изотонический раствор («физиологическая жидкость») содержит 0,9% хлорида натрия, его применяют для инъекций, промывания ран и глаз и т. п.
Гипертонические растворы (3-10% хлорида натрия) используют как примочки при лечении гнойных ран («вытягивание» гноя). 98% ионов калия в организме находится внутри клеток и только 2% во внеклеточной жидкости. В день человеку нужно 2,5-5 г калия. В 100 г кураги содержится до 2 г калия.
В 100 г жареной картошки – до 0,5 г калия. Во внутриклеточных ферментативных реакциях АТФ и АДФ участвуют в виде магниевых комплексов.
Ежедневно человеку требуется 300-400 мг магния. Он попадает в организм с хлебом (90 мг магния на 100 г хлеба), крупой (в 100 г овсяной крупы до 115 мг магния), орехами (до 230 мг магния на 100 г орехов).
Кроме построения костей и зубов на основе гидроксилапатита Ca 10 (PO 4 ) 6 (OH) 2 , катионы кальция активно участвуют в свертывании крови, передаче нервных импульсов, сокращении мышц. В сутки взрослому человеку нужно потреблять около 1 г кальция.
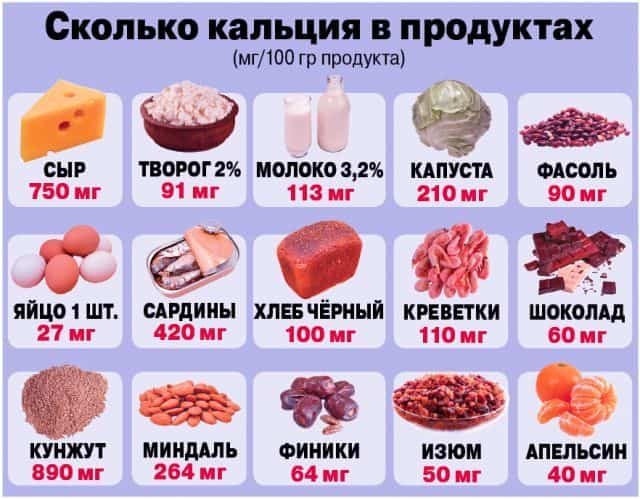
В 100 г твердых сыров содержится 750 мг кальция; в 100 г молока – 120 мг кальция; в 100 г капусты – до 50 мг.
II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
- Бериллий Be
- магний Mg
- кальций Ca,
- стронций Sr,
- барий Ba и
- радий Ra.
- Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
- Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns2:
- Be — 2s2
- Mg —3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
- 2(CaO · MgO) + Si → 2Mg + Ca2SiO4
- Кальций
- Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
- CaCl2 → Ca + Cl2
- Барий
- Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
- 4BaO+ 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:
- Ca — кирпично-красный
- Sr — карминово-красный (алый)
- Ba — яблочно-зеленый
- Взаимодействие с веществами:
- С кислородом
- С кислородом взаимодействуют при нагревании с образованием оксидов
- 2Сa + O2 → 2CaO
- Видео Горение кальция
- С галогенами
- (F, Cl, Br, I)
- Щелочноземельные металлы реагируют с галогенамипри нагревании с образованием галогенидов .
- Сa + Cl2→ 2СaCl2
- С водородом
- Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
- Сa + H2 СaH2
- Бериллий с водородом не взаимодействует.
- Магний реагирует только при повышенном давлении:
- Mg + H2 → MgH2
- С серой
- Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
- Сa + S СaS
- Ca + 2C → CaC2 (карбиды)
- С азотом
- При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
- 6Mg + 2N2 → 2Mg3N2
- Остальные щелочноземельные металлы реагируют с азотом при нагревании.
- С углеродом
- Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
- Ca + 2C → CaC2
- Бериллий при нагревании с углеродом с образует карбид — метанид:
- 2Be + C → Be2C
- С фосфором
- Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
- 3Сa + 2P Сa3 P2
Взаимодействие со сложными веществами
- С водой
- Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
- Sr + 2H2O → Sr(OH)2 + H2↑,
- Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
- С кислотами
- С растворами HCl, H2SO4, H3PO4 щелочноземельные металлы взаимодействуют с образованием соли и выделением водорода:Са + H2SO4(разб)= СаSO4 + H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 4Ca + 10H2SO4(конц) → 4CaSO4 + H2S↑ + 5H2O;
- с разбавленной и концентрированной азотной:
- 4Sr + 10HNO3(конц) → 4Sr(NO3)2 + N2O +5H2O
- С водными растворами щелочей
- В водных растворах щелочей растворяется только бериллий:
- Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
- С солями
- В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
- Ca + CuCl2 → CaCl2 + Cu
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
- С оксидами
- Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
- 2Ca + SiO2 → 2CaO + Si
- Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
- 2Mg + CO2 → 2MgO + C
Щелочноземельные элементы. Получение металлических кальция, стронция, бария, их физические и химические свойства. Оксиды, гидроксиды, гидриды щелочноземельных элементов. Гашеная и негашеная известь
Щелочноземельные металлы — кальций, стронций, барий, радий. Встречаются в природе только в виде соединений — силикатов, алюмосиликатов, карбонатов, фосфатов, сульфатов и т.д.
- Барий получают восстановлением оксида:
- 3BaO + 2Al → 3Ba + Al2O3
- Остальные металлы получают электролизом расплавов хлоридов:
Т.к. металлы данной подгруппы сильные восстановители, то получение возможно только путем электролиза расплавов солей. В случае Са обычно используют CaCl2 (c добавкой CaF2 для снижения температуры плавления)
CaCl2=Ca+Cl2↑.
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций).
Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается, только начиная с кальция, который самый лёгкий из них (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1). Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера.
1. Реакция с водой.
- В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являются сильными основаниями:
- Ве + H2O → ВеO+ H2
- Ca + 2H2O → Ca(OH)2 + H2
2. Реакция с кислородом.
- Все металлы образуют оксиды RO, барий образует пероксид – BaO2:
- 2Mg + O2 → 2MgO
- Ba + O2 → BaO2
- 3. С другими неметаллами образуются бинарные соединения:
- Be + Cl2 → BeCl2 (галогениды)
- Ba + S → BaS (сульфиды)
- 3Mg + N2 → Mg3N2 (нитриды)
- Ca + H2 → CaH2 (гидриды)
- Ca + 2C → CaC2 (карбиды)
- 3Ba + 2P → Ba3P2 (фосфиды)
- Бериллий и магний сравнительно медленно реагируют с неметаллами.
- 4. Все металлы растворяются в кислотах:
- Сa + 2HCl → CaCl2 + H2
- Mg + H2SO4(разб.) → MgSO4 + H2
- 5. Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета:
- Ca2+ — темно-оранжевый
- Sr2+- темно-красный
- Ba2+ — светло-зеленый.
- Катион Ba2+ обычно открывают обменной реакцией с серной кислотой или ее солями:
- BaCl2 + H2SO4 → BaSO4↓ + 2HCl
- Ba2+ + SO42- → BaSO4↓
- Оксиды щелочноземельных металлов.
- Получение
- 1) Окисление металлов (кроме Ba, который образует пероксид)
- 2) Термическое разложение нитратов или карбонатов:
- CaCO3 → CaO + CO2
- 2Mg(NO3)2→ 2MgO + 4NO2 + O2.
- Типичные основные оксиды. Реагируют с водой (кроме BeO и MgO), кислотными оксидами и кислотами:
- СаO + H2O → Са(OH)2
- 3CaO + P2O5 → Ca3(PO4)2
- BeO + 2HNO3 → Be(NO3)2 + H2O
- BeO — амфотерный оксид, растворяется в щелочах:
- BeO + 2NaOH + H2O → Na2[Be(OH)4].
- Гидроксиды щелочноземельных металлов R(OH)2
- Получение
- Реакции щелочноземельных металлов или их оксидов с водой:
- Ba + 2H2O → Ba(OH)2 + H2
- CaO (негашеная известь) + H2O → Ca(OH)2(гашеная известь)
- Химические свойства
- Гидроксиды R(OH)2 — белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основность R(OH)2 увеличивается с увеличением атомного номера:
- Be(OH)2 – амфотерный гидроксид
- Mg(OH)2 – слабое основание
- Са(OH)2 — щелочь
- Остальные гидроксиды — сильные основания (щелочи).
- 1) Реакции с кислотными оксидами:
- Ca(OH)2 + СO2 → CaСO3↓ + H2O (Качественная реакция на углекислый газ)
- Ba(OH)2 + SO2 → BaSO3↓ + H2O
- 2) Реакции с кислотами:
- Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
- 3) Реакции обмена с солями:
- Ba(OH)2 + K2SO4 → BaSO4↓+ 2KOH
Гидриды щел –зем. элементов – белые, кристаллические солеобразные вещества. Их получают непосредственно из элементов при нагревании. Температуры начала реакции Э + Н2 = ЭН2 равны 250 оС (Са), 200 оС (Sr), 150 оС (Ва). Термическая диссоциация ЭН2 начинается при 600 оС.
В атмосфере водорода СаН2 не разлагается при температуре плавления (816оС). В отсутствии влаги гидриды щелочноземельных металлов устойчивы на воздухе при обычной температуре. Они не реагируют с галогенами. Однако при нагревании химическая активность ЭН2 возрастает.
Они способны восстанавливать оксиды до металлов(W, Nb, Ti, Се, Zr, Ta), например 2СаН2 + ТiO2 = 2CaO + 2H2 + Ti. Реакция СаН2 с Al2O3 идет при 750оС: 3СаН2 + Al2O3 = 3СаО + 3Н2 + 2Аl, и затем: СаН2 + 2Al = CaAl2 + H2. С азотом СаН2 при 600оС реагирует по схеме: 3СаН2 + N2 = Ca3N2 +3H2.
При поджигании ЭН2 они медленно сгорают: ЭН2 + О2 = Н2О + СаО. В смеси с твердыми окислителями взрывоопасны. При действии воды на ЭН2 выделяется гидроокись и водород. Эта реакция сильно экзотермична: смоченный водой на воздухе ЭН2 самовоспламеняется.
С кислотами ЭН2 реагирует, например по схеме: 2HCl + CaH2 = CaCl2 + 2H2. ЭН2 применяют для получения чистого водорода, а также для определения следов воды в органических растворителях.
Негашеная известь или оксид кальция.
Негашеная известь широко используется в строительстве, в производстве стали для повышении сортности сульфидной руды, при изготовлении целлюлозы, для производства бумаги, для очистки питьевых и сточных вод. Дымовые газы силовых установок на угле также очищаются с помощью негашеной извести.
Негашеная известь получается посредством нагрева дробленого и сортированного известняка в роторной или шахтной печи. Известняк (CaCO3) распадается на оксид кальция, т.е. негашеную известь (CaO) и двуокись углерода (CO2).
Эта реакция, называемая кальцинацией, требует температуры приблизительно 1100 градусов по шкале Цельсия. В роторной печи процесс нагрева продолжается шесть часов; в шахтной печи кальцинация занимает около 24-36 часов.
Негашеная известь может быть комовой, дробленой и молотой.
Погрузочно-разгрузочные операции с негашеной известью следует проводить с большой осторожностью, поскольку она химически активна. При соприкосновении с водой, происходит сильная реакция гашения с выделением тепла.
Гашеная известь или гидроокись кальция.
Гашеная известь используется для очистки питьевых и сточных вод, а также в металлургии и строительной промышленности.
Известь гасится посредством добавления воды к негашеной извести. Оксид кальция соединяется с водой и превращается в гидроксид кальция (Ca(OH)2), т.е. в гашеную известь.
Щелочноземельные элементы: растворимые (галогениды, нитраты, ацетаты) и нерастворимые (сульфаты, карбонаты, оксалаты) соли. Изменение термической устойчивости карбонатов, сульфатов, нитратов в ряду кальций – барий.
При взаимодействии с кислотами окислы и гидроокиси щелочноземельных металлов легко образуют соответствующие соли. Последние, как правило, бесцветны.
Из производных обычных минеральных кислот соли с анионами Cl–, Br–, J– и NO3- – хорошо растворимы; напротив, с анионами F–, SO42–, CO32–и PO43–малорастворимы в воде. В противоположность ионам Са2+ и Sr2+ ион Ba2+ сильно ядовит.
Многие соли рассматриваемых элементов находят разнообразное практическое использование.
Галогениды щелочноземельных металлов по своим свойствам делятся на две довольно резко обособленные группы. К одной относятся фториды, к другой – производные остальных галоидов,
Фториды почти нерастворимы не только в воде, но и в разбавленных кислотах. Кристаллогидраты для них неизвестны. Хлориды, бромиды и иодиды хорошо растворимы в воде и из растворов выделяются в виде кристаллогидратов.
Азотнокислый барий кристаллизуется при обычных условиях без воды. Напротив, нитраты Са и Sr выделяются в виде кристаллогидратов.
Последние легко растворимы в воде, тогда как растворимость Ва(NO3 )3 и Ra(NO3 )2 значительно меньше. Нитрат кальция широко применяется в качестве азотсодержащего минерального удобрения.
Нитраты стронция и бария служат в пиротехнике для изготовления составов, сгорающих красным (Sr)j или зеленым (Ва) пламенем.
- Безводные нитраты бериллия и некоторых других металлов невозможно получить дегидратацией кристаллогидратов вследствие необратимого гидролиза. Обычно их получают из безводных хлоридов взаимодействием с диоксидом азота, образующуюся соль нитрозония разлагают в вакууме при слабом нагревании:
- ВеС12 + 4N204 = [N0]2[Be(N03)4] + 2NOC1
- [NО]2[Be(NО3)4] = Be(NО3)2 + 4NО2
Сернокислые соли Sr и Ва кристаллизуются без воды выше 66°С в безводном состоянии выделяется из раствора и сульфат кальция, ниже указанной температуры осаждается гипс – CaSO4 ·2H2O. В воде рассматриваемые сульфаты труднорастворимы, причем по ряду Са–Ra растворимость быстро уменьшается,а их термическая устойчивость возрастает.
Нагревание до 150°С обусловливает переход гипса в более бедный водой гидрат 2CaSO4 ·H2 O.
При замешивании теста из порошка этого гидрата с водой (60–80% от его веса) происходит обратное присоединение последней, сопровождающееся отвердеванием всей массы вследствие ее закристаллизовывания.
На этом основано применение гипса для изготовления слепков с различных предметов, а также в качестве вяжущего строительного материала.
Углекислые соли щелочноземельных металлов практически нерастворимы в воде. При накаливании они отщепляют СО2 и переходят в соответствующие окиси. По ряду Са–Sr––Ва термическая устойчивость карбонатов быстро возрастает, что объясняется увеличением в этом ряду энергии кристаллической решетки. Наиболее практически важным из них является карбонат кальция.
Применение отдельных природных разновидностей СаСО3 весьма различно. Известняк служит исходным сырьем для получения важнейших строительных материалов – извести и цемента.
Мел используется в качестве минеральной краски, как основа составов для полировки и т. д. Мрамор является прекрасным материалом для скульптурных работ, изготовления электрических распределительных щитов и т. д.
Наряду с рассмотренными выше солями для химии Са, Sr и Ва весьма важны их известные только в растворе кислые карбонаты Э(НСО3)2 . Они образуются при взаимодействии растворенного в воде углекислого газа с нормальными карбонатами по схеме:
ЭСО3 + СО2 + Н2 О = Э(НСО3)2
Реакция эта обратима, причем нагревание смещает ее равновесие в сторону распада бикарбоната. Довольно часто из бикарбонатов щелочноземельных металлов в природных водах содержится только Са(НСО3)2 . Наличие его придает воде приятный освежающий вкус (который отсутствует у дистиллированной воды).
Средний ацетат бериллия получают растворением бериллия в ледяной уксусной кислоте или нагреванием оксоацетата с ацетилхлоридом в ледяной уксусной кислоте.
При переходе от бериллия к магнию склонность к гидролизу уменьшается, а соли кальция, стронция и бария с сильными кислотами вообще не гидролизуются.






