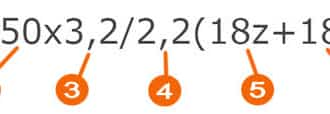- Что представляет собой
- Как был открыт
- Мировой опыт
- Новое «золото»
- История названия
- Месторождения и методы добычи
- Физико-химические характеристики
- Способы получения
- Алюминий vs медь
- Где используется
- Промышленность
- Металлургия
- Электротехника
- Энергетика
- Строительство
- Другие отрасли
- Пищевая промышленность
- Медицина
- Ювелирное дело
- Предостережение
- Цены
- Алюминий
- СТРУКТУРА
- СВОЙСТВА
- Запасы и добыча
- ПРОИСХОЖДЕНИЕ
- ПРИМЕНЕНИЕ
- КЛАССИФИКАЦИЯ
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
- Алюминий
- История открытия
- Физические свойства
- Химические свойства
- Получение
- Применение
- Рассмотрим, как используют различные изделия из алюминия
- Абросимова Елена Владимировна учитель химии и биологии — Алюминий. Строение атома алюминия. Физические и химические свойства простого вещества
Представить современную жизнь без этого металла невозможно. Упаковка таблеток, тара для напитков, начинка холодильника и многое другое – все это алюминий.

Что представляет собой
Алюминий – это металл, элемент периодической системы Д. И. Менделеева №13. Простое вещество с формулой из одного символа – Al.
- Международное обозначение – Al (Aluminium).
- Структура решетки – куб, центрированный по граням.
- Цвет изначально белый, но на воздухе создается серебристо-матовая пленка-оксид.
- По классификации цветных металлов причислен к группе легких (вместе с титаном и магнием).
Алюминий – самый распространенный в земной коре среди металлов и третий среди химических элементов, вслед за кислородом и кремнием.
Как был открыт
Бокситы и глинозем известны людям веками. С алюминием как металлом они познакомились только к середине XIX века.
Мировой опыт
История открытия – это опыты ученых-одиночек:
- Первую попытку предпринял Парацельс (XVI век). Он выделил из квасцов «квасцовую землю», содержащую оксид неизвестного металла (алюминия).
- Два века спустя процесс повторил немецкий химик Андреас Маргграф. Тоже получил оксид металла, которому присвоил название alumina («вяжущий»).
- Первые миллиграммы металла выделил датчанин Ганс Эрстед. Физик-практик выбрал исходником хлорид алюминия. Нагревая и воздействуя калийной амальгамой, получил чистый металл.
- Чистый калий, а не амальгаму использовал Фридрих Велер. Восстановив металл (получилось несколько крупинок), описал его свойства.
- Еще дальше пошел француз Сент-Клер Девиль. Он изготовил слиток металла, использовав метод Велера. Но вместо калия взял натрий. Девиль предъявил слиток публике на Всемирной выставке в Париже (1855 год), сотворив сенсацию. Спустя год получил металл методом электролиза. Такой успех объясним: ученого спонсировал сам Наполеон III, рассчитывавший приспособить металл для военных нужд.
Получение металла промышленными партиями – заслуга американца Чарльза Холла и француза Поля Эру. Независимо друг от друга они к 1886 году разработали методику расплава глинозема в криолите электролизом.
С глиноземом экспериментировали и русские ученые. Метод, предложенный К.И.Байером, стал классическим для алюминиевой промышленности мира.
Первый алюминиевый завод – Волховский – ввели в строй во времена СССР (1932 год).
Производство сырья исчислялось тысячами тонн. Эта отрасль была на особом счету: ее продукт обеспечивал обороноспособность государства.
Сегодня монополист по добыче и переработке сырья – компания «Русал» («Русский Алюминий»).
Новое «золото»
Первый алюминий был дороже золота:
- Европейская знать использовала алюминиевые столовые приборы (гостям попроще выдавались серебряные или золотые). Моду задал своим указом император Франции Наполеон III.
- Ювелиры изготавливали украшения класса люкс.
- Бесценный подарок сделали англичане русскому гению Дмитрию Менделееву – весы с чашами из золота и алюминия.
Дешевый метод появился к началу ХХ века. В 1911 году во французском Дюрене выпустили первую партию металла. Его назвали в честь этого города. А алюминий перешел в разряд бижутерии.
История названия
Латинский термин восходит к корню alumen. Так назывались квасцы, издревле используемые лекарями.
В России металл именовали «серебром из глины», поскольку глинозем – главный компонент глины.
7,4-8,1% земной коры – это алюминий. В природе представлен горными породами и минералами, формирующими земную кору.
Почти всегда это соединения алюминия:
- Бокситы (оксиды с примесью кремния, кальция, железа).
- Глиноземы (каолиново-песчаная либо известковая, магнезиальная смесь).
- Нефелины (с калием).
- Каолиниты.
- Корунды.
В сегменте корундов соседствуют «суровый» наждак и ювелирные минералы: сапфир, рубин. Строение их решеток идентично.
«Алюминиевые» самоцветы: сапфир, рубин, изумруд, аквамарин, александрит.
Соединения алюминия найдены в воде рек, морей, океанов. В чистом виде – только в жерлах вулканов.
Месторождения и методы добычи
Главное сырье для получения алюминия – бокситы. Их залежи сосредоточены в тропиках и субтропиках.
 Добыча алюминия
Добыча алюминия
Россия богата нефелиновыми рудами, источник которых – север страны (Кольский полуостров и Кемеровская область).
Мировые запасы сырья исчисляются миллионами тонн.
Добыча ведется открытым либо закрытым способом.
Физико-химические характеристики
Для практических целей важны следующие свойства алюминия:
- Теплопроводность (выше только у меди и серебра).
- Легкость, пластичность.
- Электропроводность (впереди только медь, золото и серебро).
- Неуязвимость к коррозии. Это свойство обеспечивает прочная пленка-оксид, которой на воздухе покрывается металл. Дальше он не окисляется. Взаимодействие с металлами, кислотами, водой нулевое. При удалении пленки химическая активность восстанавливается.
- Холодостойкость (на морозе не становится хрупким).
Наконец, с ним легко работается. Металл подходит для любого вида обработки (штамповка, волочение, ковка, прокат, полировка).
 Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %
Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %
Способы получения
Бокситная руда – это глинозем (45-58%) плюс соединения железа, титана, кремнезем. Ее транспортируют на обогатительную фабрику.
Для очистки глинозема применяют процесс К.И.Байера:
- Руду загружают в автоклав, где нагревают с едким натром, охлаждают.
- Отделяют твердый осадок.
- Гидроокись осаждают, прокаливают.
На выходе получают оксид алюминия, то есть чистый глинозем. Его тестируют на калибровку и чистоту, затем превращают в алюминий.
- Свойства алюминия делают невозможным применение классических для металлов способов восстановления.

- Сегодня металл высвобождают способом, придуманным в конце XIX века (метод Холла-Эру).
Изучается возможность производства металлического алюминия через частичное восстановление. Образуется карбид алюминия, который разлагают при 1950°С. По расчетам, он рентабельнее классического.
Из нефелинов попутно получают кальцинированную соду, поташ, цемент, удобрения.
Алюминий vs медь
Эти металлы – соперники на рынке. У каждого свои достоинства и недостатки.
Главные конкурентные преимущества алюминия – легкость, пластичность, дешевизна (втрое по сравнению с медью).
Медь отличается более высокой тепло- и электропроводностью.
Где используется
Характеристики алюминия обусловили его применение во всех отраслях хозяйства – от ракетостроения до производства пищевой фольги.
По степени чистоты металла различают два вида: технический и высокой чистоты.
Промышленность
Металл используют как конструкционный материал и восстановитель.
Например, трубы из него долговечны, надежны. Кроме магистральных газо-, водопроводов, радиаторов отопления, это элементы бензобаков, автомобилей, самолетов, судов. Их используют декораторы и укладчики дорог.

Металлургия
Металл применяется как базис для сплавов. В отличие от природных примесей, сплавы создаются людьми. Их искусственное происхождение обнуляет природные недостатки материала. Например, медь и магний повышают порог прочности.
Алюминиевых сплавов сотни, самые известные:
- дюралюминий – плюс медь, магний;
- силумин – плюс кремний.
Другие легирующие элементы – железо, никель.
Как мощный раскислитель задействован в производстве сталей. Благодаря ему исключена пористость отливок и слитков.
Электротехника
Это оптимальный материал для ассортимента изделий:
- Провода, кабели, тепловое оборудование.
- Холодильные, другие криогенные системы.
- Клапаны двигателей внутреннего сгорания, нефтяных платформ, турбин.
Алюминий заменяет затратный процесс цинкования.
Энергетика
Металл выступает универсальным вторичным энергоносителем для выработки тепла, производства водорода, электричества для электрохимических генераторов.
Применяется в теплообменниках, радиаторах охлаждения.
Строительство
Газообразующий агент, благодаря которому возможно получение пористого строительного материала.
Технологи работают над созданием пенистого алюминия – сверхлегкого, сверхпрочного материала нового поколения.
Из алюминия сделан первый самолет (1919 год). Сегодня это сырье номер один в авиа- и ракетостроении. Он есть в корпусах самолетов, ракет, спутников.
Алюминий и его соединения – основа либо компонент топлива для ракет.
Дешевый легкий металл приспособили для производства автоматов, гранатометов, пистолетов, взрывчатки.
Другие отрасли
Металл популярен в «мирных» сегментах.
Пищевая промышленность
- В пищепроме это упаковка продуктов питания, фольга для кулинарных целей (например, запекания в духовке).

- Алюминий – это пищевая добавка Е173.
Столовые приборы для общепита, армии (котелки, фляги), пенитенциарных заведений тоже алюминиевые.
Медицина
Алюмогель – основа препаратов при проблемах желудочно-кишечного тракта. Самые известные – Маалокс, Альмагель.
Ювелирное дело
Ювелиры любили алюминий: его легко обрабатывать, а пленка на поверхности придает сходства с благородной патиной.
Но эти времена прошли. Сегодня металл в почете только у японцев. Мастера выполняют традиционные украшения для причесок, одежды. Они проходят как бижутерия, заменяя элитарное серебро.
Мода прихотлива: сегодня появились украшения класса люкс из бетона как оправы. Так что всплеск популярности ювелирного алюминия не исключен.
Предостережение
Алюминий не заложен изначально в биологические организмы. Но человек получает его микродозы ежедневно – с пищей.
Им богаты горох, пшеница, рис, овсяный «геркулес». Доказана польза алюминия как стимулятора регенерации, развития тканей, работы ЖКТ, ферментов.
Однако его переизбыток (откладывается в костях, мозге, печени, почках) чреват тяжелыми расстройствами нервной системы.
По стандартам РФ, в литре питьевой воды не должно быть более 0,2 мг алюминия.
Алюминиевой посудой пользоваться можно, но ограниченно. Безопасны готовка, подогрев, хранение продуктов с нейтральными характеристиками. Приготовление кислых блюд (щи, томат, компот) опасно. Алюминий поступит в еду, создавая избыточную дозу при попадании в организм, плюс «железный» привкус.
Цены
На 2021 год стоимость тонны сырья на мировых рынках превышает $2000. За последние три года она колебалась, достигая максимума ($2300, май 2018) и минимума (в коронакризисс – $1500, апрель 2020 года).
Проверить совместимость мужчины и женщины по Знаку Зодиака
Алюминий

Кусок чистого алюминия
Алюминий — очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения.
Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм.
Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
СТРУКТУРА
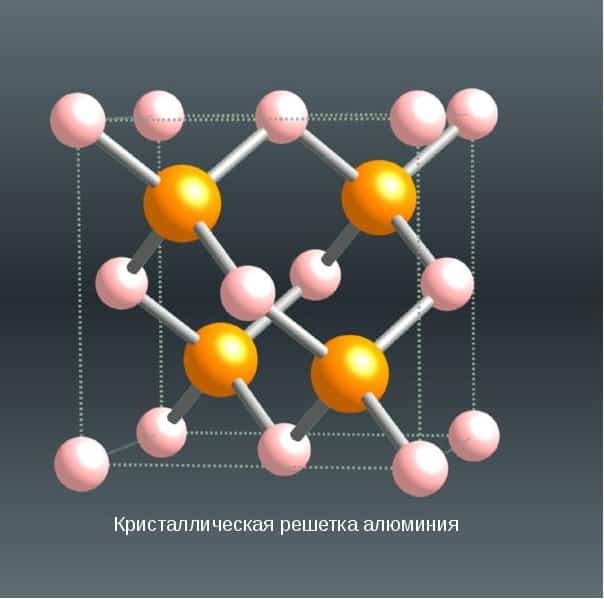
Кубическая гранецентрированная структура. 4 оранжевых атома
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно.
Элементарная ячейка состоит из четырех атомов размером 4,049596×10-10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10-10 м, а атомный объем 9,999×10-6 м3/г-атом.
Примеси в алюминии незначительно влияют на величину параметра решетки.
Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В.
В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10-5 см), но прочной пленкой оксида алюминия А1203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
СВОЙСТВА
Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см3), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость.
Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой – оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления.
Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется.
При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты – соли, содержащие алюминий в составе аниона.
Запасы и добыча

Кусочки алюминия
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов.
Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ

Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико.
Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов.
Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ

Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость.
Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу.
Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем.
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г.
были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий (англ. Aluminium) – Al
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.21
Физические свойства
Оптические свойства
Плеохроизмне плеохроирует
Кристаллографические свойства
Алюминий
Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
История открытия
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил «квасцовую землю», которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф.
Оксид алюминия он назвал «alumina», что на латинском языке означает «вяжущий». На тот момент металл не пользовался популярностью, так как не был найден в чистом виде. Долгие годы выделить чистый алюминий пытались английские, датские и немецкие учёные.
В 1855 году в Париже на Всемирной выставке металл алюминий произвёл фурор. Из него делали только предметы роскоши и ювелирные украшения, так как металл был достаточно дорогим. В конце 19 века появился более современный и дешёвый метод получения алюминия.
В 1911 году в Дюрене выпустили первую партию дюралюминия, названного в честь города. В 1919 из этого материала был создан первый самолёт.
Физические свойства
Металл алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки.
Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С. Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла.
Основные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции.
Металл высокой чистоты применяют в специальных целях. По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью.
Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. По показателю теплопроводности алюминий проигрывает только меди и серебру.
Благодаря этому свойству металл применяется в теплообменниках и радиаторах охлаждения.Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов.
Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия.
Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства.
Алюминий обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства
Алюминий — это достаточно активный амфотерный металл. При обычных условиях прочная оксидная плёнка определяет его стойкость. Если разрушить оксидную плёнку, алюминий выступает как активный металл-восстановитель.
В мелкораздробленном состоянии и при высокой температуре металл взаимодействует с кислородом. При нагревании происходят реакции с серой, фосфором, азотом, углеродом, йодом. При обычных условиях металл взаимодействует с хлором и бромом. С водородом реакции не происходит.
С металлами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
При условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. Легко протекают реакции с разбавленными кислотами. Реакции с концентрированной азотной и серной кислотой происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашло свойство восстанавливать металлы из оксидов и солей – реакции алюминотермии.
Получение
Алюминий находится на первом месте среди металлов и на третьем среди всех элементов по распространённости в земной коре. Приблизительно 8% массы земной коры составляет именно этот металл.
Алюминий содержится в тканях животных и растений в качестве микроэлемента. В природе он встречается в связанном виде в форме горных пород, минералов.
Каменная оболочка земли, находящаяся в основе континентов, формируется именно алюмосиликатами и силикатами.
Алюмосиликаты – это минералы, образовавшиеся в результате вулканических процессов в соответствующих условиях высоких температур.
При разрушении алюмосиликатов первичного происхождения (полевые шпаты) сформировались разнообразные вторичные породы с более высоким содержанием алюминия (алуниты, каолины, бокситы, нефелины). В состав вторичных пород алюминий входит в виде гидроокисей или гидросиликатов.
Однако не каждая алюминийсодержащая порода может быть сырьём для глинозёма – продукта, из которого при помощи метода электролиза получают алюминий.
Наиболее часто алюминий получают из бокситов. Залежи этого минерала распространены в странах тропического и субтропического пояса. В России также применяются нефелиновые руды, месторождения которых располагаются в Кемеровской области и на Кольском полуострове. При добыче алюминия из нефелинов попутно также получают поташ, кальцинированную соду, цемент и удобрения.
В бокситах содержится 40-60% глинозёма. Также в составе имеются оксид железа, диоксид титана, кремнезём. Для выделения чистого глинозёма используют процесс Байера.
В автоклаве руду нагревают с едким натром, охлаждают, отделяют от жидкости «красный шлам» (твёрдый осадок). После осаждают гидроокись алюминия из полученного раствора и прокаливают её для получения чистого глинозёма.
Глинозём должен соответствовать высоким стандартам по чистоте и размеру частиц.
Из добытой и обогащённой руды извлекают глинозём (оксид алюминия). Затем методом электролиза глинозём превращают в алюминий. Заключительным этапом является восстановление процессом Холла-Эру. Процесс заключается в следующем: при электролизе раствора глинозёма в расплавленном криолите происходит выделение алюминия.
Катодом служит дно электролизной ванны, а анодом – угольные бруски, находящиеся в криолите. Расплавленный алюминий осаждается под раствором криолита с 3-5% глинозёма. Температура процесса поднимается до 950°С, что намного превышает температуру плавления самого алюминия (660°С).
Глубокую очистку алюминия проводят зонной плавкой или дистилляцией его через субфторид.
Применение
Алюминий применяется в металлургии в качестве основы для сплавов (дуралюмин, силумин) и легирующего элемента (сплавы на основе меди, железа, магния, никеля).
Сплавы алюминия используются в быту, в архитектуре и строительстве, в судостроении и автомобилестроении, а также в космической и авиационной технике. Алюминий применяется при производстве взрывчатых веществ.
Анодированный алюминий (покрытый окрашенными плёнками из оксида алюминия) применяют для изготовления бижутерии. Также металл используется в электротехнике.
Рассмотрим, как используют различные изделия из алюминия
Алюминиевая лента представляет собой тонкую алюминиевую полосу толщиной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Используется лента в пищевой, лёгкой, холодильной промышленности для изготовления охлаждающих элементов и радиаторов.
Круглая алюминиевая проволока применяется для изготовления кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Алюминиевые трубы отличаются долговечностью и стойкостью в условиях сельских и городских промышленных районов. Применяются они в отделочных работах, дорожном строительстве, конструкции автомобилей, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Алюминиевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Используются они для концевого соединения металлических тросов.
Алюминиевый круг — это сплошной профиль круглого сечения. Используется это изделие для изготовления различных конструкций.
Алюминиевый пруток применяется для изготовления гаек, болтов, валов, крепежных элементов и шпинделей.Около 3 мг алюминия каждый день поступает в организм человека с продуктами питания.
Больше всего металла в овсянке, горохе, пшенице, рисе.
Учёными установлено, что он способствует процессам регенерации, стимулирует развитие и рост тканей, оказывает влияние на активность пищеварительных желёз и ферментов.
- Алюминиевый лист
- Алюминиевая плита
- Алюминиевые чушки
- Алюминиевые уголки
- Алюминиевая проволока
При использовании алюминиевой посуды в быту необходимо помнить, что хранить и нагревать в ней можно исключительно нейтральные жидкости. Если же в такой посуде готовить, к примеру, кислые щи, то алюминий поступит в еду, и она будет иметь неприятный «металлический» привкус.
Алюминий входит в состав лекарственных препаратов, используемых при заболеваниях почек и желудочно-кишечного тракта.
Абросимова Елена Владимировна учитель химии и биологии — Алюминий. Строение атома алюминия. Физические и химические свойства простого вещества
Бор представляет собой неметалл. Алюминий — переходный металл, а галлий, индий и таллий — полноценные металлы. Таким образом, с ростом радиусов атомов элементов каждой группы периодической системы металлические свойства простых веществ усиливаются.
Рассмотрим подробнее свойства алюминия.
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
- Al +13 )2)8)3
- Al0 – 3 e- → Al+3 Алюминий проявляет в соединениях степень окисления +3:
- 2. Физические свойства алюминия
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 оС. Алюминий имеет невысокую плотность (2,7 г/см3) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
3. Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
- В природе алюминий встречается только в соединениях (минералах).
- Некоторые из них:
- Бокситы Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3); Нефелины — Na3[AlSiO4]4; Алуниты — KAl(SO4)2 • 2Al(OH)3; Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3); Корунд — Al2O3; Полевой шпат (ортоклаз) — K2O•Al2O3•6SiO2; Каолинит — Al2O3•2SiO2 • 2H2O; Алунит — (Na,K)2SO4•Al2(SO4)3•4Al(OH)3; Берилл — 3ВеО • Al2О3 • 6SiO2
- 4. Химические свойства алюминия и его соединений
- Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид).
- ДЕМОНСТРАЦИЯ ОКСИДНОЙ ПЛЁНКИ
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы).
I. Взаимодействие с простыми веществами — неметаллами
- Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды.
- при нагревании он взаимодействует с серой (200 °С) 2Аl + 3S = Аl2S3 (сульфид алюминия),
- азотом (800 °С) 2Аl + N2 = 2АlN (нитрид алюминия),
- фосфором (500 °С) Аl + Р = АlР (фосфид алюминия)
- углеродом (2000 °С) 4Аl + 3С = Аl4С3 (карбид алюминия)
- с йодом в присутствии катализатора — воды (видео) 2Аl + 3I2 = 2 AlI3 (йодид алюминия)
- Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
- Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
- Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
- В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
- 4Аl + 3O2 = 2Аl2О3 + 1676 кДж.
- горение алюминия на воздухе (видео)
- Взаимодействие алюминия с кислорродом (опыт)
- II. Взаимодействие алюминия со сложными веществами
2Al + 6H2O = 2 Al(OH)3 + 3H2 без оксидной пленки!!
Опыт (видео)
- Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
- 3 Fe3O4 + 8Al = 4Al2O3 + 9Fe +Q
- Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке.
- Сr2О3 + 2Аl = 2Сr + Аl2О3
- Взаимодействие с кислотами, например с раствором серной кислоты с образованием соли и водорода:
2 Al + 3 H2SO4 = Al2(SO4)3 + 3 H2
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н2SО4(конц) = Аl2(SО4)3 + 3SО2 + 6Н2О,
Аl + 6НNO3(конц) = Аl(NO3)3 + 3NO2 + 3Н2О.
- Взаимодействие алюминия с щелочами (видео).
- 2Al + 2NaOH + 6H2O = 2 Na[Al(OH)4] + 3H2
- Na[Аl(ОН)4] – тетрагидроксоалюминат натрия
- По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
- Взаимодействие алюминия с растворами солей:
- 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
- Если поверхность алюминия потереть солью ртути, то происходит реакция:
- 2Al + 3HgCl2 = 2AlCl3 + 3Hg
- Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
- Обнаружение ионов алюминия в растворах (видео):
- 5. Применение алюминия и его соединений: РИСУНОК 1 и РИСУНОК 2
Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов.
Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом.
Из алюминия изготовляют кабели и провода: при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
Оксид алюминия используется для получения алюминия, а также как огнеупорный материал.
Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сока.
Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии.
Таким образом, сульфат алюминия является коагулянтом.
6. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите.
Расплавленный криолит Na3AlF6 растворяет Al2O3, как вода растворяет сахар.
Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия — электролитом.
2Al2O3 эл.ток→ 4Al + 3O2
В английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век — век алюминия.
В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”.
Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес.
2) 2Al2O3 + 3 C = 4 Al + 3 CO2
ЭТО ИНТЕРЕСНО:
-
- Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
- В 18-19 веках алюминий был главным ювелирным металлом. В 1889 году Д.И.Менделеев в Лондоне за заслуги в развитии химии был награжден ценным подарком – весами, сделанными из золота и алюминия.
- К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
- А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка.
- При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета «Сатурн» сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф. А. Цандер.
ТРЕНАЖЁРЫ
Тренажёр №1 — Характеристика алюминия по положению в Периодической системе элементов Д. И. Менделеева
- Тренажёр №2 — Уравнения реакций алюминия с простыми и сложными веществами
- Тренажёр №3 — Химические свойства алюминия
- ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Для получения алюминия из хлорида алюминия в качестве восстановителя можно использовать металлический кальций. Составьте уравнение данной химической реакции, охарактеризуйте этот процесс при помощи электронного баланса.
Подумайте! Почему эту реакцию нельзя проводить в водном растворе?
- №2. Закончите уравнения химических реакций:
- Al + H2SO4 (раствор) →
- Al + H2SO4 (раствор)→
- Al + CuCl2→
- Al + HNO3→
- Al + CuCl2 →
- Al + HNO3(конц) -t->
- Al + NaOH + H2O→
- Al + NaOH + H2O→
- №3. Осуществите превращения:
- Al → AlCl3→ Al → Al2S3 → Al(OH)3 -t->Al2O3 → Al