В металлах, согласно электронной теории проводимости, свободные электроны находятся в состоянии постоянного хаотичного теплового движения.
Однако при нормальных температурах они не покидают металл. У поверхности металла существует задерживающее электрическое поле.
Чтобы вылететь из металла электрон должен совершить работу по преодолению задерживающих сил. Эта работа называется работой выхода.
Работа выхода
- Работа выхода — работа, которую должен совершить электрон, чтобы выйти из металла.
- Формула для работы выхода:
- A=eU,
- где e — заряд электрона, U — разность потенциалов между точками в металле и за пределами задерживающего слоя.
- Работа выхода измеряется в электронвольтах.
- Электронвольт — внесистемная единица измерения, равная энергии, которую приобретает электрон при движении между двумя точками с разностью потенциалов в 1 Вольт.
Как у поверхности металла образуется задерживающее поле?
- Вследствие теплового движения электроны с поверхности металла могут отрываться и образуют над поверхностью электронное облако.
- На местах покинувших металл электронов образуются положительные ионы. По закону Кулона, они стремяться вернуть покинувшие металл электроны обратно.
В результате у поверхности металла образуется двойной электрический слой.
- В вакууме за пределами задерживающего слоя поле отсутствует, поэтому формула для работы выхода запишется в виде:
- A=eφ,
- где φ — потенциал выхода, равный потенциалу поля внутри металла.
Контактная разность потенциалов
Явление контактной разности потенциалов в 1797 году открыл Алессандро Вольта (1745 -1827).
Контактная разность потенциалов
Контактная разность потенциалов — разность потенциалов, которая возникает при контакте поверхностей двух разных металлов.
- Разность потенциалов, возникающая при контакте двух разных металлов, зависит от их химического состава и температуры.
- Если цепь составлена из нескольких разных проводников при одинаковой температуре, контактная разность потенциалов определяется только контактной разностью между крайними проводниками.
Причины возникновения контактной разности потенциалов:
- Разная работа выхода для разных металлов.
- Разная концентрация свободных электронов в разных металлах.
Схематически рассмотрим контакт двух металлов. Пусть у металла 1 работа выхода больше, чем у металла 2, и в металле 1 концентрация свободных электронов больше.
Между точками a и b, лежащими рядом с поверхностью, но не принадлежащими проводнику, возникает внешняя контактная разность потенциалов.
Электроны диффундируют из одного металла в другой, при этом из металла 1 в металл 2 уходит больше электронов, так как n1>n2. В результате металл 1 приобретает положительный, а металл 2 — отрицательный заряд. Возникшая разность потенциалов называется внутренней контактной разностью потенциалов.
Роман Адамчук
Преподаватель физики
полимеры в медицине
- Вид работы: Реферат
- Выполнена: 22 февраля 2022 г.
- Стоимость: 1 500 руб
Заказать такую же работу
Процессы роста и развития человека
- Вид работы: Реферат
- Выполнена: 13 декабря 2021 г.
- Стоимость: 1 200 руб
Заказать такую же работу
Методика решения расчетных задач по физике с неявно заданной физической моделью для публикациии в журнале
- Вид работы: Статья
- Выполнена: 7 декабря 2021 г.
- Стоимость: 1 500 руб
Заказать такую же работу
Особенности методов лабораторной диагностики инфекции вызванных Ecoli
- Вид работы: Курсовая работа
- Выполнена: 18 ноября 2020 г.
- Стоимость: 1 700 руб
Заказать такую же работу
Дневник по практике
- Вид работы: Дневник по практике
- Выполнена: 4 сентября 2020 г.
- Стоимость: 1 000 руб
Заказать такую же работу
Роль природных соединение в разработке новых лекарственных препаратов
- Вид работы: Аспирантский реферат
- Выполнена: 2 июня 2020 г.
- Стоимость: 11 200 руб
Заказать такую же работу
Смотреть все работы по химии
Не получается написать работу самому?
Доверь это кандидату наук!
ПОИСК
| Таблица 6. Стандартные электродные потенциалы металлов при 25 С |
| Таблица 15.1 Стандартные электродные потенциалы металлов |
Значения стандартных потенциалов металлических электродов в водных растворах приведены в табл. 20, которая является одновременно и рядом напряжения. Стандартные электродные потенциалы металлов указывают на меру восстановительной способности атомов металла и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают его ионы. Из табл. 20 видно, что к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути. [c.192]
Зная стандартные электродные потенциалы ( ) металлов, легко рассчитать ЭДС любого гальванического элемента. Для этого из потенциала электрода, имеющего большее алгебраическое значение, следует вычитать потенциал электрода, алгебраическое значение которого меньше. В качестве примера вычислим ЭДС элемента, составленного из железного и медного электродов, погруженных в растворы их солей с с = 1 моль/л при стандартных условиях. Из таблицы 18 следует что — 0,44 В, а Следователь- [c.81]
Сравните стандартные электродные потенциалы металлов -элементов II группы. [c.100]
Приближенное суждение о термодинамической устойчивости металлов и вероятных катодных деполяризационных процессах может быть сделано по величине стандартных электродных потенциалов металлов (табл. 5). [c.39]
Относительно потенциала стандартного водородного электрода измерены стандартные потенциалы для большого количества электродных реакций (t = 25 °С), что дает возможность решать различные электрохимические задачи.
Если разместить стандартные электродные потенциалы для различных металлов так, чтобы их величины возрастали, то получится ряд напряжений, известный из общего курса химии (табл. 3, с. 330).
Указанная последовательность стандартных электродных потенциалов металлов в значительной мере соответствует последовательности изменения их свойств и поэтому служит важным ориентиром при оценке возможности протекания различных реакций. [c.325]
В табл. 3 приведены значения стандартных электродных потенциалов металлов в водных растворах при 25° С. [c.24]
Защитные поверхностные покрытия металлов. Они бывают металлические (покрытие цинком, оловом, свинцом, никелем, хромом и другими металлами) и неметаллические (покрытие лаком, краской, эмалью и другими веществами). Эти покрытия изолируют металл от внешней среды.
Так, кровельное железо покрывают цинком, из оцинкованного железа изготовляют многие изделия бытового и промышленного значения. Слой цинка предохраняет железо от коррозии, так как цинк, хотя и является более активным металлом, чем железо (см. ряд стандартных электродных потенциалов металлов, рис. 5.5), покрыт оксидной пленкой. При повреждениях защитного слоя (царапины, пробои крыш и т.
д.) в присутствии влаги возникает гальваническая пара 2п Ре. Катодом (положительным полюсом) является железо, анодом (отрицательным полюсом) — цинк (рис. 5.10). Электроны переходят от цинка к железу, где связываются молекулами кислорода, цинк растворяется, но железо остается защищенным до тех пор, пока не будет разрушен весь слой цинка, на что требуется довольно много времени.
Покрытие железных изделий никелем, хромом, помимо защиты от коррозии, придает им красивый внешний вид. [c.164]
Как известно, п)1и конструировании оборудования и установок приходится часто применять разнородные металлы.
Об опасности контакта различных металлоЕ в первом приближении можно судить по величине стандартных электродных потенциалов металлов.
Желательно использовать сочетание металлов, находящихся как можно ближе друг к другу в электрохимическом ряде напряжении. Однако в большинстве случаев это практически неосуществимо. [c.85]
Приближенно судить о термодинамической возможности Протекания электрохимической коррозии можно по стандартным электродным потенциалам металлов. [c.4]
Из приведенных примеров можно сделать вывод, что рядом стандартных электродных потенциалов металлов следует пользоваться с учетом особенностей рассматриваемых процессов.
Самое же главное — всегда надо иметь в виду, что этот ряд применим только к водным растворам и характеризует химическую активность металлов лишь в окислительно-восстановительных реакциях, протекающих в водной среде.
В этих случаях гидратация ионов, зависящая от их радиусов и величины заряда, обусловливает несоответствие изменений активности металлов в ряду стандартных электродных потенциалов изменениям их активности в подгруппах периодической системы.
Например, активность лития ( °==—3,045 В) несколько больше активности цезия ( °= —2,923 В), хотя согласно месту, занимаемому в периодической системе, у лития она должна быть ниже. [c.232]
Пользуясь стандартными электродными потенциалами металлов, указать правильное значение э. д. с. гальванического элемента с электродами Fe /Fe и Nf VNi [c.109]
Если расположить стандартные электродные потенциалы металлов в порядке уменьшения их отрицательного значения и повышения положительного, т. е. в порядке возрастания электродных потенциалов, то получится ряд стандартных электродных потенциалов (ранее используемое название — ряд напряжений металлов) [c.327]
Из-за технических трудностей (платиновый электрод, водород) измерение стандартных электродных потенциалов металлов в учебной лаборатории неосуществимо. Но при наличии рН-метров (см. 17) очень просто и довольно точно определяется ЭДС гальванических элементов, составленных из двух металлических электродов, погруженных в растворы их солей. [c.331]
В зависимости от величины и знака стандартного электродного потенциала ф°, отвечающего цепи с химической реакцией (У.
7), все металлы располагаются в ряд напряжений, совпадающий с рядом активностей, эмпирически установленным путем оы-теснения металлов из их соединений другими металлами Н. Н, Бекетовым (1865).
Стандартные электродные потенциалы металлов приведены в табл. 38. [c.254]
Следует подчеркнуть, что ряд стандартных электродных потенциалов металлов нельзя рассматривать как абсолютную характеристику их свойств, действительную во всех случаях и при всяких условиях Например, металлический магний не вытесняет цинк из раствора его соли, хотя его потенциал значитель но отрицательнее, т. е. стандартный потенциал магния значительно меньше, чем цинка. [c.175]
Рассмотрим, как будет протекать восстановительный процесс на катоде в водных растворах. Руководствуясь таблицей стандартных электродных потенциалов, металлов, можно указать следующие случаи. [c.209]
Стандартные электродные потенциалы металлов [c.330]
Поясним, как образуется ряд стандартных электродных потенциалов металлов. Прн погружении любого металла в водный раствор его соли на границе раздела фаз металл/раствор возникает [c.157]
Возникновение электрического тока за счет химических реакций. Стандартные электродные потенциалы металлов. Ряд напряжений. Вытеснение металлами водорода и вытеснение одних металлов другими. Гальванический элемент. [c.167]
Стандартные электродные потенциалы металлов характеризуют способность металлов посылать ионы в растворы их солей при. ., условиях. [c.108]
Пользуясь таблицей потенциалов, выпишите стандартные электродные потенциалы металлов и соответствующие электродные реакции. Расположите металлы в порядке уменьшения отрицательного и роста положительного значения потенциалов. [c.108]
Ряд стандартных электродных потенциалов металлов. Располагая металлы в порядке возрастания алгебраической величины из стандартных электродных потенциалов Е°, получают электрохимический ряд напряжений металлов или, точнее, ряд стандартных электродных потенциалов металлов (табл. 19). [c.231]
Исторически ряду стандартных электродных потенциалов металлов предшествовал вытеснительный ряд Н. Н. Бекетова, являющийся прототипом современного ряда. [c.231]
С учетом ряда стандартных электродных потенциалов металлов возможны три случая протекания восстановительного процесса на катоде в водных растворах [c.166]
Стандартные электродные потенциалы металлов изменяются от —1,70 В у Ве до —2,92 В у На, поэтому в направлении от Ве к Ка возрастает восстановительная активность. Однако она меньше, чем у щелочных металлов. Об этом свидетельствует уменьшение радиусов атомов и увеличение энергии ионизации по сравнению со щелочными металлами. [c.204]
В средней школе вы изучаете электрохимический ряд напряжений металлов. Более точное название его — ряд стандартных электродных потенциалов металлов. Для некоторых металлов он приведен в табл. 12.1. Как же составляется такой ряд Почему, например, натрий стоит в нем после кальция Как этим рядом пользоваться [c.228]
Что такое стандартные электродные потенциалы металлов [c.264]
Для сравнительной характеристики металлов пользуются понятием — стандартный электродный потенциал металла.
Стандартным электродным потенциалом металла называют разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией 1 г-ион металла в литре, и нормальным водородным электродом.
Располагая металлы то величине их стандартных электродных потенциалов, получают ряд напряжений металлов щшожент А). [c.121]
Этим рядом вы пользовались прн изучении электролиза (с. 96), свойств солей азотной кислоты (с. 117) и в других случаях. Более точное название электрохимического ряда напрялстандартных электродных потенциалов металлов. Для важнейших металлов он предста1 лен на рис. 5.5. [c.157]
В ряду стандартных электродных потенциалов металлов располагается меаду магнием и цинком и является активным металлом. Однако химическая активность марганца в компактном состоянии сильно снижается за счет пассивирования поверхности оксидной пленкой.
При нафевании марганец сгорает на воздухе, образуя оксид состава МП3О4. Энергично юаимодействуег с галогенами, при этом образуются преимущественно солеобразные галогениды марганца (II). При нафевании марганец взаимодействует со всеми остальными неметаллами.
Водород хорошо растворим в марганце, но химических соединений не образует. [c.46]
Таким образом, при электрохимической коррозии (как в случае контакта разнородных металлов, так и в случае образования гальванических микроэлеме1 тов на поверхности одного металла) поток электронов направлен от более активного металла (с меньшей величиной электродного потенциала) к менее активному проводнику (с больщей величиной электродного потенциала) и более активный металл корродирует. Скорость коррозии тем больше, чем дальше стоят друг от друга в ряду стандартных электродных потенциалов металлы, из которых образовался гальванический элемент (галь- [c.179]
Электродные потенциалы
В металле существует динамическое равновесие:
Ме « Меn++ ,
где Ме – атом металла, Меn+ – ион металла, n – заряд иона металла, –электрон. Ионы и атомы металла находятся в узлах кристаллической решетки, а валентные электроны (или их часть) перемещаются по всему объему металла.
При погружении металла в воду или раствор электролита начинается взаимодействие ионов поверхностного слоя металла, находящихся в узлах решетки, с компонентами раствора, главным образом с полярными молекулами воды, ориентированными у поверхности электрода.
В результате часть ионов поверхностного слоя металла переходит в раствор в виде гидратированных ионов (Меn+ mH2O), а на металле остаются электроны, заряд которых не скомпенсирован положительно заряженными ионами.
Металл становится заряженным отрицательно, а раствор положительно. В результате электростатического притяжения между катионами Меn+в растворе и избыточными электронами в поверхностном слое металла образуется двойной электрический слой (рис. 8.1).
Накопление ионов металла в растворе начинает тормозить дальнейшее растворение металла. Протекает обратная реакция – восстановление ионов металла с осаждением их на поверхности металла.
Ионы металла (Меn+) находятся под действием силы притяжения их молекулами воды и силы, стремящейся «втянуть» ионы обратно в металл, т.е. одновременно протекают два противоположных процесса: растворение и кристаллизация, что приводит к равновесию
Me + mH2O Меn+∙mH2O(в растворе) + (на металле).
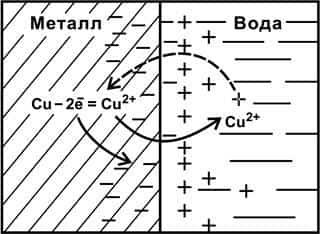
Рис. 8.1. Схема процесса, протекающего на границе раздела
«металл (Сu)/ вода»
Равновесие имеет динамический характер, так как прямой и обратный процессы идут с одинаковой скоростью в прямом и обратном направлениях. Состояние равновесия электродного процесса определяется электродным потенциалом.
На границе соприкосновения металла с жидкой фазой возникает разность потенциалов (скачок потенциала).
Разность потенциалов, возникающая между металлом и окружающей его водной средой, называется электродным потенциалом.
Абсолютное значение разности потенциалов на границе металл/ электролит принципиально измерить нельзя никакими средствами, так как на возникает между двумя фазами разной природы (твердой металл/жидкий раствор). Однако можно измерить разность потенциалов двух различных электродов, приняв один из них за электрод сравнения.
В качестве электрода сравнения, согласно международному соглашению, используют стандартный водородный электрод.
8.3. Стандартный водородный электрод
Конструктивно стандартный водородный электрод состоит из платиновой пластинки, покрытой слоем электролитической платины− платиновой чернью, контактирующей с газообразным водородом под давлением 1 атм и раствором серной кислоты с активностью ионов водорода 1 моль/л .
В водородном электроде происходит реакция, аналогичная реакциям, протекающим на поверхности металлических электродов. Pt выполняет роль инертного проводника, а ее поверхностный слой адсорбирует (концентрирует) водород.
Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя на платине электроны. При этом платина заряжается отрицательно, а раствор – положительно. Возникает скачок потенциала между платиной и раствором.
Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода.
- Равновесие на водородном электроде можно представить в виде
- 2Н+ + 2 Н2.
- Схематически водородный электрод обозначают 2Н+/Н2, где вертикальная черта – поверхность раздела фаз.
- Электродный потенциал стандартного водородного электрода условно принят за нуль (Ео2Н+/Н2=0,00 В).
Стандартным электродным потенциалом (Ео298) называется электродный потенциал, определенный относительно стандартного водородного электрода в стандартных условиях, т.е. при концентрации (активности) ионов металла в растворе 1 моль/л и температуре 25оС (298 К).
Для определениястандартных электродных потенциалов металлов (Ео298) составляется гальванический элемент из двух элементов: стандартного водородного электрода и электрода, представляющего собой металлическую пластину, погруженную в раствор соли этого металла с концентрацией(активностью) ионов металла 1 моль/л, и измеряют электродвижущую силу элемента (рис. 8.2).
Измерение осуществляют методом компенсации в условиях обратимой работы его работы (при отсутствии тока в цепи).
ЭДС элемента равна разности равновесных потенциалов положительного электрода (катода) и отрицательного электрода (анода). Так как потенциал водородного электрода принимается равным нулю, то относительный потенциал определяемого электрода будет равен ЭДС элемента.
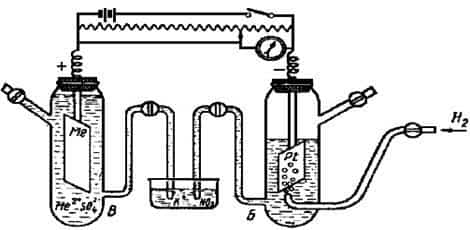
Рис. 8.2. Ячейка для измерения электродного потенциала металла:
А — аккумулятор; Б – стандартный водородный
электрод; В – металлический электрод
Знак электродного потенциала характеризует активность металла относительно водорода. Металлы имеют электродные потенциалы со знаком «минус», если их активность выше активности водорода и «плюс», если они менее активны, чем водород.
Стандартные электродные потенциалы металлов являются характеристикой активности металлов. Стандартные электродные потенциалы металлов, расположенные в ряд по мере возрастания значений стандартных электродных потенциалов, представляют собой ряд стандартных электродных потенциалов (ряд напряжений металлов) (Прил., табл. 12).
Большая Рнциклопедия Нефти Рё Газа
- Cтраница 1
- Стандартный электродный потенциал металла является одной из основных его электрохимических характеристик, определяющий, в частности, степень его термодинамической стабильности. [1]
- Стандартные электродные потенциалы металлов изменяются РѕС‚ — 1 70 Р’ Сѓ Be РґРѕ — 2 92 Р’ Сѓ Ra, поэтому РІ направлении РѕС‚ Be Рє Ra возрастает восстановительная активность. [2]
Стандартный электродный потенциал металла характеризует его электрохимическую активность: чем ниже значение потенциала, тем больше, очевидно, активность металла. Поэтому очень важно измерение стандартных электродных потенциалов для металлов. Однако непосредственно измерить эти потенциалы невозможно. Возможно лишь сравнение электродного потенциала данного металла с потенциалом другого электрода. Для этой цели чаще всего применяют стандартный водородный электрод, потенциал которого условно принимают равным нулю. [3]
Когда условный стандартный электродный потенциал металла имеет более отрицательную величину, чем условный формальный окислительно-восстановительный потенциал среды, равновесие реакции коррозии ( 16) сильно смещено в сторону образования ионов ( соединений) корродирующего металла. При благоприятных условиях ( свободном доступе окислителя и отводе продуктов реакции) коррозия идет с полным разрушением ( растворением) металла, что имеет место, например, пря коррозии всех металлов в хлоридных расплавах, через которые непрерывно продувается хлор или. [4]
Значения стандартных электродных потенциалов металлов обычно становятся при комплексообразовании ионов металлов более отрицательными, что приводит к изменению характера окислительно-восстановительных реакций. [5]
Ряд стандартных электродных потенциалов металлов ( электрохимический ряд напряжений) образуется при расположении металлов в порядке возрастания их стандартных электродных потенциалов, измеренных относительно стандартного водородного электрода. Он характеризует химические свойства металлов. [6]
Алгебраическая величина стандартного электродного потенциала металла характеризует одновременно восстановительную способность его атомов и окислительную способность ионов.
Чем меньше алгебраическая величина стандартного электродного потенциала, тем больше восстановительная способность атома данного металла и, наоборот, тем меньше окислительная способность его иона.
Р’ СЂСЏРґСѓ электродных потенциалов РІ направлении СЃРЅРёР·Сѓ вверх увеличивается восстановительная способность атомов — металлов.
Следовательно, из металлов, приведенных в таблице, наибольшей восстановительной способностью обладает калий. [7]
�спользуя значения стандартных электродных потенциалов металлов, определить, какие металлы вытесняют олово и свинец из растворов их солей и используются при гидрометаллургическом получении олова и свинца. [8]
В ряду стандартных электродных потенциалов металлов располагается между магнием и цинком и является активным металлом.
Однако химическая активность марганца в компактном состоянии сильно снижается за счет пассивирования поверхности оксидной пленкой.
При нагревании марганец взаимодействует со всеми остальными неметаллами. Водород хорошо растворим в марганце, но химических соединений не образует. [9]
Чем более электроотрицателен стандартный электродный потенциал металла, тем легче осуществляется переход его иона в раствор электролита, т.е. растворение или коррозия. [10]
Где в ряду стандартных электродных потенциалов металлов находятся Fe, Co и Ni. Как это определяет отношение металлов к кислотам. При каких условиях и какими кислотами железо пассивируется. [11]
В табл. 7 приведены стандартные электродные потенциалы металлов в водных растворах при температуре 25 СС. [12]
- Чем меньше алгебраическая величина стандартного электродного потенциала металла, тем характернее для него ионное состояние и тем труднее восстанавливаются его ионы на катоде. [13]
- Поясним, как образуется ряд стандартных электродных потенциалов металлов. [15]
- Страницы: 1 2 3 4






