Благодаря своим химическим и физическим свойствам золото относится к немногочисленной группе наиболее ценных и редко встречающихся металлов, существующих в природе. Человечество ценит этот драгоценный металл за его красоту и способность сохранять свой яркий и блестящий внешний вид в изготовленных из него ювелирных изделиях, монетах.
А также оно используется в некоторых отраслях промышленности. На протяжении многих столетий золотые изделия являлись предметом роскоши и никогда не теряли своей ценности, подчеркивая высокий уровень платежеспособности своего владельца или страны, владеющей золотовалютным запасом.
Нередко можно услышать, что именно золото является международной платежной системой, которая имеет вес и значимость на территории любого мирового государства.

По внешнему виду это полезное ископаемое выглядит как небольшие кусочки металла неправильной округлой формы соломенно-желтого цвета. Основные физические свойства золота:
- плавление металла происходит при температуре, равной 1063ºС;
- плотность вещества составляет 19,33 г/куб. см;
- показатели твердости, определяемые шкалой Мооса, могут быть от 2,5 до 3;
- довести металл до наивысшей точки кипения возможно при t=2948ºС;
- уровень удельной теплопроводности при t=0ºС равен 311,5 Вт/мК;
- прочность металла после отжига равна от 100 до 140 МПа.
По структуре своей кристаллической решетки золото довольно мягкое вещество, и для придания твердости к металлу добавляют различные примеси, называемые лигатурой.
После добавления в виде лигатуры других компонентов общая температура плавления у золотого сплава снижается, при этом изменяются и физико-механические показатели самого металла.
Ценный природный минерал обладает и другими уникальными физическими свойствами.
- Высокий уровень пластичности. Из 1 грамма золота при желании можно вытянуть проволоку длиной до 2-2,6 метра или раскатать металл в виде плоского листа фольги толщиной в 1 микрон. Ввиду природной мягкости золота было замечено, что в течение 1 года монеты, бывшие в обращении, могли утрачивать до 0,1% своего изначального веса при отливке.
Свойство пластичности золота позволяет применять его и в современной электронике.


- Высокая отражательная способность. Драгоценный сплав в готовом виде обладает способностью легко полироваться до яркого зеркального блеска. Тонкие листы раскатанного материала используют для нанесения позолоты. Это используется даже в космонавтике – тончайшие слои золота наносят на шлемы астронавтов и поверхности наружного космического оборудования, чтобы защитить их от пагубного воздействия излучений инфракрасного потока, который проявляет себя в условиях открытого космоса.


- Возможность распыления. Драгоценный минерал имеет свойство распадаться на мельчайшие фракции размером, равным длине световых волн. Такая способность позволяет этому материалу распыляться. Например, известно, что в водоемах и реках встречается дисперсия золота, которую невозможно увидеть визуально, но можно определить при помощи специальных приборов. Поверхность, покрытая тончайшим золотым слоем, способна пропускать лучи солнца, не нагреваясь при этом.
Такую способность применяют с целью тонировки стекол в южных широтах, где есть необходимость защищать помещения от перегрева.


- Хорошая ковкость. Золото обладает мягкостью и имеет способность принимать желаемую форму, что является одним из его ценнейших качеств. Например, из 1 грамма золота можно изготовить лист тонкой фольги, площадь которого будет составлять не менее, чем 1 кв. м. Такое свойство применяют для изготовления позолоты в виде тончайшего сусального золота, которое идет на покрытие церковных куполов и икон, применяется для украшения интерьеров, используется для создания предметов искусства.
- Высокий уровень электропроводности. При устойчивости к окислительным процессам драгоценный минерал обладает хорошей электропроводимостью. Это свойство металла позволяет применять его для изготовления сопротивлений в электронных схемах многих современных приборов: телефонов, телевизоров, компьютеров, мультимедийных проигрывателей, в радиотехнике и других подобных устройств.
Известно, что у драгоценного металла полностью отсутствует какой-либо запах, а также этот материал не обладает способностью намагничиваться.
Кроме того, научным путем доказано, что золото как элемент входит в состав не менее 15 минералов, добываемых в земельных недрах.
В большинстве добываемых горных пород, входящих в это число, золото включено в распыленном составе, обнаруживаемом на уровне атомов.
Месторождения арсенидов и сульфидов нередко богаты и золотыми самородками.
Металл, называемый золото (аурум), имеет обозначение – Au, что дословно может значить «солнечный» или «желтый». В системе Менделеева металл относят к 1 группе, ему присвоен 79 атомный порядковый номер. Химическая кристаллическая решетка у Au имеет кубическое строение.
Металл имеет особые химические свойства.
- Относительная инертность. Золото не меняет своих свойств при контактах с серой и кислородом, не вступает во взаимодействие с азотом, углеродом, водородом и фосфором. Золото не реагирует на многие щелочи и кислоты.
- Валентность у этого химического элемента проявляет себя как +I или +III.
- При t=20ºС металл вступает в химическую реакцию с водными растворами хлора и брома. А водно-спиртовые растворы йода, вступая в реакцию с золотом 585 пробы, оставляют на нем участки темных пятен, чего не бывает, если капнуть йодом на золото 750 пробы.
- Цветовой спектр металла зависит от того, из частиц какого размера он состоит. Наиболее мелкие частицы золота могут иметь зеленовато-серые оттенки. По данным геологоразведки, на каждый 20 приисков приходится только один, где золото добывают в виде самородков желтого цвета.
Точная химическая формула золотого сплава зависит от того, какие дополнительные компоненты входят в его состав в виде лигатуры.
Если расплавить золотой натуральный самородок, то в жидком состоянии он будет выглядеть как вещество, имеющее бледный зеленовато-серый оттенок, причем этот оттенок присущ и парам, которые поднимаются, исходя от горячего расплавленного металла.
Стоит только нагреть вещество до температуры, превышающей 1064ºС, то есть увеличить показатель плавления металла хотя бы на 1ºС, как пары золотого сплава начнут улетучиваться в атмосферу. И чем выше будет температура плавления вещества, тем выше у него будут и показатели летучести.
Если в сплав добавить компоненты ртути, мышьяка, а также сурьмы или теллура, испарения с поверхности золотого сплава увеличатся в еще большей степени, так как указанные компоненты будут образовывать так называемые летучие соединения.
Ювелиры, работающие с различными золотыми сплавами, заметили, что на химические, физические и внешние свойства материала, получившегося при переплавке золота, влияют лигатурные примеси.
Рассмотрим более подробно, как меняются свойства драгоценного минерала при сочетании с разными веществами.
В сочетании с серебром благородный желтый металл снижает температуру своего плавления, а также изменяет природный изначальный зеленовато-желтый цвет на стальные серебристые оттенки. В этом сочетании есть свои положительные и отрицательные стороны.
Несмотря на внешние визуальные изменения, прочность готового переплавленного материала при сочетании с серебром только возрастает. Но в ходе практических исследований установлено, что у драгоценного сплава при таком составе несколько снижаются такие важные качества, как ковкость и пластичность.
Однако это вовсе не означает, что сплавы Au и Ag не применяются – напротив, это довольно распространенное сочетание, которое довольно часто используют ювелиры в своей работе.
Изменения физических свойств готового драгоценного сплава произойдут, если в качестве лигатуры к нему добавить медь. Этот металл значительно повышает прочность золотого сплава, сохраняя при таком совмещении металлов пластичность полученного материала и его хорошие показатели ковкости.
Если в составе драгоценного сплава из золота меди будет присутствовать от 14,5% и более, то готовые изделия будут иметь выраженный красноватый оттенок – такое золото принято называть «червонным».
Но без недостатков в этом случае не обошлось – применяя медную лигатуру, полученный материал утрачивает свои антикоррозионные свойства, что обусловлено повышенной способностью меди к образованию окислительных реакций с кислородом.
Контактируя с влажной средой и даже просто с воздухом, со временем изделие из такого сплава обязательно потемнеет, при этом утратив свои первоначальные яркие краски и блеск.
Так как медь имеет низкую стоимость, то и сплав из нее не будет слишком дорогим в цене, что отражается на себестоимости готовой продукции – она является самой дешевой.
Во времена Советского Союза золото для населения изготавливалось 583 пробы, и только в 1995 году в производство ввели пробу 585, которая содержала меди на 0,2% меньше, чем предыдущий аналог, но при этом содержание золота увеличилось на те же 0,2%, что незамедлительно привело в свое время к удорожанию золотых изделий.
В настоящее время от 583 пробы золотого сплава отказались, и используют только 585.
Этот природный металл применяется ювелирами для того, чтобы очистить золотой сплав от природной рыжины, и особенно часто такую лигатуру применяют при изготовлении особо ценного белого золота.
При сочетании в драгоценном сплаве Au и Ni прочность готового драгоценного материала в значительной мере увеличивается.
У изделий, выполненных из такого благородного сплава, появляется стальной цвет с едва уловимым бледно-соломенным оттенком.
Чтобы окончательно устранить эту слабо проявляющуюся желтизну, поверхность готовых ювелирных изделий покрывают тонким слоем из другого металла – родия. Делают это не только для красоты, но и чтобы снизить аллергенность драгоценных изделий.
Дело в том, что металл никель известен тем, что обладает способностью вызывать аллергические проявления на коже. У 8 человек из 10 эти проявления обязательно дадут о себе знать при ношении ювелирных украшений.
Поэтому из сплавов, где в качестве лигатуры использовался никель, чаще всего изготавливают броши, запонки, подвесные кулоны, брелоки – словом, то, что мало соприкасается с кожей человека при длительном контакте. Со временем тонкое родиевое покрытие на ювелирных изделиях стирается, и примерно 1 раз в 6 или 7 лет его потребуется обновлять в ювелирной мастерской.
После проведения таких реставрационных работ украшение опять будет выглядеть как новенькое, поблескивая стальными голубовато-серебристыми переливами.
Химический элемент, называемый палладием, по мнению химиков, является продуктом, который в качестве побочного появился при обработке драгоценных металлов. Получили этот элемент, соединив вместе платину, цианид ртути и царскую водку (ее состав: 3 части азотной + 1 часть соляной кислоты).
Таким образом, открытие этого металла было сделано, когда уже были открыты Pd, Au, Pt и Ag. При обычной температурной среде на палладий не действует фтор, не влияют соляная кислота и даже царская водка.
Этот металл абсолютно не склонен к оксидированию при соприкосновении с кислородом, он обладает очень прочной структурой, и на нем не появляются царапины, трещины или сколы, а кроме того, он хорошо подвержен любой механической обработке и сварке.
Добавляя металл палладий в качестве лигатурного компонента к золотому сплаву, можно добиться получения золота белого цвета. Из-за необычности и повышенной прочности золотые изделия с палладием превосходят по своему качеству и стоимости другие золотые сплавы, имеющие в своем составе более простые компоненты.
Палладий ценится не только в ювелирном производстве, но и находит применения начиная от медицины и заканчивая самолетостроением. На международных рыночных торгах стоимость котировок палладия иногда превышает даже стоимость золота, а ювелирные изделия из него выглядят по-особенному элегантно и благородно. Они пользуются высоким спросом у ценителей белых драгоценны сплавов.
На сегодняшний день природная платина является самым дорогим из всех драгоценных металлов, известных человечеству. По своим физико-химическим свойствам платина обладает в 2 раза большей плотностью и прочностью, чем ее драгоценный собрат – золото.
Кроме того, у платины отмечены наиболее высокие показатели стойкости к корродированию металла – при соприкосновении с кислородом окисления не происходит.
Платина по своим свойствам более всего сходна с металлом палладием, разница между ними заключается более всего в стоимости – платина стоит дороже, чем палладий.
При создании благородного сплава к чистому золоту добавляют платину, и тогда после переплавки получается изделие сверкающего серебристо-белого цвета, в котором абсолютно отсутствуют любые примеси желтизны.
Входя в состав золотого сплава, платина значительно увеличивает его стоимость, что сказывается и на готовых ювелирных изделиях.
Однако этот сплав пользуется неизменно высокой популярностью и имеет очень хорошую репутацию у тех, кто ценит чистейшие белые сплавы, созданные из благородных металлов.
О том, почему золото имеет большую ценность, вы можете узнать ниже.
Свойства золота: основные физические, химические, полезные лечебные и магические
Запись обновлена: Май 26, 2020
Золото вместе с серебром и еще шестью металлами платиновой группы называют благородными, или драгоценными, металлами. Что означают эти определения? Золото очень неохотно вступает в соединения с химическими элементами, которые не относятся к металлам.
Самым простым примером является взаимодействие с кислородом: ведь неблагородные металлы в этом случае окисляются, а золото сохраняет свой внешний вид и структуру. Именно за эти качества желтый металл и получил определение «благородный».
Редкость золота в природе, его долговечность и красота позволили ему получить еще и статус драгметалла. Каковы главные свойства золота?

Характеристика физических свойств металла
Золото — один из самых тяжелых металлов, которые известны человеку. Металл относится к 11 группе таблицы им. Д.И. Менделеева. В настоящее время известно 37 изотопов элемента, из которых в природе можно найти только один — Au197.
Золото как химический элемент известно еще в древнейших времен. Описание внешнего вида металла и его свойства интересовали многих ученых, относящихся к разным эпохам истории человечества. Золото — единственный металл, который обладает красивым желтым цветом изначально. В чистом виде цвет драгметалла яркий и теплый, не зря во все века его связывали с солнцем.
Плотность золота равна 19,32 г/см3, еще большей плотностью обладают только платина, осмий, рений и иридий. Представьте себе золотой куб с ребром в 1 метр — его вес составит 19,32 тонны. Вес такого же куба железа будет в три раза меньше – около 7 880 кг.
Золото плавится при температуре 1064,43°С – при дальнейшем нагревании начинает улетучиваться, отметка кипения находится на уровне в 2947°С. В расплавленном состоянии цвет металла сменяется с желтого на бледно-зеленоватый.

Твердость золота по шкале Мооса составляет всего лишь 2,5-3,0, в чистом виде металл отличается мягкостью. Именно поэтому в чистом виде драгметалл используется редко: для повышения твердости его сплавляют с другими элементами – серебром, медью, палладием.
Многие при просмотре видео исторического характера или прочтении книг замечали, что часто герои пробуют золото «на зуб».
Это действие как раз и помогало выявить обман: на золотых монетах оставался след от зуба, на поддельных из-за наличия других элементов в составе такой след оставить невозможно.
Золото во все века использовалось для изготовления различных изделий – украшений, посуды, статуэток. Подобное применение металла обеспечивают два важнейших свойства металла: ковкость и пластичность.
Желтый металл отличается от всех остальных наибольшей ковкостью. Его можно без нагрева расковать в тоненькие листочки толщиной до 0,1 мкм. Даже в таком «раскатанном» состоянии золото сохранит и цвет, и свои главные свойства.
Примером подобного использования металла является сусальное золото для покрытия церковных куполов.
Повышенная пластичность и тягучесть драгметалла также используется на благо промышленности: из золота растягивают тончайшие проволоки для микросхем.

Физические свойства золота обеспечивают металлу широкое применение в области микроэлектроники.
Металл отличается низким сопротивлением, хорошими показателями теплопроводности и устойчивостью к окислительным процессам.
Способность драгметалла отражать инфракрасный свет используют при остеклении высоток, при изготовлении стекол для морских судов, самолетов и вертолетов, визоров шлемов космонавтов.
Благодаря своим физическим свойствам желтый металл легко поддается самым разным видам обработки, включая полировку и пайку. Все эти качества наряду с легким вступлением в сплавы с другими металлами позволили золоту с древних времен занять лидирующее положение основного драгоценного металла и сырья большинства ювелирных изделий.
Характеристика химических свойств металла
Химическое обозначение желтого металла – Au, сокращение от «aurum», что с латыни означает «сияющая заря». Золото относится к инертным веществам. В стандартных условиях оно не вступают в реакции с природными веществами, единственное исключение – амальгама – соединение золота и ртути.

Химические свойства золота исключают растворение металла в кислотах и щелочах. Сделать это можно только в царской водке, представляющей смесь азотной и соляной кислот, причем обязательно в концентрированном виде. На фото трудов алхимиков разных времен можно рассмотреть, что эту реакцию сопровождали рисунком льва, пожирающего солнечный диск.
Золото можно растворить в жидком броме и водном растворе цианидов, но обязательно при наличии кислорода. Металл медленно растворяется в хлорной и бромной воде, в растворе йода в йодистом калии.
С повышением температуры способность золота вступать в реакцию с другими соединениями возрастает: его можно растворить в селеновой кислоте.
Кислота в этом случае должна быть горячей и иметь высокую концентрацию.

Свойства золота охватывают непрочность его соединений, которые очень легко восстанавливаются до чистого металла. Ту же самую амальгаму требуется просто нагреть до 800°С.
В домашних условиях практически никакие вещества вступить в реакцию с золотом не могут. Но не стоит забывать, что все ювелирные украшения – цепочки, серьги, браслеты, кольца – сделаны не из чистого золота, а его сплавов, где присутствуют другие металлы. Поэтому рекомендуется исключать взаимодействия золотых изделий с веществами, в составе которых есть ртуть, хлор и йод.
Химические свойства золота и его физические характеристики как металла не являются единственными качествами, которые активно используются человеком. У золота есть множество других полезных свойств, не зря оно активно используется в традиционной и народной медицине.
Золото в лечебных целях
Первые способы лечения желтым металлом, как и его основные физические и химические свойства нашли отражение в трудах древних ученых и алхимиков. Изучением золота занимались и во времена Средневековья, научные исследования в этой области продолжаются и сейчас. Ученые разных стран стремятся найти новые способы использования драгметалла в медицине и промышленности.

Еще в древности золото считали средством от многих болезней, настоящим эликсиром жизни. Наши предки считали, что если золото имеет силу над человеком, то оно способно вылечить его недуги: убрать боль, придать сил и бодрости, избавить от стресса, исключить появляющиеся симптомы заболеваний.
Лечебные свойства золота включают в себя:
- Снятие воспалений;
- Улучшение протекания обменных процессов в организме;
- Излечение от аллергии;
- Благоприятное воздействие на нервную систему;
- Стимулирование мозговой активности и улучшение памяти;
- Повышение выносливости организма человека.
При лечении золотом не требуется делать каких-либо особенных процедур, достаточно носить украшения из этого драгметалла. Древние врачеватели считали, что золото продлевает жизнь.

Основные свойства золота лечебной направленности используются обычно в нетрадиционной медицине. Золотые украшения рекомендуется носить всем, кто имеет проблемы с сердцем, печенью, страдает кожными заболеваниями, а также при женских проблемах. Драгметалл способен убивать вирусы и вредные микробы, поэтому может служить средством дополнительной профилактики в сезон гриппа простуды.
Полезные свойства солнечного металла позволяют народным лекарям рекомендовать ношение золота для:
- Энергетической подпитки организма;
- Приобретения уверенности в собственных силах;
- Защиты от сглаза и порчи;
- Сохранения хорошего настроения и быстрого восстановления сил;
- Успешной борьбы с депрессиями и стрессами;
- Продуктивной работы мозга и памяти.
Применение золота в лечебных целях может подойти не каждому: у некоторых людей проявляется индивидуальная реакция на металл.
Тем, кто любит носить много массивных украшений из желтого металла, требуется оценить, не наносят ли они вред организму. Свойства золота, направленные на помощь человеку, могут оказаться во все не полезными в отдельных случаях.
При наличии чувствительности к металлу может ухудшиться рост волос, проявиться депрессия или просто преобладать плохое настроение, начаться разрушение зубов, наблюдаться сбои в работе внутренних органов или просто аллергия на кожных покровах.
В таких ситуациях использование золотых украшений необходимо строго ограничить.
Немного о магии золота
Золото считается солнечным металлом, очень мощным и сильным элементом. Магические свойства золота, как металла Солнца, воздействуют на сильных людей, у которых в космограмме ярко выражены мужские знаки.
По знакам зодиака драгметалл рекомендован к постоянному ношению для Львов, Тельцов и Овнов, по самочувствию можно носить украшения из золота Стрельцам, Водолеям, Скорпионам, Близнецам, для остальных знаков ношение золото должно иметь эпизодический характер.
Золото приносит богатство. Магическая характеристика металла свидетельствует о притяжении им новых денег, о наделении человека смелостью и мужеством, которые необходимы для достижения всех поставленных перед собой целей.

Медальон из золота в форме солнца с давних пор считается талисманов для тех, кто работает под землей. Он позволяет сохранить бодрость духа, восстановить физические силы, а также уберегает от обвалов и других несчастий. Медальон из драгметалла, носящийся в области солнечного сплетения, исполняет защитную функцию от любого приворота.
Для тех желающих, кто хочет испытать золото и его волшебное свойство металла, необходимо не просто носить драгоценные украшения, но и верить в их действие. Приобретая уверенность в себе, вы сможете претворить в жизнь все свои цели и мечты, еще недавно казавшиеся недостижимыми.

Самые разные свойства золота – физические, химические, лечебные – обуславливают его ценность в человеческом обществе и спрос на металл в современном мире. На рынке драгметалла уже много лет наблюдается дефицит: предложение намного ниже спроса.
Золото, технический анализ которого показывает снижение продаж, постоянно растет в цене, но вот добыча металла год от года продолжает снижаться.
Возмещение дефицита металла, который в силу своих характеристик востребован не только в области инвестирования и ювелирного дела, но и широко применяется в промышленном производстве, происходит только за счет плавки и повторного использования желтого металла.
Золото — свойства атома и сплавов
 |
Атомы — Lego природы. |
Золото (лат. Aurum), Au, химический элемент 1 группы периодической системы Менделеева; атомный номер 79, атомная масса 196,9665; тяжёлый металл жёлтого цвета, относящийся к благородным. Состоит из одного устойчивого изотопа 197Au.
Обзоры приведены в соответствии с энциклопедическими статьями С. А. Погодина и А. И. Стадниченко.
Разделы страницы о золоте как веществе и материале:
- Физические и физико-химические свойства золота
- Химические свойства золота и его соединений — см. также геохимию золота
- Золото в природе — см. также золоторудные поля и золотоносные узлы
- Историческая справка об использовании золота
- Извлечение золота — см. также разведку и добычу золота
- Золото в ноосфере (применение)
- Золото в биосфере и в медицине — см. также о биогенной концентрации золота
- Сетевые обзоры о золоте
- Сетевые новости о золоте
- Библиография по золоту
 ЗОЛОТО (Aurum) Au, хим. элемент I гр. периодич. системы, ат. н. 79, ат. м. 196,9665; относится к благородным металлам. В природе один стабильный изотоп 197Аu. Конфигурация внеш. электронной оболочки 5d106s1; степени окисления +1, +3, редко +5; энергии ионизации Аu0 : Аи+ : Аu2+ : Аu3+ соответственно равны 9,2258, 20,5 и 30,5 эВ; электроотрицательность по Полингу 2,4 сродство к электрону 2,8 эВ; атомный радиус 0,144 нм, ионные радиусы (в скобках указаны координац. числа) Аu+ 0,151 нм (6), Аu3+ 0,082 нм (4), 0,099 нм (6). 3олото — желтый металл; кристаллич. решетка гранецентрир. кубическая, а = 0,40786 нм, z = 4, пространств. группа Fm3m. Золото — мягкий, очень пластичный, тягучий металл (может быть проковано в листки толщиной до 8·10-5 мм, протянуто в проволоку, 2 км которой весят 1 г): твердость по Моосу ~ 2,5, по Бринеллю 220-250 МПа; модуль упругости 81 ГПа; sраст 10-25 МПа. Золото хорошо проводит тепло и электричество. ЗОЛОТО (Aurum) Au, хим. элемент I гр. периодич. системы, ат. н. 79, ат. м. 196,9665; относится к благородным металлам. В природе один стабильный изотоп 197Аu. Конфигурация внеш. электронной оболочки 5d106s1; степени окисления +1, +3, редко +5; энергии ионизации Аu0 : Аи+ : Аu2+ : Аu3+ соответственно равны 9,2258, 20,5 и 30,5 эВ; электроотрицательность по Полингу 2,4 сродство к электрону 2,8 эВ; атомный радиус 0,144 нм, ионные радиусы (в скобках указаны координац. числа) Аu+ 0,151 нм (6), Аu3+ 0,082 нм (4), 0,099 нм (6). 3олото — желтый металл; кристаллич. решетка гранецентрир. кубическая, а = 0,40786 нм, z = 4, пространств. группа Fm3m. Золото — мягкий, очень пластичный, тягучий металл (может быть проковано в листки толщиной до 8·10-5 мм, протянуто в проволоку, 2 км которой весят 1 г): твердость по Моосу ~ 2,5, по Бринеллю 220-250 МПа; модуль упругости 81 ГПа; sраст 10-25 МПа. Золото хорошо проводит тепло и электричество. |
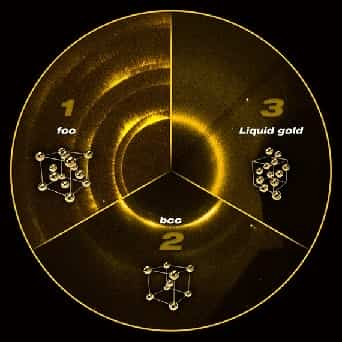
- Кристаллическая решётка золота гранецентрированная кубическая, а = 4,704 A.
- ⚛ Атомный радиус 1,44 A, ионный радиус Au1+ 1,37 A.
- tпл 1064,43°С, tkип 2947°С (приводится также величина 2880 °С); термический коэффициент линейного расширения 14,2·10-6 (0—100°С);
- температурные коэф. линейного расширения (5,98-19,10).10-6 К-1 (40-1200 К), объемного (1,79-5,73).10-5 К-1 (40-1200 К); теплопроводность 318 Вт/(м.К) при 273 К; r (2,06-2,84).10-8 Ом.м (273-373 К), температурный коэф. r 4,0.10-3 К-1 (273-373 К);
- удельная теплопроводность 311,48 вт/(м·К) [0,744 кал/см (сек·°С]; удельная теплоёмкость 132,3 дж/(кг·К) [0,0316кал/г·°С] (при 0°—100°С);
- удельное электросопротивление 2,25·10-8ом (м (2,25·10-6 ом (см) (при 20°С); температурный коэффициент электросопротивления 0,00396 (0—100°С).
- С0p 25,39 Дж/(моль.К); DH0пл 12,55 кДж/моль, DH0исп 348 кДж/моль; S0298 47,40 Дж/(моль.К);
- ур-ния температурной зависимости давления пара: для твердого 3. lgp (гПа) = 3,94 — 19820/T — 0,3061gT — 0,16.10-3 Т (298-1337 Т), для жидкого lgp(Пa) = 10,710 + 17866/Т (1337-3150 К);
- диамагнетик, магн. восприимчивость —29,59.10-6.
- Плотность твердого золота 19,32 г/см3 (при 20°С), жидкого 17,22 г/см3 (1100°С);
- Модуль упругости 79·103Мн/м2 (79·102кгс/мм2), для отожжённого золота предел прочности при растяжении 100—140 Мн/м2 (10—14 кгс/мм2), относительное удлинение 30—50%, сужение площади поперечного сечения 90%.
- После пластической деформации на холоду предел прочности повышается до 270—340 Мн/м2 (27—34 кгс/мм2). Твёрдость по Бринеллю 180 Мн/м2 (18 кгс/мм2) (для золота отожжённого около 400 °С).
Золото весьма стойко против химических воздействий. Оно устойчиво на воздухе и в воде. С О2, Н2, N2, P, Sb и С непосредственно не взаимодействует. Фосфид Аu2Р3 (DH0обр -102 кДж/моль) и антимонид AuSb2 (DH0обр — 13 кДж/моль) получают косвенным путем.
3олото не растворяется в р-рах щелочей и к-тах, раств. в горячей H2SeO4, смесях к-т — Н2SО4 с HNO3, H2SO4 с НМnО4, а также в царской водке (НСl + НNO3): Аu + HNO3 + 4НСl : H[AuCl4] + NO + 2Н2О; после осторожного выпаривания выделяются желтые кристаллы комплексной золотохлористоводородной к-ты НАuСl4.3Н2О.
В водных р-рах цианидов (Na, Ca, К) при доступе О2 или др. окислителей золота раств. с образованием дицианоаурат-иона (цианирование): 2Au + 4CN- + Н2О + 0,5О2 : 2[Au(CN)2]- + 2OH-, что лежит в основе важнейшего пром. способа извлечения золота из руд. С галогенами в отсутствие влаги золото без нагревания не взаимод., при нагр.
порошка золота в атмосфере галогенов образуются золота галогениды.
С многими металлами золото дает сплавы. На легком образовании амальгамы золота основан один из методов извлечения золота из горных пород. Соед. золота неустойчивы, в водных р-рах гидролизуются, легко восстанавливаются до металла.
Конфигурация внешних электронов атома золота 5d10 6s1. В соединениях золото имеет валентности 1 и 3 (известны комплексные соединения, в которых золото 2-валентно).
Для золота характерна лёгкая восстановимость его из соединений до металла и способность к комплексообразованию. Существование закиси золота, т. е. оксида золота (I) Au2O — сомнительно.
С неметаллами (кроме галогенов) золото не взаимодействует. С галогенами золото образует галогениды, например 2Au + 3Cl2 =2AuC13. В смеси соляной и азотной кислот золото растворяется, образуя золотохлористоводородную кислоту H [AuCl4].
В растворах цианида натрия NaCN (или калия KCN) при одновременном доступе кислорода золото превращается в цианоаурат (I) натрия 2Na [Au (CN)2]. Эта реакция, открытая в 1843 П. Р. Багратионом, получила практическое применение только в конце 19 в. (см. Цианирование).
Хлорид золота (I) AuCl получается при нагревании хлорида золота (III): AuC13 = AuCl + C12.
Хлорид золота (III) AuC13 получается действием хлора на порошок или тонкие листочки золота при 200 °С. Красные иглы AuCl3 дают с водой коричнево-красный раствор комплексной кислоты: AuC13 +Н2О=Н2[AuOC13].
При осаждении раствора AuC13 едкой щёлочью выпадает амфотерная жёлто-коричневая гидроокись золота(III) Au(OH)3 c преобладанием кислотных свойств; поэтому её называют золотой кислотой, а её соли — ауратами (III). При нагревании гидроокись золота (III) превращается в окись золота Au2O3, которая выше 220° разлагается по реакции: 2Au2O3 = 4Au + 3O2.
При восстановлении солей золота хлоридом олова (II) 2AuC13 + 3SnCl2 = 3SnCl4 + 2Au образуется весьма стойкий пурпуровый коллоидный раствор золота (кассиев пурпур); это используется в анализе для обнаружения золота. Количественное определение золота основано на его осаждении из водных растворов восстановителями (FeSO4, H2SO3, H2C2O4 и др.) или на применении пробирного анализа.
Гидроксид Au(OH)3 — темно-коричневые кристаллы; при нагревании дегидратируется с образованием сначала АuО(ОН), а затем сесквиоксида Аu2О3, к-рый выше 160°С разлагается на золото и О2; растворимость в воде 2,4.
10-12 моль/л при 20°С, в р-рах НNО3 — до 0,38 моль/л при 25 °С, в растворах NaOH — до 8.10-4 моль/л при 25°С. В последнем случае в растворе золото находится в виде гидроксоаурат-ионов [Аu(ОН)4]- (рН 7-13).
Образуется Аu(ОН)3 при добавлении концентрированного раствора щелочи или Mg(OH)2 к растворам Н[АuСl4].
Ауpaты неустойчивы, легко разлагаются при нагревании.
Аураты щелочных металлов хорошо растворяются в воде, растворимость растет с увеличением ионного радиуса катиона; аураты Mg, Ca, Sr, Ba, Тl(I) ограниченно растворимы.
Аураты с некоторыми органическими веществами образуют взрывчатые смеси. Предполагают, что при действии на гидроксид золота растворов щелочи образуются аурат-анионы [Н2АuО3]-, [HAuO3]2-, [AuO3]3-. См. также табл. 2.
Другие кислородные соединения золота неустойчивы, легко образуют взрывчатые смеси. Соединение Аu2О3 с аммиаком Au2O3.4NH3 называется «гремучим золотом»; взрывается при 145°С, иногда и при более низких температурах; без взрыва растворяется в растворах цианидов щелочных металлов.
Гемисульфид золота Au2S — черно-коричневые кристаллы; DG0обр 29 кДж/моль; плохо раств. в воде (произведение р-римости 4.10-69 при 25 °С), раств. в р-рах цианидов и полисульфидов щелочных металлов. Получают взаимод. конц. р-ра K[Au(CN)2] с H2S с послед. нагреванием до кипения с избытком соляной к-ты.
Сесквисульфид Au2S3 — черные кристаллы; разлагается при нагр. до 200 °С; не раств. в соляной и серной к-тах, раств. в HNO3 с выделением элементарного золота, р-рах KCN, бромной воде. Получают взаимод. H2S с АuСl3 или комплексными хлоридами золота в безводном эфире на холоду. Известны комплексные соед.
, содержащие анионы [AuS3]2-, [AuS2]-, [AuS]-, [Au(SO3)2]3-, [Au(S2O3)2]3- .
Моноселенид AuSe существует в двух кристаллич. модификациях моноклинной сингонии. При обработке солянокислых р-ров золота на холоду селеноводородом осаждается сесквиселенид Au2Se3.H2Se, устойчивый (после сушки) в интервале 40-390°С; при 535-650°C разлагается с выделением элементарного золота.
Селенат (IV) Au2(SeO3)3.3H2SeO3 лимонно-желтые кристаллы; не раств. в воде, раств. в соляной и селенистой (при нагр.) к-тах.
Селенат (VI) Au2(SeO4)3 желтые кристаллы; DH0обр — 954 кДж/моль; не раств. в воде, разлагается соляной к-той, раств. в H2SO4, HNO3 и горячей конц. H2Se04.
Теллурид (гемителлурид) АuТе2 — кристаллы от латунно-желтого до серебристо-белого цвета с металлич. блеском; плотн. 9,3 г/см, DH0обр — 11 кДж/моль; хрупок, твердость по Моосу 2,5-3.
Тиоцианат AuSCN — бесцв. кристаллы; не раств. в воде и орг. р-рителях; при 140°С разлагается до металлич. золота и (SCN)n; под действием воды образует в р-рах прочные комплексные анионы [Au(SCN)2]- и [Au(SCN)4]- .
При восстановлении золота в разб. р-рах его солей, а также при электрич. распылении золота в воде образуются коллоидные р-ры золота, окраска к-рых зависит от степени дисперсности частиц, а интенсивность окраски от их концентрации. Частицы золота в коллоидном р-ре отрицательно заряжены. Гидрофобный золь золота в солянокислом водном р-ре можно представить схемой:
[Аu]m — ядро мицеллы (число атомов т в зависимости от условий может меняться от неск.
сотен до миллионов единиц); АuСl4- — ионы, определяющие отрицательный заряд коллоидной частицы золота и величину потенциала адсорбционного слоя толщиной d0; Н+ — противоионы, определяющие потенциал диффузионного слоя (электрокинетич.
потенциал), из к-рых х ионов находится в размытой части двойного слоя толщиной d; n — кол-во ионов АuСl4-, адсорбированных на поверхности ядра мицеллы, при этом п
Золото (Au)
- Обозначение — Au (Aurum);
- Период — VI;
- Группа — 11 (Ib);
- Атомная масса — 196,96655;
- Атомный номер — 79;
- Радиус атома = 144 пм;
- Ковалентный радиус = 134 пм;
- Распределение электронов — 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1;
- t плавления = 1064,18°C;
- t кипения = 2856°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,54/1,42;
- Степень окисления: +5, +3, +1, -1;
- Плотность (н. у.) = 19,3 г/см3;
- Молярный объем = 10,2 см3/моль.
Золото является одним из самых «необычных» металлов, известных человеку с давних пор — наши предки использовали золото по большей части в культурно-религиозных целях, а также в качестве одного из самых надежных платежных средств.
Золото в природе встречается в подавляющем большинстве случаев в виде самородков. С некоторыми металлами золото может образовывать природные твердые растворы:
- электрум — серебристое золото;
- аурокуприд — меднистое золото;
- платинистое золото.
В виде соединений золото в природе встречается гораздо реже (калагерит AuTe2, ауростибит AuSb2). Достаточно много золота содержится в морской воде, но добыча такого золота нерентабельна.
Золото в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером «79», относится к переходным металлам (См. Атомы переходных элементов).
Рис. Строение атома золота.
Электронная конфигурация атома золота — 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1 (см. Электронная структура атомов). Золото является одним из самых малоактивных химических элементов — оно не окисляется на воздухе даже в присутствии влаги, не взаимодействует непосредственно с кислородом, водородом, азотом, углеродом, фосфором.
Физические свойства золота:
- золотисто-желтый металл;
- очень пластичный и мягкий — можно раскатать в прозрачную фольгу толщиной несколько микрон (сусальное золото), которой покрывать разнообразные художественные и религиозные изделия (производить золочение), придавая им эстетический привлекательный вид, который сохраняется длительное время;
- обладает хорошей электро- и теплопроводностью.
Химические свойства золота:
- реагирует с галогенами при нагревании: 2Au + 3Cl2 = 2AuCl3;
- не растворяется в щелочных и кислотных растворах;
- растворяется в смесях кислот: HCl+HNO3 (царской водке) и H2SO4+HNO3: Au + 3HNO3 + 3HCl = AuCl3 + 3NO2 + 3H2O;
- металлическое золото переходит в раствор в виде комплексной соли в водных растворах цианида калия и натрия в присутствии окислителей: 4Au + 8KCN + 2H2O + O2 = 4K[Au(CN)2] + 4KOH;
- легко растворяется в ртути с образованием сплава (амальгамы).
- Кислородные соединения золота при незначительном нагревании легко разлагаются со взрывом, например, гремучее золото взрывается при 145°C.
- Соединения золота достаточно легко гидролизуются и восстанавливаются до свободного металла в водных растворах, поскольку являются неустойчивыми соединениями: при нагревании гидроксид золота (III) дегидратируется образуя оксид золота (III), который, в свою очередь, распадается с образованием свободного золота при 160°C: 4Au(OH)3 → 2Au2O3 → 4Au + 3O2.
- Гидроксид и оксид золота (III) — амфотерные соединения, реагируют с кислотами и основаниями, образуя комплексные соединения:
- Au(OH)3 + KOH = K[Au(OH)4]
- Au(OH)3 + 4HCl = H[AuCl4] + 3H2O
Применение золота:
- в ювелирном деле;
- как международное платежное средство;
- в электротехнике для золочения контактов;
- для нанесения покрытий на металлические поверхности;
- в медицине для изготовления инструментов и протезов;
- как катализатор при проведении некоторых реакций в химической промышленности;
- радиоактивный изотоп золота применяют в онкологии для лечения новообразований.