- Задача 82
- Задача 84
- Задача 85
- Задача 86
- Задача 87
- Задача 88
- Задание по химии для 9 класса — Тема: «Химические свойства металлов»
- План-конспект урока химии 9 класс по теме "Общие химические свойства металлов"
- Практическая работа по химии Химические свойства металлов и их соединений 9 класс
- Химия 9 класс Габриелян Самостоятельные
- Химия 9 класс (Габриелян) Самостоятельные работы:
- Тема № 1. Общая характеристика химических элементов и химических реакций.
- Тема № 2. Металлы.
- Тема № 3. Неметаллы.
- Открытый урок в 9 классе по теме «Химические свойства металлов» — презентация
- Тест Химические свойства металлов
Решение:
Щелочные металлы стоят в начале ряда напряжений металлов. Являясь наиболее активными, они легко окисляются кислородом воздуха уже при обычных температурах. Однако для каждого из указанных металлов есть свои особенности. Литий уже при обычных температурах реагирует как с кислородом воздуха, так и со вторым компонентом воздуха — азотом, образуя, соответственно, оксид и нитрид лития:
При высоких температурах вместо оксида лития образуется пероксид лития:
Натрий: а) при обычной температуре —
б) при высоких температурах —
б) при высоких температурах —
Задача 82
Основываясь на знании общих химических свойств металлов, написать уравнения следующих химических реакций:
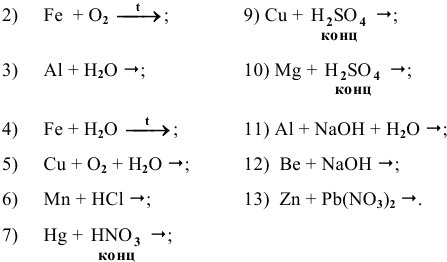
Решение:
5) Электрохимическая коррозия меди с кислородной деполяризацией:
- Задача 83
- С какими из следующих веществ может реагировать ртуть:
- Решение:
Задача 84
- Среди металлов: — найти наиболее и наименее сильный восстановитель:
- а) в водных средах;
- б) в неводных средах.
- Решение:
- В водных средах количественной характеристикой восстановительных свойств металла является величина его электродного потенциала.
Для изучаемых металлов величины стандартных электродных потенциалов следующие:
- Наиболее низкий электродный потенциал у кальция, значит, он наиболее сильный восстановитель в водных средах, а наиболее высокий электродный потенциал у цинка, значит, он наиболее слабый восстановитель среди перечисленных металлов.
- В неводных средах количественной характеристикой восстановительных свойств металла является величина его энергии ионизации.
- Величины энергий ионизации изучаемых металлов находим в справочнике:
Наиболее низкая энергия ионизации (ионизационный потенциал) у натрия — самого сильного восстановителя из перечисленных металлов, наиболее высокая энергия ионизации у цинка — самого слабого восстановителя.
Задача 85
- Составить и уравнять с помощью электронного баланса ОВ реакции.
- Решение:
- Ниже приводятся уравнения уже составленных и уравненных реакций:
Задача 86
- Каким методом может быть получен металлический магний?
- Решение:
- Магний — это очень активный металл, его электродный потенциал
Значит, магний может быть получен не электролизом водных растворов солей магния, а электролизом расплавов его солей, например электролизом расплава :
Магний также может быть получен металлотермией при использовании какого-либо металла, химическое сродство которого к атому, с которым он связан, выше, чем у магния, например:
Докажем возможность использования Na:
Так как , то реакция термодинамически возможна. Металлический натрий может быть использован для получения металлического магния из .
Задача 87
При смешивании расплавленных масс магния и свинца образуется интерметаллическое соединение, содержащее 81% РЬ. Какова его формула?
Решение:
— формула интерметаллического соединения в общем виде. Индексы х и у находим из следующих отношений:
Таким образом, формула интерметаллического соединения — .
Задача 88
Для определения процентного содержания серебра в старой монете растворили 0,3 г этой монеты в концентрированной . Затем из полученного раствора серебра осадили раствором соляной кислоты в виде осадка . Масса осадка равна 0,199 г. Каково содержание серебра в монете?
Решение:
Уравнения химических реакций, происходящих в ходе анализа, следующие:
Согласно уравнениям этих двух реакций, 1 моль образует 1 моль .
Рассчитаем массу серебра, соответствующую 0,199 г :
Вычислим процентное содержание серебра в монете:
- Эти задачи взяты со страницы решения задач по неорганической химии:
- Задачи с решением по неорганической химии
- Возможно эти страницы вам будут полезны:
Задание по химии для 9 класса — Тема: «Химические свойства металлов»
Выполните задание онлайн олимпиады и узнайте результат.
Для зарегистрированных участников, результаты отправляются на электронную почту.
Вы уже проходили тест ранее. Вы не можете запустить его снова.
Вы должны войти или зарегистрироваться для того, чтобы начать тест.
Вы должны закончить следующие тесты, чтобы начать этот:
- Правильных ответов: 0 из 10
- Ваше время:
- Время вышло
- Вы набрали 0 из 0 баллов (0)
| Средний результат |
| Ваш результат |
-

Поздравляем!
Вы отлично справились с заданием.
Ваш результат соответствует 1 месту.
Оформить диплом -

Поздравляем!
Вы хорошо справились с заданием.
Ваш результат соответствует 2 месту.
Оформить диплом -

Поздравляем!
Вы выполнили задние допустив незначительное количество ошибок.
Ваш результат соответствует 3 месту.
Оформить диплом -

Сделайте работу над ошибками.
Попробуйте пройти тестирование еще раз и добиться хорошего результата.
Ваш результат может стать значительно лучше.
План-конспект урока химии 9 класс по теме "Общие химические свойства металлов"
- «План-конспект урока»
- Тема урока: «Общие химические свойства металлов»
- Цель: Рассмотреть общие химические свойства металлов.
- Задачи:
1.Охарактеризовать общие химические свойства металлов на основе знаний о строении атома и кристаллической решетки металлов.
2. На примере реакций, характеризующих химические свойства, повторить типы химических реакций.
3. Совершенствовать навыки учащихся по обращению с веществами и химическим оборудованием;
3.Развить умение сравнивать и делать выводы из увиденного.
4. Воспитать самостоятельность учащихся.
- Методы обучения:
- Объяснительно-иллюстративные (интерактивные схемы); репродуктивные (тренажеры); частично-поисковый (лабораторная работа)
- Тип урока: Комбинированный урок
- План урока
- 1. Актуализация опорных знаний изучаемой темы
- 2. Изложение нового материала:
- А) Обзор свойств металлов;
- Б) Изучение каждого из свойств металлов более подробно.
3. Закрепление знаний учащихся на уроке.
Источники:
Федеральный центр цифровых образовательных ресурсов http://www.fcior.edu.ru
Единая коллекция цифровых образовательных ресурсов http://school-collection.edu.ru
- Ход урока:
- 1. Актуализация опорных знаний изучаемой темы
- Фронтальный опрос с применением интерактивного задания:
Положение металлов в периодической системе элементов Д. И. Менделеева http://files.school-collection.edu.ru/dlrstore/0ab8f178-4185-11db-b0de-0800200c9a66/x9_008.swf
Строение атома металла по положении в ПСХЭ http://files.school-collection.edu.ru/dlrstore/bb574e8d-aae7-11db-abbd-0800200c9a66/ch09_01_03.swf
Вывод из работ:
Какие свойства будут иметь металлы (восстановители или окислители). Как вы думаете, почему? http://files.school-collection.edu.ru/dlrstore/0ab966ab-4185-11db-b0de-0800200c9a66/x9_059.swf
- Наша цель раскрыть этот вопрос, используя виртуальные и «живые» лабораторные работы.
- 2. Объяснение нового материала с закреплением:
- Лабораторные работы и используемые ЭОР
- Реакция металлов с простыми веществами: виртуальная лаборатория:
1)Для большинства металлов характерна реакция с кислородом (горение магния в кислороде)http://files.school-collection.edu.ru/dlrstore/55a4babd-d3a0-e5b4-6daa-0f50b8f5267f/index.htm,
2) Большинство металлов взаимодействуют с галогенами (Взаимодействие йода с алдюминием)http://files.school-collection.edu.ru/dlrstore/bf44b9fa-6fc0-d64d-c5f0-39781d96d5d1/index.htm;
интерактивные задания по опытам: http://files.school-collection.edu.ru/dlrstore/0ab9dbd9-4185-11db-b0de-0800200c9a66/x9_093.swf и http://files.school-collection.edu.ru/dlrstore/0aba510c-4185-11db-b0de-0800200c9a66/x9_146.swf
Реакции металлов с водой: реакция щелочных металлов с водой (лабораторный опыт) и интерактивный вопрос по работе:
реакции металлов с водой (виртуально): http://files.school-collection.edu.ru/dlrstore/bcdf78d2-10a1-a609-e295-1c79473e6eb0/index.htm
интерактивное уравнение: http://files.school-collection.edu.ru/dlrstore/0aba510d-4185-11db-b0de-0800200c9a66/x9_147.swf
http://files.school-collection.edu.ru/dlrstore/0ab9dbdc-4185-11db-b0de-0800200c9a66/x9_096.swf ;
Реакции металлов с кислотами: лабораторно и виртуально:
1) http://files.school-collection.edu.ru/dlrstore/432f464f-1f22-5224-e016-91243ab1f09c/index.htm,
2)http://files.school-collection.edu.ru/dlrstore/9a897ea8-64e1-3877-def6-aba916d777ee/index.htm,
3) http://files.school-collection.edu.ru/dlrstore/94bc9644-96dc-f72e-f414-61f8dca00994/index.htm;
интерактивное уравнение: http://files.school-collection.edu.ru/dlrstore/bed08fa8-8cff-11db-b606-0800200c9a66/ch09_27_04.swf
Реакция металлов с солями: лабораторно и виртуально:
http://files.school-collection.edu.ru/dlrstore/071e7152-156c-edf1-3fe1-f52d09f94462/index.htm , запись уравнений реакций.
- Вывод: Металлы вступают в реакцию:
- С неметаллами;
- С водой (с учетом условий);
- С кислотами(с учетом ряда напряжения металлов);
- С солями(с учетом ряда напряжения металлов);
- 3. Закрепление нового материала
- Коллективная работа с интерактивными ресурсами (интерактивная доска)
- Ответ на тестовые вопросы по теме:
http://files.school-collection.edu.ru/dlrstore/0abac632-4185-11db-b0de-0800200c9a66/x9_184.swf
Решение задач по теме:
http://files.school-collection.edu.ru/dlrstore/0abac633-4185-11db-b0de-0800200c9a66/x9_185.swf
4. Домашнее задание.
1.Проработать параграф учебника
2. Выполнить: задача по химическим свойствам металлов http://files.school-collection.edu.ru/dlrstore/f5980b67-b96d-6409-22f9-cf82249459c0/00119985291253996.htm
Практическая работа по химии Химические свойства металлов и их соединений 9 класс
- Соловьева Джамиля Бисеновна
- МОУ СШ№128 Дзержинского района Волгограда
- учитель химии
- Практическая работа «Химические свойства металлов и их соединений».
- Цель: на практике изучить химические свойства металлов и их соединений.
- Оборудование и реактивы: штатив с пробирками, спиртовая горелка, цинк в гранулах, медь, растворы сульфата меди (II), хлорид железа (III), соляная кислота, железо, азотная кислота, хлорид железа (III), гидроксид калия.
- Порядок выполнения.
- Задание 1
В пробирку поместить 1 гранулу цинка и налить 2-3 мл соляной кислоты.
Что наблюдаете? Сделайте вывод о взаимодействии металлов, стоящих в ряду активности до водорода, с кислотами.
В пробирку поместите медь и налейте 2-3 мл соляной кислоты. Что наблюдаете? Сделайте вывод об отношении малоактивных металлов к кислотам — неокислителям.
Налейте в пробирку 3-4 мл раствора сульфата меди (II) и добавьте гранулу цинка. Что наблюдаете? В другую пробирку налейте 3-4 мл раствора хлорида железа (III) и добавьте медь. Что наблюдаете? Сделайте вывод о способности металлов вытеснять из растворов солей другие металлы.
Задание 2 Исследование отношения железа к различным кислотам
Поместить в пробирку немного порошкообразного железа, налейте 2-3 мл соляной кислоты. Что наблюдаете?
(демонстративный) Поместить в пробирку немного порошкообразного железа, налейте 2-3 мл разбавленной азотной кислоты и слегка нагрейте пробирку в пламени спиртовки. Что наблюдаете?
Сделайте вывод о различном отношении железа к кислотам – неокислителям и окислителям.
Задание 3 Получите гидроксиды железа
Налейте в пробирку 3-4 мл раствора хлорида железа (II). Добавьте по каплям раствор гидроксида калия до образования осадка.
Налейте в пробирку 3-4 мл раствора хлорида железа (III). Добавьте по каплям раствор гидроксида калия до образования осадка.
Сравните цвет осадков гидроксида железа (II) и (III).
По итогам работы заполните таблицу.
| Опыт | Исходные вещества | Условия реакции | Признаки реакции | Уравнение реакции | Вывод |
| Задание 1 | |||||
| Взаимодействие металлов с кислотами | |||||
| Взаимодействие металлов с кислотами | |||||
| Взаимодействие металлов с солями | |||||
| Взаимодействие металлов с солями | |||||
| Задание 2 | |||||
| Взаимодействие железа с соляной кислотой | |||||
| Взаимодействие железа с разб азотной кислотой | |||||
| Задание 3 | |||||
| Получение гидроксида железа (II) | |||||
| Получение гидроксида железа (III) |
Вывод:
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/232816-prakticheskaja-rabota-po-himii-himicheskie-sv
Химия 9 класс Габриелян Самостоятельные
Химия 9 класс Габриелян Самостоятельные работы. Проверочные работы по химии в 9 классе с решениями и ответами в 3-х вариантах из пособия для учащихся Контрольные и самостоятельные работы по химии: 9 класс: к учебнику О. С. Габриеляна «Химия 9 класс» / Н. С. Павлова. — М. : Издательство «Экзамен».
Цитаты из вышеуказанного учебного пособия использованы на сайте исключительно в учебных целях (пп. 1 п. 1 ст.
1274 ГК РФ): цитаты переработаны в удобный формат (каждая работа на 1-й странице), что дает экономию денежных средств учителю и образовательному учреждению я в использовании бумаги и ксерокопирующего оборудования.
При постоянном использовании самостоятельных работ по химии в 9 классе рекомендуем купить книгу: Наталья Павлова: Химия 9 класс. Контрольные и самостоятельные работы по химии. К учебнику О. С.
Габриеляна, которая содержит 3 контрольные работы, 13 тестов по основным темам курса, 28 самостоятельных работ. Все работы представлены в 3 вариантах.
Данное пособие полностью соответствует ФГОС (второго поколения).
Химия 9 класс (Габриелян)
Самостоятельные работы:
Тема № 1. Общая характеристика химических элементов и химических реакций.
Самостоятельная работа № 1. Характеристика химических элементов и их соединений по положению в Периодической системе химических элементов Д.И. Менделеева.
Самостоятельная № 1 + Ответы
Самостоятельная работа № 2. Амфотерные оксиды и гидроксиды.
Самостоятельная № 2 + Ответы
Самостоятельная работа № 3. Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
Самостоятельная № 3 + Ответы
Самостоятельная работа № 4. Скорости химических реакций. Катализаторы.
Тема № 2. Металлы.
Самостоятельная работа № 5. Положение элементов-металлов в Периодической системе Д.И. Менделеева и строение их атомов. Физические свойства металлов. Химические свойства металлов.
Самостоятельная работа № 6. Коррозия металлов.
Самостоятельная работа № 7. Общая характеристика элементов главной подгруппы I группы.
Самостоятельная работа № 8. Соединения щелочных металлов.
Самостоятельная работа № 9. Общая характеристика элементов главной подгруппы II группы. Соединения щелочноземельных металлов.
Самостоятельная работа № 10. Алюминий, его физические и химические свойства. Соединения алюминия.
Самостоятельная работа № 11. Железо, его физические и химические свойства.
Самостоятельная работа № 12. Соединения железа.
Тема № 3. Неметаллы.
Самостоятельная работа № 13. Неметаллы: атомы и простые вещества. Кислород, озон, воздух.
Самостоятельная № 13 + Ответы
Самостоятельная работа № 14. Водород.
Самостоятельная № 14 + Ответы
Самостоятельная работа № 15. Вода.
Самостоятельная № 15 + Ответы
Самостоятельная работа № 16. Общая характеристика галогенов.
Самостоятельная № 16 + Ответы
Самостоятельная работа № 17. Соединения галогенов. Получение галогенов.
Самостоятельная № 17 + Ответы
Самостоятельная работа № 18. Кислород.
Самостоятельная № 18 + Ответы
Самостоятельная работа № 19. Сера, ее физические и химические свойства.
Самостоятельная работа № 20. Соединения серы: сероводород, сульфиды, оксиды серы (IV) и (VI).
Самостоятельная работа № 21. Серная кислота и ее соли.
Самостоятельная работа № 22. Азот и его свойства. Аммиак и его свойства.
Самостоятельная работа № 23. Соли аммония.
Самостоятельная работа № 24. Азотная кислота и ее свойства.
Самостоятельная работа № 25. Фосфор и его соединения.
Самостоятельная работа № 26. Углерод.
Самостоятельная работа № 27. Кислородные соединения углерода.
Самостоятельная работа № 28. Кремний и его соединения.
Вы смотрели: Химия 9 класс Габриелян Самостоятельные работы с решениями и ответами в 3-х вариантах. Цитаты из учебного пособия использованы на сайте в учебных целях.
Вернуться на страницу «Химия 9 класс».
Открытый урок в 9 классе по теме «Химические свойства металлов» — презентация
- 1 Открытый урок в 9 классе по теме «Химические свойства металлов»
- 2 Цель урока: обобщить знание учащихся, полученные ранее при рассмотрении общих химических свойств металлов; повторить особенности протекания реакций металлов с растворами электролитов; развить логические операции мышления при обобщении знаний и конкретизации общих свойств металлов для отдельных представителей этого класса простых веществ.
- 3 Оборудование и реактивы: Mg (лента); Na; Cu; Zn; HCl (1:5); Fe; Al; CuSO 4 ; MgCl 2 ; спиртовка; тигельные щипцы; пробирки.
- 4 Девиз урока: «Для описания свойств вещества достаточно знать его электронную структуру».
5 Первая часть урока – обучающая. Проводится в форме лекции с элементами беседы. В атомах металлов на внешнем энергетическом уровне удерживается небольшое число электронов. Эти электроны могут сравнительно легко отрываться от атомов. Такая особенность металлов является причиной не только их физических, но и химических свойств.
6 На доске записываем общую схему, характеризующую основной процесс происходящий с металлами при химических реакциях:
7 1. Металлы реагируют с неметаллами. Наиболее энергично с кислородом, хлором, серой (галогенами). Опыт! Горение магния.
8 Эти уравнения учащиеся составляют самостоятельно:
9 2. Металлы реагируют с водой. Опыт! Взаимодействия натрия с водой. Взаимодействие меди с водой. Из опытов видно, что металлы реагируют с водой неоднозначно.
10 а) Щелочные металлы и щелочноземельные Ca и Ba c водой образуют гидроксиды соответствующих металлов и водород!
11 б) Mg, Al, Mn, Zn, Cr, Fe, Ni, Pb с водой реагируют при нагревании с образованием оксидов металлов и водорода. в) Cu, Ag, Au с водой не реагируют
12 3. Металлы способны реагировать с кислотами. Опыт! Взаимодействие соляной кислоты с магнием, цинком, железом, медью.
13 Если металл способен проявлять несколько степеней окисления, то при взаимодействии со слабым окислителем образуется соль, в которой металл имеет низшую степень окисления.
14 Дан натрий и раствор соляной кислоты. Как будет протекать реакция между этими двумя веществами. Составьте уравнение реакций: Проблемный вопрос:
15 Далее следует беседа с классом о взаимодействии металлов с концентрированной серной кислотой и о взаимодействии с азотной кислотой.
16 Взаимодействие 1) Fe; Al; Pb с раствором CuSO 4 2) Fe; Zn; Cu с раствором MgCl 2 4.Металлы взаимодействуют с растворами солей. Опыт!
17 Данные факты позволяют сделать вывод, что металлы обладают различной восстановительной способностью.
18 Если учитывать только энергию отрыва валентных электронов от отдельных изолированных атомов (энергию ионизации), то металлы можно расположить в таком порядке : K Na Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au Такое расположение предложил в 1865 году русский ученый Н.Н. Бекетов.
Если же еще учитывать энергию, которая тратится на разрушение кристаллической решетки, а также энергию, которая выделяется при гидратации ионов, то металлы по их способности образовывать гидратированные ионы, следует расположить так: Li K Ca Na Mg Al Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au Этот ряд называют электрохимическим рядом расположения металлов.
19 Домашнее задание § 44 (9-11) стр , задание 4 стр. 120.
20 2 часть урока: контролирующая (5-7мин.) На доске заранее записаны или напечатаны на листах на каждый стол три программы разной степени сложности. Каждый ученик сам выбирает программу, по которой он будет работать.
В течении 1-2 минут учащиеся повторяют материал, могут консультироваться с учителем или товарищами. По истечении времени закрывают учебники, тетради, выполняют каждый свое задание по одному из вариантов выбранной программы.
Номер варианта называет учитель.
21 Программа – А 1 вариант Закончите уравнения тех реакций, которые относятся к /Ox-Red/ окислительно- восстановительным : 2 вариант Какие типы реакций характерны для металлов? Приведите четыре примера. Запишите уравнения реакций, разберите два из них как /Ox-Red/ окислительно- восстановительный процесс.
22 Программа – B 1 вариант Закончите уравнения окислительно- восстановительных реакций: 2 вариант Какие реакции практически осуществимы? Допишите уравнения реакций. Разберите одно как окислительно-восстановительный процесс.
23 Программа – C 1 вариант Закончите уравнения /Ox-Red/ окислительно- восстановительных реакций: 2 вариант Допишите схемы и составьте уравнения реакций, характеризующие химические свойства металлов.
Тест Химические свойства металлов
Последний раз тест пройден более 24 часов назад.
- Подсказка
- Подсказка
- Подсказка
- Подсказка
- Подсказка
- Подсказка
- Подсказка
- Подсказка
- Подсказка
- Подсказка
Чтобы попасть сюда — пройдите тест.
Тест «Химические свойства металлов» (9 класс) с ответами – превосходный инструмент для тех, кто всерьез интересуется химией и занимается предметом самостоятельно. Ведь эта разработка, которую можно найти у нас на сайте, поможет обобщить все изученное и – самое главное – даст объективный ответ на вопрос, насколько хорошо вы владеете материалом.
Тест по теме «Химические свойства металлов» одержит десять вопросов с выбором ответа из предложенных. Он охватывает весь материал по теме: реакции с различными веществами, коррозия, вытеснение и т.д.
Решить тест можно у нас на сайте онлайн.
Средняя оценка: 3.8
Всего получено оценок: 722.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
Гость завершил
Тест «Тристан и Изольда»с результатом 9/10
Гость завершил
Тест «Детство»с результатом 11/14
Гость завершил
Тест «Человек на часах»с результатом 8/10
Гость завершил
Тест «Судьба человека»с результатом 6/12
Гость завершил
Тест «Ромео и Джульетта»с результатом 12/16
Гость завершил
Тест «Моцарт и Сальери»с результатом 10/11
Гость завершил
Тест «Горе от ума»с результатом 6/15
Гость завершил
Тест «Дубровский»с результатом 15/16
Гость завершил
Тест «Метель»с результатом 12/13
Гость завершил
Тест «Мертвые души»с результатом 9/19
Гость завершил
Тест «Алые паруса»с результатом 4/12
Гость завершил
Тест «Толстый и тонкий»с результатом 5/8
Не подошло? Напиши в х, чего не хватает!






