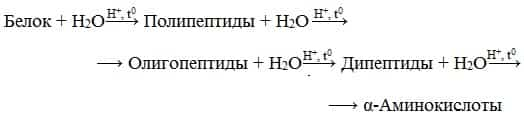- 1. Амфотерные свойства белков
- 2. Денатурация белка (необратимое осаждение, свертывание)
- 3. Гидролиз белков
- 4. Цветные (качественные) реакции на белки
- Денатурация белков
- Денатурация: особенности процесса, влияющие факторы, механизмы и последствия
- Что такое денатурация белка?
- Особенности процесса
- Свойства денатурированных белков, виды денатурации
- Факторы, вызывающие денатурацию белков
- Что происходит в процессе денатурации белков
- Последствия
- Механизмы денатурации
- 5.5.5. Денатурация и ренатурация белков [1990 Грин Н., Стаут У., Тейлор Д. — Биология: В 3-х т. Т. 1]
- Ренатурация
- Денатурация белков: сущность процесса, изменение свойств белка, виды денатурации
- Реакции необратимого осаждения белков
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
- Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
- Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
- При действии же кислот он выступает в форме катиона:
- Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
- Денатурация бывает обратимой и необратимой.
- Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
- Необратимаяденатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
- Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
- Видеоопыт «Свертывание белков при нагревании»
- Видеоопыт «Осаждение белков солями тяжелых металлов»
- Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
- Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
- Анализируя продукты гидролиза, можно установить количественный состав белков.
- Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
- В лабораторных условиях и в промышленности проводится кислотный гидролиз.
- В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
- Для белков известно несколько качественных реакций.
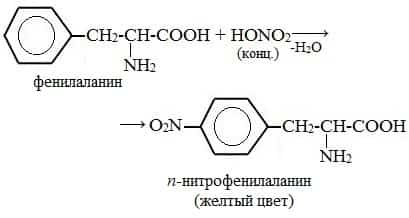
- а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
- Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
- Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
- Видеоопыт«Ксантопротеиновая реакция на белки»
- б) Биуретовая реакция (на пептидные связи)
- Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
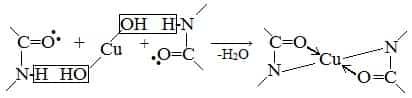
- Причина появления окраски – образование комплексных соединений с координационным узлом:
- Видеоопыт «Биуретовая реакция белков»
- Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
- в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
- Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
- Видеоопыт «Качественное определение азота в органических соединениях»
- Белки
Денатурация белков



Природные белковые тела наделены определенной, строго заданной пространственной конфигурацией и обладают рядом характерных физико-химических и биологических свойств при физиологических значениях температуры и рН среды. Под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства. Таким образом, под денатурацией следует понимать нарушение общего плана уникальной структуры нативной молекулы белка, преимущественно ее третичной структуры, приводящее к потере характерных для нее свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.). Большинство белков денатурирует при нагревании их растворов выше 50–60°С.
Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей.
Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной).
При денатурации белка, вызванной 8М мочевиной или другим агентом, разрушаются в основном нековалентные связи (в частности, гидрофобные взаимодействия и водородные связи).
Дисульфидные связи в присутствии восстанавливающего агента меркаптоэтанола разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры (рис. 1.12).
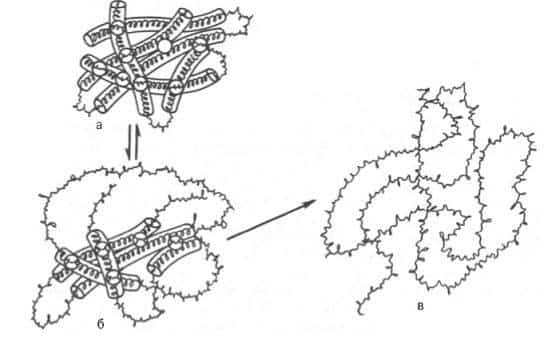
Рис. 1.12. Денатурация белковой молекулы (схема).
а — исходное состояние; б — начинающееся обратимое нарушение молекулярной структуры; в — необратимое развертывание полипептидной цепи.
Рис. 1.13. Денатурация и ренатурация рибонуклеазы (по Анфинсену).
а — развертывание (мочевина + меркаптоэтанол); б — повторное свертывание.
При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы (рис. 1.13), включая биологическую активность.
Таким образом, при денатурации белковая молекула полностью теряет биологические свойства, демонстрируя тем самым тесную связь между структурой и функцией.
Для практических целей иногда используют процесс денатурации в «мягких» условиях, например при получении ферментов или других биологически активных белковых препаратов в условиях низких температур в присутствии солей и при соответствующем значении рН .
При лиофилизации белков (высушивание в вакууме путем возгонки влаги из замороженного состояния) для предотвращения денатурации часто пользуются химическими веществами (простые сахара, глицерин, органические анионы).
- Предыдущая страница | Следующая страница
- СОДЕРЖАНИЕ
Денатурация: особенности процесса, влияющие факторы, механизмы и последствия
Человеческий организм нуждается в различных типах молекул, и наиболее важными являются молекулы белков, которые содержат азот и состоят из аминокислот. Молекулы белка образуют основной строительный блок мышц и других тканей в организме человека.
Их название указывает на то, что они имеют решающее значение для здоровья человека. Слово «белок» происходит от греческого «протеос», что означает «первый» или «первом месте». Каждый белок имеет свое место действия и задачи, которые он выполняет.
Функции белка можно разделить на 9 основных:
- рост и сохранение тканей
- биохимические реакции
- передача связи между клетками
- структура ткани
- поддержание правильного pH
- баланс жидкости
- укрепление иммунной системы
- передача и поставка питательных веществ
- обеспечение энергии
Молекулы белка имеют разные размеры, в зависимости от количества аминокислот. Малые молекулы включают, например, инсулин из 51 аминокислоты, в то время как очень большие молекулы включают титан из почти 27 000 аминокислот.
Однако размер молекул не имеет значения, для правильного функционирования они должны быть в подходящей форме. Каждый тип белка имеет уникальную форму, которая определяет роль белка в организме.
Попробуйте представить белки как ключи, которые принадлежат только определенным дверям в человеческом организме.
Человеческий метаболизм расщепляет белки на более простые частицы – аминокислоты. 20 аминокислот необходимы для роста мышц и обмена веществ, 11 из которых не являются необходимыми.
Это означает, что наш организм может создавать их сам, и их не нужно употреблять в пищу. Остальные аминокислоты помечены как незаменимые, и организм человека получает их из пищи и пищевых добавок.
Мышечная ткань не может расти или регенерировать без них.
Что такое денатурация белка?

Денатурация – это процесс, при котором структура белковой молекулы нарушается, тем самым теряя свою функцию. Различия в форме белка могут быть вызвать:
- изменение температуры
- изменение pH
- воздействие химических веществ
Денатурация меняет форму белка, но последовательность аминокислот остается прежней. Цель протеина в форме пищевой добавки состоит в том, чтобы восполнить достаточное количество белка, и чтобы пищеварительная система могла разрушиться, тем самым снабжая мышечную ткань. Эта функция не теряется при термообработке белков.
Хорошим примером также является белок пепсин, который действует как фермент и расщепляет белки в желудке. Он работает только при низком pH, теряет свою функцию в среде с высоким pH и денатурирует. По этой причине pH желудка поддерживается на очень низком уровне, чтобы обеспечить правильное функционирование пепсина.
Тепло используется для разрыва водородных связей и неполярных гидрофобных взаимодействий в молекуле белка. Более высокая температура увеличивает кинетическую энергию и заставит молекулы вибрировать очень быстро, пока связи между ними не будут разрушены. Молекула белка разворачивается из своей трехмерной структуры, обеспечивая лучший доступ пищеварительного фермента к белковым связям.
Вот почему мы готовим продукты, чтобы изменить структуру белка и облегчить его переваривание. Например, этот процесс происходит, когда вы готовите яйца. В это время белок из яиц денатурируется и во время варки.
После употребления вареных яиц переваривание и усвоение содержащихся в них питательных веществ происходит быстрее. Вы можете быть удивлены тем, что такой же процесс происходит при стерилизации медицинских инструментов.
Тепло денатурирует белки в бактериях, которые затем уничтожают бактерии и дезинфицируют объекты.
Особенности процесса
- Он сопровождается разворачиванием полипептидной связи, которая в растворе изначально представлена в виде беспорядочного клубка.
- Процесс денатурации белка сопровождается утрачиванием гидратной оболочки, выпадением белка в осадок, утрачиванием им нативных свойств.
- Среди основных факторов, которые провоцируют процесс денатурации, выделим физические параметры: давление, температуру, механическое действие, ионизирующее и ультразвуковое излучение.
- Денатурация белка происходит под воздействием органических растворителей, минеральных кислот, щелочей, солей тяжелых металлов, алкалоидов.
Свойства денатурированных белков, виды денатурации
- При денатурации утрачивается гидратная оболочка и белок выпадает в осадок и при этом утрачивает нативные свойства.
- Денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
- Различают 2 вида денатурации:
- Обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности.
- необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
Свойства денатурированных белков:
- Увеличение числа реактивных или функциональных групп по сравнению с нативной молекулой белка (это группы COOH, NH2, SH, OH, группы боковых радикалов аминокислот).
- Уменьшение растворимости и осаждение белка (связано с потерей гидратной оболочки), развертыванием молекулы белка, с «обнаружением» гидрофобных радикалов и нейтрализации зарядов полярных групп.
- Изменение конфигурации молекулы белка.
- Потеря биологической активности, вызванная нарушением нативной структуры.
- Более легкое расщепление протеолитическими ферментами по сравнению с нативным белком – переход компактной нативной структуры в развернутую рыхлую форму облегчает доступ ферментов к пептидным связям белка, которые они разрушают.
- Ферментные методы гидролиза основаны на избирательности действия протеолитических ферментов расщепляющих пептидные связи между определенными аминокислотами.
- Пепсин расщепляет связи, образованные остатками фенилаланина, тирозина и глутаминовой кислоты.
- Трипсин расщепляет связи между аргинином и лизином.
- Химотрипсин гидролизует связи триптофана, тирозина и фенилаланина.
- Гидрофобные взаимодействия, а также ионные и водородные связи относятся к числу слабых, тк энергия их лишь ненамного превосходит энергию теплового движения атомов при комнатной температуре(т е уже при данной температуре возможен разрыв связей ).
- Поддержание характерной для белка конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи.
Однако, белки состоят из огромного числа атомов , находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи , которые обычно не нарушают общую структуру белка и его функции.
Следовательно, белки обладают конформационной лабильностью – склонностью к небольшим изменениям конформации за счет разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических средств среды, а также при взаимодействии белка с другими молекулами.
При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом. Конформационные изменения играют роль огромную в функционировании белков в клетке живой.
Факторы, вызывающие денатурацию белков
Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические.
- Высокие температуры. Для разных белков характерна различная чувствительность к тепловому воздействию. Часть белков подвергается денатурации уже при 40-500С. Такие белки называют термолабильными. Другие белки денатурируют при гораздо более высоких температурах, они являются термостабильными.
- Ультрафиолетовое облучение
- Рентгеновское и радиоактивное облучение
- Механическое воздействие (например, вибрация).
Химические факторы:
- Концентрированные кислоты и щелочи. Например, трихлоруксусная кислота (органическая), азотная кислота (неорганическая).
- Соли тяжелых металлов (например, CuSO4).
- Органические растворители (этиловый спирт, ацетон)
- Мочевина в высоких концентрациях
- Другие вещества, способные нарушать слабые типы связей в молекулах белков.
Воздействие факторами денатурации применяют для стерилизации оборудования и инструментов, а также как антисептики.
Что происходит в процессе денатурации белков
 See Also
See Also 
В процессе денатурации белка имеет место разрыв химических связей (дисульфидных, водородных, ван-дер-ваальсовых, электростатических и др.), которые стабилизируют высшие уровни организации белковой молекулы, что обуславливает изменение пространственной структуры белка. Следует отметить, то в большинстве случаев первичная структура белка в процессе денатурации не нарушается, поэтому после раскрутки цепи полипептидов (стадия нити), протеин может снова стихийно скручиваться, при этом образуя «случайный клубок», то есть переходит к хаотическому состоянию, отличного от нативной конформации.
Процесс денатруации белков происходит при температуре выше, чем 56 °С.
Типичными признаками необратимой денатурации белков является снижение гидрофильности и растворимости белков, увеличение оптической активности, изменение изоэлектрической точки, уменьшение устойчивости белковых растворов и молекулярной массы и изменение формы белковых молекул, увеличение вязкости и усиление способности к расщеплению ферментами, переход молекулы в хаотическое состояние, при котором наблюдается агрегация частиц белка и выпадение их в осадок.
Схема денатурации белка: а — нативная молекула; б — развертывание полипептидной цепи; в — стадия нити; г — случайный клубок
При непродолжительном действии денатурирующего агента (например, органического растворителя) возможно восстановление нативной структуры белка. Этот процесс называется ренатурацией. При ренатурации происходит восстанавлениене только структуры, но и биологических функций белка.
С денатурацией связаны процессы переработки продуктов питания, изготовления одежды, обуви, консервирования и сушки овощей и фруктов. Результатом необратимой денатурацией протеинов является потеря способности к прорастанию семян при длительном хранении, особенно при неблагоприятных условиях.
Процесс денатурации белков широко применяется в медицине, ветеринарии, фармации, клинике и биохимических исследованиях с целью осаждения протеина в биологическом материале с целью дальнейшей идентификации в нем низкомолекулярных и небелковых субстанций, с целью как установления наличия протеина, так и его количественного определения, для обеззараживания слизистых покровов и кожи, для конъюгации солей тяжелых металлов при терапии отравлений солями свинца, ртути, меди и т.п. или с целью профилактики подобных токсикозов на предприятии.
Процесс денатурации белков происходит также при приеме фармакологических препаратов танальбина и танина, на чем базируются их противовоспалительное и вяжущее действие.
Вяжущие свойства танина базируются на его способности осаждать протеины с синтезом плотных альбуминатов, защищающих от раздражения тканей, в частности чувствительные нервные окончания.
При этом уменьшается проявление воспалительной реакции, а также снижаются болевые ощущения и происходит непосредственное уплотнение мембран клеток.
Препарат танальбин представляет собой продукт взаимодействия белка казеина с танином — в отличие от танина, данный препарат не оказывает вяжущего действия на слизистую оболочку желудка и ротовой полости. Только после попадания в кишечник он поддается процессу расщепления, выделяя при этом свободный танин. Применяется в медицине и ветеринарии как вяжущее лекарственное средство при хронических и острых болезнях кишечника, в частности у детей.
В практике фармацевтики использование процессов денатурации белка дает возможность контролировать качество протеиновых препаратов, например, в ампулах.
Последствия
- После денатурации происходит переход нативной компактной структуры в рыхлую развернутую форму, упрощается проникновение к пептидным связям ферментов, необходимых для разрушения.
- Конформация белковых молекул определяется возникновением достаточного количества связей между разными участками определенной полипептидной цепочки.
- Белки, состоящие из достаточного количества атомов, которые находятся в непрерывном хаотичном движении, способствует определенным перемещениям частей полипептидной цепи, что вызывает нарушение общей структуры белков, снижение его физиологических функций.
- Белки имеют конформационную лабильность, то есть предрасположенность к незначительным изменениям конформации, происходящим в результате обрыва одних и образования других связей.
Денатурация белка приводит к изменениям его химических свойств, способности вступать во взаимодействие с другими веществами.
Наблюдается изменение пространственной структуры и участка, непосредственно контактирующего с иной молекулой, и всей конформацией в целом. Наблюдаемые конформационные изменения имеют значение для функционирования белков в живой клетке.
Механизмы денатурации
Практически любое заметное изменение внешних условий, например, нагревание или обработка белка щелочью приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др.
Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
- https://gymbeam.ua/blog/denaturyrovannyj-belok-kak-hotovka-y-vypechka-vlyiaiut-na-soderzanye-belkov-v-bliude/
- https://www.syl.ru/article/279308/new_chto-takoe-denaturatsiya-belka
- https://magictemple.ru/pri-kakoj-temperature-proishodit-denaturacija/
- https://studfile.net/preview/2487380/page:6/
- https://dic.academic.ru/dic.nsf/ruwiki/77941
5.5.5. Денатурация и ренатурация белков [1990 Грин Н., Стаут У., Тейлор Д. — Биология: В 3-х т. Т. 1]
НОВОСТИ БИБЛИОТЕКА КАРТА САЙТА ССЫЛКИ О САЙТЕ
Под денатурацией подразумевают утрату трехмерной конформации, присущей данной белковой молекуле.
Это изменение может носить временный или постоянный характер, но и в том и в другом случае аминокислотная последовательность белка остается неизменной.
При денатурации молекула развертывается и теряет способность выполнять свою обычную биологическую функцию. Вызывать денатурацию белков могут следующие разнообразные факторы.
Нагревание или воздействие каких-либо излучений, например инфракрасного или ультрафиолетового. Кинетическая энергия, сообщаемая белку, вызывает сильную вибрацию его атомов, вследствие чего слабые водородные и ионные связи разрываются. Белок свертывается (коагулирует).
Сильные кислоты, сильные щелочи и концентрированные растворы солей. Ионные связи разрываются, и белок коагулирует. Длительное воздействие реагента может вызвать разрыв и пептидных связей.
Тяжелые металлы. Катионы образуют прочные связи с карбоксил-анионами и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок.
Органические растворители и детергенты. Эти реагенты нарушают гидрофобные взаимодействия и образуют связи с гидрофобными (неполярными) группами. В результате разрываются и внутримолекулярные водородные связи. Использование спирта в качестве дезинфицирующего средства основано именно на том, что он вызывает денатурацию белка любых присутствующих бактерий.
Ренатурация
Иногда денатурированный белок в подходящих условиях вновь спонтанно приобретает свою нативную структуру. Этот процесс называется ренатурацией. Ренатурация убедительно показывает, что третичная структура белка полностью определяется его первичной структурой и что сборка биологических объектов может осуществляться на основе немногих общих принципов.
Если вам нравится услуга минет без презерватива, то выслеживайте молодых женщин на этом интим сайте для взрослых http://prostitutkiekaterinburgagirls.com/sex-services/minet-bez-prezervativa/. Значительные наши проститутки обожают без памяти, когда молодые люди берут побуждение в свои руки и всячески над ними возносятся.
Денатурация белков: сущность процесса, изменение свойств белка, виды денатурации
Денатурация — это сложный процесс, при котором под влиянием внешних факторов (температуры, механического воздействия, действия кислот, щелочей, ультразвука и др.) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т. е. нативной (естественной) пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются.
При кулинарной обработке денатурацию белков чаще всего вызывает нагревание. Процесс этот в глобулярных и фибриллярных белках происходит по-разному.
В глобулярных белках при нагревании усиливается тепловое движение полипептидных цепей внутри глобулы водородные связи, которые удерживали их в определенном положении, разрываются и полипептидная цепь развертывается, а затем сворачивается по-новому.
При этом полярные (заряженные) гидрофильные группы, расположенные на поверхности глобулы и обеспечивающие ее заряд и устойчивость, перемещаются внутрь глобулы, а на поверхность ее выходят реакционноспособные гидрофобные группы (дисульфидные, сульфгидрильные и др.
), не способные удерживать воду.
- Денатурация сопровождается изменениями важнейших свойств белка:
- потерей индивидуальных свойств (например, изменение окраски мяса при его нагревании вследствие денатурации миоглобина);
- потерей биологической активности (например, в картофеле, грибах, яблоках и ряде других растительных продуктов содержатся ферменты, вызывающие их потемнение, при денатурации белки-ферменты теряют активность);
- повышением атакуемости пищеварительными ферментами (как правило, подвергнутые тепловой обработке продукты, содержащие белки, перевариваются полнее и легче);
- потерей способности к гидратации (растворению, набуханию);
- потерей устойчивости белковых глобул, которая сопровождается их агрегированием (свертыванием, или коагуляцией, белка).
Агрегирование — это взаимодействие денатурированных молекул белка, которое сопровождается образованием более крупных частиц. Внешне это выражается по-разному в зависимости от концентрации и коллоидного состояния белков в растворе.
Так, в малоконцентрированных растворах (до 1%) свернувшийся белок образует хлопья (пена на поверхности бульонов).
В более концентрированных белковых растворах (например, белки яиц) при денатурации образуется сплошной гель, удерживающий всю воду, содержащуюся в коллоидной системе.
Белки, представляющее собой более или менее обводненные гели (мышечные белки мяса, птицы, рыбы; белки круп, бобовых, муки после гидратации и др.), при денатурации уплотняются, при этом происходит их дегидратация с отделением жидкости в окружающую среду.
Белковый гель, подвергнутый нагреванию, как правило, имеет меньшие объем, массу, большие механическую прочность и упругость по сравнению с исходным гелем нативных (натуральных) белков. Скорость агрегирования золей белка зависит от рН среды.
Менее устойчивы белки вблизи изоэлектрической точки.
Для улучшения качества блюд и кулинарных изделий широко используют направленное изменение реакции среды.
Так, при мариновании мяса, птицы, рыбы перед жаркой; добавлении лимонной кислоты или белого сухого вина при припускании рыбы, цыплят; использовании томатного пюре при тушении мяса и др.
создают кислую среду со значениями рН значительно ниже изоэлектрической точки белков продукта. Благодаря меньшей дегидратации белков изделия получаются более сочными.
Фибриллярные белки денатурируют иначе: связи, которые удерживали спирали их полипептидных цепей, разрываются, и фибрилла (нить) белка сокращается в длину. Так денатурируют белки соединительной ткани мяса и рыбы. Литература [4, с 118-122]
- Различают 2 вида денатурации:
- Обратимая денатурация — ренатурация или ренактивация — это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности.
- Необратимая денатурация — это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
- Итак, денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
Взбивание яичного белка, сливок превращает их в пену, состоящую из пузырьков воздуха, окруженных тонкими белковыми пленками, образование которых сопровождается развертыванием полипептидных цепей в результате разрыва связей при механическом воздействии. Таким образом, при образовании пленок происходит частичная или полная денатурация белка. Такой вид денатурации называется поверхностной денатурацией белка.
Для кулинарных процессов особое значение имеет тепловая денатурация белков. Механизм тепловой денатурации белков можно рассмотреть на примере глобулярных белков.
Основная молекула глобулярного белка состоит из одной или нескольких полипептидных цепей, сложенных складками и образующих клубки.
Такая структура стабилизируется непрочными связями, среди которых большую роль играют водородные связи, образующие поперечные мостики между параллельными пептидными цепями или их складками.
При нагревании белков начинается усиленное движение полипептидных цепей или складок, что приводит к разрыву непрочных связей между ними. Белок разворачивается и приобретает необычную, неприродную форму, водородные и другие связи устанавливаются в несвойственных данной молекуле местах, и конфигурация молекулы меняется.
В результате происходит развертывание и перегруппировка складок, сопровождаемые перераспределением полярных и неполярных групп, причем неполярные радикалы концентрируются на поверхности глобул, понижая их гидрофильность.
При денатурации белки становятся нерастворимыми и в большей или меньшей мере утрачивают способность к набуханию.
При длительной тепловой обработке белки подвергаются более глубоким изменениям, связанным с разрушением их макромолекул. На первом этапе изменений от белковых молекул могут отщепляться функциональные группы с образованием таких летучих соединений, как аммиак, сероводород, фосфористый водород, углекислый газ и др.
Накапливаясь в продукте, они участвуют в образовании вкуса и аромата готовой продукции. При дальнейшей гидротермической обработке белки гидролизуются, при этом первичная (пептидная) связь разрывается с образованием растворимых азотистых веществ небелкового характера (например, переход коллагена в глютин).
Деструкция белков может быть целенаправленным приемом кулинарной обработки, способствующим интенсификации технологического процесса.
Реакции необратимого осаждения белков
- Лабораторная работа № 2
- Реакции осаждения белков
- Реакции обратимого осаждения белков
Реакции осаждения белков бывают обратимыми и необратимыми.
При обратимом осаждении макромолекулы белка в основном не подвергаются глубокой денатурации, а осадки могут быть снова растворены в первоначальном растворителе.
Обратимое осаждение вызывается действием нейтральных солей аммония, щелочных и щелочно-земельных металлов (высаливание), спирта, ацетона, эфира и некоторых других органических растворителей.
- Реактивы: раствор яичного белка с добавлением хлорида натрия (белок одного куриного яица отделяют от желтка и растворяют в 230 см3 дистиллированной воды, к которой прибавляют 100 см3 насыщенного раствора хлорида натрия, раствор фильтруют через марлю, сложенную в 3–4 слоя, и хранят в холодильнике); насыщенный раствор сульфата аммония; сульфат аммония, растертый в порошок; 10 %-й раствор гидроксида натрия; 1 %-й раствор сульфата меди.
- Оборудование: пробирки; воронка для фильтрования; бумажные фильтры.
- Ход работы
Задание 1. Осаждение белков сульфатом аммония.
- В пробирку отмерьте 2–3 см3 раствора яичного белка, добавьте равный объем насыщенного раствора сульфата аммония и смесь перемешайте.
- Выпадает осадок глобулинов, альбумины остаются в растворе. Осадок отфильтруйте на бумажном фильтре.
- К фильтрату добавьте порошок сульфата аммония до получения насыщенного раствора (последняя порция не растворяется).
- Выпадает осадок альбуминов, который также отфильтруйте.
- Фильтр с осадком альбуминов промойте 5 см3 воды, собирая фильтрат в чистую пробирку.
- Проделайте с фильтратом биуретовую реакцию. Произошло ли растворение альбуминов?
Задание 2. Осаждение белков спиртом.
Органические растворители вызывают осаждение белков вследствие разрушения гидратной оболочки макромолекул.
- В пробирку налейте 1 см3 раствора яичного белка с добавлением хлорида натрия.
- По каплям прилейте 4–6 см3 спирта и сильно взболтайте. Через 5–8 мин. выпадает осадок белков.
При необратимом осаждении происходит глубокая денатурация и агрегация белка. Денатурированный белок не способен к восстановлению своих первоначальных физико-химических и биологических свойств. Необратимое осаждение вызывается высокой температурой, действием концентрированных минеральных и некоторых органических кислот, ионов тяжелых металлов, алкалоидных реагентов, детергентов, красителей.
Реактивы: водный раствор яичного белка (раствор готовят, как указано в лабораторной работе №1; концентрированные серная, соляная и азотная кислоты; 5 %-й раствор ацетата свинца; 2,5 %-й раствор нитрата серебра; 5 %-й раствор сульфата меди.
Задание 1. Осаждение белков минеральными кислотами.
- Реакция находит применение для быстрого определения белка в биологических жидкостях, например, моче.
- Ход работы
- Данную работу необходимо выполнять в вытяжном шкафу, соблюдая особую осторожность!
- В три пробирки налейте по 15–20 капель концентрированных кислот: в первую – серной; во вторую – азотной и в третью – соляной.
- Пробирки наклоните под углом 45о и ОСТОРОЖНО (из пипетки) наслоите по стенке раствор белка. Пробирку держите отверстием от себя. На границе белка и кислоты появляется белое кольцо.
- Пробирки осторожно встряхните. Осадки растворяются в серной и соляной кислотах, но не растворяются в азотной кислоте.
Задание 2. Осаждение белков солями тяжелых металлов.
Белки осаждаются солями меди, свинца, ртути, цинка, серебра и других тяжелых металлов. Свойство белков связывать ионы тяжелых металлов используется в медицине при оказании первой помощи пострадавшим от отравления солями меди, свинца, ртути.
Ход работы
- В три пронумерованные пробирки налейте по 5-10 капель раствора белка.
- В первую пробирку по каплям прибавьте раствор ацетата свинца. Образуется осадок. Добавьте еще несколько капель, осадок должен раствориться в избытке раствора соли.
- Во вторую пробирку по каплям приливайте раствор нитрата серебра. Образовавшийся осадок в избытке соли не растворяется.
- В третью пробирку прибавьте раствор сульфата меди до появления осадка. Убедитесь, что осадок растворяется в избытке соли.
Оформление результатов
Оформите результаты проведенных исследований в виде таблицы.
| Осаждающий реагент | Описание осадка | Растворимость осадка в избытке реагента |
Тепловая денатурация белка
При нагревании белки денатурируют. На процесс денатурации оказывают сильное влияние рН раствора и добавление электролитов.
- Реактивы: водный раствор яичного белка (раствор готовят, как указано в лабораторной работе №1); 1%-й раствор уксусной кислоты; 10 %-й раствор уксусной кислоты; 10 %-й раствор гидроксида натрия; насыщенный раствор хлорида натрия.
- Оборудование: пробирки, водяная баня или спиртовка.
- Ход работы
- В пять пронумерованных пробирок налейте по 10 капель раствора яичного белка.
- Белок в первой пробирке нагрейте до кипения. Раствор мутнеет (разрушаются гидратные оболочки вокруг макромолекул), но осадок не образуется. Мицеллы, образованные макромолекулами, сохраняют одноименный заряд, что препятствует их осаждению.
- К раствору белка во второй пробирке добавьте одну каплю 1 %-го раствора уксусной кислоты и нагрейте до кипения. Осадок белка выпадает быстро. Заряд мицелл нейтрализован и белок близок к изоэлектрической точке.
- К раствору белка в третьей пробирке прибавьте 1-2 капли 10 %-ого раствора уксусной кислоты и нагрейте до кипения. Осадок не образуется, так как мицеллы белка приобрели, присоединяя ионы водорода, положительный заряд, что препятствует их осаждению.
- В четвертую пробирку добавьте 1–2 капли 10 %-го раствора гидроксида натрия и нагрейте до кипения. Осадок не выпадает. Мицеллы за счет отщепления протонов от карбоксильных групп боковых цепей белка заряжены отрицательно.
- В пятую пробирку прибавьте 1–2 капель насыщенного раствора хлорида натрия и нагрейте до кипения. Белок выпадает в осадок.
Оформление результатов.
Оформите результаты исследования, заполнив таблицу и кратко записав механизм денатурирующего действия исследуемого фактора в виде вывода.
| № про-бирки | Добавляемый электролит | Наблюдаемый эффект денатурации | Вывод |