Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

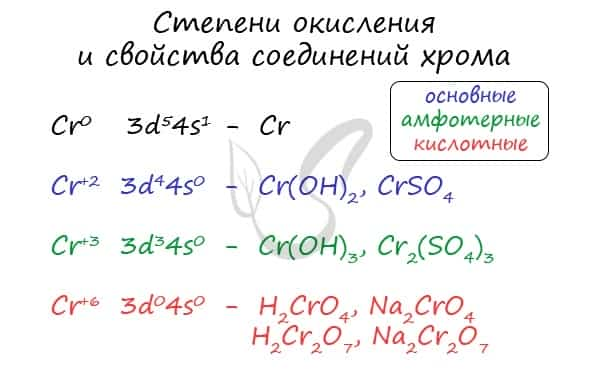
Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.
В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
- Fe(CrO2)2 + C = Fe + Cr + CO
- Cr2O3 + Al = Al2O3 + Cr
- Химические свойства
- Реакции с неметаллами
- Cr + O2 = (t) Cr2O3
- Cr + S = (t) Cr2S3
- Cr + N2 = (t) CrN
- Cr + C = Cr2C3
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) — Cr2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.

Протекает в раскаленном состоянии. Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑  Cr + H2SO4(разб.) = CrSO4 + H2↑ С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании. Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Cr + H2SO4(разб.) = CrSO4 + H2↑ С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании. Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него. Cr + CuSO4 = CrSO4 + Cu
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы — оксида хрома (III), реагирует с кислотами, кислотными оксидами.

- CrO + O2 = Cr2O3
- CrO + H2SO4 = CrSO4 + H2O
- CrO + SO3 = CrSO4
- Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

- Cr(OH)2 = (t) CrO + H2O
- Cr(OH)2 + HCl = CrCl2 + H2O
- Cr(OH)2 + SO3 = CrSO4 + H2O
- Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании — смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
- H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
- Cr2O3 + Ba(OH)2 → (t°) Ba(CrO2)2 + H2O (прокаливание, хромит бария)
- Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
- Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr+3)

- Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
- Cr2O3 + Al = Al2O3 + Cr
- При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
- K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
- Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
- Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
- Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
- Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
- Na2Cr2O7 + NaOH = Na2CrO4 + H2O
- Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» ?
- (NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит
Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Химические свойства
- Реакции с неметаллами
- Fe + S = FeS (t > 700°C)
- Fe + S = FeS2 (t < 700°C)
- Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов FeO*Fe2O3)
- При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
- Fe + Cl2 = (t) FeCl3
- Fe + P = (t) FeP
- Fe + C = (t) Fe3C
- Fe + Si = (t) FeSi
- Реакции с кислотами
- Железо активнее водорода, способно вытеснить его из кислот.
- Fe + HCl = FeCl2 + H2↑
- На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными серной и азотной кислотами.
- Fe + H2SO4(разб.) = FeSO4 + H2↑
- Реакции с солями
- Восстановительные свойства
- Железо способно восстанавливать соединения железа +3 до +2.
- Fe + Fe2O3 = (t) FeO
- Fe + FeCl3 = (t) FeCl2
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.
Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Соединения железа (II) проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа (II) распадается на соответствующий оксид и воду.
- FeO + H2SO4 = FeSO4 + H2O
- Fe(OH)2 + HCl = FeCl2 + H2O
- Fe(OH)2 = (t) FeO + H2O
При хранении на открытом воздухе соли железа (II) приобретают коричневый цвет из-за окисления до железа +3.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] — гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
- Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
- Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
- При сплавлении комплексные соли не образуются из-за испарения воды.
- Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа (III) — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.
Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
- FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
- Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
- FeCl3 + KCNS = Fe(CNS)3 + KCl
И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа (VI) — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
- Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
- Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
- Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O
Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит
- Получение
- Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
- CuFeS2 + O2 = Cu2S + FeS + SO2↑
- Cu2S + O2 = Cu2O + SO2
- Cu2O + Cu2S = Cu + SO2
- Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.
- CuSO4 + Fe = Cu + FeSO4
- Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
- CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
- Химические свойства
- Реакции с неметаллами
- Во влажном воздухе окисляется с образованием основного карбоната меди.
- Cu + CO2 + H2O + O2 = (CuOH)2CO3
- При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
- 4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
- 2Cu + O2 = (t) 2CuO (в избытке кислорода)
- Реакции с кислотами
- Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
- Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
- Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
- С оксидами неметаллов
- Медь способна восстанавливать неметаллы из их оксидов.
- Cu + SO2 = (t) CuO + S
- Cu + NO2 = (t) CuO + N2↑
- Cu + NO = (t) CuO + N2↑
Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
- CuCl2 + Cu = CuCl
- CuO + Cu = Cu2O
- Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
- Cu2O + CO = (t) Cu + CO2
- Cu2O + Al = (t) Cu + Al2O3
- Cu2O + H2 = (t) Cu + H2O
- Оксид меди (I) окисляется кислородом до оксида меди (II).
- Cu2O + O2 = (t) CuO
- Оксид меди (I) вступает в реакции с кислотами.
- Cu2O + HCl = CuCl + H2O
- Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
- CuOH → Cu2O + H2O
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
- Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
- Cu(OH)2 = (t) CuO + H2O
- Cu + O2 = (t) CuO
- Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
- CuO + CO = Cu + CO2
- CuO + C = Cu + CO
- CuO + H2 = Cu + H2O
CuO + H2SO4 = CuSO4 + H2O CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
Гидроксид меди (II) — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.
CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
- Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди (II) — (CuOH)2CO3)
- Обратите особое внимание на реакцию взаимодействия соли меди (II) — сульфата меди (II), карбоната натрия и воды.
- CuSO4 + Na2CO3 + H2O = (CuOH)2CO3 + Na2SO4 + CO2
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду. Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс. Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Общие способы получения металлов
Природные соединения металлов:
| хлориды | сильвинит КСl ∙ NaCl, каменная соль NaCl; |
| сульфиды | серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS; |
| карбонаты | мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 ∙ MgCO3; |
| сульфаты | глауберова соль Na2SO4 ∙ 10 H2O, гипс CaSO4 ∙ 2Н2О; |
| оксиды | магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 ∙ Н2О. |
| нитраты | чилийская селитра NaNO3; |
- Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
- Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией.
- Способы получения металлов из руд.
1. Электрометаллургический способ — это способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
- При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
- NaCl (расплав) D Na+ + Cl-
- катод Na+ + e à Na0 ¦ 2
- анод 2Cl — — 2e à Cl20 ¦ 1
суммарное уравнение: 2NaCl (распл.) – (э. ток)à 2Na + Cl2
Современный способ получения алюминия был изобретен в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар.
- Al2O3 (расплав) D Al3+ + AlO33–
- катод Al3+ +3e à Al 0 ¦ 4
- анод 4AlO33– –12 e à 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3(распл.) – (э. ток)à 4Al + 3O2 .
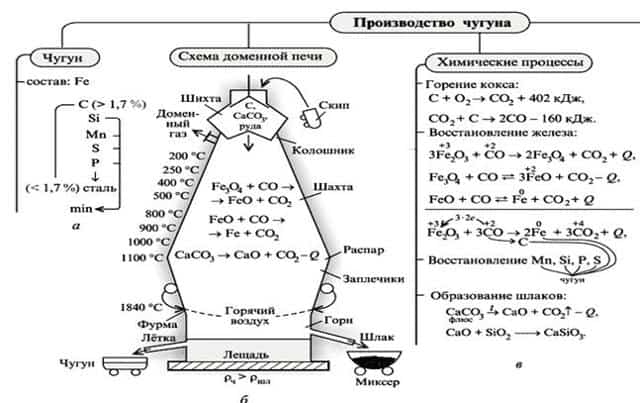
2. Пирометаллургический способ — это восстановление металлов из их руд при высоких температурах с помощью восстановителей: неметаллических: кокс, оксид углерода (II), водород; металлических: алюминий, магний, кальций.
| Алюмотермия: Fe+32O3 +2Al = 2Fe0 + Al2O3 | Получают железо, хром. |
| Восстановление оксидов металлов водородом (водородотермия): Cu +2O + H2 –(t)à Cu0 + H2O | Получают малоактивные металлы – медь, вольфрам. |
| Получение чугуна: В вертикальной печи кокс окисляется до СО, затем происходит постепенное восстановление железа из руды: |
|
| Восстановление углём (коксом): ZnO + C –(t)à Zn + CO | Получают цинк, никель. |
3. Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения:
- CuSO4 + Fe = FeSO4 + Cu.
- Таким способом получают серебро, цинк, молибден, золото, ванадий.
- Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
- а) из сульфида – обжигом в кислороде: 2ZnS + 3O2 = 2ZnO + 2SO2
- б) из карбоната – разложением: СаСО3 –(t)à СаО + СО2
- Чугун и сталь.
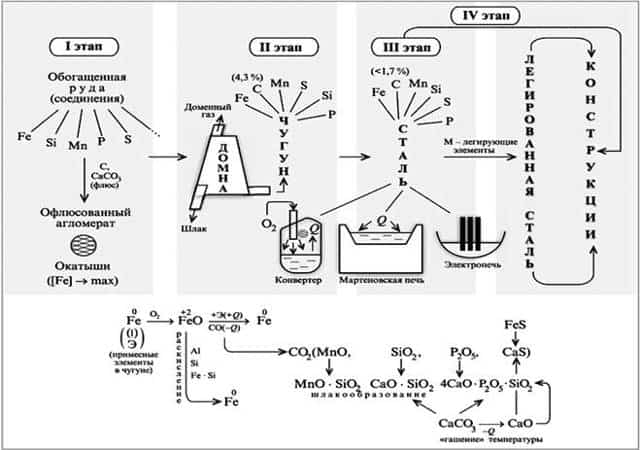
- Производство железа основано на карботермическом восстановлении оксидных металлсодержащих руд.
- 1) Сульфидные и другие руды вначале подвергают окислительному обжигу: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
- 2)Восстановление оксидных руд осуществляется в доменных печах, при этом протекают следующие реакции:
- 3Fe2O3 + CO –(t)àCO2 + 2Fe3O4, Fe3O4 + CO–(t)àCO2 + 3FeO, FeO + CO–(t)àCO2 + Feили FeO + C –(t)àCO + Fe.
Полученное железо насыщено углеродом. 3)Затем происходит «выжигание» углерода в сталеплавильных или конверторных печах с образованием стали.
Задания ЕГЭ по химии: Электролиз расплавов и растворов
Электролиз расплавов и растворов (солей, щелочей, кислот) 1. Установите соответствие между формулой соли и продуктом, образующемся на инертном аноде при электролизе ее водного раствора.
| ФОРМУЛА СОЛИ А) Na 3 PO 4 Б) NaNO 3 В) Al 2 (SO 4 ) 3 Г) AlBr 3 | ПРОДУКТ ЭЛЕКТРОЛИЗА НА АНОДЕ |
| 1) O 2 2) H 2 S 3) Br 2 4) HBr | 5) NO 2 6) SO 2 |
2. Установите соответствие между формулой соли и уравнением процесса, протекающего на аноде при электролизе ее водного раствора
| ФОРМУЛА СОЛИ А) Al(NO 3 ) 3 Б) CuCl 2 В) SbCl 3 Г) Cu(NO 3 ) 2 | СХЕМА АНОДНОГО ПРОЦЕССА |
| 1) 2H 2 O — 4е → O 2 + 4H + 2) 2H 2 O + 2е → H 2 + 2OH – 3) 2Cl – — 2е → Cl 2 | 4) Sb 3 + + 3е → Sb 0 5) Cl – + 4H 2 O — 8е → ClO 4 – + 8H + 6) 4NO 3 – — 4 е → 2N 2 O + 5O 2 |
3. Установите соответствие между формулой соли и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
| ФОРМУЛА СОЛИ А) CaI 2 Б) Na 2 CO 3 В) AgF Г) AuF 3 | ПРОДУКТ ЭЛЕКТРОЛИЗА НА КАТОДЕ |
| 1) Кальций 2) натрий 3) серебро 4) золото | 5) водород 6) фтор |
4. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на катоде.
| ФОРМУЛА ВЕЩЕСТВА А) AlCl 3 Б) RbOH В) Hg(NO 3 ) 2 Г) AuCl 3 | ПРОДУКТЫ НА КАТОДЕ |
| 1) золото 2) алюминий 3) кислород 4) рубидий | 5) водород 6) ртуть |
5. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе ее водного раствора.
| ФОРМУЛА СОЛИ А) CuCl 2 Б) AgNO 3 В) K 2 S Г) NaBr | ПРОДУКТ НА КАТОДЕ |
| 1) водород 2) кислород 3) металл 4) галоген | 5) сера 6) азот |
6. Установите соответствие между формулой вещества и продуктом, образующемся на инертном аноде при электролизе его водного раствора.
| ФОРМУЛА ВЕЩЕСТВА А) NiSO 4 Б) NiCl 2 В) NiF 2 Г) K 2 S | ПРОДУКТ НА АНОДЕ |
| 1) Cl 2 2) O 2 3) H 2 4) S | 5) SO 2 6) HF |
7. Установите соответствие между формулой соли и продуктом, образующемся на инертном аноде при электролизе ее водного раствора.
| ФОРМУЛА СОЛИ А) Cu(NO 3 ) 2 Б) Na 2 S В) AlCl 3 Г) ZnSO 4 | ПРОДУКТ ЭЛЕКТРОЛИЗА НА АНОДЕ |
| 1) водород 2) кислород 3) металл 4) хлор | 5) сера 6) азот |
8. Установите соответствие между металлом и способом его электролитического получения.
| МЕТАЛЛ А) литий Б) натрий В) медь Г) свинец | ЭЛЕКТРОЛИЗ 1) Расплавленного нитрата 2) Водного раствора гидроксида 3) Расплава хлорида 4) Расплавленного оксида 5) Раствора оксида в расплавленном криолите 6) Водного раствора солей |
9. Установите соответствие между формулой соли и продуктом, образующемся на инертном аноде при электролизе ее водного раствора.
| ФОРМУЛА СОЛИ А) Hg(NO 3 ) 2 Б) MgCl 2 В) Na 2 S Г) CuSO 4 | ПРОДУКТ ЭЛЕКТРОЛИЗА НА АНОДЕ |
| 1) азот 2) сера 3) водород 4) кислород | 5) металл 6) галоген |
10. Установите соответствие между формулой вещества и уравнением процесса, протекающего на аноде при электролизе его водного раствора
| ФОРМУЛА СОЛИ А) Сu(NO 3 ) 2 Б) NaI В) NaOH Г) H 2 SO 4 | СХЕМА АНОДНОГО ПРОЦЕССА |
| 1) 2H 2 O — 4 е → O 2 + 4H + 2) 4OH – — 4е → O 2 + 2H 2 O 3) 2SO 4 2- -4 е → 2SO 3 + O 2 | 4) 2I — — 2е → I 2 5) 2NO 3 – — 2е → 2NO 2 + O 2 6) 2H + + 2е → H 2 |
11. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА А) K 2 CO 3 Б) AgNO 3 В) ZnCl 2 Г) NaHC 2 O 4 | КАТОДНЫЙ ПРОДУКТ |
| 1) Кислород 2) Только металл 3) Только водород 4) Металл и водород | 5) Азот 6) Хлор |
12. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА А) NaNO 3 Б) Cu(NO 3 ) 2 В) PbHCO 3 Г) SnCl 2 | КАТОДНЫЙ ПРОДУКТ |
| 1) Кислород 2) Только металл 3) Только водород 4) Металл и водород | 5) Азот 6) Хлор |
13. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА А) K 2 CO 3 Б) AgNO 3 В) ZnCl 2 Г) NaHC 2 O 4 | АНОДНЫЙ ПРОДУКТ |
| 1) Кислород 2) Металл 3) Водород 4) Азот | 5) Углекислый газ 6) Хлор |
14. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА А) NaF Б) Hg(NO 3 ) 2 В) FeCl 2 Г) KHSO 4 | АНОДНЫЙ ПРОДУКТ |
| 1) Кислород 2) Металл 3) Водород 4) Сера | 5) Фтор 6) Хлор |
15. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА А) KF Б) K 2 CO 3 В) CuCl 2 Г) KHSO 4 | АНОДНЫЙ ПРОДУКТ 1) Кислород 2) Галоген 3) Водород 4) Сера |
16. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА А) Na 2 HPO 4 Б) SnCl 2 В) BeF 2 Г) SnBr 4 | АНОДНЫЙ ПРОДУКТ 1) Кислород 2) Галоген 3) Водород 4) Фосфор |
17. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА А) Na 2 HPO 4 Б) BaCl 2 В) Al 2 (SO 4 ) 3 Г) Cu(ClO 3 ) 2 | КАТОДНЫЙ ПРОДУКТ |
| 1) натрий 2) барий 3) алюминий 4) медь | 5) Водород 6) кислород |
18. Установите соответствие между названием металла и электролитическим способом его получения.
| МЕТАЛЛ А) калий Б) медь В) хром Г) кальций | СПОСОБ ПОЛУЧЕНИЯ 1) электролиз водного раствора сульфата 2) электролиз расплавленного хлорида 3) электролиз расплавленного нитрата 4) электролиз водного раствора гидроксида |
19. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
| ФОРМУЛА ВЕЩЕСТВА А) KI Б) AgF В) FeCl 2 Г) KHCO 3 | АНОДНЫЙ ПРОДУКТ |
| 1) Кислород 2) Металл 3) Йод 4) Фтор | 5) Углекислый газ 6) Хлор |
20. Установите соответствие между названием металла и промышленным электролитическим спосом его получения.
| МЕТАЛЛ А) кальций Б) серебро В) натрий Г) свинец | СПОСОБ ПОЛУЧЕНИЯ 1) электролиз водного раствора хлорида 2) электролиз водного раствора нитрата 3) электролиз расплавленного нитрата 4) электролиз расплавленного хлорида |
21. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора
| ФОРМУЛА ВЕЩЕСТВА А) AgNO 3 Б) NaNO 3 В) Ni(NO 3 ) 2 Г) KF | ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА |
| 1) Ag, N 2 2) Ag, O 2 3) H 2 , O 2 4) Ni, H 2 , O 2 HNO 3 | 5) H 2 , NO 2 , O 2 6) NaOH, H 2 , F 2 |
22. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора, выделяющимися на аноде
| ФОРМУЛА ВЕЩЕСТВА А) KF Б) CaBr 2 В) Na 3 PO 4 Г) AgNO 3 | ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА |
| 1) Ag 2) O 2 3) H 2 4) Br 2 | 5) NO 2 6) F 2 |
23. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора, выделяющимся на катоде
| ФОРМУЛА ВЕЩЕСТВА А) Cu(NO 3 ) 2 Б) Na 2 SO 4 В) AlCl 3 Г) AuCl 3 | ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА |
| 1) Cu 2) Na 3) H 2 4) O 2 | 5) Au 6) Al |
24. Установите соответствие между формулой вещества и схемой катодного процесса, протекающего при электролизе его водного раствора
| НАЗВАНИЕ ВЕЩЕСТВА А) сульфат натрия Б) бромид золота(III) В) бромид бария Г) серная кислота | СХЕМА КАТОДНОГО ПРОЦЕССА |
| 1) Na + + 1е → Na 0 2) 2H 2 O — 4е → O 2 + 4H + 3) 2H 2 O + 2е→ H 2 + 2OH – 4) 2Br – — 2е → Вr 2 | 5) 2H + + 2е → H 2 6) Au 3+ + 3е → Au 0 7) Ba 2+ + 2е→ Ba 0 |
25. Установите соответствие между формулой вещества и схемой анодного процесса, протекающего при электролизе его водного раствора
| НАЗВАНИЕ ВЕЩЕСТВА А) карбонат калия Б) хлорид калия В) гидроксид калия Г) хлорид меди (II) | СХЕМА АНОДНОГО ПРОЦЕССА |
| 1) K + + 1e → K 0 2) 2H 2 O — 4e → O 2 + 4H + 3) 2H 2 O + 2e → H 2 + 2OH – 4) 2Cl – — 2e→ Cl 2 | 5) 2H + + 2e → H 2 6) 4OH – — 4e → O 2 + 2H 2 O 7) Cu 2+ + 2e→ Cu 0 |
26. Установите соответствие между формулой вещества и газообразными продуктами электролиза его водного раствора
| ФОРМУЛА ВЕЩЕСТВА А) СuF 2 Б) CuCl 2 В) NaClO 4 Г) CuSO 4 | ГАЗООБРАЗНЫЕ ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО Р-РА |
| 1) водород 2) кислород 3) водород и кислород 4) фтор | 5) фтор и водород 6) хлор 7) хлор и водород |
27. Установите соответствие между названием вещества и газообразными продуктами электролиза его водного раствора
| НАЗВАНИЕ ВЕЩЕСТВА А) хлорат калия Б) фторид калия В) нитрат меди (II) Г) сульфат калия | ГАЗООБРАЗНЫЕ ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО Р-РА |
| 1) Хлор и водород 2) Хлор 3) Фтор и водород 4) Фтор | 5) Водород 6) Кислород 7) Водород и кислород |
28. Установите соответствие между формулой вещества и газообразными продуктами электролиза его водного раствора, выделяющимися на аноде
| ФОРМУЛА ВЕЩЕСТВА А) HgCl 2 Б) CaCl 2 В) NaNO 3 Г) CuSO 4 | ГАЗООБРАЗНЫЕ ПРОДУКТЫ НА АНОДЕ |
| 1) Хлор и водород 2) Хлор 3) Азот и водород 4) Оксид серы (IV) | 5) Водород 6) Кислород 7) Водород и кислород |
29. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора, образующимся на катоде
| ФОРМУЛА ВЕЩЕСТВА А) LiNO 3 Б) Ba(OH) 2 В) AlCl 3 Г) HgCl 2 | КАТОДНЫЙ ПРОДУКТ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА |
| 1) H 2 2) O 2 3) Cl 2 4) Li | 5) Ba 6) Al 7) Hg |
Продукт, выделяющийся на катоде , зависит от положения катиона в ЭХРН: 1) До алюминия включительно — выделяется водород, т.к катионы активных металлов не восстанавливаются.
|
ПОИСК
Один из распространенных методов получения ниобия — метод восстановления фторониобата калия металлическим натрием [c.
248]
Нормальный иодистый пропил был обработан спиртовым раствором едкого кали. На полученное соединение последовательно действовали хлористым водородом и металлическим натрием.
Написать реакции и назвать конечный продукт. [c.94]
Рений получают посредством восстановления перрената калия металлическим калием. Полученный порошкообразный рений подвергают спеканию в вакууме или в атмосфере благородных газов [c.296]
Оксалат-С) калия был получен Лонгом [10] взаимодействием двуокиси углерода-С с расплавленным металлическим калием. Выход 50%. [c.112]
Для удаления следов влаги и кислорода из минерального масла и керосина в них заливают расплавленный металлический калий, и полученную смесь периодически встряхивают в течение од-ного-двух дней, после чего жидкую фазу отфильтровывают в сухой камере в среде аргона [50]. [c.397]
Для осуществления синтеза используют сплав свинца и натрия в соотношении 9 1 или этот сплав с добавкой 0,3—1,2% калия.
Процесс получения сплава основан на смешении расплавленных металлов — свинца, натрия и калия (металлический калий получают путем взаимодействия хлористого калия с металлическим натрием).
После сплавления трех металлов при 400—550 °С сплав гранулируют. [c.319]
Для синтеза используют сплав свинца и натрия в соотношении 9 1 пли этот сплав с добавкой 0,3—1,2% калия. Процесс получения сплава основан на смешении расплавленных металлов— свинца, натрия и калия (металлический калий получают при взаимодействии хлорида калия с металлическим натрием).
После сплавления этих металлов в электрической печи при 400—550 °С сплав гранулируют. Готовый свинцово-натриевый сплав представляет собой серо-стальные пластинки диаметром не более 30 мм. Содержание активных щелочных металлов должно быть 9,65—1р,1% (в том числе 0,3—1,2% калия) плот- [c.
349]
Так было разложено едкое кали и получен металлический калий. Аналогично был открыт натрий при электролизе едкого натра. [c.31]
Для количественного определения висмут выделяют и взвешивают чаще всего в виде сульфида. Можно также осаждать его в Виде гидроокиси или основного карбоната, затем восстанавливать цианистым калием и полученный металлический висмут взвешивать. [c.734]
В сухой пробирке сплавляют на голом огне равные количества ор ганического вещества и металлического калия до получения однородного сплава (под тягой). При этом происходит разложение вещества и образуется цианистый калий.
Горячую пробирку осторожно опускают в стакан с небольшим количеством воды вследствие токсичности цианистых соединений и возможности взрыва при взаимодействии остатков металла с водой эту операцию проводят под тягой. Пробирка при этом растрескивается и плав растворяется в воде.
Водный раствор плава [c.146]
Велер впервые в 1827 г. получил металлический бериллий, восстанавливая его хлорид металлическим калием. Но полученный продукт был сильно загрязнен окислами и содержал всего около 80% бериллия. [c.445]
Элемент металлический рений, полученный из перрената калия ] металлический рений, полученный из перрената аммония металлический ре-ний, полученный галоидным методом (восстановлением двуокиси рения, полученной разложением хлорида в воде) [c.135]
В случае анализа медных минералов полученный по-предыдущему солянокислый раствор нагревают перед испытанием с металлическим свинцом. В случае анализа минералов, содержащих примесь молибдена, вольфрама, урана, ванадия или титана, пробу предварительно обжигают.
0,5 г подготовленной пробы в фарфоровом тигле сплавляют в течение 20—30 мин. с 2 г кислого сернокислого калия и полученный плав растворяют в холодной воде.
Нерастворившийся остаток, содержащий касситерит, оловянную кислоту, вольфрамовую кислоту и силикатные минералы, отфильтровывают через небольшой фильтр и промывают три-четыре раза водой.
Для удаления вольфрамовой кислоты остаток на фильтре промывают несколько раз разбавленным раствором аммиака. Фильтр с осадком озоляют по-предыдущему в фарфоровом тигле. [c.270]
Для получения крупнокристаллического кремния было предложено несколько методов, из которых приведем здесь наиболее важные.
Так, крупнокристаллический кремний можно получить, восстанавливая кремнефтористый калий металлическим натрием в присутствии цинка.
Кремний образует при этом кристаллы игольчатой формы, а остаточный цинк удаляют соляной кислотой затем кремний очищают последовательным кипячением в азотной и плавиковой кислотах.
[c.209]
Металлический цирконий получен Берцелиусом в 1824 г. восстановлением фтороцирконата калия металлическим натрием. Выбор способа получения циркония определяется термодинамикой его соединений.
Во многих случаях свободная энергия образования их превышает свободную энергию образования соответствующих соединений элементов, которые могли бы быть использованы в качестве восстановителей. Это обстоятельство ограничивает их число.
Реакционная способность циркония очень высока, поэтому при получении металла необходимо удалить кислород из всех используемых материалов. По этим причинам восстановление двуокиси циркония кальцием, магнием, алюминием, углеродом не позволяет получить чистый ковкий металл.
Более чистый металл получается восстановлением тетрахлорида циркония магнием, натрием или кальцием, восстановлением фтороцирконатов щелочных металлов натрием или алюминием, электролизом расплавлен- [c.204]
Калий металлический К. Характеристика. Серебристый мягкий металл, легко режется ножом. Металлический калий хранят в керосине или обезвоженном минеральном масле. Применяют при получении различных химических продуктов. [c.211]
Имеются также диафрагмы, плавающие на жидком ртутном электроде и состоящие из непроводящего электрический ток пористого или сыпучего материала (песок, ВаЗО , соль и др.). Диафрагму из сульфата калия для получения на аноде персульфата, а на ртутном катоде —металлического калия предлагает Щербаков (авт. свид. СССР 29835, 1933). [c.100]
Поэтому после открытия натрия и изучения его свойств, имеющих несомненно весьма важное значение, стали разрабатываться способы получения натрия путем химического восстановления его соединений (едкого натра, соды, поваренной соли) действием углерода или расплавленного чугуна при высокой температуре. Натрий получался при этом в виде паров, которые отгонялись из печей и конденсировались при охлаждении. Техническое значение получили лишь немногие способы. Так, промышленное производство натрия было начато в 1856 г. Сен-Клэр-Девиллем, когда им стал применяться натрий вместо калия для получения металлического алю МИНИН из двойной соли ЗНаСЬА1С1з. Девилль получал натрий химическим путем из солей натрия при взаимодействии их с углеродом. В течение 30 лет по способу Девилля вырабатывалось 5—6 г натрия в год и было выпущено в общей сложности около 200 т натрия. [c.301]
Для титрования кислот применяют стандартный 0,1 н. раствор метилата калия или метилата натрия а смеси бензола с метанолом или 0,1 н спиртовый раствор гидроокиси тетраэтиламмония N( 2H5)40H.
Раствор метилата калия или натрия готовят, растворяя металлические калий или натрий в смеси 1 части метанола с 6 частями бензола (в случае натрия) и 1 часть метанола с 12 частями бензола (в случае калия). Для получения 0,1 н.
раствора гидроокиси тетраэтиламмония рассчитанное количество N( 2Hr,)4l растворяют в безводном этиловом спирте и встря.хивают полученный раствор с окисью серебра для осаждения Agi. [c.446]
Порошок металлического титана получают восстановлением гексафторотитаната калия металлическим натрием. Написать уравнения реакций получения [c.173]
Рабидо в очень тщательной работе по исследованию гидролиза Pu(IV) [604] применил бихромат калия для приготовления растворов плутония с заданным отношением Ри(III) Ри(IV).
Очищенный от окиси металлический плутоний растворяли в 70%-ной H IO4.
После разбавления водой аликвотные части раствора плутония(III) смешивали с рассчитанными количествами стандартного раствора бихромата калия для получения заданного отношения Pu(IIl) Pu(IV). [c.188]
Для определения олова и ванадия в кремнийолово- или кремнийванадий-органических соединениях 30—50 мг пробы помещают в термостойкий стакан вместимостью 50 мл, добавляют по 2,5 мл концентрированных серной и азотной кислот, накрывают стакан часовым стеклом и нагревают на электроплитке до получения прозрачного или желтого (с ванадием) раствора. После охлал деиия раствор количественно переносят в мерную колбу вместимостью 100 мл, доводят объем до метки водой и фильтруют. Эталоны, содержащие 10—100 мкг/мл кремния, 0,7—1,3 мкг/мл хрома, 50—150 мкг/мл олова и 12,5—150 мкг/мл ванадия, готовят из силиката натрия, хромата калия, металлического олова (после растворения в серной кислоте) и ванадата аммония (в присутствии серной кислоты). Олово и хром определяют в ацетилено-воздушном пламени по линиям Sn 286,3 нм и Сг 357,9 нм, а кремний и ванадий — в пламени ацетилен — оксид диазота по линиям Si 251,6 нм и V 318,5 нм. [c.195]
Цирконий и гафний обладают чрезвычайно большим сходством химических и физико-химических свойств. Соединения гафния были выделены Г. Хевеши путем дробной кристаллизации фторцирконата—- фторгафнаТа калия. Несколько позднее, в 1926 г., им же был получен черновой гафний путш восстановления гафна-та калия металлическим натрием. Компактный ковкий гафний [c.5]
Из всех гетероциклических соединений тиофен по своему химическому поведению больше всего походит на бензол. Как следует из способов получения, тиофен устойчив при высокой температуре, но, как правило, он более подвержен действию химических агентов, чем бензол.
Сильные кислоты (серная, фосфорная), монтмориллонитные земли и синтетические алюмосиликаты при 80—100° полимеризуют тиофен, давая тример и пентамер.
Хлористый алюминий, введенный в жидкий тиофен, покрывается мгновенно аморфной смолой и одновременно дезактивируется, вследствие чего избыток тиофена остается непревращенньш.
(По этой причине хлористый алюминий не можот служить катализатором в реакциях тиофена типа Фриделя—Крафтса, а бензол, применяемый в этих реакциях, не должен содержать тиофена). Металлический калий разлагает тиофен с образованием сернистого калия металлический натрий неактивен. Тиофен автоокисляется на свету. [c.606]
Соли КС1 — сильвин и Na l-K l — сильвинит — важнейшие минералы, используемые для получения почти всех соединений калия. Металлический калий получают электролизом расплавленного хлористого калия или едкого кали КОН. [c.217]
Восстановлением перрената калия металлическим калием в эти-леидиамине со следами воды получен твердый ренид состава ККе 4Н2О. Полагают, что в этом соединении молекулы воды расположены в виде плоского квадрата вокруг Ке». [c.240]
В сухой пробирке сплавляют на открытом пламени равные количества (- 0,1 г) исследуемого полимера и металлического натрия (калия) до получения однородного сплава. При этом происходит разложение полимера и образование Na N (K N), который легко обнаружить по образованию берлинской лазури. [c.108]
В сухой пробирке сплавляют па открытом пламени равные количества (- 0,1 г) исследуемого полимера и металлического натрия (калия) до получения однородного сплава.
Полученный сплав растворяют в воде, раствор фильтруют, фильтрат подкисляют 20 мл HNOg (плотность 1,153 е/см ), добавляют 30 мл 34%-НОГО водного раствора NH4NO3, нагревают до кипения.
Одновременно в другом стакане нагревают до кипения 120 мл [c.111]
Получение и свойства натрия и калия. Металлический натрий в промышленности получают электролизом расплавленной поваренной соли Na l или расплавленной гидроокиси NaOH. Для пони-жения температуры плавления хлористого натрия к нему обычно добавляют некоторые другие соли (плавни или флюсы). [c.245]
Восстановление фторидов гафния. Впервые металлический гафний был получен восстановлением гексафторгафната калия металлическим натрием [7j. Расплавленные двойные фториды щелочного металла и тугоплавких металлов (Ti, Zr, Hf, Nb, Та, V и др.
) при 1800° С и выше взаимодействуют с углеродсодержащими материалами (углем, карбидами тех же металлов) с образованием газообразного F4 и соответствующего тугоплавкого металла [8]. Солевой расплав отделяют от металла выщелачиванием. [c.
79]
Много лет считалось, что металлический титан впервые был получен Берцелиусом в 1825 году при восстановлении фтортитаната калия металлическим натрием.
Однако сегодня, сравнивая свойства титана и продукта, полученного Берцелиусом, можно утверждать, что президент Шведской академии наук ошибался, ибо чистый титан быстро растворяется в плавиково кислоте (в отличие от многих других кислот), а металлический титан Берцелиуса успешно сопротивлялся ее действию. [c.323]
Первые сведения об элементарном боре относятся к началу XIX в. и связаны с именами Дэви [13], Гей-Люссака и Тейяра [14], отолучившими бор 1на платиновом катоде при электролизе борного ангидрида и восстановлением В2О3 металлическим калием.
Продукты, полученные этими способами, содержали не более 60—70% основного вещества. Поэтому начало изучению элементарного бора было положено только Муаоса-ном [15], разработавшим в 1892 г. магнийтермический способ, который дал возможность сравнительно легко получать продукт с содержанием 91—93%.
В (главные примеси —высший борид магния и низшие окислы бора). [c.5]
Элементарный кремний, полученный в результате вышеописанных реакций, представляет собой высокодиоперсный порошок темно-бурого цвета. Рентгенографическое исследование обнаруживает в нем кристаллическую структуру.
Для получения крупнокристаллического кремния было предложено несколько методов. Приведем здесь наиболее важные. Так, крупнокристаллический кремний можно получить, воостанавливая креМ(Нефтористый калий металлическим натрием в присутствии цинка.
Кремний образует при этом кристаллы игольчатой формы, а остаточный цинк удаляют соляной кислотой затем кремний очищают последовательным кипячением в азотной и плавиковой кислотах.
Крупнокристаллический кремний можно также получить, восстанавливая ремнефтористый калий металлическим алюминием. Реакция протекает достаточно полно, 12 [c.12]
Получение тория в металлическом состоянии—сложная задача. Металлический торий имеет высокую температуру плавления и в расплавленном состоянии очень реакцнонноснособен.
Торий, по-видимому, более электроположителен, чем цирконий или церий, и приблизительно так же электроположителен, как магний, что делает получение чистого тория более сложным делом, чем, скажем, получение чистого металлического урана.
Впервые металлический торий был получен Берцелиусом [24] нри восстановлении тетрахлорида тория металлическим калием, однако полученный продукт не был чистым.
Позднее металл получали различными путями, пригодными для получения металлов с высокой электроположительностью восстановлением окиси тория более электроположительным металлом, например кальцием восстановлением тетрахлорида или тетрафторида тория кальцием, магнием или натрием электролизом расплавленных солей. [c.35]






