- Общая характеристика элементов IVa группы
- Природные соединения
- Получение
- Химические свойства
- Оксид углерода II — СO
- Оксид углерода IV — CO2
- Угольная кислота
- Химические свойства углекислого газа, реакции с другими веществами
- Взаимодействие с другими веществами:
- Заключение
- Физические и химические свойства углекислого газа
- Химические свойства углекислого газа
- Физические свойства углекислого газа
- Получение и применение углекислого газа
- Примеры решения задач
- 2.3.4. Химические свойства углерода и кремния
- Восстановительные свойства углерода
- Взаимодействие углерода с оксидами неметаллов
- Окислительные свойства углерода
- Химические свойства кремния
- Взаимодействие кремния с простыми веществами
- неметаллами
- металлами
- Взаимодействие кремния со сложными веществами
- Соединения углерода
- Диоксид углерода (углекислый газ)
- Угольная кислота и карбонаты
- Углекислый газ, он же углекислота, он же двуокись углерода…
- Содержание
- Жидкая двуокись углерода
- Сухой лед
- История открытия углекислого газа
- Способы получения углекислого газа
- Вредность и опасность углекислого газа
- Хранение и транспортировка углекислого газа
- Характеристики углекислого газа
- Коэффициенты перевода объема и массы CO2 при Т=15°С и Р=0,1 МПа
- Коэффициенты перевода объема и массы CO2 при Т=0°С и Р=0,1 МПа
- Углекислый газ в баллоне
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

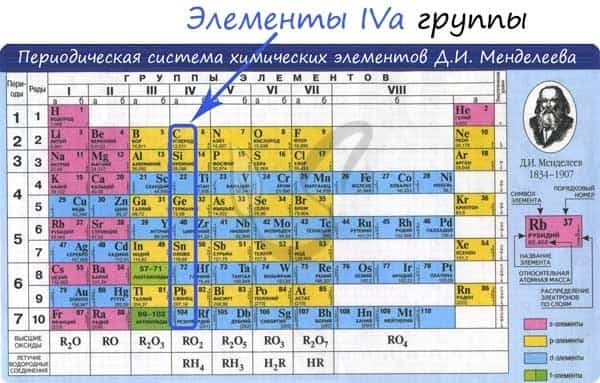
Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
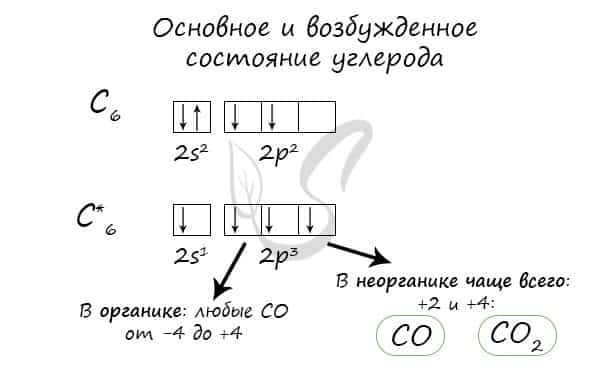
- При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
- C + H2 → (t) CH4 (метан)
- 2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
- С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
- С + F2 → (t) CF4
- Реакции с металлами
- Ca + C → CaC2 (карбид кальция, СО углерода = -1)
- Al + C → Al4C3 (карбид алюминий, СО углерода -4)
- Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
- Восстановительные свойства
- Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
- Fe2O3 + C → Fe + CO2
- ZnO + C → Zn + CO
- FeO + C → Fe + CO
- Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
- SiO2 + C → (t) Si + CO
- Может восстановить и собственный оксид:
- CO2 + C → CO
- Реакция с водой
- Реакции с кислотами
- В реакциях с кислотами углерод проявляет себя как восстановитель:
- C + HNO3(конц.) → (t) CO2 + NO2 + H2O
- C + HNO3 → CO2 + NO + H2O
- C + H2SO4(конц.) → CO2 + SO2 + H2O
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.


Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
- Получение
- В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
- CO2 + C → (t) CO
- C + H2O → (t) CO + H2
- В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
- HCOOH → (H2SO4) CO + H2O
- Химические свойства
- Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
- CO + O2 → CO2
- Fe2O3 + CO → Fe + CO2
- FeO + CO → Fe + CO2
- Образование карбонилов — чрезвычайно токсичных веществ.
- Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
- Получение
- В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
- CaCO3 → (t) CaO + CO2↑
- C6H12O6 → C2H5OH + CO2↑
- В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
- CaCO3 + HCl → CaCl2 + H2O + CO2↑
- Углекислый газ образуется при горении органических веществ:
- C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
- 2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
- KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
- Na2O + CO2 → Na2CO3
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ. CO2 + H2O ⇄ H2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
- Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
- CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)
- Средние и кислые соли
- Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
- Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
- LiHCO3 + LiOH → Li2CO3 + H2O
- Нагревание солей угольной кислоты
- При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
- MgCO3 → (t) MgO + CO2
- KHCO3 → (t) K2CO3 + CO2↑ + H2O
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха. MgCO3 + HCl → MgCl2 + CO2↑ + H2O Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Химические свойства углекислого газа, реакции с другими веществами
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O ↔ CO2 × H2O (растворение) ↔ Н2СО3
Диоксид углерода + вода ↔ угольная кислота
 Молекула угольной кислоты
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония
 Углеаммонийная соль
Углеаммонийная соль
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Zn + CO2 → ZnO + CO
 Оксид цинка
Оксид цинка
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
CH4 + 2O2 → CO2 + 2H2O + 891кДж
 Горение газа на плите
Горение газа на плите
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
C2H5OH + 3O2 = 3H2O + 2CO2 + Q
 Молекула этанола
Молекула этанола
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
В зелёных растениях играет важную роль в процессе фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2
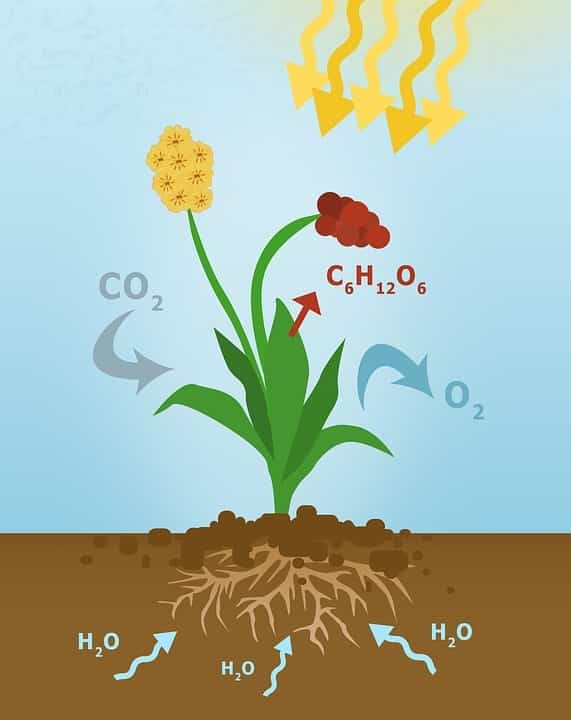 Образование глюкозы
Образование глюкозы
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород
 Колба с пероксидом натрия
Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Физические и химические свойства углекислого газа
Формула – СО2. Молярная масса – 44 г/моль.
Химические свойства углекислого газа
Углекислый газ относится к классу кислотных оксидов, т.е. при взаимодействии с водой он образует кислоту, которая называется угольная. Угольная кислота химически неустойчива и в момент образования сразу же распадается на составляющие, т.е. реакция взаимодействия углекислого газа с водой носит обратимый характер:
- CO2 + H2O ↔ CO2×H2O(solution) ↔ H2CO3.
- При нагревании углекислый газ распадается на угарный газ и кислород:
- 2CO2 = 2CO + O2.
- Как и для всех кислотных оксидов, для углекислого газа характерны реакции взаимодействия с основными оксидами (образованными только активными металлами) и основаниями:
- CaO + CO2 = CaCO3;
- Al2O3 + 3CO2 = Al2(CO3)3;
- CO2 + NaOH(dilute) = NaHCO3;
- CO2 + 2NaOH(conc) = Na2CO3 + H2O.
- Углекислый газ не поддерживает горения, в нем горят только активные металлы:
- CO2 + 2Mg = C + 2MgO (t);
- CO2 + 2Ca = C + 2CaO (t).
- Углекислый газ вступает в реакции взаимодействия с простыми веществами, такими как водород и углерод:
- CO2 + 4H2 = CH4 + 2H2O (t, kat = Cu2O);
- CO2 + C = 2CO (t).
- При взаимодействии углекислого газа с пероксидами активных металлов образуются карбонаты и выделяется кислород:
- 2CO2 + 2Na2O2 = 2Na2CO3 + O2↑.
Качественной реакцией на углекислый газ является реакция его взаимодействия с известковой водой (молоком), т.е. с гидроксидом кальция, в которой образуется осадок белого цвета – карбонат кальция:
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
Физические свойства углекислого газа
Углекислый газ – газообразное вещество без цвета и запаха. Тяжелее воздуха. Термически устойчив. При сжатии и охлаждении легко переходит в жидкое и твердое состояния. Углекислый газ в твердом агрегатном состоянии носит название «сухой лед» и легко возгоняется при комнатной температуре. Углекислый газ плохо растворим в воде, частично реагирует с ней. Плотность – 1,977 г/л.
Получение и применение углекислого газа
- Выделяют промышленные и лабораторные способы получения углекислого газа.
Так, в промышленности его получают обжигом известняка (1), а в лаборатории – действием сильных кислот на соли угольной кислоты (2):
- CaCO3 = CaO + CO2 (t) (1);
- CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O (2).
- Углекислый газ используется в пищевой (газирование лимонада), химической (регулировка температур при производстве синтетических волокон), металлургической (защита окружающей среды, например, осаждение бурого газа) и других отраслях промышленности.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
2.3.4. Химические свойства углерода и кремния
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем.
1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
- Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
- Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
- Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
- а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам.
Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
- Карбиды активных металлов гидролизуются водой:
- а также растворами кислот-неокислителей:
- При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
- При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
- С хлором, бромом и йодом кремний реагирует только при нагревании.
При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
- Так с хлором реакция протекает при 340-420 оС:
- С бромом – 620-700 оС:
- С йодом – 750-810 оС:
- Все галогениды кремния легко гидролизуются водой:
- а также растворами щелочей:
- Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
- При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
- С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
- Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
- При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
- С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
- Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
- Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Соединения углерода
Способы получения угарного газа
В промышленности угарный газ получают:
- при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
- паровая конверсия метана – взаимодействие перегретого водяного пара (температура – 800-900ºС) с метаном. В качестве катализаторов используют Ni, MgO, Al2O3:
СН4 + Н2O → СО + 3Н2
- взаимодействие метана с углекислым газом (температура – 800-900ºС, кат. – Ni, MgO, Al2O3):
СН4 + CO2 → 2СО + 2Н2
- горение углерода в недостатке кислорода (неполное окисление углерода):
2C + O2 → 2CO
- неполное окисление метана:
2СН4 + О2 → 2СО + 4Н2
В лаборатории угарный газ можно получить:
- Нагреванием муравьиной кислоты в присутствии концентрированной серной кислоты:
НСООН → CO + H2O
- Нагреванием щавелевой кислоты в присутствии концентрированной серной кислоты:
- H2C2O4 → CO + CO2 + H2O
- Химические свойства угарного газа
- СО – несолеобразующий оксид
- Формально СО
можно рассматривать как ангидрид муравьиной кислоты, т.к. он образуется при
дегидратации муравьиной кислоты:
- НСООН → CO + H2O
- А также
образование формиата натрия в реакции с гидроксидом натрия при высоком
давлении: - CO + NaOH → HCOONa
- Однако при обычных условиях он не вступает в реакции с
водой, кислотами и щелочами, поэтому относится к типу несолеобразующих оксидов. - Является сильным восстановителем, поэтому реагирует с окислителями:
- Горит синим пламенем в атмосфере кислорода:
2СO + O2→ 2CO2
- Окисляется
хлором в присутствии катализатора или под
действием света с образованием ядовитого газа фосгена:
CO + Cl2 → COCl2
- Окисляется другими сильными окислителями до углекислого газа или
карбонатов:
CO + Na2O2→ Na2CO3
- Восстанавливает
металлы из оксидов (при Т~300 — 1500ºС):
- СО + CuO → Cu + CO2
- СО + NiO → Ni + CO2
- 4CO + Fe3O4→ 3Fe + 4CO2
- Восстановление
водорода из воды в присутствии катализатора Fe, Cr при температуре 400-500 ºС:
СО + Н2О= CO2 + Н2
- Восстановление некоторых благородных металлов из солей:
СО + PdCl2 + Н2О→ Pd + CO2 + 2HCl
- Взаимодействие с водородом при повышенном давлении. Из синтез-газа (смеси угарного газа и водорода) при определенных условиях (P, T, kt) можно получить метанол, метан, или другие углеводороды:
- СО + 2Н2 → СН3ОН
- СО + 3Н2 → СН4 +
Н2О - nСО + (2n+1)Н2 → СnН2n+2 + nН2О
- Образование
карбонилов металлов при
нагревании:
4СO + Ni = [Ni(СO)4]
4СO + Fe = [Fe(СO)5]
- Образование
карбоксигемоглобина при
связывании угарного газа с гемоглобином крови подобно кислороду:
HbO2 + CO = HbCO + O2
Этим свойством СО и объясняется его
высокая токсичность для организма человека.
Диоксид углерода (углекислый газ)
Способы получения углекислого газа
- CO2 – Конечный продукт окисления органических веществ в клетках аэробных организмов
- Образуется
при действии сильных
кислот на карбонаты
(растворимые и нерастворимые) и гидрокарбонаты
металлов:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HBr → NaBr +H2O +CO2
- При взаимодействии растворимых карбонатов с растворимыми солями алюминия, железа (III) и хрома (III), которые необратимо гидролизуются в водном растворе:
2AlCl3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6KCl
- При
термическом разложении нерастворимых
карбонатов и при разложении растворимых гидрокарбонатов:
CaCO3 → CaO + CO2
2NaHCO3 → Na2CO3 + H2O +CO2
- При сжигании всех видов топлив:
СxHy + O2 = H2O + CO2
- При
спиртовом брожении глюкозы под действием ферментов:
- С6H12O6 → 2CO2 + 2C2H5OH
- Химические свойства углекислого газа
- Углекислый
газ — типичный кислотный
оксид. Проявляет слабые окислительные
свойства
- Качественная реакция на углекислый газ — помутнение известковой воды:
Ca(OH)2 + CO2 → CaCO3 + H2O
- Взаимодействует с водой, но реакция сильно обратима, и с водой соединяется лишь 1% молекул угольной кислоты:
CO2 + H2O ↔ H2CO3
- С основными оксидами и сильными основаниями (щелочами), с образованием карбонатов или гидрокарбонатов. При этом возможно образование как кислых, так и средних солей:
- Na2O + CO2 → 2Na2CO3
- KOH + CO2 → KHCO3
- 2KOH + CO2 → K2CO3+ H2O
- С карбонатами, с образованиемгидрокарбонатов:
Na2CO3 + CO2+ H2O → 2NaHCO3
- С водными растворами солей, образованными кислотами, слабее угольной (очень слабые кислоты):
Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3
C6H5OK + CO2+ H2O → C6H5OH + KHCO3
- С
некоторыми восстановителями:
- CO2 + 3H2 → 2CН3OН + H2O
- CO2 + C → 2CO
- 2Мg +
CO2→C
+ 2MgO
Внимание! Магнийгорит в атмосфере углекислого газа, поэтому горящий магний нельзя тушить углекислотными огнетушителями.
- В листьях растений на свету из CO2 и H2O образуются углеводы и кислород:
nCO2 + mH2O = Cn(H2O)m + nO2
- С пероксидом натрия, с образованием карбоната натрия:
2CO2 + 2Na2O2 → 2Na2CO3 + O2
- Синтез карбамида (мочевины):
CO2 + 2NH3 = CO(NH2)2 + H2O
- Получение питьевой соды по методу Сольвэ:
NaCl + CO2 + NH3 + H2O= NaHCO3 + NH4Cl
Угольная кислота и карбонаты
- Химические свойства угольной кислоты и карбонатов
- Угольная
кислота – слабая двухосновная
кислота - Угольная кислота существует только в водном растворе, где количество ее
молекул и анионов в сотни раз меньше, чем количество растворенных молекул
углекислого газа CO2
- Диссоциирует по 2-м ступеням с образованием гидрокарбонат- и карбонат ионов:
- H2CO3 ↔ H+ + НCO3—
- НCO3— ↔ H+ + CO32-
- H2CO3 как индивидуальное соединение неустойчиво и не имеет практического значения, но ее соли устойчивы и нашли широкое применение.
- Растворимыми являются карбонаты щелочных металлов. Высокая степень гидролиза является причиной щелочной реакции их водных растворов рН(0,1 М р-ра) ~ 11,7:
Na2CO3 + H2O = NaOH + NaHCO3
CO32-+ H2O = OH— + HCO3—
- Все
карбонаты, кроме карбонатов щелочных металлов и аммония при нагревании (более
900ºС) разлагаются до оксида металла и оксида углерода (IV):
- CaCO3 → CaO + CO2
- Карбонат аммония при нагревании разлагается иначе:
- (NH4)2CO3 → 2NH3 + 2H2O + CO2
- Качественной реакцией является взаимодействие с кислотами является на ионы СО32─ и НСО3− в результате которой происходит выделение СО2:
Na2CO3 + 2HCl → 2NaCl +
CO2 ↑ + H2O
- при взаимодействии с разбавленными растворами соляной или серной кислот происходит выделение углекислого газа, который затем пропускают через раствор известковой воды. При этом наблюдается помутнение раствора:
- NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
- CO2 + Сa(OH)2 = CaCO3↓ + H2O
- При дальнейшем пропускании раствор вновь становится прозрачным,
помутнение исчезает: - CaCO3 + CO2 + H2O = Сa(НCO3)2
- Переход в гидрокарбонаты при пропускании CO2 через растворы карбонатов или постепенном добавлении кислот:
Na2CO3 + CO2 + H2O = 2NaНCO3
Na2CO3 + HCl → NaНCO3 + NaCl
- Гидрокарбонаты все, кроме NaНCO3 легко растворяются в воде. Водные растворы также имеют щелочную реакцию вследствие гидролиза:
НCO3—+ H2O = OH— + H2CO3
- при нагревании гидрокарбонаты переходят в карбонаты или гидроксиды:
2NaHCO3 → Na2CO3 + CO2 ↑+ H2O
Mg(HCO3)2 = Mg(OH)2↓ + 2CO2↑+ H2O
Углекислый газ, он же углекислота, он же двуокись углерода…
Углекислый газ бесцветный газ с едва ощутимым запахом не ядовит, тяжелее воздуха. Углекислый газ широко распространен в природе. Растворяется в воде, образуя угольную кислоту Н2CO3, придает ей кислый вкус. В воздухе содержится около 0,03% углекислого газа.
Плотность в 1,524 раза больше плотности воздуха и равна 0,001976 г/см3 (при нулевой температуре и давлении 101,3 кПа). Потенциал ионизации 14,3В. Химическая формула – CO2.
Содержание
Как получилось так, что у данного газа столько много терминов неизвестно, но в сварочном производстве, согласно ГОСТ 2601, используется термин «углекислый газ». В «Правилах устройства и безопасной эксплуатации сосудов, работающих под давлением» принят термин «углекислота», а в ГОСТ 8050 — «двуокись углерода». Поэтому далее мы будем оперировать всеми этими понятиями.
Плотность двуокиси углерода зависит от давления, температуры и агрегатного состояния, в котором она находится. При атмосферном давлении и температуре -78,5°С углекислый газ, минуя жидкое состояние, превращается в белую снегообразную массу «сухой лед».
Под давлением 528 кПа и при температуре -56,6°С углекислота может находиться во всех трех состояниях (так называемая тройная точка).
Двуокись углерода термически устойчива, диссоциирует на окись углерода и кислород только при температуре выше 2000°С.
Жидкая двуокись углерода
Жидкая двуокись углерода бесцветная жидкость без запаха, плотность которой сильно изменяется с изменением температуры. Она существует при комнатной температуре лишь при давлении более 5,85 МПа. Плотность жидкой углекислоты 0,771 г/см3 (20°С).
При температуре ниже +11°С она тяжелее воды, а выше +11°С — легче.
Удельная масса жидкой двуокиси углерода значительно изменяется с температурой, поэтому количество углекислоты определяют и продают по массе.
Растворимость воды в жидкой двуокиси углерода в интервале температур 5,8-22,9°С не более 0,05%.
Жидкая двуокись углерода превращается в газ при подводе к ней теплоты.
При нормальных условиях (20°С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа.
Впервые жидкую двуокись углерода получили в 1823 г. Гемфри Дэви (Humphry Davy) и Майкл Фарадей (Michael Faraday).
Сухой лед
Твердая двуокись углерода (сухой лед) по внешнему виду напоминает снег и лед. Содержание углекислого газа, получаемого из брикета сухого льда, высокое — 99,93-99,99%. Содержание влаги в пределах 0,06-0,13%. Сухой лед, находясь на открытом воздухе, интенсивно испаряется, поэтому для его хранения и транспортировки используют контейнеры.
Получение углекислого газа из сухого льда производится в специальных испарителях. Твердая двуокись углерода (сухой лед), поставляемая по ГОСТ 12162.
При чрезмерно быстром отборе газа, понижении давления в баллоне и недостаточном подводе теплоты углекислота охлаждается, скорость ее испарения снижается и при достижении «тройной точки» она превращается в сухой лед, который забивает отверстие в понижающем редукторе, и дальнейший отбор газа прекращается.
При нагреве сухой лед непосредственно превращается в углекислый газ, минуя жидкое состояние. Для испарения сухого льда необходимо подвести значительно больше теплоты, чем для испарения жидкой двуокиси углерода — поэтому если в баллоне образовался сухой лед, то испаряется он медленно.
История открытия углекислого газа
Углекислый газ – это первый газ, который был описан как дискретное вещество. В семнадцатом веке, фламандский химик Ян Баптист ван Гельмонт (Jan Baptist van Helmont) заметил, что после сжигания угля в закрытом сосуде масса пепла была намного меньше массы сжигаемого угля. Он объяснял это тем, что уголь трансформируется в невидимую массу, которую он назвал «газ».
Свойства углекислого газа были изучены намного позже в 1750г. шотландским физиком Джозефом Блэком (Joseph Black).
Он обнаружил, что известняк (карбонат кальция CaCO3) при нагреве или взаимодействии с кислотами, выделяет газ, который он назвал «связанный воздух». Оказалось, что «связанный воздух» плотнее воздуха и не поддерживает горение.
CaCO3 + 2HCl = СО2 + CaCl2 + H2O
Пропуская «связанный воздух» т.е. углекислый газ CO2 через водный раствор извести Ca(OH)2 на дно осаждается карбонат кальция CaCO3.
Джозеф Блэк использовал этот опыт для доказательства того, что углекислый газ выделяется в результате дыхания животных.
CaO + H2O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 + H2O
Способы получения углекислого газа
В статье «Как получить углекислый газ» рассказано все в мельчайших подробностях, здесь лишь скажем, что основными способами получения являются:
- из известняка;
- из газов при брожении спирта;
- из газов котельных;
- из газов производств химической отрасли.
Двуокись углерода чаще всего применяют:
- для создания защитной среды при сварке полуавтоматом;
- в производстве газированных напитков;
- охлаждение, замораживание и хранения пищевых продуктов;
- для систем пожаротушения;
- очистка сухим льдом от загрязнений поверхности изделий.
Плотность углекислого газа достаточно высока, что позволяет обеспечивать защиту реакционного пространства дуги от соприкосновения с газами воздуха и предупреждает азотирование металла шва при относительно небольших расходах углекислоты в струе.
Низкий потенциал ионизации и теплопроводность способствуют образованию горячей зоны в центре столба дуги и как следствие более глубокое проплавление и меньшую ширину шва. Углекислый газ является активным газом, т.е.
в процессе сварки он взаимодействует с металлом шва и оказывает на металл сварочной ванны окисляющее, а также науглероживающее действие.
Молекула углекислого газа CO2, попадая в зону сварочной дуги распадается на атомарный кислород О и угарный газ СО. В результате происходит выгорание легирующих элементов металла сварочной ванны и окисление основного металла (возникает окалина, шлак и дым). Реакция окисления расплавленного металла сварного шва имеет следующий вид:
Fe + CO2 = FeO + CO
Ранее препятствием для применения углекислоты в качестве защитной среды являлось образование большого количества дефектов в сварных швах (преимущественно пор).
Поры при сварке возникают в результате кипения затвердевающего металла сварочной ванны от выделения окиси углерода (СО) из-за недостаточной его раскисленности. При этом поверхность сварного шва сильно окислена и имеет большое количество шлака ввиду окисляющей атмосферы внутри сварочной дуги.
Помимо неудовлетворительного эстетического вида, при необходимости дальнейшего нанесения защитного покрытия потребуется дополнительная операция зачистки поверхности.
- При высоких температурах углекислый газ диссоциирует с образованием весьма активного свободного, одноатомного кислорода:
- CO2=CO+O
- Окисление металла шва выделяющимся при сварке из углекислого газа свободным кислородом нейтрализуется содержанием дополнительного количества легирующих элементов с большим сродством к кислороду, чаще всего кремнием и марганцем (сверх того количества, которое требуется для легирования металла шва) или вводимыми в зону сварки флюсами (сварка порошковой проволокой).
- Как двуокись, так и окись углерода практически не растворимы в твердом и расплавленном металле. Свободный активный кислород окисляет элементы, присутствующие в сварочной ванне, в зависимости от их сродства к кислороду и концентрации по уравнению:
Мэ + O = МэO, где Мэ — металл (марганец, алюминий или др.).
Кроме того, и сам углекислый газ реагирует с этими элементами. В результате этих реакций при сварке в углекислоте наблюдается значительное выгорание алюминия, титана и циркония, и менее интенсивное — кремния, марганца, хрома, ванадия и др.
Особенно энергично окисление примесей происходит при полуавтоматической сварке. Это связано с тем, что при сварке плавящимся электродом взаимодействие расплавленного металла с газом происходит при пребывании капли на конце электрода и в сварочной ванне, а при сварке вольфрамовым электродом — только в ванне.
Как известно, взаимодействие газа с металлом в дуговом промежутке происходит значительно интенсивнее вследствие высокой температуры и большей поверхности контактирования металла с газом.
Для компенсации выгорания легирующих элементов в сварном шве, необходимо применять сварочную проволоку с повышенным содержанием раскислителей (кремния и марганца).
Уже давно известна зависимость, чем больше сила сварочного тока, тем больше размер капель расплавленного металла. В свою очередь увеличение размера капель электродного металла увеличивает разбрызгивание.
В настоящее время ввиду большого разбрызгивания металла сварочной ванны при сварке в углекислоте все чаще применяют сварочные смеси с аргоном.
Производители сварочного оборудования не остались в стороне от данной проблемы и предусматривают специальный режим на сварочных полуавтоматах, при котором уменьшается эффект разбрызгивания.
Еще один путь решения данного вопроса – это использование специальных спреев или жидкостей, которые не позволяют прикипать брызгам к металлу свариваемой детали. В любом случае применение любого из данных методов с лихвой окупит затраты времени и расходных материалов на удаление брызг путем механической зачистки.
При сварке тонких деталей применением оптимальных режимов сварки возможно добиться короткозамкнутого переноса электродного металла и тем самым получить минимальное разбрызгивание. Например, при использовании сварочной проволоки ? 1 мм, силе сварочного тока 150 А и напряжения дуги 16-23 В происходит перенос металла небольшими каплями за счет поверхностного натяжения.
Для MAG сварки толстостенных конструкций целесообразно применение проволоки большого диаметра и, следовательно увеличение силы сварочного тока, увеличение разбрызгивания, что ведет к уменьшению скорости наплавки электродного металла. Для уменьшения разбрызгивания уменьшают скорость подачи сварочной проволоки.
Поэтому применение чистой углекислоты оказывает негативное влияние на производительность сварки и качества сварного шва.
Углекислоту в качестве защитного газа рационально применять при сварке порошковой проволокой (FCAW) углеродистых сталей поскольку обеспечивается короткозамкнутый перенос и хорошее качество сварного шва.
Ввиду химической активности углекислого газа по отношению к вольфраму сварку в этом газе ведут только плавящимся электродом.
При выборе защитного газа стоит учитывать не только его стоимость, но и влияние потерь на разбрызгивание, последующую зачистку и общую трудоемкость процесса.
Вредность и опасность углекислого газа
Двуокись углерода нетоксична и невзрывоопасна. При концентрациях более 5% (92 г/м3) углекислый газ оказывает вредное влияние на здоровье человека, так как он тяжелее воздуха и может накапливаться в слабо проветриваемых помещениях у пола.
При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья. Помещения, где производится сварка с использованием углекислоты, должны быть оборудованы общеобменной приточно-вытяжной вентиляцией.
Предельно допустимая концентрация углекислого газа в воздухе рабочей зоны 9,2 г/м3 (0,5%).
Хранение и транспортировка углекислого газа
Углекислый газ поставляется по ГОСТ 8050. Для получения качественных швов используют газообразную и сжиженную двуокись углерода высшего и первого сортов.
Углекислоту транспортируют и хранят в стальных баллонах по ГОСТ 949 или цистернах большой емкости в жидком состоянии с последующей газификацией на заводе, с централизованным снабжением сварочных постов через рампы.
В стандартный баллон с водяной емкостью 40 л заливается 25 кг жидкой углекислоты, которая при нормальном давлении занимает 67,5% объема баллона и дает при испарении 12,5 м3 углекислого газа.
В верхней части баллона вместе с газообразной углекислотой скапливается воздух. Вода, как более тяжелая, чем жидкая двуокись углерода, собирается в нижней части баллона.
Для снижения влажности углекислого газа рекомендуется установить баллон вентилем вниз и после отстаивания в течение 10…15 мин осторожно открыть вентиль и выпустить из баллона влагу.
Перед сваркой необходимо из нормально установленного баллона выпустить небольшое количество газа, чтобы удалить попавший в баллон воздух.
Часть влаги задерживается в углекислоте в виде водяных паров, ухудшая при сварке качество шва.
При выпуске газа из баллона вследствие эффекта дросселирования и поглощения теплоты при испарении жидкой двуокиси углерода газ значительно охлаждается. При интенсивном отборе газа возможна закупорка редуктора замерзшей влагой, содержащейся в углекислоте, а также сухим льдом.
Во избежание этого при отборе углекислого газа перед редуктором устанавливают подогреватель газа.
Окончательное удаление влаги после редуктора производится специальным осушителем, наполненным стеклянной ватой и хлористым кальцием, силикогелием, медным купоросом или другими поглотителями влаги.
Баллон окрашен в черный цвет, с надписью желтыми буквами «УГЛЕКИСЛОТА».
Характеристики углекислого газа
Характеристики углекислого газа представлены в таблицах ниже:
Коэффициенты перевода объема и массы CO2 при Т=15°С и Р=0,1 МПа
| 1,848 | 1 |
| 1 | 0,541 |
Коэффициенты перевода объема и массы CO2 при Т=0°С и Р=0,1 МПа
| 1,975 | 1 |
| 1 | 0,506 |
Углекислый газ в баллоне
| CO2 | 40 | 25,0 | 12,5 |
Благодаря этой таблице теперь можно легко дать ответы на вопросы, которые очень часто задают сварщики:
- Сколько углекислоты в 40 л баллоне?Ответ: 12,5 м3 или 25,0 кг
- Сколько весит баллон углекислоты?Ответ: 58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949; 25,0 — кг масса углекислоты в баллоне;Итого: 58,5 + 25,0 = 83,5 кг вес баллона с углекислотой.






