- Обсуждение: «Химические свойства оксидов»
- Разница между оксидами металлов и неметаллов
- Основное отличие — оксиды металлов по сравнению с оксидами металлов
- Что такое оксиды металлов
- Что такое неметаллические оксиды?
- Определение
- Природа
- Реакция с водой
- Состав
- Реакция с кислотами и основаниями
- Заключение
- Рекомендации:
- Оксиды их классификация, способы получения и химические свойства (таблица, схема)
- Схема классификация оксидов
- Таблица классификация оксидов с примерами
- Способы получения оксидов таблица
- Химические свойства оксидов таблица
- Задание 37 — бывшее С2
- Материал по химии для подготовки к ЕГЭ — 2018. Характерные химические свойства оксидов
- Разница между оксидами металлов и неметаллов
- Содержание
Вопрос А10 ГИА (ОГЭ) по химии —
Химические свойства оксидов: основных, амфотерных, кислотных

Классификация оксидов:
| Оксиды, образованные металлами | Оксиды, образованные неметаллами | ||
| Основные | Амфотерные | Кислотные | Несолеобразующие |
|
Оксиды металлов щелочных и щелочно-земельных металлов — Na2O, CaO; |
Оксиды: Al2O3, ZnO, d-элементы в средней с.о. — Cr2O3, Fe2O3, MnO2 |
1) оксиды неметаллов в высших и средних степенях окисления CO2, N2O3, N2O5, SO3, SO2 2) оксиды d-элементов в высшей с.о.: CrO3, Mn2O7 |
оксиды неметаллов в промежуточных степенях окисления: |
Химические свойства основных оксидов:
- Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
- Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей:
- K2O + H2O = 2KOH
- 1. Окисление кислородом:
- если металл — d-элемент и «ему есть до чего окисляться»: 2FeO + O2 = Fe2O3
- 2. Взаимодействие с неметаллами:
- 2Na2O + S = 4Na + SO2
- Fe2O3 + C = 2FeO + CO
- 3. Восстановление — реакции с водородом:
- CuO + H2 = Cu + H2O
- 4. Образование солей с кислотными оксидами:
- CaO + CO2 = CaCO3 (соль)
- 5. Взаимодействие с кислотами:
- BaO + 2HNO3 = Ba(NO3)2 (соль) + H2O
- Химические свойства амофтерных оксидов:
- Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли
при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами).
1. Взаимодействие в растворе(!) с щелочами:
Al2O3 + 2H2O + 2NaOH = 2Na[Al(OH)4] + 3H2
2. Образование солей с кислотами:
ZnO + H2SO4 = ZnSO4 + H2O
- Ответ: 3)
- Химические свойства кислотных оксидов:
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
- Реакция с водой: образование кислот:
- N2O3 + H2O = 2HNO2
- 1. + O2
если элемент, образующий оксид в средней с.о.:
- 2SO2 + O2 = 2SO3
- 2. + H2
- восстановление до несолеобразующего оксида или простого вещества:
- CO2 + H2 = CO + H2O
- SO2 + H2 = S + H2O
3. + вещества. образованные металлами:
- SO2 + 2Ca = 2CaO + S
- SO2 + CaO = CaSO3 (соль)
- SO2 + 2LiOH = Li2SO3 + H2O
- Химические свойства несолеобразующих оксидов
- здесь все просто — они только
окисляются до кислотных и восстанавливаются до простых веществ:
- N2O + O2 = N2O3
- CO + H2 = C + H2O
- Ответ: 3)
Обсуждение: «Химические свойства оксидов»
(Правила комментирования)
Разница между оксидами металлов и неметаллов
Основное отличие — оксиды металлов по сравнению с оксидами металлов
Оксид — это любое химическое соединение, которое содержит один или несколько атомов кислорода. Металлы — это вещества, обладающие уникальными свойствами, такими как отличная электрическая и теплопроводность, отражательная способность света, пластичность и пластичность.
Металлы образуют широкий спектр соединений, таких как галогениды металлов, оксиды металлов, сульфиды металлов и т. Д. Неметаллы — это химические элементы, которые не проявляют металлических свойств. Большинство членов блока p в периодической таблице являются неметаллами.
При рассмотрении оксидов элементов существуют оксиды металлов, а также оксиды неметаллов. Оксиды металлов — это оксиды металлов. Неметаллические оксиды являются оксидами неметаллов.
Основное различие между оксидами металлов и неметаллическими оксидами заключается в том, что оксиды металлов являются основными соединениями, тогда как неметаллические оксиды являются кислотными соединениями.
1. Что такое оксиды металлов — определение, свойства, разные типы 2. Что такое неметаллические оксиды? — определение, свойства, разные типы 3. В чем разница между оксидами металлов и неметаллов — Сравнение основных различий
Ключевые слова: кислота, основание, металл, оксид металла, неметалл, оксид неметалла, оксикислоты, оксид, пероксид, супероксид
Что такое оксиды металлов
Оксиды металлов представляют собой химические соединения, содержащие металл и один или несколько атомов кислорода. Здесь степень окисления кислорода составляет -2, и это по существу анион, где металл является катионом.
Щелочные металлы (элементы группы 1), щелочноземельные металлы (элементы группы 2) и переходные металлы (некоторые элементы d-блока) образуют ионные оксиды.
Но металлы, демонстрирующие высокие степени окисления, могут образовываться из оксидов с ковалентной природой.
Оксиды металлов — это кристаллические твердые соединения. Эти соединения содержат катион металла и анион оксида. Эти соединения часто являются основными соединениями и могут реагировать с водой, давая основание. Если нет, они могут реагировать с кислотами, образуя соль металла.
Существует три типа оксидов металлов, образованных щелочными металлами и щелочноземельными металлами.
- Оксиды, содержащие оксидные анионы (O2-)
- Пероксиды, содержащие пероксидные анионы (O–)
- Супероксиды, содержащие супероксидные анионы. (О2–)
Количество атомов кислорода, которые связываются с ионом металла, зависит от степени окисления иона металла. Щелочные металлы образуют только одновалентные катионы. Следовательно, они образуют только М2Оксиды типа O (где М — ион металла, а О — анион оксида). Щелочноземельные металлы образуют двухвалентные катионы. Следовательно, они образуют катионы типа МО.

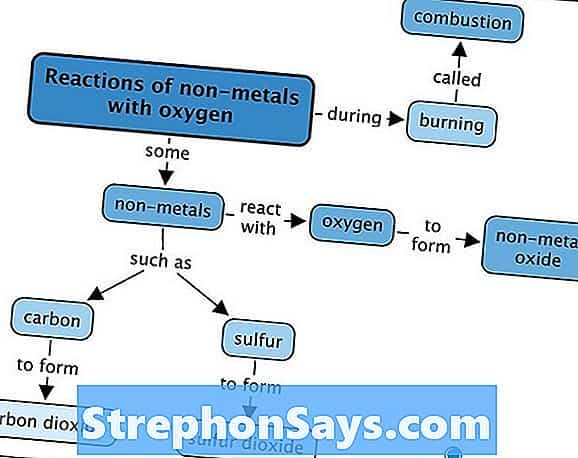
Рисунок 1: Оксиды редкоземельных элементов — по часовой стрелке от верхнего центра: оксиды празеодима, церия, лантана, неодима, самария и гадолиния
Как оксиды щелочных, так и щелочноземельных металлов образуют гидроксиды при взаимодействии с водой. Следовательно, они являются основными соединениями. Блочные элементы D образуют разные оксиды в зависимости от степени окисления. Например, ванадий показывает степень окисления +2, +3, +4 и +5. Следовательно, оксиды, которые он может образовать, VO, V2О, В.О.2 и V2О5.
Что такое неметаллические оксиды?
Неметаллические оксиды представляют собой оксидные соединения, образованные неметаллическими элементами. Большинство элементов p-блока являются неметаллами. Они образуют различные оксидные соединения. Неметаллические оксиды являются ковалентными соединениями, поскольку они разделяют электроны с атомами кислорода, образуя молекулы оксида.
Большинство неметаллических оксидов дают кислоты после реакции с водой. Следовательно, неметаллические оксиды являются кислотными соединениями. Например, когда ТАК3 растворяется в воде, дает H2ТАК4 раствор, который очень кислый. Неметаллические оксиды реагируют с основаниями с образованием солей.
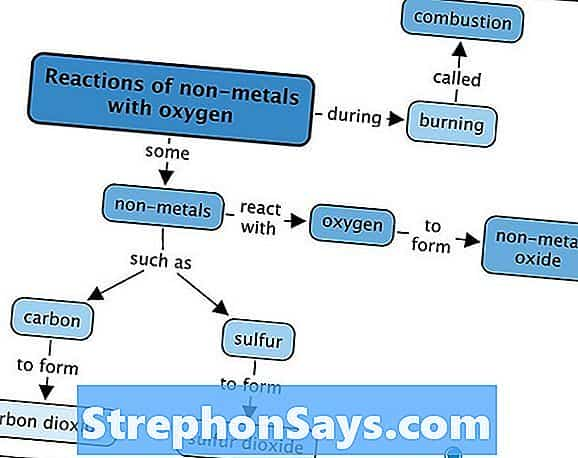
Рисунок 2: Некоторые реакции неметаллов с кислородом
Неметаллические оксиды могут образовывать оксикислоты, Оксикислоты дают гидрониевые ионы в водных растворах. Существует два типа кислотных оксидов:
- Кислотные ангидриды, чьи неметаллы демонстрируют одно из самых распространенных состояний окисления, например, в N2O5, SO3.
- Кислотные оксиды, чьи неметаллы не проявляют своих наиболее распространенных степеней окисления. Пример: НЕТ2, ClO2.
Определение
Оксиды металлов: Оксиды металлов представляют собой химические соединения, содержащие металл и один или несколько атомов кислорода.
Не металл Оксиды: Неметаллические оксиды представляют собой оксидные соединения, образованные неметаллическими элементами.
Природа
Оксиды металлов: Оксид металла являются основными соединениями.
Неметаллические оксиды: Неметаллические оксиды являются кислотными соединениями.
Реакция с водой
Оксиды металлов: Оксиды металлов реагируют с водой, образуя основные растворы.
Не металл Оксиды: Неметаллические оксиды реагируют с водой, образуя кислые растворы.
Состав
Оксиды металлов: Оксиды металлов являются ионными соединениями. Но оксиды металлов с более высокой степенью окисления мета-катионов имеют ковалентную природу.
Неметаллические оксиды: Неметаллические оксиды являются ковалентными соединениями.
Реакция с кислотами и основаниями
Оксиды металлов: Оксиды металлов реагируют с кислотами, образуя соли.
Не металл Оксиды: Неметаллические оксиды реагируют с основаниями, образуя соли.
Заключение
Оксиды металлов представляют собой соединения, состоящие из ионов металлов и оксидных ионов.
Неметаллические оксиды представляют собой соединения, состоящие из неметаллических атомов и атомов кислорода.
Основное различие между оксидами металлов и неметаллическими оксидами состоит в том, что оксиды металлов являются основными соединениями, тогда как неметаллические оксиды являются кислотными соединениями.
Рекомендации:
1. «Оксиды металлов». Химия LibreTexts, Libretexts, 3 ноября 2016 г.,
Оксиды их классификация, способы получения и химические свойства (таблица, схема)
- Оксиды — это бинарные соединения кислорода, то есть сложные вещества, состоящие из двух элементов, один из которых является кислород.
- Э2+nOn-2 — общая формула оксидов, где
- n — степень окисления элемента
- -2 — степень окисления кислорода
- Названия оксидов составляется из слова «оксид» и названия элемента образующего оксид в родительном падеже (CaO — оксид кальция).
Схема классификация оксидов
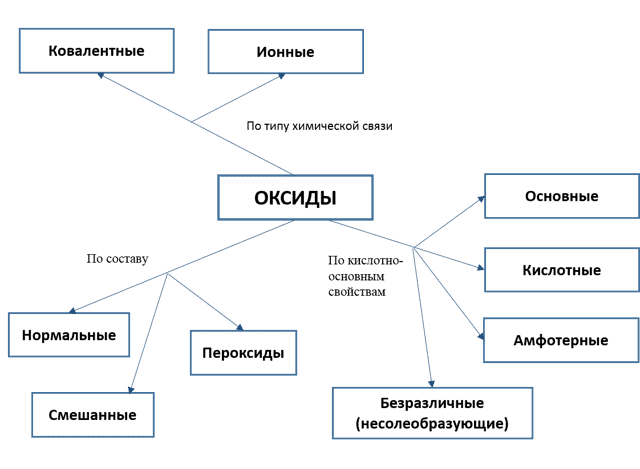
Таблица классификация оксидов с примерами
| Классификация оксидов | Определение | Примеры реакций | Типичные взаимодействия |
| Нормальные | Оксиды, в которых есть только связи между кислородом и каким-нибудь элементом | MgO, SO3, SiO2 | Смотрите свойства кислотных и основных оксидов |
| Пероксиды | Те, в которых есть связи между двумя атомами кислорода | Na2O2, H2O2 | Смотрите таблицу свойства пероксида водорода |
| Смешанные оксиды | Те, которые представляют собой смесь двух оксидов одного элемента в разных степенях окисления | Pb3O4 = 2РbО · PbO2 Fe3O4 = FeO · Fe2O3 | Обладают теми же свойствами, что и входящие в их составы оксиды |
| Кислотные или ангидриды | Оксиды, которые реагируют с водой, образуя кислоты; с основаниями и основными оксидами — образуют соли | SO3, SO2, Mn2O7 |
|
| Основные оксиды | Те, которые реагируют с водой, образуя основания; с кислотами и кислотными оксидами образуют соли | CaO, Na2O |
|
| Амфотерные оксиды | Те, которые в зависимости от условий проявляют свойства и кислотных, и основных оксидов | ZnO, Al2O3 |
|
| Безразличные (несолеобразующие) | Оксиды, которые не реагируют ни с кислотами, ни с основаниями. Солей не образуют | NO, N2O | NO + Н2O -/-> N2O + NaOH |
Способы получения оксидов таблица
Почти все хим. элементы образуют оксиды. На данный момент не получены оксиды гелия, неона и аргона.
| Способы получения оксидов | Примеры | Примечание |
| Взаимодействие простых веществ с кислородом | S + O2 → SO2 4Аl + 3O2 → 2Аl203 | Так получают преимущественно оксиды неметаллов |
| Термическое разложение оснований, солей, кислот |
|
Так получают преимущественно оксиды металлов |
| Взаимодействие простых веществ и солей с кислотами-окислителями |
|
Способ получения преимущественно оксидов неметаллов |
Химические свойства оксидов таблица
| Классификация оксидов | Химические свойства оксидов | Примеры реакции |
| Основные оксиды | 1. Основной оксид* + вода —> щелочь | К2О + Н2О → 2КОН, ВаО + Н2O → Ва(ОН)2 |
| 2. Основной оксид + кислота —> соль + вода | CuO + H2SO4 → CuSO4 + Н2О | |
| 3. Основной оксид + кислотный оксид —> соль | MgO + СО2 → MgCO3, ЗСаО + P2O5 → Ca3(PO4)2 | |
| Кислотные оксиды | 1. Кислотный оксид + вода —> кислота |
|
| 2. Кислотный оксид + щелочь —> соль + вода | SO3 + 2NaOH → Na2SO4+ Н2O | |
| 3. Кислотный оксид + основной оксид —> соль | SiO2 + CaO t→ CaSiO3, Р2O4 + ЗК2O → 2К3РО4 | |
| Амфотерные оксиды | 1. С кислотами реагируют как основные оксиды | ZnO + H2SO4 → ZnSO4 + Н2O |
| 2. С основаниями (щелочами) реагируют как кислотные оксиды | ZnO + 2NaOH → Na2ZnO2 + Н2O |

_______________
Источник информации: Насонова А.Е. Химия, школьная программа в таблицах и формулах, 1998
Задание 37 — бывшее С2
1.
Металл + Неметалл. В данное взаимодействие не вступают
инертные газы. Чем выше электроотрицательность неметалла, тем с большим числом
металлов он будет реагировать.
Например, фтор реагирует со всеми металлами, а
водород – только с активными. Чем левее в ряду активности металлов находится
металл, тем с большим числом неметаллов он может реагировать.
Например, золото
реагирует только с фтором, литий – со всеми неметаллами.
2.
Неметалл + неметалл. При этом более электроотрицательный
неметалл выступает окислителем, менее ЭО – восстановителем. Неметаллы с близкой
электроотрицательностью плохо взаимодействуют между собой, например,
взаимодействие фосфора с водородом и кремния с водородом практически не
возможно, так как равновесие этих реакций смещено в сторону образования простых
веществ. Не реагируют с неметаллами гелий, неон и аргон, остальные инертные
газы в жестких условиях могут реагировать с фтором.
Не взаимодействуют кислород
с хлором, бромом и йодом. Со фтором кислород может реагировать при низких
температурах.
3.
Металл + кислотный оксид. Металл восстанавливает неметалл из
оксида. После этого избыток металла может реагировать с получившимся
неметаллом. Например:
2Mg + SiO2
= 2MgO
+ Si
(при недостатке магния)
2Mg + SiO2
= 2MgO
+ Mg2Si (при избытке магния)
4. Металл + кислота. Металлы,
стоящие в ряду напряжений левее водорода, реагируют с кислотами с выделением
водорода.
Исключение
составляют кислоты – окислители (серная концентрированная и любая азотная),
которые могут реагировать с металлами, стоящими в ряду напряжений правее
водорода, в реакциях не выделяется водород, а получается вода и продукт
восстановления кислоты.
Нужно
обратить внимание на то, что при взаимодействии
металла с избытком многоосновной кислоты может получиться кислая соль: Mg +2H3PO4
= Mg(H2PO4)2
+ H2.
Если
продуктом взаимодействия кислоты и металла является нерастворимая соль, то
металл пассивируется, так как поверхность металла защищается нерастворимой
солью от действия кислоты. Например, действие разбавленной серной кислоты на
свинец, барий или кальций.
5. Металл + соль. В растворе в
данную реакцию вступают металл, стоящий в ряду напряжений правее магния,
включая сам магний, но левее металла соли.
Если металл активнее магния, то он
реагирует не с солью, а с водой с
образованием щелочи, которая в дальнейшем реагирует с солью. При этом исходная
соль и получающаяся соль должны быть растворимыми.
Нерастворимый продукт
пассивирует металл.
Однако,
из этого правила бывают исключения:
2FeCl3 + Cu = CuCl2 + 2FeCl2;
2FeCl3 + Fe = 3FeCl2. Так
как железо имеет промежуточную степень окисления, то его соль в высшей степени
окисления легко восстанавливается до соли в промежуточной степени окисления,
окисляя даже менее активные металлы.
В расплавах
ряд напряжений металлов не действует. Определить, возможна ли реакция между
солью и металлом, можно только с помощью термодинамических расчетов.
Например,
натрий может вытеснить калий из расплава хлорида калия, так как калий более
летучий: Na
+ KCl
= NaCl
+ K↑
(эту реакцию определяет энтропийный фактор).
С другой стороны алюминий получали
вытеснением из хлорида натрием: 3Na + AlCl3
= 3NaCl
+ Al.
Этот процесс экзотермический, его определяет энтальпийный фактор.
Возможен вариант, что соль при
нагревании разлагается, и продукты ее разложения могут реагировать с металлом,
например нитрат алюминия и железо. Нитрат алюминия разлагается при нагревании
на оксид алюминия, оксид азота (IV)
и кислород, кислород и оксид азота будут окислять железо:
10Fe + 2Al(NO3)3
= 5Fe2O3+ Al2O3 + 3N2
6. Металл + основный оксид. Также, как и в
расплавах солей, возможность этих реакций определяется термодинамически. В
качестве восстановителей часто используют алюминий, магний и натрий. Например:
8Al
+ 3Fe3O4
= 4Al2O3
+ 9Fe
реакция экзотермическая, энтальпийный фактор);2 Al + 3Rb2O = 6Rb↑ + Al2O3 (рубидий
летучий, энтальпийный фактор).
7. Неметалл + основный оксид. Здесь возможно два
варианта: 1) неметалл – восстановитель (водород, углерод): CuO + H2
= Cu
+ H2O; 2) неметалл – окислитель
(кислород, озон, галогены): 4FeO
+ O2
=
2Fe2O3.
8. Неметалл + основание. Как
правило, реакция идет между неметаллом и щелочью.Не все неметаллы могут реагировать с щелочами: нужно помнить, что
в это взаимодействие вступают галогены (по-разному в зависимости от
температуры), сера (при нагревании), кремний, фосфор.
-
KOH + Cl2
= KClO
+ KCl
+ H2O (на холоде) -
6KOH + 3Cl2 =
KClO3
+ 5KCl
+ 3H2O (в горячем растворе) -
6KOH + 3S = K2SO3 + 2K2S
+ 3H2O -
2KOH + Si + H2O = K2SiO3+
2H2 -
3KOH + 4P + 3H2O
= PH3 + 3KPH2O2
9.
Неметалл+
кислотныйоксид. Здесь также возможно
два варианта:
-
1)
неметалл – восстановитель (водород, углерод): -
СО2
+ С = 2СО; - 2NO2 + 4H2 = 4H2O + N2;
-
SiO2 + C = CO2 + Si. Если
получившийся неметалл может реагировать с металлом, использованным в качестве
восстановителя, то реакция пойдет дальше (при избытке углерода) SiO2
+ 2C
= CO2
+ SiС -
2)
неметалл – окислитель (кислород, озон, галогены): -
2СO + O2 =
2СО2. -
СO + Cl2 =
СОCl2. -
2NO + O2 =
2NО2.
10. Кислотный оксид + основный
оксид. Реакция идёт, если получающаяся соль в принципе
существует. Например, оксид алюминия может реагировать с серным ангидридом с
образованием сульфата алюминия, но не может реагировать с углекислым газом, так
как соответствующей соли не существует.
11. Вода + основный оксид.
Реакция возможна, если образуется щелочь, то есть растворимое основание (или
мало растворимое, в случае кальция). Если основание нерастворимое или мало
растворимое, то идёт обратная реакция разложения основания на оксид и воду.
12. Основный оксид + кислота.
Реакция возможна, если образующаяся соль существует. Если получающаяся соль
нерастворима, то реакция может пассивироваться из-за перекрытия доступа кислоты
к поверхности оксида. В случае избытка многоосновной кислоты возможно
образование кислой соли.
13.
Кислотный оксид + основание. Как правило, реакция идет между щелочью и кислотным
оксидом. Если кислотный оксид соответствует многоосновной кислоте, может
получиться кислая соль: CO2
+ KOH
= KHCO3.
Кислотные
оксиды, соответствующие сильным кислотам, могут реагировать и с нерастворимыми
основаниями.
Иногда
с нерастворимыми основаниями реагируют оксиды, соответствующие слабым кислотам,
при этом может получиться средняя или основная соль (как правило, получается
менее растворимое вещество): 2Mg(OH)2 + CO2
= (MgOH)2CO3
+ H2O.
14.
Кислотный оксид + соль. Реакция может идти в расплаве и в растворе. В расплаве
менее летучий оксид вытесняет из соли более летучий. В растворе оксид,
соответствующий более сильной кислоте, вытесняет оксид, соответствующий более
слабой кислоте.
Например, Na2CO3
+ SiO2
= Na2SiO3
+ CO2, в прямом направлении эта реакция идет в
расплаве, углекислый газ более летучий, чем оксид кремния; в обратном
направлении реакция идет в растворе, угольная кислота сильнее кремниевой, к
тому же оксид кремния выпадает в осадок.
-
Возможно соединение кислотного оксида с
собственной солью, например, из хромата можно получить дихромат, и сульфата –
дисульфат, из сульфита – дисульфит: -
Na2SO3
+ SO2
= Na2S2O5 -
Для
этого нужно взять кристаллическую соль и чистый оксид, или насыщенный раствор
соли и избыток кислотного оксида. -
В растворе соли могут реагировать с
собственными кислотными оксидами с образованием кислых солей: Na2SO3
+ H2O + SO2
= 2NaHSO3
15. Вода + кислотный оксид.
Реакция возможна, если образуется растворимая или мало растворимая кислота.
Если кислота нерастворимая или мало растворимая то идёт обратная реакция
разложения кислоты на оксид и воду.
Например, для серной кислоты характерна
реакция получения из оксида и воды, реакция разложения практически не идёт,
кремниевую кислоту нельзя получить из воды и оксида, но она легко разлагается
на эти составляющие, а вот угольная и сернистая кислоты могут участвовать как в
прямых, так и обратных реакциях.
16. Основание + кислота. Реакция идет,
если хотя бы одно из реагирующих веществ растворимо. В зависимости от
соотношения реагентов могут получаться средние, кислые и основные соли.
17. Основание + соль. Реакция идет, если оба
исходные вещества растворимы, а в качестве продукта получается хотя бы один
неэлектролит или слабый электролит (осадок, газ, вода).
18. Соль + кислота. Как правило,реакция идет, если оба исходные
вещества растворимы, а в качестве продукта получается хотя бы один неэлектролит
или слабый электролит (осадок, газ, вода).
Сильная
кислота может реагировать с нерастворимыми солями слабых кислот (карбонатами,
сульфидами, сульфитами, нитритами), при этом выделяется газообразный продукт.
Реакции
между концентрированными кислотами и кристаллическими солями возможны, если при
этом получается более летучая кислота: например, хлороводород можно получить
действием концентрированной серной кислоты на кристаллический хлорид натрия,
бромоводород и йодоводород – действием ортофосфорной кислоты на соответствующие
соли. Можно действовать кислотой на собственную соль для получения кислой соли,
например: BaSO4
+ H2SO4
= Ba(HSO4)2.
19. Соль + соль. Как правило,реакция идет, если оба исходные
вещества растворимы, а в качестве продукта получается хотя бы один неэлектролит
или слабый электролит.
Особо
обратим внимание на те случаи, когда образуется соль, которая в таблице
растворимости показана прочерком. Здесь возможны 2 варианта:
1)
соль не существует, потому что необратимо гидролизуется. Это
большинство карбонатов, сульфитов, сульфидов, силикатов трехвалентных металлов, а так же некоторые
соли двухвалентных металлов и аммония. Соли трехвалентных металлов
гидролизуются до соответствующего основания и кислоты, а соли двухвалентных
металлов – до менее растворимых основных солей.
-
Рассмотрим
примеры: -
2FeCl3
+ 3Na2CO3
= Fe2(CO3)3
+ 6NaCl
(1) -
Подчеркнутая
соль не существует из-за необратимого гидролиза: - Fe2(CO3)3 + 6H2O = 2Fe(OH)3 + 3H2CO3
-
H2CO3
разлагается
на воду и углекислый газ, вода в левой и правой части сокращается и получается:
Fe2(CO3)3
+ 3H2O = 2Fe(OH)3 + 3CO2 (2) -
Если
теперь объединить (1) и (2) уравнения и сократить карбонат железа, мы получим
суммарное уравнение, отражающее взаимодействие хлорида железа (III) и карбоната натрия: 2FeCl3
+ 3Na2CO3
+ 3H2O = 2Fe(OH)3 + 3CO2 +
6NaCl -
CuSO4
+ Na2CO3
= CuCO3
+ Na2SO4
(1) -
Подчеркнутая
соль не существует из-за необратимого гидролиза: -
2CuCO3+ H2O = (CuOH)2 CO3+CO2
(2) -
Если
теперь объединить (1) и (2) уравнения и сократить карбонат меди, мы получим
суммарное уравнение, отражающее взаимодействие сульфата (II) и карбоната натрия: -
2CuSO4 + 2Na2CO3
+ H2O = (CuOH)2 CO3+ CO2 + 2Na2SO4 -
2)
Соль не существует за счёт внутримолекулярного окисления-восстановления, таким солям
относятся Fe2S3,
FeI3,
CuI2.
Как только они получаются, тут же разлагаются: Fe2S3 =
2FeS+
S;
2FeI3
= 2FeI2
+I2;
2CuI2
= 2CuI
+ I2 -
Например;
FeCl3
+ 3KI
= FeI3
+ 3KCl
(1), -
но
вместо FeI3
нужно записать продукты его разложения: FeI2
+I2.
-
Тогда получится: 2FeCl3
+ 6KI
= 2FeI2
+I2
+ 6KCl -
Это
не единственный вариант записи данной реакции, если йодид был в недостатке, то
может получиться йод и хлорид железа (II): -
2FeCl3
+ 2KI
= 2FeCl2
+I2
+ 2KCl
В
предложенной схеме ничего не сказано про амфотерные
соединения и соответствующие им простые вещества. На них мы обратим особое
внимание.
Итак, амфотерный оксид в данной схеме может занять место и кислотного
и основного оксидов, амфотерный гидроксид – место кислоты и основания.
Нужно помнить, что, выступая в качестве
кислотных, амфотерные оксиды и
гидроксиды образуют в безводной среде обычные соли, а в растворах –
комплексные соли:
-
Al2O3
+ 2NaOH
= 2NaAlO2
+ H2O (спекание) -
Al2O3
+ 2NaOH
+ 3H2O = 2Na[Al(OH)4 ] (в растворе) -
Простые
вещества, соответствующие амфотерным оксидам и гидроксидам, реагируют с
растворами щелочей с образованием комплексных солей и выделением водорода: 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4 ] + 3Н2
Примеры заданий.
Материал по химии для подготовки к ЕГЭ — 2018. Характерные химические свойства оксидов
ХАРАКТЕРНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ:
ОСНОВНЫХ, АМФОТЕРНЫХ, КИСЛОТНЫХ.
Прежде чем начать говорить про химические свойства оксидов, нужно вспомнить о том, что все оксиды делятся на 4 типа, а именно основные, кислотные, амфотерные и несолеобразующие. Для того чтобы определить тип какого-либо оксида, прежде всего нужно понять — оксид металла или неметалла перед вами, а затем воспользоваться алгоритмом (его надо выучить!), представленным в следующей таблице:
| Оксид неметалла | Оксид металла |
| 1) Степень окисления неметалла +1 или +2Вывод: оксид несолеобразующийИсключение: Cl2O не относится к несолеобразующим оксидам | 1) Степень окисления металла +1 или +2Вывод: оксид металла — основныйИсключение: BeO, ZnO и PbO не относятся к основным оксидам |
| 2) Степень окисления больше либо равна +3Вывод: оксид кислотныйИсключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 | 2) Степень окисления металла +3 или +4Вывод: оксид амфотерныйИсключение: BeO, ZnO и PbO амфотерны, несмотря на степень окисления +2 у металлов3) Степень окисления металла +5, +6, +7Вывод: оксид кислотный |
Помимо типов оксидов, указанных выше, введем также еще два подтипа основных оксидов, исходя из их химической активности, а именно активные основные оксиды и малоактивные основные оксиды.
К активным основным оксидам отнесем оксиды щелочных и щелочноземельных металлов (все элементы IA и IIA групп, кроме водорода H, бериллия Be и магния Mg).
Например, Na2O, CaO, Rb2O, SrO и т.д.
К малоактивным основным оксидам отнесем все основные оксиды, которые не попали в список активных основных оксидов.
Например, FeO, CuO, CrO и т.д.
Логично предположить, что активные основные оксиды часто вступают в те реакции, в которые не вступают малоактивные.
Следует отметить, что несмотря на то что фактически вода является оксидом неметалла (H2O), обычно ее свойства рассматривают в отрыве от свойств иных оксидов.
Обусловлено это ее специфически огромным распространением в окружающем нас мире, в связи с чем в большинстве случаев вода является не реагентом, а средой, в которой может осуществляться бесчисленное множество химических реакций.
Однако нередко она принимает и непосредственное участие в различных превращениях, в частности, некоторые группы оксидов с ней реагируют.
- Какие оксиды реагируют с водой?
- Из всех оксидов с водой реагируют только:
- 1) все активные основные оксиды (оксиды ЩМ и ЩЗМ);
- 2) все кислотные оксиды, кроме диоксида кремния (SiO2);
т.е. из вышесказанного следует, что с водой точно не реагируют:
- 1) все малоактивные основные оксиды;
- 2) все амфотерные оксиды;
- 3) несолеобразующие оксиды (NO, N2O, CO, SiO).
- Примечание:
Оксид магния медленно реагирует с водой при кипячении. Без сильного нагревания реакция MgO с H2O не протекает.
Способность определить то, какие оксиды могут реагировать с водой даже без умения писать соответствующие уравнения реакций, уже позволяет получить баллы за некоторые вопросы тестовой части ЕГЭ.
Активные основные оксиды, реагируя с водой, образуют соответствующие им гидроксиды. Напомним, что соответствующим оксиду металла является такой гидроксид, который содержит металл в той же степени окисления, что и оксид. Так, например, при реакции с водой активных основных оксидов K+12O и Ba+2O образуются соответствующие им гидроксиды K+1OH и Ba+2(OH)2:
K2O + H2O = 2KOH – гидроксид калия
BaO + H2O = Ba(OH)2 – гидроксид бария
Все гидроксиды, соответствующие активным основным оксидам (оксидам ЩМ и ЩЗМ), относятся к щелочам. Щелочами называют все хорошо растворимые в воде гидроксиды металлов, а также малорастворимый гидроксид кальция Ca(OH)2 (как исключение).
Взаимодействие кислотных оксидов с водой так же, как и реакция активных основных оксидов с водой, приводит к образованию соответствующих гидроксидов.
Только в случае кислотных оксидов им соответствуют не основные, а кислотные гидроксиды, чаще называемые кислородсодержащими кислотами.
Напомним, что соответствующей кислотному оксиду является такая кислородсодержащая кислота, которая содержит кислотообразующий элемент в той же степени окисления, что и в оксиде.
Таким образом, если мы, например, хотим записать уравнение взаимодействия кислотного оксида SO3 с водой, прежде всего мы должны вспомнить основные, изучаемые в рамках школьной программы, серосодержащие кислоты. Таковыми являются сероводородная H2S, сернистая H2SO3 и серная H2SO4 кислоты.
Cероводородная кислота H2S, как легко заметить, не является кислородсодержащей, поэтому ее образование при взаимодействии SO3 с водой можно сразу исключить. Из кислот H2SO3 и H2SO4 серу в степени окисления +6, как в оксиде SO3, содержит только серная кислота H2SO4.
Поэтому именно она и будет образовываться в реакции SO3 с водой:
- H2O + SO3 = H2SO4
- Аналогично оксид N2O5, содержащий азот в степени окисления +5, реагируя с водой, образует азотную кислоту HNO3, но ни в коем случае не азотистую HNO2, поскольку в азотной кислоте степень окисления азота, как и в N2O5, равна +5, а в азотистой — +3:
Разница между оксидами металлов и неметаллов
Основное различие между оксидами металлов и неметаллов заключается в том, что оксиды металлов являются основными соединениями, тогда как оксиды неметаллов являются кислотными соединениями.
«Оксиды» — это большая группа соединений, в которых химические элементы связаны по существу с атомами кислорода. Однако благородные газы не образуют эти соединения из-за их инертной природы и более высокой стабильности.
Большинство металлов и неметаллов образуют оксиды с различными степенями окисления, в то время как некоторые другие химические элементы образуют оксиды с фиксированной степенью окисления; например, магний образует только оксид магния, имеющий химическую формулу MgO, в то время как ванадий образует различные оксиды, такие как V2O3 и V2O5.
Содержание
- Обзор и основные отличия
- Что такое оксиды металлов
- Что такое неметаллические оксиды
- В чем разница между оксидами металлов и неметаллов
- Заключение
Оксиды металлов представляют собой неорганические химические соединения, содержащие металлы, связанные по существу с атомами кислорода. В этих соединениях кислород по существу является анионом соединения, имеющего степень окисления -2. Следовательно, металл является катионом соединения. Металлы, которые образуют оксиды, относятся к группе щелочных металлов (элементы группы 1), щелочноземельным металлам (элементы группы 2) и элементам d-блока, включая переходные металлы. Они образуют ионный оксид, то есть соединения, которые они образуют, имеют ионную природу. Но некоторые химические элементы образуют оксиды с ковалентной природой, особенно химические элементы, демонстрирующие более высокие степени окисления.
Оксид серебра (II)
В большинстве случаев оксиды металлов являются кристаллическими твердыми веществами и часто являются основными соединениями. Следовательно, они могут реагировать с водой, давая щелочной раствор.
Кроме того, они могут реагировать с кислотами с образованием солей посредством реакций нейтрализации. Хотя почти все оксиды имеют кислород со степенью окисления -2, могут быть оксиды со степенями окисления -1 и -1/2; мы называем их пероксидами и супероксидами соответственно.
Количество атомов кислорода в соединениях зависит от степени окисления металла.
Примеры для оксидов металлов:
- Оксид натрия (Na2O)
- Оксид магния (MgO)
- Пентаоксид ванадия (V2O5)
- Оксид серебра (AgO)
Неметаллические оксиды представляют собой неорганические химические соединения, содержащие неметаллы, связанные по существу с атомами кислорода.
Следовательно, эти соединения в основном содержат p-блочные элементы, потому что p-блочные элементы являются неметаллами, которые мы имеем.
Почти все неметаллические оксиды являются ковалентными соединениями, потому что они имеют тенденцию делить электроны с другими атомами, например с атомами кислорода.
Это кислотные соединения, следовательно, они образуют кислоту при растворении в воде. По той же причине они могут реагировать с основаниями с образованием солей посредством реакций нейтрализации. Кроме того, они могут образовывать оксикислоты, которые могут образовывать гидроксиды в водной среде.
Кварта или диоксид кремния является неметаллическим оксидом
Примеры неметаллических оксидов:
- Диоксид серы (SO2) и триоксид серы (SO3)
- Двуокись углерода (углекислый газ — CO2) и окись углерода (угарный газ — CO)
- Диоксид кремния (SiO2)
- Оксиды азота (N2O, NO2, N2O5)
Оксиды металлов представляют собой неорганические химические соединения, содержащие металлы, связанные по существу с атомами кислорода, тогда как неметаллические оксиды представляют собой неорганические химические соединения, содержащие неметаллы, связанные по существу с атомами кислорода.
В этом принципиальная разница между оксидами металлов и неметаллов. Более того, эти соединения отличаются друг от друга по своей химической природе.
Таким образом, ключевое различие между оксидами металлов и неметаллов заключается в том, что оксиды металлов являются основными соединениями, тогда как неметаллические оксиды являются кислотными соединениями.
Кроме того, существует некоторая разница между металлическими и неметаллическими оксидами также и по их химической структуре. В большинстве случаев оксиды металлов являются ионными соединениями, в то время как неметаллические оксиды являются ковалентными соединениями.
Кроме того, оксиды металлов имеют тенденцию реагировать с водой с образованием щелочных растворов, но неметаллические оксиды имеют тенденцию реагировать с водой с образованием кислых растворов.
Кроме того, оксиды металлов реагируют с кислотами с образованием солей, тогда как неметаллические оксиды реагируют с основаниями с образованием солей.
Оксиды представляют собой химические соединения, имеющие либо металл, либо неметалл, связанный с одним или несколькими атомами кислорода. Основное различие между оксидами металлов и неметаллов заключается в том, что оксиды металлов являются основными соединениями, тогда как неметаллические оксиды являются кислотными соединениями.






