- Общая характеристика элементов IVa группы
- Природные соединения
- Получение
- Химические свойства
- Оксид углерода II — СO
- Оксид углерода IV — CO2
- Угольная кислота
- Углерод и его соединения в химии — формулы и определения с примерами решения задач
- Углерод и его соединения
- Химические свойства углерода
- Оксиды углерода
- КАРБИДЫ
- Карбонилы металлов | это… Что такое Карбонилы металлов?
- История открытия
- Строение карбонилов
- Свойства карбонилов
- Способы получения
- Применение
- Углерод и его соединения
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
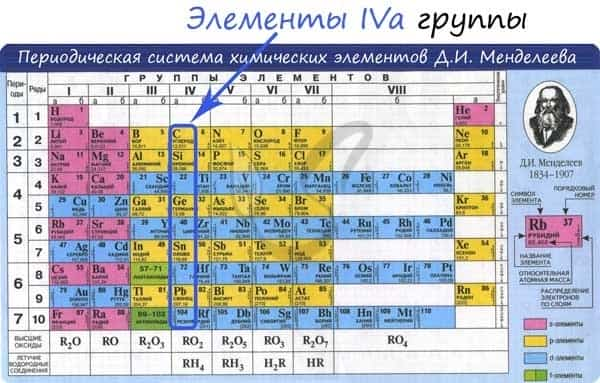
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
- C + H2 → (t) CH4 (метан)
- 2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
- С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
- С + F2 → (t) CF4
- Реакции с металлами
- Ca + C → CaC2 (карбид кальция, СО углерода = -1)
- Al + C → Al4C3 (карбид алюминий, СО углерода -4)
- Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
- Восстановительные свойства
- Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
- Fe2O3 + C → Fe + CO2
- ZnO + C → Zn + CO
- FeO + C → Fe + CO
- Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
- SiO2 + C → (t) Si + CO
- Может восстановить и собственный оксид:
- CO2 + C → CO
- Реакция с водой
- Реакции с кислотами
- В реакциях с кислотами углерод проявляет себя как восстановитель:
- C + HNO3(конц.) → (t) CO2 + NO2 + H2O
- C + HNO3 → CO2 + NO + H2O
- C + H2SO4(конц.) → CO2 + SO2 + H2O
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.


Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
- Получение
- В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
- CO2 + C → (t) CO
- C + H2O → (t) CO + H2
- В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
- HCOOH → (H2SO4) CO + H2O
- Химические свойства
- Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
- CO + O2 → CO2
- Fe2O3 + CO → Fe + CO2
- FeO + CO → Fe + CO2
- Образование карбонилов — чрезвычайно токсичных веществ.
- Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
- Получение
- В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
- CaCO3 → (t) CaO + CO2↑
- C6H12O6 → C2H5OH + CO2↑
- В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
- CaCO3 + HCl → CaCl2 + H2O + CO2↑
- Углекислый газ образуется при горении органических веществ:
- C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
- 2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
- KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
- Na2O + CO2 → Na2CO3
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ. CO2 + H2O ⇄ H2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
- Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
- CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)
- Средние и кислые соли
- Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
- Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
- LiHCO3 + LiOH → Li2CO3 + H2O
- Нагревание солей угольной кислоты
- При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
- MgCO3 → (t) MgO + CO2
- KHCO3 → (t) K2CO3 + CO2↑ + H2O
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха. MgCO3 + HCl → MgCl2 + CO2↑ + H2O Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Углерод и его соединения в химии — формулы и определения с примерами решения задач
Содержание:
- Углерод и его соединения
- Химические свойства углерода
- Оксиды углерода
Соединения углерода весьма распространены: все живые организмы, каменный уголь, торф, нефть и др. содержат углерод.
Углерод входит в состав многих неорганических веществ (известняк, мел, мрамор и др). ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА.
Углерод — малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Углерод и его соединения
Охарактеризуйте углерод по его месту в Периодической системе. Назовите соединения углерода и валентность углерода в этих соединениях.
Углерод в виде угля, копоти, сажи известен человечеству с незапамятных времен. Элементарная природа углерода была установлена А. Лавуазье в конце 1780-х годов. Свое название элемент получил в 1824 г., в переводе с латинского оно означает «уголь».
Положение в периодической системе. Углерод – элемент 2-го периода главной подгруппы IV группы (IVА), атомный номер 6, относительная атомная масса 12, в ядре атома содержится 6 протонов и 6 нейтронов общее число электронов также 6.
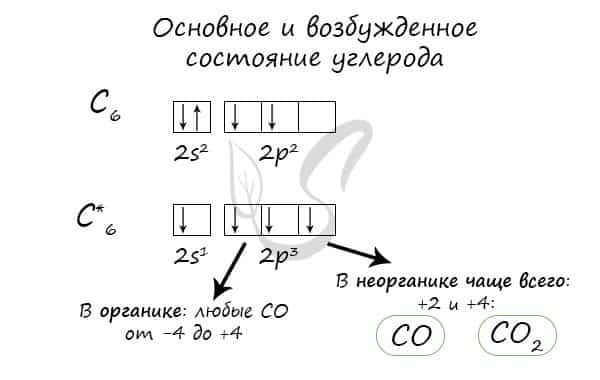
Строение атома. Электронная конфигурация атома углерода: Углерод – неметалл, p-элемент.
Валентные электроны (II, IV) размещены по орбиталям:
При возбуждении один электрон переходит с 2s-подуровня на 2p-подуровень. Поэтому в основном состоянии атом углерода двухвалентен (CО), а в возбужденном состоянии – четырехвалентен
Нахождение в природе. Углерод входит в состав всех живых организмов. В свободном состоянии углерод встречается в виде алмаза, графита и карбина (аллотропные видоизменения, рис. 69). Природные соединения углерода – доломит мрамор магнезит Нефть, каменный уголь и природный газ содержат углерод в связанном состоянии.
В свободном виде углерод не токсичен, а вот многие его соединения обладают значительной токсичностью.
Аллотропные видоизменения углерода характеризуются различным строением кристаллических решеток. Этим и объясняется резкое различие их физических свойств.
Физические свойства. Алмаз – самое твердое природное соединение на Земле. Это прозрачное, бесцветное, кристаллическое вещество, имеет тетраэдрическое строение, не электропроводен.
Графит – мягкий, непрозрачный, серого цвета, маслянистый и блестящий (рис. 68). Графит при температуре 2000оС и низком давлении превращается в карбин.
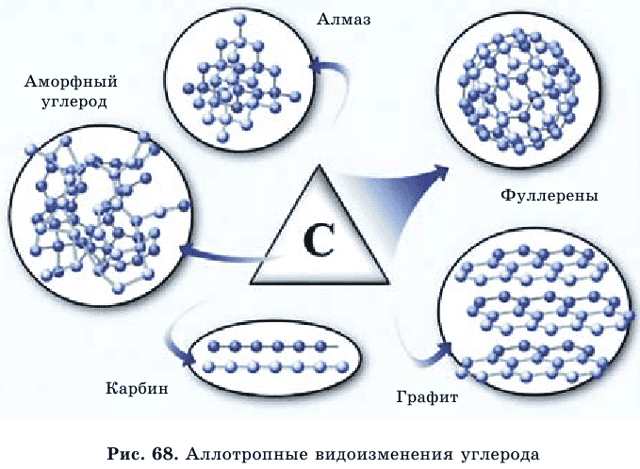
В последние годы открыли еще одну форму – фуллерен. У него структура‚ как у футбольного мяча.
К этим разновидностям можно прибавить аморфный углерод, простейшим представителем которого является древесный уголь. При сухой перегонке древесины образуется древесный уголь, у которого сильно выражена способность к адсорбции (поглощение на поверхности) газов, паров и растворенных веществ.
Получение. Сажа – аморфный углерод, продукт неполного сгорания углеводорода. Кокс – твердое искусственное топливо, продукт термической обработки каменного угля.
Запомни! Площадь поверхности активированного угля массой 1 г составляет 800 м2, поэтому он обладает повышенной адсорбционной способностью.
Адсорбент — это вещество, способное поглощать на своей поверхности газы и жидкости.
Таблетки активированного угля применяют для подготовки желудочно-кишечного тракта к рентгеновскому обследованию и УЗИ; для очистки спирта. Активированный уголь не поглощает угарный газ (СО).
Аллотропные видоизменения углерода.
Химические свойства углерода
Углерод может вступать в реакцию со многими простыми и сложными веществами (схема 9).
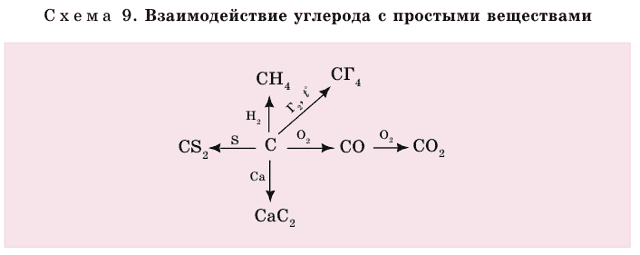
- Далее приводятся некоторые уравнения реакций с простыми веществами:
- 1) а) при неполном сгорании углерода:
- б) при полном сгорании углерода в избытке кислорода:
- 2) углерод при освещении соединяется с хлором:
- 3) с металлами образуются карбиды:
- 4) с серой образуется сероуглерод:
- Сероуглерод применяется для получения вискозного волокна и как растворитель;
- 5) с водородом образуется метан:
- Метан – газообразное топливо (основа природного газа).
- Углерод также взаимодействует со сложными веществами:
1) с водой образуется водяной газ, который является ценным топливом. Именно поэтому уголь смачивают водой, когда топят печь.
- 2) Углерод с углекислым газом образует оксид углерода (II).
- 3) С оксидами железа (этот процесс происходит в доменной печи). Углерод выделяет железо в свободном состоянии:
Применение. Алмаз используют для резки стекла, изготовления наконечников буровых установок. Из ограненного алмаза делают великолепные
Графит применяют для изготовления электродов, а также грифелей карандашей. Кокс (С) получают при сухой перегонке (нагревание без доступа воздуха). Используется в производстве металлов как восстановитель. Адсорбционная способность активированного угля находит применение в медицине, а также в противогазах (рис. 69).
- Фуллерены – это наночастицы, имеющие очень ценные особенности.
- Каждая молекула содержит 60 атомов углерода, упорядоченных в виде пяти и шестиугольников и позволяет изготавливать кристаллы, которые применяются в электронике, в компьютерах.
- Практическая работа №6 Физические и химические свойства углерода
- Цель: Знать условия образования диоксида и монооксида углерода при сжигании углерода.
- Ход работы
Опыт 1. изучение древесного угля 1. В коническую колбу налейте водный раствор какой-нибудь краски. 2. Всыпьте в раствор 0,3–0,5 г мелко истолченного древесного угля, взболтайте содержимое в течение 2–3 минут.
3. Отфильтруйте, наблюдайте исчезновение окраски.
Опыт 2. Восстановительные свойства угля. 1. Примерно одинаковые по массе порции оксида меди (II) и измельченного древесного угля перемешать на листе бумаги. 2.
Смесь пересыпьте в сухую пробирку, укрепите горизонтально в штативе. 3. Закройте пробирку пробкой с газоотводной трубкой, изогнутой под прямым углом. 4. Конец трубки опустите в раствор известковой воды. 5.
Пробирку сильно нагрейте до прекращения выделения газа.
6. Дайте пробирке остыть, отметьте цвет содержимого.
Вопросы и задания 1. Как изменился цвет раствора красителя? Дайте объяснения. 2. Напишите уравнения реакций опыта №2.
3. Каким химическим свойством обладает углерод?
Оксиды углерода
Какие оксиды углерода вы знаете? К каким оксидам они относятся? Какой из оксидов углерода (II, IV) тяжелее воздуха?
- Углерод образует два оксида: угарный газ СО и углекислый газ (диоксид углерода), которые соответствуют двух- и четырехвалентному состоянию атома углерода.
- Оксид углерода (II) – угарный газ СО.
- Впервые он был получен французским химиком Жаком де Лассаном в 1776 году при нагревании оксида цинка с углем.
Нахождение в природе. В естественных условиях, на поверхности Земли, СО образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, например, при лесных и степных пожарах.
В атмосфере СО является продуктом ряда реакций с участием метана и других углеводородов. Основным антропогенным источником СО служат выхлопные газы двигателей внутреннего сгорания.
Получение:
Физические свойства.
Оксид углерода (II) – бесцветный, плохо растворимый в воде ядовитый газ, чуть легче воздуха Он называется угарным газом, потому что связывает ион железа в молекуле гемоглобина крови, вызывая тем самым удушье, его предельно допустимая концентрация (ПДК) = 2%. В выхлопных газах двигателей внутреннего сгорания обнаружено CO (рис. 70). Признаки отравления угарным газом: кровь становится алой, головокружение, иногда потеря сознания. В первую очередь человека необходимо вывести на свежий воздух.
Химические свойства. Угарный газ СО – несолеобразующий оксид. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами. При нагревании он восстанавливает металлы из их оксидов:
- Оксид углерода (II) на воздухе горит голубоватым пламенем:
Оксид углерода (IV) – углекислый газ Он бесцветный, без запаха, тяжелее воздуха (D (возд.) = 1,52).
Оксид углерода не поддерживает горения. Он используется при огнетушении. Выделяется при дыхании животных и человека.
Из-за того что углекислый газ тяжелее воздуха, он накапливается в подвалах, шахтах, колодцах. Углекислый газ легко переходит в жидкое (при давлении 50 атм.
), а затем в твердое состояние («сухой лед»). Углекислый газ, растворенный в воде, придает воде кислый привкус (рис. 71).
Графическая формула: O = C = OКонцентрация углекислого газа в атмосфере Земли составляет 0,039%. При большой концентрации оксида углерода (IV) люди и животные задыхаются. При его концентрации до 3% у человека наблюдается учащенное дыхание, более 10% – потеря сознания и даже смерть.
Повышение концентрации углекислого газа в атмосфере вызывает «парниковый эффект», что приводит к повышению температуры и таянию ледников. Концентрация углекислого газа в атмосфере растет из-за автомобильного транспорта, количество которого увеличивается из года в год.
- Получение: 1) при сгорании углерода:
- 2) при разложении карбонатов:
- 3) из карбонатов под действием сильных кислот (рис. 73):
- Это лабораторный способ получения 4) при разложении основных солей:
- 5) при горении органических веществ:
Химические свойства. – кислотный оксид, ему соответствует угольная кислота которая существует только в растворе . Вступает в следующие реакции:
- 1) с основными оксидами образует соли:
- 2) с растворимыми основаниями образуются соль и вода:
Гидроксид кальция (известковая вода) является реагентом на углекислый газ (выделяется белый осадок). Помутнение известковой воды – качественная реакция на .
- 3) при избытке углекислого газа карбонат превращается в растворимую кислую соль:
- 4) с водой образуется слабая, неустойчивая угольная кислота:
Применение. Углекислый газ применяется при тушении пожаров, в производстве прохладительных напитков, в холодильных установках и других областях.
- Угарный, углекислый газы; ПДК угарного газа, метан, физические и химические свойства оксидов углерода, качественная реакция на
- Практическая работа №7 Получение углекислого газа и изучение его свойств
- Цель: получить углекислый газ, доказать его наличие и изучить свойства.
- Ход работы
1. В пробирку с газоотводной трубкой положите кусочки мрамора и налейте раствор соляной кислоты, наблюдайте выделение газа (рис. 73).
2. Наполните два сухих стакана углекислым газом. Каким способом его можно собирать? Наполненность проверьте горящей лучиной и затем закройте стеклянными пластинками.
3. В сухой стакан бросьте кусочек ваты, смоченной спиртом, и подожгите его горящей лучинкой.
4. Затем возьмите стакан с углекислым газом и осторожно перелейте в стакан, где горит вата? Что происходит?
5. В стакан, наполненный углекислым газом, поместите подожженную магниевую ленту, держа ее шипцами. Наблюдайте за горением магния.
6. Продукты реакции залейте разбавленным раствором соляной кислоты. Что остается на дне стакана?
Вопросы и задания 1. Напишите все уравнения реакций, определите типы реакций. 2. К каким оксидам относится углекислый газ? 3. Можно ли собирать углекислый газ методом вытеснения воды? Ответ мотивируйте.
4. Углекислый газ тяжелее или легче воздуха? На каких этапах работы вы это наблюдали?
ДЕЛЛЕМ ВЫВОДЫ
- 1. Углерод встречается в четырех аллотропных видоизменениях (алмаз, графит, карбин). Фуллерен — это искусственная модификация углерода, не существующая в природе.
- 2. В соединениях углерод проявляет валентность II, IV (СН4, СО, со2).
- 3. СО — угарный (ядовитый) газ, несолеобразующий оксид. СО., -кислотный оксид.
- 4. Углекислому газу соответствует угольная кислота Н„СО3. Она непрочная, разлагается. Соли этой кислоты называются карбонатами.
- 5. Активированный уголь — хороший адсорбент.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
- Лекции по химии:
- Лекции по неорганической химии:
- Лекции по органической химии:
КАРБИДЫ
КАРБИДЫ (от латинского carbo – уголь) – соединения углерода с металлами, а также с бором и кремнием. Эти соединения обладают удивительным разнообразием физических и химических свойств.
Так, карбид золота Au2C2 взрывается уже при попытке пересыпать его с листочка фильтровальной бумаги, на котором он был высушен.
С другой стороны, карбиды некоторых элементов (например, бора и тантала) не разлагаются даже при температуре белого каления и настолько химически инертны, что на них не действует царская водка, а по твердости они приближаются к алмазу!
Впервые необычное соединение металла с углеродом (К2С2) получил в 1809 знаменитый английский химик Гемфри Дэви. В 1863 французский химик Марселен Бертло изучил свойства другого карбида – очень неустойчивого и легко взрывающегося карбида одновалентной меди Cu2C2. В 1878 немецкий металлург Ф.Мюллер, растворив образцы стали в разбавленной серной кислоте, выделил карбид железа Fe3C.
Но только в конце 19 в. французский химик Анри Муассан, прославившийся получением фтора, синтезировал многие из этих необычных соединений и изучил их свойства. Он получал карбиды, нагревая до очень высокой температуры смеси древесного угля с разными металлами, их оксидами или карбонатами. Для этого он использовал жар вольтовой дуги в электрической печи собственной конструкции.
Карбиды, как оказалось, можно получить не только в лаборатории. Еще до работ Муассана австрийский ученый Э.
Вайнсхенк в 1889 открыл в метеоритах минерал когенит, представляющий собой смешанный карбид железа, кобальта и никеля состава (FeNiCo)3C.
А сам Муассан в 1904 обнаружил в метеорите, привезенном из каньона Диабло в штате Аризона, темно-зеленый минерал, представляющий собой карбид кремния SiC. Этот минерал в честь ученого назвали муассанитом.
Раньше карбиды классифицировали по их устойчивости к действию воды и кислот, а также по тому, какие газы выделяются при их разложении.
Современная классификация учитывает тип химической связи между атомами в карбидах – именно от этого зависят в основном физические и химические свойства.
В соответствии с этой классификацией, карбиды можно разделить на три группы, которые довольно сильно отличаются по своим свойствам.
К первой группе относятся так называемые солеобразные карбиды с ионной связью. Эти карбиды образуют щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды. Их состав иногда соответствует типичным валентностям металлов (Al4C3), а иногда – нет (Ве2С).
Многие ионные карбиды можно получить непосредственно из элементов (Са + 2С ® СаС2) или восстановлением оксидов углеродом (СаО + 3С ® СаС2 + СО). Ионный характер связи приводит к высокой температуре плавления; например, карбид кальция СаС2 плавится при 2300°С, карбид тория ThC2 – при 2655°С.
Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются. При этом образуются различные углеводороды и гидроксид металла. Самый известный пример – получение ацетиленагидролизом карбида кальция: СаС2 + 2Н2О ® Ca(OH)2 + С2Н2. Ацетилен выделяется также при гидролизе Na2C2, К2С2 и др.
Поэтому такие карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. При этом катионы металла и анионы С2–2 размещаются в соответствующих узлах кристаллической решетки. Солеобразный характер этих карбидов подтверждается возможностью их электролиза в расплавленном состоянии.
Интересно отметить, что чистый карбид кальция – бесцветные кристаллы, хотя увидеть их непросто, так как обычный технический продукт имеет цвет от бурого до черного.
Взаимодействие карбидов щелочных металлов с водой протекает исключительно бурно. Так, если карбид калия просто облить водой, произойдет бурная реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию К2С2 + 2Н2О ® 2КОН + С2Н2, надо медленно пропускать над карбидом водяной пар.
В ряде случаев карбиды ионного типа образуются непосредственно при пропускании ацетилена через растворы солей металлов. Так карбиды серебра, меди(I), золота и ртути, которые чаще называют ацетиленидами. Ацетилениды щелочных металлов можно получить действием ацетилена на свободные металлы. В сухом виде ацетилениды тяжелых металлов легко разлагаются со взрывом.
Гидролиз ионных карбидов других металлов показывает, что они «происходят» из других углеводородов. Например, при гидролизе карбида алюминия выделяется метан: Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С), а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O ® 2Mg(OH)2+ НС≡С–СН3.
Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O ® 3Mn(OH)2 + CH4 + H2.
Карбиды редкоземельных металлов и тория при разложении разбавленными кислотами выделяют не чистый ацетилен, а его смесь с метаном, этиленом и другими углеводородами.
Например, при гидролизе карбида церия СеС2 получается смесь ацетилена с метаном в соотношении 4:1, а также немного этилена и жидких и твердых углеводородов (состав продуктов зависит от условий проведения реакции). Еще больше жидких и твердых углеводородов дает при гидролизе карбид урана.
Выделение углеводородов при гидролизе карбидов позволило Д.И.Менделееву выдвинуть так называемую карбидную теорию происхождения нефти в глубинах Земли из неорганических веществ.
По представлению Менделеева, в глубинах земного шара должны быть расплавленные металлы, в основном железо, которое с углеродом дает карбид. Во время горообразования в земной коре образуются трещины, по которым в глубины проникает вода.
Воздействуя на карбид железа и карбиды других металлов, вода (в виде пара) образует углеводороды, например: 2FeC + 3H2O ® Fe2O3 + C2H4. Газообразные углеводороды по тем же трещинам поднимаются ближе к поверхности, где скапливаются в пористых пластах. Однако когда в 60-е гг. 20 в.
был подробно изучен состав углеводородов нефти, оказалось, что смесь «искусственных углеводородов», образующихся при гидролизе карбидов, по своему составу резко отличается от природной смеси.
Кроме того, все нефти, полученные неорганическим путем, оптически неактивны, тогда как природная нефть оптически активна. На основании этих, а также ряда других фактов неорганическая теория происхождения нефти была подвергнута критике, и в настоящее время многие ученые полагают, что нефть имеет биологическое происхождение.
Ко второй группе относятся карбиды, которые образуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Это металлоподобные соединения с другой структурой. В них атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов.
Различная упаковка атомов металла в кристаллической решетке приводит к разному составу карбидов даже для одного и того же металла; например, хром образует карбиды состава Cr3C2, Cr4C, Cr7C3 и др. Эти карбиды (их называют карбидами внедрения) часто отличаются большой твердостью и очень высокими температурами плавления.
Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890°С соответственно).
Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке).
Они используются для упрочнения чугуна и стали (карбиды железа, хрома, вольфрама, молибдена), а также для производства очень твердых сплавов, которые применяют для обработки металлов резанием (карбиды WC, TiC, TaC, VC, Cr3C2).
Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта. Очень важную роль играет карбид железа Fe3C (цементит) – твердые кристаллы, входящие в структуру чугуна и стали.
Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических алмазов, для нанесения износостойких покрытий на поверхности металлов.
Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх, где х колеблется в пределах от 0,49 до 1 (см. СТЕХИОМЕТРИЯ).
Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257°С). Карбидом титана выкладывают внутренние стенки высокотемпературных печей.
К третьей группе относятся ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности.
Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного.
По своей структуре это соединение аналогично алмазу; решетку карбида кремния можно получить, если в немного расширенной решетке алмаза заменить половину атомов углерода на атомы кремния.
Это вещество обладает очень высокой твердостью; помимо этого оно имеет свойства полупроводника. Из него делают шлифовальные бруски и круги, огнеупорные материалы для печей и литейных машин, нагревательные элементы для электропечей, полупроводниковые диоды.
Бор образует по два карбида с точно известной структурой – В4С и В13С2.
Наибольшее значение имеет первый из них – черные блестящие кристаллы, которые по твердости уступают лишь алмазу и нитриду бора BN.
Этот карбид применяют для изготовления абразивных и шлифовальных материалов и в качестве полупроводника. Карбид, обогащенный изотопом 10В, используется как поглотитель нейтронов в ядерных реакторах.
Илья Леенсон
Карбонилы металлов | это… Что такое Карбонилы металлов?
Строение молекулы карбонила хрома Cr(CO)6
Карбонилы металлов — химические соединения, координационные комплексы монооксида углерода СО с переходными металлами общей формулой Mem(CO)n, например, карбонил железа — Fe(CO)5.
История открытия
Первым (в 1890) был открыт карбонил никеля Ni(CO)4.
Строение карбонилов
Атом металла в карбониле находится в нулевой степени окисления. Карбонилы бывают одно-, двух- и многоядерными, при этом d-элементы с чётным числом валентных электронов образуют одноядерные, а с нечётным — двухъядерные карбонилы со связью металл-металл. Молекулы карбонилов элементов подгруппы хрома (Cr, Mo, W) имеют форму октаэдра с атомом металла в центре.
Свойства карбонилов
Карбонилы никеля, железа, осмия, рутения — жидкости; большинство других — кристаллические вещества. Карбонилы диамагнитны, весьма летучи, чрезвычайно токсичны, хорошо растворимы в органических растворителях, но, как правило, плохо растворимы в воде. При нагревании выше определённой температуры карбонилы разлагаются с выделением угарного газа и металла в мелкодисперсном состоянии.
Физические свойства некоторых карбонилов металлов
| V(CO)6 | зелёно-голубой | разлагается | — | |
| Cr(CO)6 | бесцветный | 150 | разлагается | 1,77 |
| Mn2(CO)10 | жёлтый | 157 | возгоняется | 1,75 |
| Fe(CO)5 | жёлтый | −20 | 103 | 1,455 |
| Fe2(CO)9 | оранжевый | разлагается | 2,85 | |
| Fe3(CO)12 | тёмно-зелёный | 165 | разлагается | |
| Со2(СО)8 | оранжево-красный | 51 | разлагается | 1,87 |
| Со4(СО)12 | чёрный | разлагается | ||
| Ni(CO)4 | бесцветный | −19,3 | 43 | 1,31 |
| Mo(CO)6 | бесцветный | 150 | разлагается | 1,96 |
| Tc2(CO)10 | бесцветный | 160 | ||
| Ru(CO)5 | бесцвеный | −22 | ||
| Ru3(CO)12 | оранжевый | 155 | ||
| Rh2(CO)8 | оранжевый | 76 | ||
| Rh4(CO)12 | красный | |||
| W(CO)6 | бесцветный | 150 | разлагается | 2,65 |
| Re2(CO)10 | бесцветный | 177 | разлагается | 2,87 |
| Os(CO)5 | бесцветный | −15 | ||
| Os3(CO)12 | жёлтый | 224 | разлагается | |
| Ir2(CO)8 | зелёно-жёлтый | разлагается | — | |
| Ir4(CO)12 | жёлтый |
Способы получения
Общий способ получения карбонилов металлов заключается во взаимодействии окиси углерода с металлами или их солями при повышенных температурах и давлении.
В частности, для получения Fe(CO)5 необходимы температура порядка 180—220 °C и давление 1·107-2·107 Па; для Co2(CO)8 — 150—200 °C и 2,5·107 Па; сравнительно легко можно получить тетракарбонил никеля Ni(CO)4, образующийся уже при 60-80 °C.
Применение
Наибольшее техническое значение имеют карбонилы никеля Ni(CO)4, кобальта Со2(СО)8 и железа Fe(CO)5. Карбонилы применяют для получения чистых металлов, образующихся при их термическом разложении.
Термическое разложение карбонилов кобальта, никеля и хрома используется для нанесения металлических покрытий, особенно на поверхности сложной формы.
Карбонилы кобальта и никеля применяются в качестве катализаторов важных химических процессов, используют при синтезе карбоновых кислот и их производных из олефинов, акриловой кислоты из ацетилена, при гидроформилировании.
Лёгкость образования тетракарбонила никеля используется для разделения кобальт-никелевых смесей, поскольку для получения Co2(CO)8 необходимы более высоокие температуры и давления. Также высокой степени разделения никеля и кобальта удаётся достичь разгонкой смесей их карбонилов, так как летучесть последнего значительно меньше.
Карбонилы металлов — хорошие антидетонаторы моторного топлива, однако при их сгорании образуются трудноудаляемые оксиды. Некоторые карбонилы используются для получения абсолютно чистого оксида углерода (II).
Углерод и его соединения
Углерод находится в природе, как в свободном состоянии, так и виде соединений. Свободный углерод встречается в виде алмаза и графита. Некоторые из ископаемых углей содержат до 99 % углерода. Кроме ископаемого угля, в недрах Земли находятся большие скопления нефти, представляющие собой в основном смесь углеводородов.
Хотя содержание углерода в земной коре мало (0.09 %) , этот элемент, наряду с азотом, серой и фосфором является основой жизни на Земле. По разнообразию своих соединений углерод занимает особое место в химии.
В настоящее время число изученных соединений углерода оценивается примерно в 2 млн, тогда как соединения всех остальных элементов, вместе взятые, исчисляются лишь сотнями тысяч.
Алмаз-бесцветное, прозрачное вещество, чрезвычайно сильно преломляющее лучи света. Из всех простых веществ он имеет максимальное число атомов, приходящихся на единицу объема.
С этим, а также с большой прочностью связи между атомами углерода связано то, что по твердости алмаз превосходит все известные вещества. Будучи весьма твердым, алмаз в то же время хрупок, и его можно растереть в порошок в стальной ступке.
Отшлифованные прозрачные алмазы называются бриллиантами.
Алмаз имеет низкую реакционную способность. Он горит в кислороде только при 8000, превращаясь в двуокись углерода с сильным выделением света (Лавуазье). Кислоты, основания и галогены не реагируют с алмазом, но раствор хлорки (гипохлорита кальция) его окисляет.
При низких температурах уголь и графит относительно инертны, хотя известны случаи самовозгорания больших масс угля. При нагревании их активность увеличивается. Уголь служит хорошим восстановителем, отнимая кислород у оксидов металлов. Таким образом, выплавляют многие металлы
MemOn + n/2C = mMe + n/2CO2
При сгорании на воздухе углерод образует два соединения: углекислый газ CO2 при избытке кислорода
рН слабых оснований
- C + O2 = CO2
- и угарный газ СО при его недостатке
- C + 1/2O2 = CO
Угарный газ не имеет цвета и запаха. При его вдыхании кровь человека насыщается этим газом, что приводит к сильному снижению концентрации кислорода в крови, человек при этом засыпает, и во сне наступает смерть от удушья. Подобные случаи известны жителям загородных домов, где есть печка или банька.
На солнечном свету или в присутствии активного угля (катализатор) оксид углерода непосредственно соединяется с хлором, образуя чрезвычайно ядовитый газ-фосген
СO + Cl2 = COCl2
При пожарах в помещениях из-за недостатка кислорода образуется угарный газ, а из полимерных материалов, содержащих хлор, может выделяться молекулярный хлор. При взаимодействии этих газов при пожаре может образовываться фосген.
При очень высоких температурах углерод соединяется с водородом, серой, кремнием, бором и многими металлами. Соединения металлов с углеродом называются карбидами.
Карбиды — кристаллические тела. Природа химической связи в них может быть различной.
Так, многие карбиды металлов главных подгрупп I, II и III групп периодической системы представляют собой солеобразные соединения с преобладанием ионной связи.
К их числу относятся карбиды алюминия Al4C3 и кальция СаС2. При взаимодействии с водой эти карбиды (неорганические соединения) дают метан и ацетилен (органические соединения)
- Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
- CaC2 + 2H2O = Ca(OH)2 + C2H2
- При взаимодействии карбида магния Mg2C3 с водой получается более сложное органическое соединение пропин (метилацетилен) СH3-CºCH.
В карбидах кремния SiC и бора B4C связь меду атомами ковалентная. Эти вещества характеризуются высокой твердостью, тугоплавкостью и химической инертностью.
Большинство металлов побочных подгрупп IV-VIII групп образуют карбиды, связь в которых близка к металлической, вследствие чего эти карбиды в некоторых отношениях сходны с металлами, например, обладают значительной электрической проводимостью. Они характеризуются также высокой твердостью и тугоплавкостью; карбиды этой группы применяются в ряде отраслей промышленности.
Висмут и его соединения
- Большинство ценных свойств чугунов и сталей обусловлены присутствием в них карбида железа Fe3C.
- При растворении углекислого газа в воде образуется очень слабая угольная кислота
- CO2 + H2O = H2CO3
- Равновесие этой реакции сильно сдвинуто влево, лишь очень небольшое количество растворенного углекислого газа превращается в угольную кислоту.
Со слабыми основаниями угольная кислота в большинстве случаев дает только основные соли. Встречающийся в природе минерал — (CuOH)2CO3 (основная соль), называется малахитом. Из солей угольной кислоты в природе распространен карбонат кальция CaCO3. Он встречается в виде известняка, мела и мрамора.
В быту хорошо известен карбонат натрия-сода Na2CO3. Сода — один из главных продуктов химической промышленности. Она в больших количествах потребляется стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной и другими отраслями промышленности.
Карбонат калия, или поташ, К2СО3 применяется для получения мыла, при изготовлении тугоплавкого стекла, в фотографии.
При взаимодействии углекислого газа с аммиаком под давлением получают карбамид (мочевину)
СO2 + 2NH3 = CO(NH2)2 + H2O
Он используется в сельском хозяйстве в качестве азотного удобрения. На основе карбамида получают карбамидные пластики.
Ваша оценка?






