- Химическая активность металлов
- Реакции металлов с кислородом и водой
- Взаимодействие металлов с кислотами. ряд активности металлов
- Взаимодействие металлов с растворами солей
- Активные металлы
- Ряд активности металлов
- Активные металлы — список в химии, таблица, реакции и ряд — Природа Мира
- Подведение итогов
- § 44. Общие химические свойства металлов
- Ряд активности металлов
- Содержание:
- Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
- Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
- На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химическая активность металлов
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Реакции металлов с кислородом и водой
Что вы знаете о ржавлении железа? Расскажите о разрушении металлов? Как вы думаете, как можно защитить металлы от разрушения? Где применяются металлы? Приведите примеры из жизни.
Металлы мы часто применяем в повседневной жизни. Это алюминий, медь, железо, золото, серебро и т. д. Алюминий и медь применяются для изготовления проводов. Алюминиевой фольгой упаковывают лекарства.
В домашнем обиходе вы часто встречаете алюминиевую посуду и упаковки для напитков. Но больше всего применяется железо для изготовления различных металлоконструкций, трубопроводов, деталей машин и т. д.
Этот металл от воды и кислорода воздуха приходит в негодность, изменяет цвет и тускнеет.
Железо покрывается ржавчиной красно-бурого цвета. Железо + вода + воздух → ржавчина. Такой химический процесс называется коррозией (от лат. corrodere – разъедать).
- Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- Поверхность алюминия покрывается оксидной пленкой, которая препятствует коррозии:
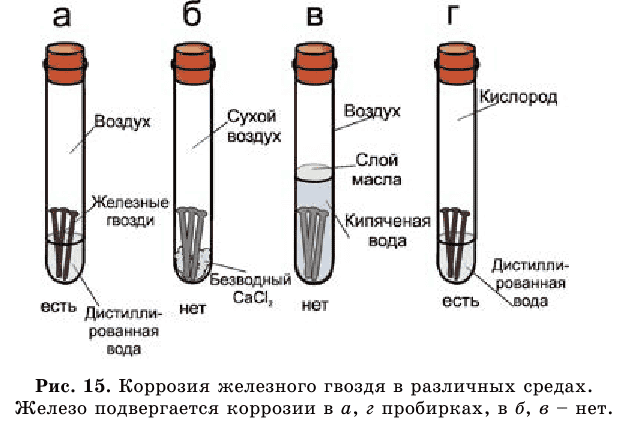
Химические активные металлы легко окисляются кислородом воздуха (Na, Mg, Ca). Железо и медь окисляются только при нагревании:
А золото и некоторые благородные металлы вообще не окисляются кислородом.
Рассмотрите рисунок 15 и сами сделайте выводы.
Ежегодно четвертая часть всего производимого металла из-за коррозии приходит в негодность (рис. 16).
Знаменитую Эйфелеву башню в Париже красили уже 18 раз, в результате чего ее масса увеличилась на 70 т.
Коррозия вызывает серьезные экологические катастрофы. Из разрушенных трубопроводов может быть утечка газа, нефти, опасных химических продуктов. Это приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
Металлы защищают от коррозии нанесением покрытий на поверхность изделия: окраска металла лаками, красками, эмалями. Но это покрытие недолговечно. Предохраняют металл покрытием другого металла, менее подверженного коррозии.
Это – золото, серебро, хром, никель, олово, цинк и др. В повседневной жизни часто применяют оцинкованные ведра, никелированные кровати. Для консервных банок применяют железо, покрытое оловом. Такое железо называют белой жестью. Белую жесть получают в г.
Темиртау Карагандинской области на металлургическом заводе. Можно уменьшить коррозию железа, добавляя другие металлы: никель, хром, молибден. Таким образом, получают сплав, который называется нержавеющей сталью.
Из этой стали изготавливают столовые приборы, трубы и другие изделия.
Олово — достаточно редкий, но очень полезный металл. Известно, что его начали добывать раньше, чем железо. Олово — это мягкий белый металл, который можно сплавлять с медью, чтобы получить бронзу.
Олово — один из первых освоенных человеком металлов. Оно не подвержено коррозии, поэтому из него делают тару для упаковки. Слой олова, нанесенный на другие металлы, делает их поверхность гладкой и блестящей.
Банки для хранения консервов и напитков также делают из тонкого стального листа, покрытого оловом.
Взаимодействие воды с некоторыми металлами (рис. 17). 1. Взаимодействие воды с активными металлами в обычных условиях идет очень интенсивно.
При этом протекают реакции замещения
При проведении таких опытов необходимо соблюдать меры предосторожности.
2. При взаимодействии металлов средней активности с водой вместо щелочи выделяется оксид металла:
3. Малоактивные металлы (Cu) с водой не реагируют.
Коррозия, ржавчина, защита от коррозии, белая жесть, алюминиевая фольга, сплав
Свинец — тяжелый голубовато-серый металл, который не ржавеет. Он используется в автомобильных аккумуляторах. Свинцовые экраны защищают людей от опасной радиации. Но свинец токсичен и ядовит для человека.
- Демонстрация №2
- Взаимодействие активных металлов с холодной и горячей водой
- Демонстрацию выполняет учитель, учащиеся наблюдают, делают выводы.
- Цель: узнать, как реагируют активные металлы с холодной и горячей водой.

Обрежьте кусочек натрия скальпелем, высушите фильтровальной бумагой. Высушенный кусочек натрия следует бросить в кристаллизатор с холодной, а затем горячей водой. Наблюдать за ходом реакции через стекло вытяжного шкафа. Такую же реакцию проделать и с металлическим кальцием. Испытать полученные растворы двумя индикаторами.
Взаимодействие металлов с кислотами. ряд активности металлов
Что такое кислоты? Какие кислые вещества вы встречали в природе?
В соответствии с определением кислоты должны вступать в реакции с металлами. Все ли металлы взаимодействуют с кислотами? Это можно проверить на опыте.
В четыре пронумерованные пробирки нальем одинаковое количество раствора соляной кислоты и добавим: в первую пробирку – Mg; во вторую – Zn; в третью – Sn; в четвертую – Cu.
Как видим, не все металлы могут взаимодействовать с кислотами и скорости их взаимодействия различны (рис. 18).
На основании интенсивности взаимодействия металлов с кислотами русским ученым Н.Н. Бекетовым был составлен ряд активности металлов:
Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag Au
При использовании ряда химической активности нужно помнить следующие правила:
1) металлы, стоящие в начале этого ряда, химически активны, они могут вытеснить водород из воды. 2) активность металлов в этом ряду снижается слева направо 3) только металлы, стоящие в ряду активности до водорода, вытесняют водород из растворов кислот (рис. 18):
активный металл + кислота —> соль + водород
Протекает реакция замещения. Металлы, стоящие в ряду активности после водорода, не реагируют с разбавленными растворами кислот (табл. 6).
- Лабораторный опыт №3
Взаимодействие металлов с растворами кислот - Цель: исследовать реакции различных металлов с растворами кислот и сделать вывод о существовании химически инертных металлов.
Налейте в четыре пробирки раствор соляной кислоты. В одну из пробирок насыпьте порошка магния, в другую – поместите гранулы цинка, в третью – опилки железа, в четвертую – стружки меди.
Может ли железо не подвергаться коррозии? Да, если оно очень чистое. Например, в Дели (Индия) находится Кутубская колонна высотой 7 м, массой 6,5 т. Она установлена в IX в. до н. э., в ее составе 99,72% Fe. До сих пор эта колонна не подверглась коррозии.
Взаимодействие металлов с растворами солей
Какие соли вы встречали в повседневной жизни?
Химически активные металлы вытесняют менее активные металлы из растворов солей, при этом протекает реакция замещения. Например, из раствора сульфата меди (ІІ) железо вытесняет медь (рис. 19):
Выделение красного налета меди является признаком реакции. Обратная реакция не протекает потому что медь в ряду активности металлов находится после железа, поэтому не вытесняет его.
- Схема реакций замещения выглядит следующим образом:
- соль 4- активный металл = новая соль + новый металл (менее активный)
- Реакции такого типа протекают при следующих условиях: 1) взаимодействующие соли должны быть растворимыми в воде;
- 2) более активный металл вытесняет из соли менее активный металл.
- Демонстрация №3
Вытеснение металлов из растворов солей - Цель: понимать, что более активный металл вытесняет менее активный металл из растворов его солей.
В пробирку поместите гранулы цинка и налейте раствор сульфата меди. В другую пробирку поместите небольшие кусочки железа и налейте раствор сульфата меди. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Практическая работа № 1 Сравнение активности металлов
Цель: Разработать ряд активности металлов. Обобщить результаты и сделать выводы.
Ход работы
В пять пробирок налейте растворы солей по 5 мл, опустите в каждую пробирку стружки меди. Затем такие опыты повторите с другими металлами. Наблюдайте за интенсивностью хода реакций. Заполните таблицу: где идет реакция следует поставить знак “+”, если не идет реакция – знак “–”. По сравнительной интенсивности, т. е. по числу протекающих реакций, составьте ряд активности металлов.
ДЕЛАЕМ ВЫВОДЫ:
- 1. Атомы металлов в реакциях только отдают электроны, образуя положительно заряженные ионы.
- 2. Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- 3. Сравнительную активность металлов можно определить с помощью ряда активности, составленного Н. Н. Бекетовым.
- 4. Металлы IA, НА группы очень легко вступают во взаимодействие с кислородом и водой. Многие металлы образуют оксидную пленку, которая препятствует дальнейшему окислению. Благородные металлы вообще не реагируют с кислородом и водой.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
- Лекции по химии:
- Лекции по неорганической химии:
- Лекции по органической химии:
Активные металлы


Средняя оценка: 4.4
Всего получено оценок: 1077.
Средняя оценка: 4.4
Всего получено оценок: 1077.
Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.
 Рис. 2. Электрохимический ряд напряжений металлов.
Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
| Реакция | Уравнение | Исключение |
| Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом | K + O2 → KO2 | Литий реагирует с кислородом только при высокой температуре |
| Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются | 2Ca + O2 → 2CaO | |
| Реагируют с простыми веществами, образуя соли | – Ca + Br2 → CaBr2; – 2Al + 3S → Al2S3 | Алюминий не вступает в реакцию с водородом |
| Бурно реагируют с водой, образуя щёлочи и водород | – 2Na + 2H2O → 2NaOH + H2; – Ca + 2H2O → Ca(OH)2 + H2 | Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки |
| Реагируют с кислотами, образуя соли |
– Ca + 2HCl → CaCl2 + H2; – 2K + 2HMnO4 → 2KMnO4 + H2 |
|
| Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью |
2Na + CuCl2 + 2H2O: – 2Na + 2H2O → 2NaOH + H2; – 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl |
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.
 Рис. 3. Минералы и чистые металлы.
Рис. 3. Минералы и чистые металлы.
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня.
Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли.
Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.4
Всего получено оценок: 1077.
А какая ваша оценка?
Гость завершил
Тест на тему «Былина»с результатом 3/5
Гость завершил
Тест Старый генийс результатом 6/10
Гость завершил
Тест «Илья Обломов»с результатом 10/10
Гость завершил
Тест «Тарас Бульба»с результатом 12/16
Гость завершил
Тест «Ионыч»с результатом 10/10
Гость завершил
Тест «Матрёнин двор»с результатом 9/11
Гость завершил
Тест «Мцыри»с результатом 11/18
Гость завершил
Тест «Пиковая дама»с результатом 12/14
Не подошло? Напиши в х, чего не хватает!
Ряд активности металлов
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления.
По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами.
Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
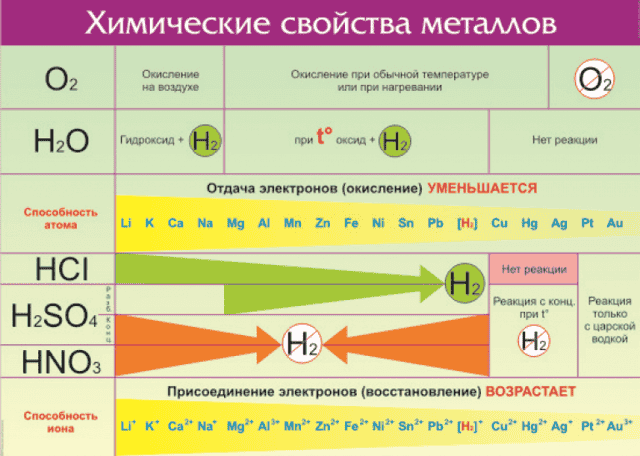
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций.
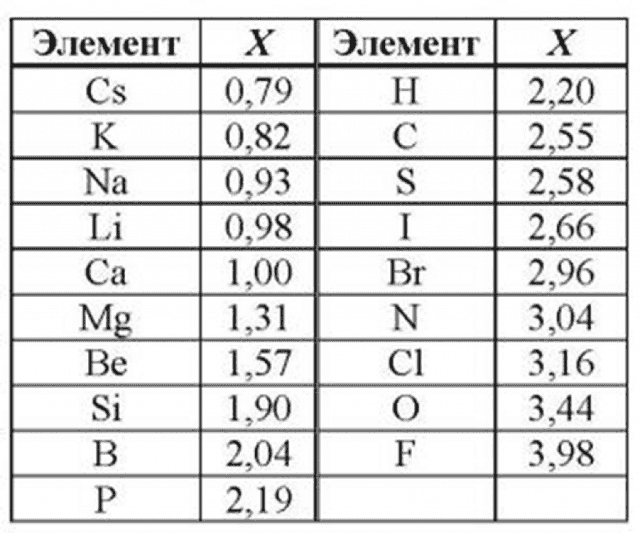
Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем.
Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
- Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
- Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее.
Пример реакции — Zn + Cu2+ → Zn2+ + Cu, которая протекает только в одном направлении.
Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является.
Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами.
Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
- 2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
- Fe + 2HCl = FeCl2 + H2↑
- Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью.
Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом.
Если извлечь их из керосина, то металлы практически мгновенно сгорают.
- Реакции кальция и натрия с водой при комнатной температуре выглядят так:
- 2Na + 2H2O = 2NaOH + H2↑
- Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
- 3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция.
Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла.
Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Активные металлы — список в химии, таблица, реакции и ряд — Природа Мира
Среди всех металлов некоторые отличаются тем, что они очень легко вступают в восстановительные реакции. Такие металлы имеют много схожих свойств и объединяются в класс активных металлов.
К активным металлам относятся три группы элементов:
- щелочные металлы;
- щелочноземельные металлы;
- алюминий.
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr).
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
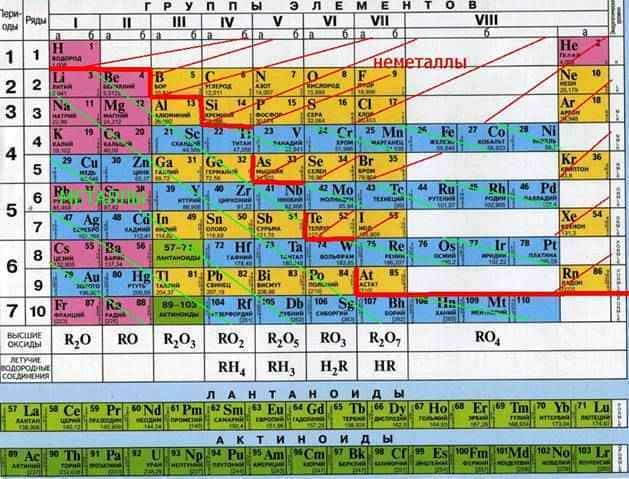 Активные металлы в таблице Менделеева
Активные металлы в таблице Менделеева
В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей.
Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий.
В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.
 Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов
Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Цвет всех щелочных металлов – белый, с серебристым оттенком. Исключением является цезий, имеющий серебристо-желтый цвет. Щелочные металлы можно резать простым скальпелем, так как у них низкая твердость. Также они имеют малую плотность – от 534 кг/м3 у лития до 1900 кг/м3 у цезия.
Литий, калий и натрий настолько легкие, что они плавают в воде, но построить корабль из них не получится, так как вода быстро окисляет и разрушает эти металлы.
Франций и цезий плавятся уже при комнатной температуре, а самый тугоплавкий щелочной металл – это литий, плавящийся при 180,6°С.
Для защиты щелочных металлов от воздуха и волы их хранят в керосине. При реагировании лития с водой выделяется водород, а натрий и особенно калий просто взрываются в воде. При взаимодействии с кислородом образуются оксиды.
Щелочноземельные металлы значительно тверже щелочных, их нельзя просто взять и разрежать ножом. Также они тяжелее – их плотность колеблется от 1550 кг/м3 у кальция до 5500 кг/м3 у радия. Цвет щелочноземельных металлов – серый. Температуры плавления этих элементов находятся в диапазоне 650-840°С. Исключение – бериллий, плавящийся лишь при 1278°С.
Чем больше порядковый номер щелочноземельного металла в таблице Менделеева, тем выше его химическая активность. Например, бериллий вообще не взаимодействует с кислородом и по своим свойствам напоминает алюминий. Наиболее активные стронций, барий и радий приходится хранить в керосине, также как и щелочные металлы.
Подведение итогов
Активные металлы отличаются тем, что имеют лишь один-два валентных электрона, которые они легко отдают. Поэтому эти элементы очень быстро вступают в химические реакции, а в природе в чистом виде не встречаются.
Не все нашли? Используйте поиск по сайту
§ 44. Общие химические свойства металлов
Общие химические свойства металлов
По химическим свойствам металлы являются восстановителями, так как легко отдают свои электроны атомам неметаллов, превращаясь в положительно заряженные ионы — катионы.
Способность атомов металлов отдавать, а их катионов — присоединять электроны может служить мерой их химической активности.
Так, алюминий на воздухе очень быстро покрывается оксидной плёнкой, а с золотом заметных изменений не происходит. Цинк активно взаимодействует с соляной кислотой, а серебро — нет.
Поэтому алюминий и цинк можно отнести к активным металлам, а золото и серебро — к неактивным.
Ряд активности металлов
Химическую активность разных металлов легко сопоставить, анализируя их поведение в водных растворах солей и кислот.
Например, если в раствор сульфата меди(II) опустить цинковую пластинку или железный гвоздь, то практически сразу же на их поверхности появляется красноватый налёт меди.
Это свидетельствует о том, что цинк и железо вытесняют медь из раствора. Эти процессы можно представить следующими уравнениями:
- Zn + CuSО4 = ZnSО4 + Сu↓,
- Zn0 + Сu2+ = Zn2+ + Cu0;
- Fe + CuSО4 = FeSО4 + Сu↓,
- Fe0 + Cu2+ = Fe2+ + Сu0.
В этих реакциях цинк и железо отдают свои электроны ионам меди, то есть они окисляются. Ионы меди принимают электроны, поэтому медь восстанавливается.
Если поступить наоборот и в раствор сульфата цинка поместить медную пластинку, то на ней не произойдёт осаждения цинка. В чём тут причина?
Экспериментальным путём, изучая способность одних металлов вытеснять другие из водных растворов их солей, русский учёный Н. Н. Бекетов расположил металлы в ряд. В нём металлы, находящиеся левее, способны восстанавливать последующие из растворов их солей. Поскольку эта способность металлов связана с их восстановительной активностью, то этот ряд получил название ряда активности металлов.
Ряд активности металлов
Li K Ba Sr Cа Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H2) Cu Hg Ag Pd Pt Au
Чем левее в этом ряду расположен металл, тем большими восстановительными свойствами в водном растворе он обладает, то есть легче отдаёт свои электроны окислителю и переходит в виде катиона в раствор; тем труднее катион этого металла восстанавливается. Цинк и железо легче отдают свои электроны, чем медь, и поэтому восстанавливают Cu2+ из раствора.
- По положению цинка в ряду активности можно прогнозировать, что этот металл способен восстановить из раствора ионы олова, меди и серебра:
- Zn0 + Sn2+ = Zn2+ + Sn0;
- Zn0 + Сu2+ = Zn2+ + Cu0;
- Zn0 + 2Ag+ = Zn2+ + 2Ag0.
- В то же время медь будет восстанавливать только ионы серебра, но не восстановит ионы олова:
- Cu0 + 2Ag+ = Cu2+ + 2Ag0.
Это означает, что цинк обладает большей восстановительной способностью. Он легче отдаёт электроны, чем олово, медь и серебро. Поэтому цинк считается более активным металлом, чем эти металлы. В свою очередь, медь — более активный металл, чем серебро.
Ряд активности металлов позволяет не только прогнозировать поведение металлов в реакциях с растворами солей, но и сравнивать их отношение к воде, растворам кислот, а также к неметаллам и ряду других веществ.
Так, слева от водорода расположены металлы, которые вытесняют водород из воды и кислот (то есть восстанавливают ионы водорода Н+). Металлы, расположенные справа от водорода, такой восстановительной активности в реакциях с растворами кислот не проявляют. Например, цинк реагирует с соляной кислотой, вытесняя водород:
- Zn + 2НСl = ZnCl2 + Н2↑,
- Zn0 + 2Н+ = Zn2+ + ,
- а серебро водород не вытесняет.
Взаимодействие металлов с простыми и сложными веществами
К общим химическим свойствам металлов относят их реакции с неметаллами, водой, кислотами, солями. Для некоторых металлов также характерны реакции с растворами щелочей. Часть металлов вступает в реакции с органическими веществами.
Многие перечисленные взаимодействия вам известны из предыдущих глав пособия. Кроме того, вы изучали химические свойства металлов в 9-м классе. Поэтому на данном этапе обучения мы систематизируем известные вам свойства, составив таблицу 31.
Таблица 31. Общие химические свойства металлов
| Реагенты и уравнения реакций | Особенности взаимодействия с металлами |
| Неметаллы | Образуют бинарные соединения: оксиды, гидриды, нитриды, галогениды. Реакции протекают как при обычных условиях, так и при нагревании |
|
Вода |
|
|
Щелочные металлы реагируют с кислотами-окислителями HNO3(конц), H2SO4(конц) со взрывом. Pb пассивируется в разбавленных HCl, H2SO4. Напомним, что при взаимодействии металлов с кислотами-окислителями HNO3(конц) и H2SO4(конц) водород не выделяется, а образуются продукты восстановления азота и серы |
|
В водных растворах металлы s-элементов, обладая сильными восстановительными свойствами, вытесняют из воды водород, а не ионы менее активных металлов из солей. Остальные металлы реагируют в соответствии с положением в ряду активности |
| Растворы щелочей | В такие реакции вступают цинк, алюминий, бериллий |
Отметим, что с водой при нормальных условиях взаимодействуют все металлы s-элементов, кроме бериллия и магния. Магний реагирует с водой при нагревании. Алюминий взаимодействует с водой при комнатной температуре, но только после удаления с его поверхности плёнки оксида алюминия.
При этом образуются гидроксиды металлов. Остальные металлы от марганца до водорода в ряду активности взаимодействуют с парами воды при нагревании, образуя, как правило, оксиды металлов. Металлы, находящиеся в ряду напряжений после водорода, не взаимодействуют с водой ни при каких условиях.
Активные металлы (Na, K) вступают в реакции с карбоновыми кислотами, спиртами, фенолами.
Положение металла в ряду активности металлов позволяет прогнозировать его поведение в окислительно-восстановительных реакциях, протекающих в водных растворах.
Атомы металлов во всех химических превращениях являются восстановителями.
Металлы в химических превращениях являются восстановителями и легко отдают свои электроны, превращаясь в положительно заряженные ионы — катионы.
Активность металлов в окислительно-восстановительных реакциях, протекающих в водных растворах, определяется по их положению в ряду активности: чем левее в этом ряду расположен металл, тем большими восстановительными свойствами он обладает и тем труднее катионы этого металла восстанавливаются.
Более активные металлы восстанавливают менее активные металлы из растворов их солей. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из разбавленных кислот (кроме азотной). Металлы s-элементов, за исключением бериллия и магния, вытесняют водород из воды при обычной температуре.
- Назовите характерные для металлов физические свойства.
- Перечислите p-элементы, которые относятся к элементам-металлам.
- Расставьте коэффициенты в уравнении реакции методом электронного баланса: Cu + HNO3(разб) → Cu(NO3)2 + NO↑ + H2O.
- Составьте уравнения возможных химических реакций с учётом, что медь окисляется до степени окисления +2:
- а) Ag + НСl →; б) Сu + Hg(NО3)2 → ;
- в) Mg + H2SО4(pазб) →; г) Ni + NaCl → ;
- д) Zn + АgNО3 → ; е) Au + H2O → .
- Составьте уравнения реакций взаимодействия цинка с неметаллами (O2, P), кислотами (разбавленными HCl, H2SO4), с растворами щелочей (NaOH, KOH), с солями (AgNO3, Pb(NO3)2).
- Цинк массой 1,3 г растворили в концентрированном растворе гидроксида натрия. Рассчитайте объём выделившегося газа.
- Составьте уравнения реакций, которые могут протекать на поверхности активного металла, например лития, на воздухе.
- Укажите, как изменится масса цинковой пластинки (увеличится, уменьшится, не изменится) при погружении её на небольшое время в раствор: 1) серной кислоты; 2) гидроксида натрия; 3) сульфата магния; 4) сульфата меди(II); 5) нитрата серебра(I).
- Определите объём водорода, который выделится при взаимодействии 260 г цинка с раствором серной кислоты объёмом 250 см3. Массовая доля H2SO4 равна 15 %, плотность — 1,1 г/см3.
- Железную пластинку массой 90 г погрузили в раствор медного купороса. Через некоторое время её вынули, промыли, высушили и взвесили. Масса стала равна 92,4 г. Определите массу прореагировавшего железа и массу меди, осевшей на пластинке.
*Самоконтроль
1. В порядке увеличения восстановительной активности металлы расположены в ряду:
- а) Mg, Ca, Na;
- б) Cu, Ag, Hg;
- в) Cа, K, Cs;
- г) Zn, Al, Pb.
2. Реагируют с растворами щелочей:
- а) Zn;
- б) Ca;
- в) Al;
- г) Be.
3. Реагируя с парами воды, образуют оксиды:
- а) Li;
- б) Ag;
- в) Fe;
- г) Zn.
4. Масса цинковой пластинки увеличится при погружении её в раствор:
- а) Hg(NO3)2;
- б) Cu(NO3)2;
- в) AgNO3;
- г) HNO3.
5. На растворение 13 г цинка требуется раствор, содержащий гидроксид натрия массой (г):
- а) 40;
- б) 20;
- в) 16;
- г) 4.






