- Серная кислота — химические свойства и промышленное производство
- Промышленное производство серной кислоты (контактный способ):
- Химические свойства серной кислоты:
- Особые свойства концентрированной H 2 SO 4 :
- Взаимодействие металлов с кислотами
- Серная кислота (H2SO4): свойства, получение, применение
- Химические свойства H2SO4
- Получение и применение серной кислоты
- Соли серной кислоты
- Серная кислота. Решение заданий Тестовой части ЕГЭ 2022
- Взаимодействие серной кислоты с металлами и неметаллами » ГДЗ онлайн
- Общее описание
- Этапы производства
- Использование H2SO4 в разбавленном виде
- Свойства концентрированной кислоты
- Токсичность и сферы применения
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
- FeS2 + O2 → (t) Fe2O3 + SO2↑
- SO2 + O2 ⇄ (кат. — V2O5) SO3
- Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
- Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
- 2. NO + NO2 + 2H2SO4 = 2NO(HSO4) + H2O
- 3. NO(HSO4) + H2O = H2SO4 + HNO2
- NO2 + SO2 + H2O = H2SO4 + NO
- Кислотные свойства
- В водном растворе диссоциирует ступенчато.
- H2SO4 ⇄ H+ + HSO4-
- HSO4- ⇄ H+ + SO42-
- MgO + H2SO4 → MgSO4 + H2O
- KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
- 2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)
- Реакции с солями
- BaBr2 + H2SO4 → BaSO4↓ + 2HBr
- MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O
- Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
- Реакция с неметаллами
- Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
- S + H2SO4 → SO2 + H2O
- C + H2SO4 → CO2 + SO2 + H2O
- Реакции с металлами
- Fe + H2SO4(разб.) → FeSO4 + H2↑
- Zn + H2SO4(разб.) → ZnSO4 + H2↑
- Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
- Na + H2SO4(конц.) → Na2SO4 + H2S + H2O
- Zn + H2SO4(конц.) → ZnSO4 + S + H2O
- Cu + H2SO4(конц.) → CuSO4 + SO2 + H2O
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.

С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.

Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.

Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.
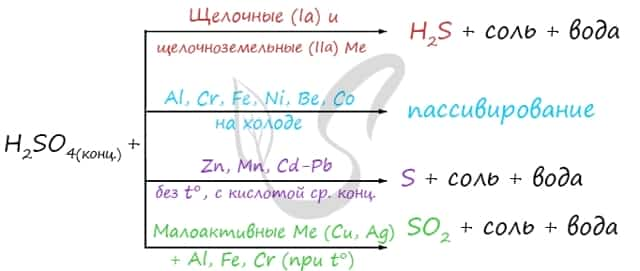

Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Fe + H2SO4(конц.) → (t) Fe2(SO4)3 + SO2 + H2O
Cr + H2SO4(конц.) → (t) Cr2(SO4)3 + SO2 + H2O

Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
Серная кислота — химические свойства и промышленное производство
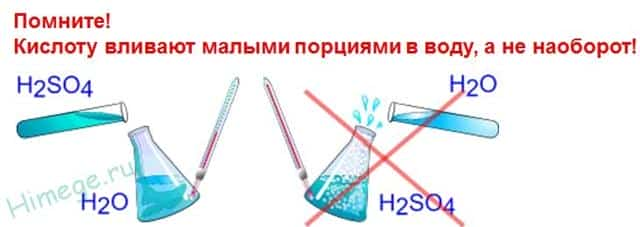
Физические свойства серной кислоты: Тяжелая маслянистая жидкость («купоросное масло»); плотность 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Теплота гидратации настолько велика, что смесь может вскипать, разбрызгиваться и вызывать ожоги. Поэтому необходимо добавлять кислоту к воде, а не наоборот, поскольку при добавлении воды к кислоте более легкая вода окажется на поверхности кислоты, где и сосредоточится вся выделяющаяся теплота.
Промышленное производство серной кислоты (контактный способ):
-
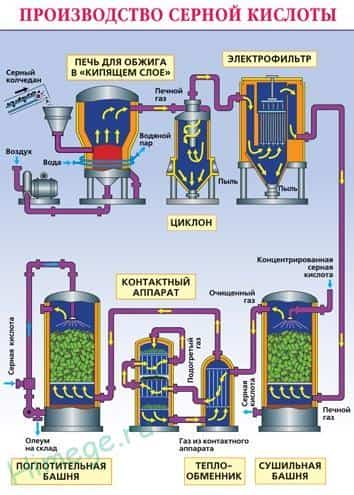 1) 4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2
1) 4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2 - 2) 2SO 2 + O 2 V 2 O 5 → 2SO 3
- 3) nSO 3 + H 2 SO 4 → H 2 SO 4 ·nSO 3 (олеум)
Измельчённый очищенный влажный пирит (серный колчедан) сверху засыпают в печь для обжига в « кипящем слое «. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом. Из печи выходит печной газ, состав которого: SO 2 , O 2 , пары воды (пирит был влажный) и мельчайшие частицы огарка (оксида железа). Газ очищают от примесей твёрдых частиц (в циклоне и электрофильтре) и паров воды (в сушильной башне). В контактном аппарате происходит окисление сернистого газа с использованием катализатора V 2 O 5 ( пятиокись ванадия) для увеличения скорости реакции. Процесс окисления одного оксида в другой является обратимым. Поэтому подбирают оптимальные условия протекания прямой реакции — повышенное давление (т.к прямая реакция идет с уменьшением общего объема) и температура не выше 500 С ( т.к реакция экзотермическая).
В поглотительной башне происходит поглощение оксида серы (VI) концентрированной серной кислотой. Поглощение водой не используют, т.
к оксид серы растворяется в воде с выделением большого количества теплоты, поэтому образующаяся серная кислота закипает и превращается в пар.
Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H 2 SO 4 ·nSO 3
Химические свойства серной кислоты:
- H 2 SO 4 — сильная двухосновная кислота, одна из самых сильных минеральных кислот, из-за высокой полярности связь Н – О легко разрывается.
- 1) В водном растворе серная кислота диссоциирует , образуя ион водорода и кислотный остаток: H 2 SO 4 = H + + HSO 4 — ; HSO 4 — = H + + SO 4 2- . Суммарное уравнение:
- H 2 SO 4 = 2H + + SO 4 2- .
- 2) Взаимодействие серной кислоты с металлами : Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
- Zn 0 + H 2 +1 SO 4 (разб) → Zn +2 SO 4 + H 2
- 3) Взаимодействие серной кислоты с основными оксидами: CuO + H 2 SO 4 → CuSO 4 + H 2 O
- 4) Взаимодействие серной кислоты с гидроксидами: H 2 SO 4 + 2NaOH → Na 2 SO 4 + 2H 2 O H 2 SO 4 + Cu(OH) 2 → CuSO 4 + 2H 2 O
- 5) Обменные реакции с солями: BaCl 2 + H 2 SO 4 → BaSO 4 ↓ + 2HCl Образование белого осадка BaSO 4 (нерастворимого в кислотах) используется для обнаружения серной кислоты и растворимых сульфатов (качественная реакция на сульфат ион).
Особые свойства концентрированной H 2 SO 4 :
1) Концентрированная серная кислота является сильным окислителем ; при взаимодействии с металлами (кроме Au, Pt) восстанавливаться до S +4 O 2 , S 0 или H 2 S -2 в зависимости от активности металла. Без нагревания не реагирует с Fe, Al, Cr – пассивация.
При взаимодействии с металлами, обладающими переменной валентностью, последние окисляются до более высоких степеней окисления , чем в случае с разбавленным раствором кислоты: Fe 0 → Fe 3+ , Cr 0 → Cr 3+ , Mn 0 → Mn 4+ , Sn 0 → Sn 4+
-
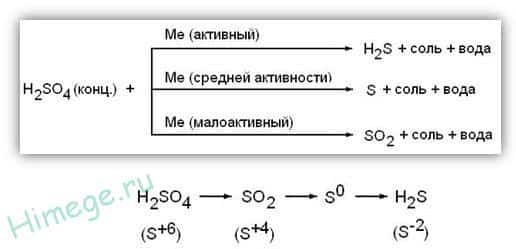
- Активный металл
- 8 Al + 15 H 2 SO 4(конц.) →4Al 2 (SO 4 ) 3 + 12H 2 O + 3 H 2 S 4│2Al 0 – 6 e — → 2Al 3+ — окисление 3│ S 6+ + 8e → S 2– восстановление
- 4Mg+ 5H 2 SO 4 → 4MgSO 4 + H 2 S + 4H 2 O
- Металл средней активности
- 2Cr + 4 H 2 SO 4(конц.) → Cr 2 (SO 4 ) 3 + 4 H 2 O + S 1│ 2Cr 0 – 6e →2Cr 3+ — окисление 1│ S 6+ + 6e → S 0 – восстановление
- Металл малоактивный
- 2Bi + 6H 2 SO 4( конц .) → Bi 2 (SO 4 ) 3 + 6H 2 O + 3 SO 2 1│ 2Bi 0 – 6e → 2Bi 3+ – окисление 3│ S 6+ + 2e →S 4+ — восстановление
- 2Ag + 2H 2 SO 4 →Ag 2 SO 4 + SO 2 + 2H 2 O
- 2) Концентрированная серная кислота окисляет некоторые неметаллы как правило до максимальной степени окисления, сама восстанавливается до S +4 O 2 :
- С + 2H 2 SO 4 (конц) → CO 2 + 2SO 2 + 2H 2 O
- S+ 2H 2 SO 4 (конц) → 3SO 2 + 2H 2 O
- 2P+ 5H 2 SO 4 (конц)→5SO 2 + 2H 3 PO 4 + 2H 2 O
- 3) Окисление сложных веществ: Серная кислота окисляет HI и НВг до свободных галогенов:
- 2 КВr + 2Н 2 SO 4 = К 2 SО 4 + SO 2 + Вr 2 + 2Н 2 О
2 КI + 2Н 2 SО 4 = К 2 SO 4 + SO 2 + I 2 + 2Н 2 О Концентрированная серная кислота не может окислить хлорид-ионы до свободного хлора, что дает возможность получать НСl по реакции обмена:
NаСl + Н 2 SO 4 (конц.) = NаНSO 4 + НСl
Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы. Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этилена: С 2 Н 5 ОН = С 2 Н 4 + Н 2 О.
Обугливание сахара, целлюлозы, крахмала и др. углеводов при контакте с серной кислотой объясняется также их обезвоживанием: C 6 H 12 O 6 + 12H 2 SO 4 = 18H 2 O + 12SO 2 ↑ + 6CO 2 ↑.

Взаимодействие металлов с кислотами
С разбавленными кислотами, которые проявляют
окислительные свойства за счет ионов водорода (разбавленные серная,
фосфорная, сернистая, все бескислородные и органические кислоты и др.)
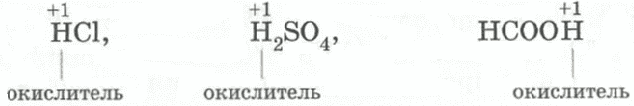
реагируют металлы:
• расположенные в ряду напряжений до водорода (эти металлы способны
вытеснять водород из кислоты);
• образующие с этими кислотами растворимые соли (на поверхности этих металлов
не образуется защитная солевая пленка).
В результате реакции образуются растворимые соли и выделяется водород:
2А1 + 6НСI = 2А1С13 + ЗН2↑
Мg
+ Н2SO4 =
МgSu
+ Н2 SO4 →X(так
как Сu
стоит после Н2) разб.
РЬ + Н2
SO4 →X(так
как РЬSO4
нерастворим
в воде) разб.
Некоторые кислоты являются окислителями за счет элемента, образующего кислотный
остаток, К ним относятся концентрированная серная, а также азотная кислота
любой концентрации. Такие кислоты называют кислотами-окислителями.
Анионы
данных кислот содержат атомы серы и азота в высших степенях окисления

Окислительные свойства кислотных остатков и
значительно сильнее, чем нона водорода Н, поэтому азотная и концентрированная
серная кислоты взаимодействуют практически со всеми металлами, расположенными в
ряду напряжений как до водорода, так и после него, кроме золота и платины.
Так как окислителями в этих случаях являются ноны кислотных остатков (за
счет атомов серы и азота в высших степенях окисления), а не ноны водорода Н, то
при взаимодействии азотной, а концентрированной серной кислот с металлами
не выделяется водород.
Металл под действием данных кислот окисляется до характерной
(устойчивой) степени окисления и образует соль, а продукт восстановления
кислоты зависит от активности металла и степени разбавления кислоты

Взаимодействие серной кислоты с металлами
Разбавленная и концентрированная серные кислоты ведут
себя по-разному. Разбавленная серная кислота ведет себя, как обычная
кислота. Активные металлы, стоящие в
ряду напряжений левее водорода
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu,
Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты. Мы
видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с
цинком.
-
H2SO4
+ Zn = Zn SO4 + H2 ↑ -
Медь стоит в ряду напряжений после водорода – поэтому
разбавленная серная кислота не действует на медь. А в концентрированной серной
кислоты, цинк и медь, ведут себя таким образом… -
Цинк, как активный металл, может образовывать с
концентрированной серной кислотой сернистый газ, элементарную серу, и даже
сероводород. -
2H2SO4 + Zn = SO2↑
+ZnSO4 + 2H2O
Медь — менее активный металл. При взаимодействии с
концентрированно серной кислотой восстанавливает ее до сернистого газа.
-
2H2SO4
конц. + Cu = SO2↑ + CuSO4 + 2H2O -
В пробирках с концентрированной серной кислотой
выделяется сернистый газа. -
Следует иметь в виду, что на схемах указаны продукты,
содержание которых максимально среди возможных продуктов восстановления кислот.
На основании
приведенных схем составим уравнения конкретных реакций — взаимодействия меди и
магния с концентрированной серной кислотой: 0 +6
+2 +4
С
u
+ 2Н2SO4
= СuSO4
+ SO2
+ 2Н2Og
+ 5Н2SO4
= 4МgSO4
+ Н2S
+ 4Н2O
Некоторые металлы (Fe.
АI, Сr)
не взаимодействуют с концентрированной серной и азотной кислотами при обычной
температуре,
так как происходит пассивации металла.
Это явление связано с образованием на поверхности металла тонкой, но очень
плотной оксидной пленки, которая и защищает металл. По этой причине азотную и концентрированную
серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, являющимися
окислителями за счет ионов Н+, он образует соли, в которых его
степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых
его степень окисления более устойчива: 0 +2 Fе+Н2SO4=
FеSO4+Н2
0 разб. +3
Fе+Н2SO4=
Fе2(SO4)3 + 3SO2 + 6Н2O
И.И.Новошинский
Н.С.Новошинская Химия
не забудь….) поделиться с друзьями
Серная кислота (H2SO4): свойства, получение, применение
Молекула серной кислоты имеет крестовидную форму:
Физические свойства серной кислоты:
- плотная маслянистая жидкость без цвета и запаха;
- плотность 1,83 г/см3;
- температура плавления 10,3°C;
- температура кипения 296,2°C;
- очень гигроскопична, смешивается с водой в любых отношениях;
- при растворении концентрированной серной кислоты в воде происходит выделение большого кол-ва тепла (ВАЖНО! Приливают кислоту в воду! Воду в кислоту приливать нельзя!!!)
Серная кислота бывает двух видов:
- разбавленная H2SO4(разб) — водный раствор кислоты, в котором процентное содержание H2SO4 не превышает 70%;
- концентрированная H2SO4(конц) — водный раствор кислоты, в котором процентное содержание H2SO4 превышает 70%;
Химические свойства H2SO4
Серная кислота полностью диссоциирует в водных растворах в две ступени:
H2SO4 ↔ H++HSO4- HSO4- ↔ H++SO4-
Разбавленная серная кислота проявляет все характерные свойства сильных кислот, вступая в реакции:
- с основными оксидами: MgO+H2SO4 = MgSO4+H2O
- с основаниями: H2SO4+2NaOH = Na2SO4+2H2O
- с солями: H2SO4+BaCl2 = BaSO4↓+2HCl качественная реакция на сульфат-ион: SO42-+Ba2+ = BaSO4↓
В окислительно-восстановительных реакциях серная кислота выступает в роли окислителя, при этом, в разбавленной H2SO4 роль окислителей играют катионы водорода (H+), а в концентрированной — сульфат-ионы (SO42-) (более сильные окислители, чем катионы водорода).
- разбавленная серная кислота: H2+1S+6O4-2 окислитель H+: 2H++2e- → H20↑
- концентрированная серная кислота: H2+1S+6O4-2 окислитель S+6:
- S+6+2e- → S+4 (SO2)
- S+6+6e- → S0 (S)
- S+6+8e- → S-2 (H2S)
Разбавленная серная кислота реагирует с металлами, стоящими в электрохимическом ряду напряжений левее водорода (реакция проходит с образованием сульфатов и выделением водорода):
H2SO4(разб)+Fe = FeSO4+H2↑

С металлами, стоящими правее водорода (медь, серебро, ртуть, золото), разбавленная серная кислота не реагирует.
Концентрированная серная кислота является более сильным окислителем, особенно это проявляется при нагревании.
Концентрированная серная кислота не реагирует только с золотом, с остальными металлами, стоящими правее водорода, кислота взаимодействует с образованием сульфатов и сернистого газа.
Более активными металлами (цинк, алюминий, магний) концентрированная серная кислота восстанавливается до свободной серы или сероводорода.
С остальными металлами серная кислота взаимодействует с образованием сернистого газа, серы или сероводорода (конкретный продукт восстановления серной кислоты зависит от ее концентрации):
2H2SO4(конц)+Cu = CuSO4+SO2↑+2H2O 5H2SO4(конц)+4Mg = 4MgSO4+H2S↑+4H2O 4H2SO4(конц)+3Zn = 3ZnSO4+S↓+4H2O
Концентрированная серная кислота окисляет некоторые неметаллы, восстанавливаясь до сернистого газа:
2H2S+6O4(конц)+S0 = 3SO2↑+2H2O 2H2S+6O4(конц)+C = C+4O2↑+2S+4O2↑+2H2O
При низких температурах концентрированная серная кислота пассивирует некоторые металлы (железо, алюминий, никель, хром, титан), что дает возможность ее промышленной перевозки в железных цистернах.
Подробнее см. Уравнения окислительно-восстановительных реакций серной кислоты…
Получение и применение серной кислоты
Серную кислоту в промышленности получают двумя способами: контактным и нитрозным.
Контактный способ получения H2SO4:
- На первом этапе получают сернистый газ путем обжига серного колчедана: 4FeS2+11O2 = 2Fe2O3+8SO2↑
- На втором этапе, сернистый газ окисляют кислородом воздуха до серного ангидрида, реакция идет в присутствии оксида ванадия, играющего роль катализатора: 2SO2+O2 = 2SO3
- На третьем, последнем этапе, получают олеум, для этого серный ангидрид растворяют в концентрированной серной кислоте: H2SO4+nSO3 ↔ H2SO4·nSO3
- В дальнейшем олеум транспортируется в железных цистернах, а серная кислота получается из олеума разбавлением водой: H2SO4·nSO3+H2O → H2SO4
Нитрозный способ получения H2SO4:
- На первом этапе очищенный от пыли сернистый газ обрабатывается серной кислотой, в которой растворена нитроза (оксид азота): SO2+H2O+N2O3 = H2SO4+2NO↑
- Выделившийся оксид азота окисляется кислородом и снова поглощается серной кислотой: 2NO+O2 = 2NO2 NO2+NO = N2O3
Применение серной кислоты:
- для осушки газов;
- в производстве других кислот, солей, щелочей и проч.;
- для получения удобрений, красителей, моющих средств;
- в органическом синтезе;
- в производстве органических веществ.
Соли серной кислоты
Поскольку серная кислота является двухосновной кислотой, она дает два вида солей: средние соли (сульфаты) и кислые соли (гидросульфаты).
Сульфаты хорошо растворяются в воде, исключение составляют CaSO4, PbSO4, BaSO4 — первые два плохо растворяются, а сульфат бария практически нерастворим. Сульфаты, в состав которых входит вода, называются купоросами (медный купорос — CuSO4·5H2O).
Отличительной особенностью солей серной кислоты является их отношение к нагреванию, например, сульфаты натрия, калия, бария устойчивы к нагреванию, не разлагаясь даже при 1000°C, в то же время, сульфаты меди, алюминия, железа разлагаются даже при незначительном нагревании с образованием оксида металла и серного ангидрида: CuSO4 = CuO+SO3.
Горькая (MgSO4·7H2O) и глауберова (Na2SO4·10H2O) соль используются в качестве слабительного средства. Сульфат кальция (CaSO4·2H2O) — при изготовлении гипсовых повязок.
Серная кислота. Решение заданий Тестовой части ЕГЭ 2022
Задания по подготовке к ЕГЭ по химии 15 марта 2022 г., 9:47 
Все задания этого урока относятся к ЕГЭ по Химии 2022 года Тестовой части с использованием химических свойств серной кислоты.
Задание 1:В одну из пробирок с раствором вещества X добавили раствор вещества A и наблюдали образование белого осадка.
В другую пробирку, также содержащую раствор вещества X, добавили вещество Y и наблюдали выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) хлорид натрия; 2) нитрат бария; 3) соляная кислота; 4) карбонат кальция;
5) серная кислота.
Решение: В данном задании есть две реакции: в одной образовался осадок белого цвета, в другой – выделился газ. Единственное, что объединяет эти две реакции – вещество Х.
Для начала, вспомним несколько важных аспектов: 1) в ионно-обменных реакциях выделение газа происходит при взаимодействии солей слабых кислот с более сильными кислотами(например, соли угольной и сернистой кислот) 2) осадков белого цвета не так много, и одним из часто встречающихся в ЕГЭ является сульфат бария(соединения бария являются качественными на сульфат-анион) 3) все соли калия и натрия являются РАСТВОРИМЫМИ. Исходя из условия, ищем кислоту(так как выделился газ), это либо соляная, либо серная. Если возьмем соляную кислоту, то она дает белые осадки с солями серебра и свинца, а среди ответов таких солей нет. Поэтому берем серную кислоту (вещество Х). Она в реакции с нитратом бария(вещество А) дает белый осадок сульфат бария. Вторая реакция проходит с выделением газа, очевидно, что из вариантов подходит карбонат кальция(вещество Y): образуется угольная кислота, которая распадается на углекислый газ и воду. Ответ: 54
- Задание 2:
- Fe2O3 ( + Al) → X ( + H2SO4(конц.)) → Y
- 5) феррит железа.
Задана следующая схема превращений: Определите, какие из указанных веществ являются веществами X и Y. 1) сульфат железа(III) 2) сульфат железа(II) 3) железо 4) сульфид железа(III)
Решение: Первая реакция – это взаимодействие оксида железа(III) с алюминием, известный способ получения металлов из их оксидов с помощью алюминия при высокой t (алюминотермия). В результате образуется чистый металл железо. Вторая реакция проходит между железом и концентрированной серной кислотой с образованием сульфата железа(III), сернистого газа и воды. Ответ: 31
Задание 3: Установите соответствие между изменением степени окисления серы в реакции и формулами веществ, при взаимодействии которых происходит такое изменение: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) S +4 → S +6
Б) S -2 → S 0 В) S +6 → S +4
1) Cu и H2SO4(разб.) 2) H2S и O2 3) S и H2SO4(конц.) 4) SO2 и O2
Решение: 1) медь + разбавленная серная кислота; эта реакция НЕ идет, так как медь стоит в ряду активности ПОСЛЕ водорода и не вытесняет его.
2) сероводород + кислород; это процесс окисления, в результате которого образуются сера(S) и вода, степень окисления серы увеличивается S -2 → S 0.
3) сера + серная кислота; в этом взаимодействии образуются сернистый газ(SO2) и вода, степень окисления серы уменьшается S +6 → S +4. 4) сернистый газ + кислород; это окислительный процесс, в результате которого образуется высший оксид серы(серный ангидрид), степень окисления серы увеличивается S +4 → S +6. Ответ: 423
Задание 4: Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Реагирующие вещества:
А) Zn и H2SO4(разб.)
Б) ZnO и H2SO4(разб.) В) Zn и H2SO4(конц.) Г) ZnS и O2
Продукты реакции: 1) ZnSO4 и H2O 2) ZnO и SO2 3) ZnSO4, H2S и H2O 4) ZnO и SO3 5) ZnSO4 и H2 6) ZnS, SO2 и H2O
Решение: Данное задание является относительно легким: цинк реагирует как с разбавленной, так и с концентрированной серной кислотой. В реакции с H2SO4(конц.
) он помимо сульфата цинка, выдает газ с неприятным запахом – сероводород. Процесс взаимодействия с H2SO4(разб.) это реакция замещения с выделением водорода.
Оксид цинка и серная кислота представляют ионно-обменную реакцию с образованием соли и воды. Сульфид цинка окисляется до оксида цинка и воды.
- Ответ: 5132
- Задание 5: Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Реагирующие вещества:
- А) Cl2 и NaOH(хол. р-р)
Б) C и H2SO4(конц.) В) C и FeO
- Г) Cu и H2SO4(конц.)
- Продукты реакции: 1) CuSO4, SO2 и H2O 2) NaCl, NaClO и H2O 3) FeO и CO
- 4) CuSO4 и H2
5) CO2, H2O и SO2 6) NaCl, NaClO3 и H2O
Решение: 1) Cl2 и NaOH(хол. р-р): здесь не просто так дан именно холодный раствор, потому что при взаимодействии с горячим раствором NaOH будут другие продукты реакции(NaCl, NaClO3 и H2O). В данном процессе образуются NaCl, NaClO и H2O. 2) C и H2SO4(конц.
): углерод реагирует только с концентрированной серной кислотой с образованием углекислого газа(а не кислоты, как с другими неметаллами), сернистого газа и воды(CO2, H2O и SO2). 3) C и FeO:в данной реакции восстановления образуются два оксида — FeO и CO.
4) Cu и H2SO4(конц.): медь реагирует с концентрированной серной кислотой с образованием сульфата меди(II), сернистого газа и воды(CuSO4, SO2 и H2O).
Ответ: 2531
Задание 6: Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Реагирующие вещества:
А) H2SO4(конц.) и C
Б) H2SO4(конц.) и S В) H2SO4(конц.) и Cu Г) H2SO4(конц.) и Ag
Продукты реакции: 1) CO2, H2O и SO2 2) Ag2SO4, SO2 и H2O 3) SO2 и H2O 4) CuSO4 и H2 5) CuSO4, SO2 и H2O 6) Ag2SO4 и H2
Решение: Для начала вспомним: в реакциях концентрированной серной кислоты с неметаллами образуются кислоты этих неметаллов, кроме серы и углерода(они образуют оксиды).
1) H2SO4(конц.) и C: образуются CO2, H2O и SO2 2) H2SO4(конц.) и S: образуются SO2 и H2O
В реакциях серной кислоты(конц.) с металлами, стоящими в ряду активности ПОСЛЕ водорода образуются соли, сернистый газ и вода(с разбавленной H2SO4 не реагируют). 3) H2SO4(конц.) и Cu: образуются CuSO4, SO2 и H2O 4) H2SO4(конц.) и Ag: образуются Ag2SO4, SO2 и H2O Ответ: 1352
- Задание 7: Задана следующая схема превращений:
- H2SO3 (X)→ H2SO4 (Y)→ NaHSO4
- 1) Br2
Определите, какие из указанных веществ являются веществами X и Y. 2) H2O 3) NaNO3 4) NaOH
- 5) SO2
- Решение: На первый взгляд, это задание кажется простым, однако, реакция образования серной кислоты из сернистой может вызвать сложности. Дело в том, что сернистую кислоту мы должны расписать на составные оксиды и тогда процесс пойдет:
- SO2 + Br2 + 2H2O → H2SO4(k.) + 2HBr
- Ответ: 14
- Задание 8: Установите соответствие между схемой реакции и формулой недостающего в ней вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Схема реакции:
- А) FeS + O2 → Fe2O3 + …
Поэтому, первое вещество это бром. Во второй реакции все легко: серная кислота вступает в реакцию нейтрализации с гидроксидом натрия с образованием кислой соли гидросульфата натрия(недостаток щелочи). Б) H2SO4 + S → … + H2O В) H2SO4(разб.) + Al → Al2(SO4)3 + … Формула вещества:
1) H2S
2) SO2 3) S
4) H2
5) SO3
Решение: 1) FeS + O2 → Fe2O3 + …: эта реакция окислительно-восстановительная, железо здесь окисляется с +2 до +3, а кислород по очевидным причинам меняет степень окисления с 0 до -2; значит, сера степень не изменит и останется при +4. Получается, единственное соединение серы с такой степенью окисления – это SO2.
2) H2SO4 + S → … + H2O: данный процесс также ОВР, у серы до стрелки было +6 и 0, то есть эта реакция диспропорционирования(один и тот же элемент и окислитель, и восстановитель); нам нужно такое соединение серы, которое имеет степень окисления между выше указанными, это опять таки SO2. 3) H2SO4(разб.
) + Al → Al2(SO4)3 + …: тут все проще всего – разбавленная серная кислота ведет себя так же, как все кислоты, металл замещает водород и вытесняет его, ответ H2. Ответ: 224
- Задание 9: Задана следующая схема превращений:
- Cu (H2SO4) → X (KOH) → A(t) → Y
- 3) CuSO4
Определите, какие из указанных веществ являются веществами X и Y. 1) CuO 2) CuS 4) K2[Cu(OH)4] 5) CuSO3
- Решение: Схема превращений в этом задании не сложная: — медь с серной кислотой(конц.) образует сульфат меди(II) – ответ 3;
- — сульфат меди(II) в ионно-обменной реакции с гидроксидом калия дает нерастворимое основание Cu(OH)2;
- Ответ: 31
- Задание 10: Задана следующая схема превращений:
- Mg + X → Y + H2S + H2O
- 1) H2SO4(разб.)
— гидроксид меди(II), как и все нерастворимые основания при нагревании разлагается на соответствующий оксид(CuO) и воду, ответ 1. Определите, какие из указанных веществ являются веществами X и Y. 2) H2SO3 3) MgSO4 4) MgSO3 5) H2SO4(конц.)
Решение: Магний относится к тем активным металлам, которые при взаимодействии с концентрированной серной кислотой образуют S, SO2, H2S. В данном задании нужно расписать только одну химическую реакцию, причем, нам уже практически все известно: магний реагирует с конц. H2SO4 с образованием сульфата магния, сероводорода и воды. Ответ: 53
Задание 11: Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Реагирующие вещества:
А) Cu2O и H2SO4(конц.)
Б) CuS и HNO3 (конц.) В) CuO и H2SO4(конц.) Г) CuCl и H2SO4(конц.)
Продукты реакции: 1) CuSO4 и H2O 2) CuSO4, SO2, HCl и H2O 3) Cu(NO3)2 и H2S 4) Cu2SO4 и H2O 5) CuSO4, NO2 и H2O 6) CuSO4, SO2 и H2O
Решение: А) Cu2O и H2SO4(конц.): в результате этой реакции ОВР происходит окисление меди до сульфата меди(II), сернистого газа и воды(CuSO4, SO2 и H2O), пункт 6; Б) CuS и HNO3 (конц.
): так как азотная кислота концентрированная, то в этом процессе образуются не нитрат меди(II), а сульфат меди(II), а также диоксид азота и вода(CuSO4, NO2 и H2O), пункт 5; В) CuO и H2SO4(конц.): оксид меди(II) и серная кислота образуют сульфат меди с аналогичной валентностью и воду(CuSO4 и H2O), пункт 1; Г) CuCl и H2SO4(конц.
): эта реакция относится к окислительно-восстановительным, в результате происходит окисление хлорида меди(I) с образованием сульфата меди(II), сернистого газа, хлороводорода и воды, пункт 2. Ответ: 6512
Задание 12: Установите соответствие между реагирующими веществами и формулой газа, выделяющегося при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Реагирующие вещества: А) Zn и HCl
Б) Cu и H2SO4(конц.)
В) Mg и H2SO4(разб.) Г) Ag и HNO3(конц.)
Формула газа: 1) H2 2) NO
3) NO2
4) SO2 5) Cl2
Решение: А) Zn и HCl: это простая реакция замещения, которая, кстати, является одним из лабораторных способов получения чистого водорода, в результате он и выделяется, пункт 1;
Б) Cu и H2SO4(конц.): медь окисляется до сульфата меди(II) с образованием сернистого газа, пункт 4;
В) Mg и H2SO4(разб.): магний с серной кислотой выделяет чистый водород в процессе реакции замещения, пункт 1; Г) Ag и HNO3(конц.): серебро реагирует с концентрированной азотной кислотой с образованием нитрата серебра, диоксида азота и воды, пункт 3. Ответ: 1413
Задание 13: Из предложенного перечня выберите все внешние воздействия, которые не оказывают влияния на скорость реакции железа с серной кислотой. 1) измельчение железа 2) добавление сульфата железа(II) 3) понижение температуры 4) увеличение концентрации водорода
5) повышение давления
Решение: Для начала вспомним, какие факторы могут воздействовать на скорость химической реакции: — сами реагирующие вещества; — частота столкновения молекул(степень измельчения веществ, давление для газов и т.д); — температура; — катализаторы и ингибиторы(ускоряют и замедляют химическую реакцию соответственно). Теперь нам нужно понять сам химический процесс, для этого запишем его:
H2SO4(p.) + Fe = FeSO4 + H2↑
В данном вопросе нам необходимо выбрать те факторы, которые НЕ влияют на скорость химической реакции. 1) измельчение железа – это действие приведет к ускорению скорости, нам не подходит; 2) добавление сульфата железа(II) – этот фактор не приведет к изменению скорости реакции, так как добавление продуктов реакции только увеличат концентрацию этих веществ; 3) понижение температуры приведет к снижению скорости реакции, нам не подходит; 4) увеличение концентрации водорода – увеличение продукта реакции к изменению скорости не ведет, этот вариант подходит; 5) повышение давления – не приведет к изменению скорости химической реакции, так как исходные вещества в данном процессе не газы, подходит.
Ответ: 245
Задание 14: Установите соответствие между названием вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Название вещества: А) сера Б) серная кислота(конц.) В) серная кислота(разб.)
- Г) сульфид аммония
- Реагенты: 1) CaCl2, C, Pt 2) NaOH, HCl, H2O 3) Ag, KCl, S
- 4) H2SO4(конц.), LiOH, P
5) Pb, CuS, SiO2 6) Fe(н.у.), ZnS, CaCO3
Решение: А) сера – это неметалл, который реагирует с кислотами(серной(конц.), азотной), неметаллами, металлами, с щелочами, некоторыми солями, среди пунктов ответа нам подходит вариант 4; Б) серная кислота(конц.) – является одной из сильнейших в химическом плане кислот, реагирует со многими веществами(даже с другими кислотами), для нее здесь подходит вариант ответа 3. Почему именно 3?
- 1) с данным списком не подходит платина, она ни при каких условиях с H2SO4 не реагирует;
- Г) сульфид аммония((NH4)2S) – эта соль слабого основания и слабой кислоты, она подвергается гидролизу(реагирует с водой), вступает во взаимодействие с щелочами(с образованием аммиака и воды), а также реагирует с кислотами, подходит пункт 2.
- Задание 15: В пробирку, содержащую раствор соединения бария(вещество X), добавили вещество Y. В результате произошла реакция, которую описывает следующее сокращенное ионное уравнение:
- Ba2+ + SO42- → BaSO4
- Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию. 1) серная кислота 2) оксид серы(VI) 3) гидроксид бария 4) бромид бария
- 5) сульфит бария
2) здесь не подходит вода; 4) серная кислота сама с собой не реагирует; 5) здесь не подходит оксид кремния, он стоек к воздействию кислот, не считая плавиковой(HF); 6) в данном списке веществ не подходит железо, дано условие – н.у., стандартные условия, а при нормальной температуре серная кислота пассивирует железо и реакция не пойдет. В) серная кислота(разб.) – тут не подходят все пункты, кроме 6: — с железом при нормальных условиях происходит реакция замещения, — с сульфидом цинка и карбонатом кальция проходят обычные реакции обмена; Ответ: 4362
Решение: Для понимания этого задания нужно разбираться в ионно-обменных реакциях, и уметь составлять молекулярные, полные и сокращенные ионные уравнения. Здесь представлен катион бария, который при взаимодействии с анионом сульфата образует осадок белого цвета – сульфат бария.
Теперь нужно найти два соединения, которые содержат данные ионы и соответствуют вышеуказанному ионному уравнению.
1) серная кислота – пока подходит, она содержит анион сульфат; 2) оксид серы – тут не подходит никак, оксиды не распадаются на ионы; 3) гидроксид бария – он содержит ион бария, однако, в сокращенном ионном уравнении после стрелки должна быть вода, а в нашем задании ее нет, поэтому, не подходит; 4) бромид бария – подходит, так как выделится сульфат бария и бромоводород;
5) сульфит бария – не подходит, при взаимодействии с серной кислотой выделится сульфат бария и сернистая кислота, которая является слабой и распадется на сернистый газ и воду, и мы должны будем вписать их в сокращенное ионное уравнение, а у нас есть только BaSO4, не подходит.
Ответ: 41.
На этом все!
pangenes.ru © 2022

Взаимодействие серной кислоты с металлами и неметаллами » ГДЗ онлайн
Серная кислота относится к категории тяжёлых маслянистых жидкостей, так как её плотность составляет 1.84 г/см3.
Она хорошо растворяется в воде, гигроскопична, а также характеризуется водоотнимающими свойствами (способна обуглить сахар, бумагу и даже дерево). Эта двухосновная жидкость отличается высокой теплотой гидратации.
Перед использованием химического вещества нужно изучить взаимодействие серной кислоты с металлами и неметаллами.
Общее описание
Серная кислота является токсичным реагентом, который отличается специфичностью применения и высоким показателем опасности для живого организма. Эта жидкость характеризуется как сильный окислитель. Температура плавления H2SO4 составляет +10 °C. Закипает кислота при +296 °C.
В результате выделяется вода и оксид серы SO3. Так как эта жидкость способна поглощать пары воды, её часто используют для осушения газов.
Добывают серу промышленным путём, используя для этого диоксид серы SO2, который можно получить только в результате горения серы либо серного колчедана.
Под воздействием низких температур H2SO4 пассивирует некоторые металлы, например алюминий, железо, хром, никель, титан. Благодаря этому транспортировать кислоту можно в герметичных железных цистернах.
Добыть H2SO4 можно двумя способами:
- Нитрозным (концентрация 75%). Происходит окисление диоксида серы с помощью диоксида азота при взаимодействии воды. Формула выглядит так: SO2 + NO2 + H2O → H2SO4 + NO.
- Контактным (концентрация находится в пределах 94%). В промышленных условиях происходит окисление диоксида серы до трехокиси серы с последующим гидролизом. Пример формулы: 2SO2 + O2 → 2SO3; SO3 + H2O → H2SO4.
Присутствующий в кислоте раствор SO3 называется олеумом, который также используют для получения H2SO4. Реакция на металлы и неметаллы всегда отличается. При использовании двухосновной маслянистой жидкости образуется 2 вида солей: средние — сульфаты (барий, кальций), кислые — гидросульфаты (натрий, калий).
Этапы производства
Изготовление кислоты является довольно интересным и познавательным процессом. Изначально серный колчедан (измельчённый влажный пирит) засыпают в специальную печь для обжига. В нижней части оборудования пускают воздух, который специально обогащают кислородом. Постепенно из печи начинает выходить газ, в состав которого входят: SO2, O2, микроскопические частицы огарка (оксида железа) и пары воды (использовался влажный пирит). С помощью электрофильтра и циклона газ очищают от примесей твёрдых частиц. Сушильная башня удаляет все пары воды.
Окисление полученного серного газа происходит благодаря катализатору V2O5 в контактном аппарате. Такой подход позволяет ускорить химическую реакцию.
Процесс окисления одного оксида в другой на практике является обратным. Специалисты стараются создать оптимальные условия, чтобы добиться протекания прямой реакции — повышенное давление и температура от +500 °C.
Всё это позволяет получить необходимую экзотермическую реакцию.
В специальной башне поглощается оксид серы концентрированной кислоты. Приём с водой не используют, так как оксид серы легко растворяется с выделением большого количества теплоты, из-за чего жидкость закипает и превращается в пар. Избежать сернокислотного тумана помогает H2SO4 в концентрации 98%. Оксид серы хорошо растворяется и образует олеум: H2SO4*nSO3.
Использование H2SO4 в разбавленном виде
Серная кислота имеет одну особенность — она может отнимать воду, из-за чего её часто используют как надёжное гигроскопическое средство во многих химических реакциях.
С помощью этой жидкости можно получать органические вещества, провести осушку, а также снизить вероятность поглощения воды конкретными элементами.
Для решения всех этих задач в лабораторных условиях используются специальные герметические ёмкости, которые называются эксикаторами.
Востребованность H2SO4 никогда не уменьшается, так как она имеет широкую сферу применения. Концентрированная жидкость может обугливать органические вещества (например, древесину), а также вызывать сильные ожоги кожного покрова.
Если для проведения химических экспериментов нужно использовать кислоту, тогда должны быть соблюдены все правила безопасности.
Если капля разбавленной жидкости H2SO4 попала на кожу либо одежду, то по мере испарения воды она постепенно будет увеличивать свою концентрацию.
Разбавленная кислота может вступать в реакцию замещения, что спровоцировано окислением катионов. По этой причине на все активные металлы, которые находятся до водорода в ряду напряжений, H2SO4 реагирует как обычная кислота. Постепенно происходит вытеснение водорода.
Этот эффект подробно объясняют на уроках химии в 8 классе. С разбавленной серной кислотой не взаимодействуют благородные металлы (например, золото, платина) и те элементы, которые стоят после водорода в ряду напряжения.
Другими окислительными свойствами разбавленная маслянистая жидкость H2SO4 не обладает.
Лабораторные исследования подтвердили, что кислота реагирует на основные оксиды и основания, из-за чего образуется сразу 2 ряда солей: кислые — гидросульфаты, средние — сульфаты.
К качественным реакциям на H2SO4 можно отнести взаимодействие с солями бария, в результате чего образуется белый осадок, который не растворяется в воде и кислой среде.
Эту химическую реакцию можно изобразить с помощью формулы: H2SO4 + BaCl 2 = BaSO 4↓ + 2HCl.
Свойства концентрированной кислоты
В концентрированном виде жидкость H2SO4 способна максимально проявить свои окислительные свойства. Это вызвано тем, что в молекулах кислоты находятся атомы серы в высшей степени окисления (+6).
В концентрированном виде H2SO4 взаимодействует с металлами, которые находятся в электрохимическом ряду напряжения (правее водорода). Речь касается серебра, ртути и меди. В результате химической реакции образуется вода, сульфаты и продукты восстановления серы.
Степень восстановления кислоты зависит от металлов. Например:
- До свободной серы возможно восстановление в том случае, если речь касается металлов, которые расположены в ряду напряжений от алюминия до железа.
- Калий, натрий, литий. Активные металлы восстанавливают H2SO4 до сероводорода.
- Металлы с меньшей активностью позволяют образовать сернистый газ.
В концентрированном виде H2SO4 не вступает в реакцию с платиной и золотом, так как эти металлы обладают небольшой активностью. Если речь касается хрома, алюминия и железа, тогда понадобится нагревание. В противном случае реакция не произойдёт, что связано с пассивированием этих металлов (на поверхности образуется тонкая защитная плёнка).
Продукт восстановления кислоты всецело зависит от концентрации H2SO4 и активности используемого металла. Каждая химическая реакция должна быть рассмотрена индивидуально.
Алюминий, хром и железо могут растворяться в концентрированной кислоте, но при условии сильного нагревания. В результате образуется соль металла и продукты восстановления серной кислоты.
Формулы выглядят следующим образом:
- 2Cr + 6H2SO4 = Cr2 (SO4)3 + 3SO2↑ + 6H2O.
- 8Al + 15H2SO4 = 4AL2 (SO4)3 + 3H2S↑ + 12H2O.
- 2Fe + 6H2SO4 = FE (SO4)3 + 3SO2↑ + 6H2O.
Совершенно другую реакцию можно наблюдать в том случае, если нужно проверить взаимодействие кислоты с металлами. Происходит выделение SO2 и окисление неметаллов до высшей степени. Например:
- S + 2H2SO4 = 3SO2↑ + 2H2O.
- C + 2H2SO4 = CO2↑ + 2SO2↑ + 2H2O.
- H2SO4 + H2S = SO2↑ + S↓ + 2H2O.
- 2P + 5H2SO4 = 2H3PO4 + 5SO2↑ + 2H2O.
В разбавленном виде кислота ничем не отличается от других похожих жидкостей. В категорию исключений входит только то, что H2SO4 не вступает в реакцию со свинцом, так как образовавшийся сульфат свинца невозможно растворить.
Токсичность и сферы применения
Серная кислота и олеум относятся к категории наиболее едких веществ. Они могут обжечь кожу, слизистые оболочки и дыхательные пути. Из-за неаккуратного обращения с агрессивной жидкостью не исключено возникновение химического ожога.
Вдыхание паров этих веществ может спровоцировать кашель, затруднённое дыхание, бронхит. В атмосфере может образовываться аэрозоль из-за ядовитого дыма металлургических и химических производств. В такой ситуации могут выпадать кислотные дожди.
При правильном применении H2SO4 может пригодиться в следующих случаях:
- Серийное производство минеральных удобрений.
- Изготовление электролита для свинцовых аккумуляторов.
- Производство химических волокон, взрывчатых и дымообразующих веществ, а также красителей.
- Получение солей и минеральных кислот.
- Изготовление пищевой добавки (эмульгатора) Е513.
- Использование в металлообрабатывающей, нефтяной, кожевенной, текстильной промышленности.
- Гидратация (например, этанол из этилена).
- Дегидратация (получение сложных и диэтиловых эфиров).
- Алкилирование. H2SO4 позволяет получить полиэтилен гликоль, изооктан, капролактам.
- Восстановление смол в очистительных фильтрах на участке производства дистиллированной воды.
Во всём мире в год используется до 160 тонн кислоты. Больше всего эту жидкость применяют в производстве минеральных удобрений. По этой причине сернокислотные заводы стараются возводить вместе с предприятиями, которые будут заниматься изготовлением удобрений.
Не менее востребованными являются соли серной кислоты. Мирабилит (Nа2SO4•10Н2O) был получен немецким химиком И. Глаубером, который экспериментировал с тем, как действует H2SO4 на хлорид натрия. В медицинской практике это средство используется в качестве слабительного.
Спрос также получил железный купорос (FeSO4*7H2O), который ранее применяли для лечения диагностированной чесотки.
Но в настоящее время этот химический компонент используется только для борьбы с сельскохозяйственными вредителями. Применение большой концентрации железного купороса чревато гибелью обработанной культуры.
Медный купорос (CuSO4*5H2O) получил большой спрос в сельском хозяйстве для борьбы с вредителями растений.






