- Задача 82
- Задача 84
- Задача 85
- Задача 86
- Задача 87
- Задача 88
- Химическая активность металлов в химии — формулы и определения с примерами решения задач
- Химическая активность металлов
- Реакции металлов с кислородом и водой
- Взаимодействие металлов с кислотами. ряд активности металлов
- Взаимодействие металлов с растворами солей
- Взаимодействие металлов с кислотами
- Взаимодействие кислот с металлами
- Практическая работа по химии "Металлы"
- Задания 7. Характерные химические свойства оснований, амфотерных гидроксидов, кислот и солей
Решение:
Щелочные металлы стоят в начале ряда напряжений металлов. Являясь наиболее активными, они легко окисляются кислородом воздуха уже при обычных температурах. Однако для каждого из указанных металлов есть свои особенности. Литий уже при обычных температурах реагирует как с кислородом воздуха, так и со вторым компонентом воздуха — азотом, образуя, соответственно, оксид и нитрид лития:
При высоких температурах вместо оксида лития образуется пероксид лития:
Натрий: а) при обычной температуре —
б) при высоких температурах —
б) при высоких температурах —
Задача 82
Основываясь на знании общих химических свойств металлов, написать уравнения следующих химических реакций:
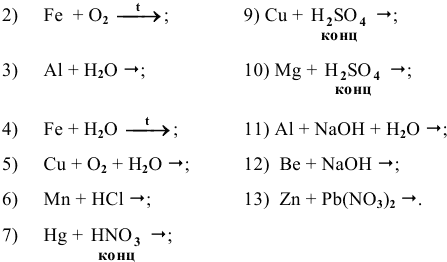
Решение:
5) Электрохимическая коррозия меди с кислородной деполяризацией:
- Задача 83
- С какими из следующих веществ может реагировать ртуть:
- Решение:
Задача 84
- Среди металлов: — найти наиболее и наименее сильный восстановитель:
- а) в водных средах;
- б) в неводных средах.
- Решение:
- В водных средах количественной характеристикой восстановительных свойств металла является величина его электродного потенциала.
Для изучаемых металлов величины стандартных электродных потенциалов следующие:
- Наиболее низкий электродный потенциал у кальция, значит, он наиболее сильный восстановитель в водных средах, а наиболее высокий электродный потенциал у цинка, значит, он наиболее слабый восстановитель среди перечисленных металлов.
- В неводных средах количественной характеристикой восстановительных свойств металла является величина его энергии ионизации.
- Величины энергий ионизации изучаемых металлов находим в справочнике:
Наиболее низкая энергия ионизации (ионизационный потенциал) у натрия — самого сильного восстановителя из перечисленных металлов, наиболее высокая энергия ионизации у цинка — самого слабого восстановителя.
Задача 85
- Составить и уравнять с помощью электронного баланса ОВ реакции.
- Решение:
- Ниже приводятся уравнения уже составленных и уравненных реакций:
Задача 86
- Каким методом может быть получен металлический магний?
- Решение:
- Магний — это очень активный металл, его электродный потенциал
Значит, магний может быть получен не электролизом водных растворов солей магния, а электролизом расплавов его солей, например электролизом расплава :
Магний также может быть получен металлотермией при использовании какого-либо металла, химическое сродство которого к атому, с которым он связан, выше, чем у магния, например:
Докажем возможность использования Na:
Так как , то реакция термодинамически возможна. Металлический натрий может быть использован для получения металлического магния из .
Задача 87
При смешивании расплавленных масс магния и свинца образуется интерметаллическое соединение, содержащее 81% РЬ. Какова его формула?
Решение:
— формула интерметаллического соединения в общем виде. Индексы х и у находим из следующих отношений:
Таким образом, формула интерметаллического соединения — .
Задача 88
Для определения процентного содержания серебра в старой монете растворили 0,3 г этой монеты в концентрированной . Затем из полученного раствора серебра осадили раствором соляной кислоты в виде осадка . Масса осадка равна 0,199 г. Каково содержание серебра в монете?
Решение:
Уравнения химических реакций, происходящих в ходе анализа, следующие:
Согласно уравнениям этих двух реакций, 1 моль образует 1 моль .
Рассчитаем массу серебра, соответствующую 0,199 г :
Вычислим процентное содержание серебра в монете:
- Эти задачи взяты со страницы решения задач по неорганической химии:
- Задачи с решением по неорганической химии
- Возможно эти страницы вам будут полезны:
Химическая активность металлов в химии — формулы и определения с примерами решения задач
- Содержание:
- Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
- Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
- На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химическая активность металлов
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Реакции металлов с кислородом и водой
Что вы знаете о ржавлении железа? Расскажите о разрушении металлов? Как вы думаете, как можно защитить металлы от разрушения? Где применяются металлы? Приведите примеры из жизни.
Металлы мы часто применяем в повседневной жизни. Это алюминий, медь, железо, золото, серебро и т. д. Алюминий и медь применяются для изготовления проводов. Алюминиевой фольгой упаковывают лекарства.
В домашнем обиходе вы часто встречаете алюминиевую посуду и упаковки для напитков. Но больше всего применяется железо для изготовления различных металлоконструкций, трубопроводов, деталей машин и т. д.
Этот металл от воды и кислорода воздуха приходит в негодность, изменяет цвет и тускнеет.
Железо покрывается ржавчиной красно-бурого цвета. Железо + вода + воздух → ржавчина. Такой химический процесс называется коррозией (от лат. corrodere – разъедать).
- Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- Поверхность алюминия покрывается оксидной пленкой, которая препятствует коррозии:
Химические активные металлы легко окисляются кислородом воздуха (Na, Mg, Ca). Железо и медь окисляются только при нагревании:
А золото и некоторые благородные металлы вообще не окисляются кислородом.
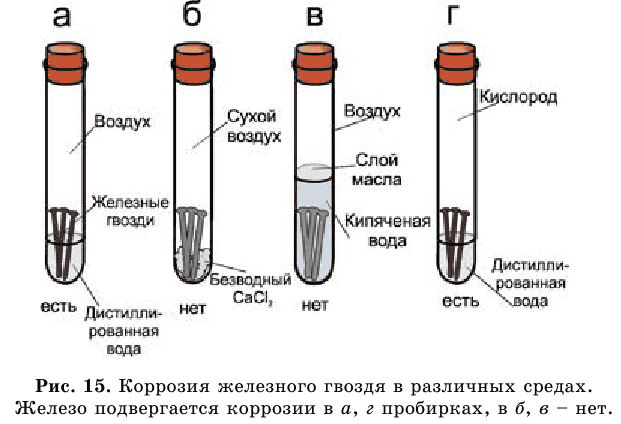
Рассмотрите рисунок 15 и сами сделайте выводы.
Ежегодно четвертая часть всего производимого металла из-за коррозии приходит в негодность (рис. 16).
Знаменитую Эйфелеву башню в Париже красили уже 18 раз, в результате чего ее масса увеличилась на 70 т.
Коррозия вызывает серьезные экологические катастрофы. Из разрушенных трубопроводов может быть утечка газа, нефти, опасных химических продуктов. Это приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
Металлы защищают от коррозии нанесением покрытий на поверхность изделия: окраска металла лаками, красками, эмалями. Но это покрытие недолговечно. Предохраняют металл покрытием другого металла, менее подверженного коррозии.
Это – золото, серебро, хром, никель, олово, цинк и др. В повседневной жизни часто применяют оцинкованные ведра, никелированные кровати. Для консервных банок применяют железо, покрытое оловом. Такое железо называют белой жестью. Белую жесть получают в г.
Темиртау Карагандинской области на металлургическом заводе. Можно уменьшить коррозию железа, добавляя другие металлы: никель, хром, молибден. Таким образом, получают сплав, который называется нержавеющей сталью.
Из этой стали изготавливают столовые приборы, трубы и другие изделия.
Олово — достаточно редкий, но очень полезный металл. Известно, что его начали добывать раньше, чем железо. Олово — это мягкий белый металл, который можно сплавлять с медью, чтобы получить бронзу.
Олово — один из первых освоенных человеком металлов. Оно не подвержено коррозии, поэтому из него делают тару для упаковки. Слой олова, нанесенный на другие металлы, делает их поверхность гладкой и блестящей.
Банки для хранения консервов и напитков также делают из тонкого стального листа, покрытого оловом.
Взаимодействие воды с некоторыми металлами (рис. 17). 1. Взаимодействие воды с активными металлами в обычных условиях идет очень интенсивно.
При этом протекают реакции замещения
При проведении таких опытов необходимо соблюдать меры предосторожности.
2. При взаимодействии металлов средней активности с водой вместо щелочи выделяется оксид металла:
3. Малоактивные металлы (Cu) с водой не реагируют.
Коррозия, ржавчина, защита от коррозии, белая жесть, алюминиевая фольга, сплав
Свинец — тяжелый голубовато-серый металл, который не ржавеет. Он используется в автомобильных аккумуляторах. Свинцовые экраны защищают людей от опасной радиации. Но свинец токсичен и ядовит для человека.
- Демонстрация №2
- Взаимодействие активных металлов с холодной и горячей водой
- Демонстрацию выполняет учитель, учащиеся наблюдают, делают выводы.
- Цель: узнать, как реагируют активные металлы с холодной и горячей водой.

Обрежьте кусочек натрия скальпелем, высушите фильтровальной бумагой. Высушенный кусочек натрия следует бросить в кристаллизатор с холодной, а затем горячей водой. Наблюдать за ходом реакции через стекло вытяжного шкафа. Такую же реакцию проделать и с металлическим кальцием. Испытать полученные растворы двумя индикаторами.
Взаимодействие металлов с кислотами. ряд активности металлов
Что такое кислоты? Какие кислые вещества вы встречали в природе?
В соответствии с определением кислоты должны вступать в реакции с металлами. Все ли металлы взаимодействуют с кислотами? Это можно проверить на опыте.
В четыре пронумерованные пробирки нальем одинаковое количество раствора соляной кислоты и добавим: в первую пробирку – Mg; во вторую – Zn; в третью – Sn; в четвертую – Cu.
Как видим, не все металлы могут взаимодействовать с кислотами и скорости их взаимодействия различны (рис. 18).
На основании интенсивности взаимодействия металлов с кислотами русским ученым Н.Н. Бекетовым был составлен ряд активности металлов:
Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag Au
При использовании ряда химической активности нужно помнить следующие правила:
1) металлы, стоящие в начале этого ряда, химически активны, они могут вытеснить водород из воды. 2) активность металлов в этом ряду снижается слева направо 3) только металлы, стоящие в ряду активности до водорода, вытесняют водород из растворов кислот (рис. 18):
активный металл + кислота —> соль + водород
Протекает реакция замещения. Металлы, стоящие в ряду активности после водорода, не реагируют с разбавленными растворами кислот (табл. 6).
- Лабораторный опыт №3
Взаимодействие металлов с растворами кислот - Цель: исследовать реакции различных металлов с растворами кислот и сделать вывод о существовании химически инертных металлов.
Налейте в четыре пробирки раствор соляной кислоты. В одну из пробирок насыпьте порошка магния, в другую – поместите гранулы цинка, в третью – опилки железа, в четвертую – стружки меди.
Может ли железо не подвергаться коррозии? Да, если оно очень чистое. Например, в Дели (Индия) находится Кутубская колонна высотой 7 м, массой 6,5 т. Она установлена в IX в. до н. э., в ее составе 99,72% Fe. До сих пор эта колонна не подверглась коррозии.
Взаимодействие металлов с растворами солей
Какие соли вы встречали в повседневной жизни?
Химически активные металлы вытесняют менее активные металлы из растворов солей, при этом протекает реакция замещения. Например, из раствора сульфата меди (ІІ) железо вытесняет медь (рис. 19):
Выделение красного налета меди является признаком реакции. Обратная реакция не протекает потому что медь в ряду активности металлов находится после железа, поэтому не вытесняет его.
- Схема реакций замещения выглядит следующим образом:
- соль 4- активный металл = новая соль + новый металл (менее активный)
- Реакции такого типа протекают при следующих условиях: 1) взаимодействующие соли должны быть растворимыми в воде;
- 2) более активный металл вытесняет из соли менее активный металл.
- Демонстрация №3
Вытеснение металлов из растворов солей - Цель: понимать, что более активный металл вытесняет менее активный металл из растворов его солей.
В пробирку поместите гранулы цинка и налейте раствор сульфата меди. В другую пробирку поместите небольшие кусочки железа и налейте раствор сульфата меди. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Практическая работа № 1 Сравнение активности металлов
Цель: Разработать ряд активности металлов. Обобщить результаты и сделать выводы.
Ход работы
В пять пробирок налейте растворы солей по 5 мл, опустите в каждую пробирку стружки меди. Затем такие опыты повторите с другими металлами. Наблюдайте за интенсивностью хода реакций. Заполните таблицу: где идет реакция следует поставить знак “+”, если не идет реакция – знак “–”. По сравнительной интенсивности, т. е. по числу протекающих реакций, составьте ряд активности металлов.
ДЕЛАЕМ ВЫВОДЫ:
- 1. Атомы металлов в реакциях только отдают электроны, образуя положительно заряженные ионы.
- 2. Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- 3. Сравнительную активность металлов можно определить с помощью ряда активности, составленного Н. Н. Бекетовым.
- 4. Металлы IA, НА группы очень легко вступают во взаимодействие с кислородом и водой. Многие металлы образуют оксидную пленку, которая препятствует дальнейшему окислению. Благородные металлы вообще не реагируют с кислородом и водой.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
- Лекции по химии:
- Лекции по неорганической химии:
- Лекции по органической химии:
Взаимодействие металлов с кислотами
С разбавленными кислотами, которые проявляют
окислительные свойства за счет ионов водорода (разбавленные серная,
фосфорная, сернистая, все бескислородные и органические кислоты и др.)
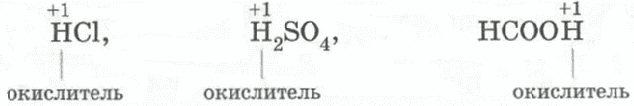
реагируют металлы:
• расположенные в ряду напряжений до водорода (эти металлы способны
вытеснять водород из кислоты);
• образующие с этими кислотами растворимые соли (на поверхности этих металлов
не образуется защитная солевая пленка).
В результате реакции образуются растворимые соли и выделяется водород:
2А1 + 6НСI = 2А1С13 + ЗН2↑
Мg
+ Н2SO4 =
МgSu
+ Н2 SO4 →X(так
как Сu
стоит после Н2) разб.
РЬ + Н2
SO4 →X(так
как РЬSO4
нерастворим
в воде) разб.
Некоторые кислоты являются окислителями за счет элемента, образующего кислотный
остаток, К ним относятся концентрированная серная, а также азотная кислота
любой концентрации. Такие кислоты называют кислотами-окислителями.
Анионы
данных кислот содержат атомы серы и азота в высших степенях окисления

Окислительные свойства кислотных остатков и
значительно сильнее, чем нона водорода Н, поэтому азотная и концентрированная
серная кислоты взаимодействуют практически со всеми металлами, расположенными в
ряду напряжений как до водорода, так и после него, кроме золота и платины.
Так как окислителями в этих случаях являются ноны кислотных остатков (за
счет атомов серы и азота в высших степенях окисления), а не ноны водорода Н, то
при взаимодействии азотной, а концентрированной серной кислот с металлами
не выделяется водород.
Металл под действием данных кислот окисляется до характерной
(устойчивой) степени окисления и образует соль, а продукт восстановления
кислоты зависит от активности металла и степени разбавления кислоты

Взаимодействие серной кислоты с металлами
Разбавленная и концентрированная серные кислоты ведут
себя по-разному. Разбавленная серная кислота ведет себя, как обычная
кислота. Активные металлы, стоящие в
ряду напряжений левее водорода
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu,
Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты. Мы
видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с
цинком.
-
H2SO4
+ Zn = Zn SO4 + H2 ↑ -
Медь стоит в ряду напряжений после водорода – поэтому
разбавленная серная кислота не действует на медь. А в концентрированной серной
кислоты, цинк и медь, ведут себя таким образом… -
Цинк, как активный металл, может образовывать с
концентрированной серной кислотой сернистый газ, элементарную серу, и даже
сероводород. -
2H2SO4 + Zn = SO2↑
+ZnSO4 + 2H2O
Медь — менее активный металл. При взаимодействии с
концентрированно серной кислотой восстанавливает ее до сернистого газа.
-
2H2SO4
конц. + Cu = SO2↑ + CuSO4 + 2H2O -
В пробирках с концентрированной серной кислотой
выделяется сернистый газа. -
Следует иметь в виду, что на схемах указаны продукты,
содержание которых максимально среди возможных продуктов восстановления кислот.
На основании
приведенных схем составим уравнения конкретных реакций — взаимодействия меди и
магния с концентрированной серной кислотой: 0 +6
+2 +4
С
u
+ 2Н2SO4
= СuSO4
+ SO2
+ 2Н2Og
+ 5Н2SO4
= 4МgSO4
+ Н2S
+ 4Н2O
Некоторые металлы (Fe.
АI, Сr)
не взаимодействуют с концентрированной серной и азотной кислотами при обычной
температуре,
так как происходит пассивации металла.
Это явление связано с образованием на поверхности металла тонкой, но очень
плотной оксидной пленки, которая и защищает металл. По этой причине азотную и концентрированную
серную кислоты транспортируют в железных емкостях.
Если металл проявляет переменные степени окисления, то с кислотами, являющимися
окислителями за счет ионов Н+, он образует соли, в которых его
степень окисления ниже устойчивой, а с кислотами-окислителями — соли, в которых
его степень окисления более устойчива: 0 +2 Fе+Н2SO4=
FеSO4+Н2
0 разб. +3
Fе+Н2SO4=
Fе2(SO4)3 + 3SO2 + 6Н2O
И.И.Новошинский
Н.С.Новошинская Химия
не забудь….) поделиться с друзьями
Взаимодействие кислот с металлами
Учащиеся познакомились с химическим составом и классификацией кислот, выяснили их некоторые общие химические свойства. А именно: кислоты могут взаимодействовать с основаниями и основными оксидами.
Поэтому цель нашего урока — продолжить характеризовать общие химические свойства кислот в свете ионных представлений. Для этого нужно: научиться пользоваться рядом напряжений металлов для прогнозирования возможных химических реакций кислот.
В тетрадях записываем число и тему урока:
Взаимодействие кислот с металлами.
Если кислоты могут взаимодействовать с основаниями и основными оксидами, а ключевым элементом в их составе является металл, то возможно ли взаимодействие металлов с кислотами. Проверим это экспериментально.
Mg + HCl — выделяется газ. Следовательно, кислоты могут взаимодействовать с металлами. Попробуем разнообразить металлы. Возьмем Zn и Cu.
Дети демонстрационно проводят реакции взаимодействия цинка и хлороводородной кислоты при нормальных условиях (видимых изменения нет), затем при нагревании. Наблюдается выделение газа.
Другой ученик проводит реакцию взаимодействия меди с той же кислотой при обычных условиях и при нагревании. Реакция не идет. Отрицательный результат — тоже результат.
Подведем итог магний взаимодействует с кислотой при нормальных условиях, цинк — при нагревании, медь — не взаимодействует.
Почему же металлы по-разному взаимодействуют с кислотами? Разная химическая активность!
Подобные опыты проводил в прошлом веке русский химик Н.Н.Бекетов. На основании экспериментально полученных данных он составил ряд активности металлов, который называется рядом напряжения металлов. В нем металлы располагаются в порядке уменьшения химической активности. Учитель показывает активные металлы, металлы средней активности и малоактивные.
Хотелось бы мне посмотреть на вашу активность. Поднять руки вверх, выпрямить их и очень быстро сжимать и разжимать кулачки по 10 раз. (Повторить дважды) Достаточно! Теперь пальчиками потрите мочки ушей по 10 раз. (Повторить дважды). В процессе упражнения учитель быстро считает от 1 до 10. Кто успел за моим счетом, тот активный, а кто не успел — тот малоактивный.
Данный фрагмент урока объединяет физминутку и позволяет детям почувствовать понятие активности и малой активности.
Для следующего ролевого этапа урока нужны два мальчика. Один — знаменитый боксер Александр Балуев, а другой — маленький щупленький, трусливый Слабачок. Задание: сидят две подружки на стульчиках. Вам понравился стульчик под одной из подружек.
Как вы будете его освобождать для себя, находясь в сценическом образе своего героя? Дети предполагают возможные ситуации: боксер силой «вытряхнет» или попытается испугать сидящих. Слабачок же, тоже попытается выгнать, угрожать, испугать, но ему это не удается.
Нисколько не страшно.
А если это не персонажи, а химические элементы. Тогда можно увидеть суть наших химических реакций. Более активный металл замещает водород в составе кислоты. А почему же медь не взаимодействует с кислотой? Дети приходят к выводу, что медь — малоактивный металл и не может вытеснить водород из растворов кислот.
Вывод.
Мы выяснили закономерности взаимодействия кислот с металлами: водород из кислот вытесняют металлы, стоящие до водорода в ряду активности.
Пришло время закончить работу со схемами, соответствующими проведенным химическим реакциям взаимодействия металлов с кислотой:
На доске дети составляют реакции взаимодействия хлороводородной кислоты с цинком и магнием в молекулярном и ионном виде. Как видно из кратких ионных уравнений, вместо хлороводородной кислоты можно взять какую-либо другую кислоту. Конечно, есть кислоты, которые взаимодействуют с металлами по-особому, но об этом мы поговорим на уроках химии позже.
Итак, на уроке сегодня вы
- познакомились с рядом активности металлов;
- пополнили знания о химических свойствах кислот;
- выяснили, что о возможности реакции между кислотой и металлом подскажет ряд активности.
Домашнее задание, оценки за урок.
7.06.2011
Практическая работа по химии "Металлы"
- Практическая работа №2
- По теме: «Общие свойства металлов и их соединений».
- Цель работы: изучение химических свойств металлов и их соединений.
- Задачи работы:
-
Закрепить знания о химических свойствах металлов: взаимодействие металлов с растворами кислот и солей.
-
Экспериментальным путем убедиться в различной химической активности металлов, доказать, что более активные металлы восстанавливают менее химически активные из водных растворов их солей.
-
Изучить общие свойства амфотерных гидроксидов.
-
Изучить общие свойства нерастворимых оснований.
-
Отработать навыки экспериментальной работы согласно правилам техники безопасности.
Краткие теоретические сведения.
Металлы в периодической системе находятся в I, II, III группах, в побочных подгруппах всех групп. Кроме того, металлами являются наиболее тяжелые элементы IV, V, VI и VII групп.
Особенностью строения атомов металлов является небольшое число электронов во внешнем электронном уровне, как правило, не превышающее трёх. Атомы металлов легко отдают электроны и являются хорошими восстановителями.
- Металлы по их активности расположены в ряд, называемый электрохимическим рядом напряжений металлов.
- Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Au
- Металлы, стоящие в электрохимическом ряду напряжений металлов до водорода, могут вытеснять его из растворов кислот, а всякий металл, стоящий ближе к началу ряда, может вытеснять (восстанавливать) последующие из растворов их солей.
- 1.Металлы, расположенные в начале ряда — от лития до магния –восстанавливают водород из воды с образованием щелочи:
- 2Na + 2HOH 2NaOH + H2↑.
- 2. Металлы менее активные (от марганца до железа), восстанавливая из воды водород, образуют оксиды:
- 3Fe + 4H2O Fe3O4 + 4H2↑.
3.Металлы реагируют с кислотами. Взаимодействие металлов зависит от их активности (см. электрохимическим рядом напряжений металлов) и от концентрации кислоты:
- а) кислоты HCl, H3PO4, H2SO4(разб.) реагируют со всеми металлами (кроме Pb), которые стоят в ряду напряжений до водорода, при этом выделяется водород;
- Zn + 2HCl ZnCl2 + H2↑.
- б) концентрированная H2SO4 при нагревании реагирует со всеми металлами (кроме Pt и Au), при этом водород не выделяется; с тяжелыми (плотность 5 г/ см3) металлами образует газ SO2 (оксид серы (IV)); с более активными легкими (плотность 3) металлами выделяется H2S (сероводород):
- Cu +2H2SO4 (конц) CuSO4 + 2H2O + SO2↑.
- в) концентрированная НNO3 c щелочными и щелочноземельными металлами образует газ N2O – оксид азота (IV), с другими тяжелыми металлами – оксид азота (IV) NO2:
- Ca + 10HNO3(конц.) → Ca(NO3)2 + N2O + 5 H2O
- Cu + 4HNO3(конц.) → Cu(NO3)2 + NO2 + 2 H2O
- г) разбавленная НNO3 взаимодействует c щелочными и щелоч-ноземельными металлами, а также с Zn, Fe, Sn, при этом выделяется газ NH3 (аммиак) или образуется соль аммония (NH3 + НNO3 =NH4NO3), при реакции с остальными металлами (плотность 5 г/ см3) образуется оксид азота (II)NO:
- Ca + 10HNO3(разб.) → 4Ca(NO3)2 + NH4NO3 + 3 H2O
- Cu + 4HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
- д) кислоты H2CO3,H2SO3, CH3COOH – слабые, взаимодействуют с активными металлами:
- 2CH3COOH + 2Na → 2CH3COONa + H2
4. Каждый последующий металл может быть восстановлен из раствора соли предыдущим металлом: Fe + CuSO4 FeSO4 + Cu.
Переходные металлы расположены в Периодической системе с 4 по 7 период. Переходные металлы, символы которых расположены в самой таблице, называют d-элементами, а те элементы, символы которых расположены в нижней части Периодической системы, называют лантаноидами и актиноидами или f-элементами.
Амфотерные оксиды — оксиды переходных металлов.
Свойства.
1. Амфотерные оксиды не растворяются в воде.
- 2. Амфотерные оксиды, реагируя с основными и с кислотными оксидами, дают соли:
- Al2O3 + K2O 2KAlO2,
- Al2O3 + 3SO3 Al2(SO4)3.
- 3. Амфотерные оксиды, реагируя с основными или кислотными гидроксидами, дают соли:
- ZnO + 2KOH K2ZnO2 + H2O,
- ZnO + H2SO4 ZnSO4 + H2O
- 4. Соответствующие амфотерным оксидам гидроксиды обладают амфотерными свойствами:
- Zn(OH)2Zn2+ + 2OH— — как основание
- H2ZnO2 2H+ + ZnO22- — как кислота
- Амфотерные гидроксиды — это такие гидроксиды, где растворенная в воде часть, диссоциирует на катионы водорода, металла и анионы гидроксида и кислотного остатка.
- Zn(OH)2⇆ Zn2+ + 2OH—, H2ZnO2⇆ 2H+ + ZnO22-
- Получение:
- 1.Взаимодействием переходных металлов (после удаления оксидной пленки) с водой:
- 2Al + 6H2O = 2Al(OH)3+ 3H2↑
- 2.Взаимодействие солей со щелочами:
- ZnCl2 + 2KOHZn(OH)2 + 2KCl
- 3. Взаимодействием солей с кислотами:
- Na[Al(OH)4] + HCl Al(OH)3+ NaCl + H2O
- Свойства:
- 1. Диссоциирует на ионы растворенная в воде часть амфотерного гидроксида: Zn(OH)2⇆Zn(OH)+ + OH—⇆Zn2+ + 2OH—
- H2ZnO2⇆ HZnO2- + H+⇆ZnO22- + 2H+
- 2. Взаимодействие с кислотными оксидами, кислотами и кислыми солями:
- 2Cr(OH)3 + 3SO3 Cr2(SO4)3 + 3H2O
- Al(OH)3 + 3HBr AlBr3 + 3H2O
- Zn(OH)2+ 2NaHSO4 ZnSO4 + Na2SO4 + 2H2O
- 3. Взаимодействуют с основными оксидами, основаниями и основными солями:
- Zn(OH)2 + Li2OLi2ZnO2 + H2O
- Zn(OH)2 + Ba(OH)2BaZnO2 + 2H2O
- 4. Подвергаются разложению при нагревании:
- 2Al(OH)3 Al2O3 + 3H2O
- Приборы и реактивы:
- — штатив с пробирками, пипетка, держатель для пробирок, спиртовки, спички, стеклянная палочка.
- — растворы: серной кислоты, гидроксида натрия; растворы солей:сульфат меди (II),хлорид цинка, сульфат алюминия, сульфат натрия; кусочки: цинка, меди.
- Порядок выполнения работы.
Опыт № 1. Взаимодействие металлов с растворами кислот.
Ход работы: В три пробирки положить: в первую кусочек магния, во вторую – гранулу цинка, в третью – медь (кусочек проволоки). Прилить во все пробирки 1 мл раствора серной кислоты.
Записать наблюдения в таблицу «Оформление отчета». Сравнить скорость происходящих реакций. Почему в одной из пробирок реакция не идёт? Дать объяснение. Записать уравнения реакций в молекулярном и ионном видах.
Опыт № 2. Взаимодействие металлов с солями.
Ход работы: В одну пробирку положить одну гранулу цинка и прилить раствор медного купороса, во вторую – кусочек медной проволоки и прилить раствор сульфата натрия.
Записать наблюдения в таблицу «Оформление отчета». Составить схему электронного баланса в окислительно–восстановительных реакциях.
Опыт № 3. Получение гидроксида цинка и испытание его амфотерных свойств.
- Ход работы: В две пробирки налить по 5-6 капель раствора соли цинка и очень аккуратно по каплям добавить в них раствор щелочи до появления осадка.
- Затем в одну пробирку добавить 2-3 капли раствора серной кислоты.
- В другую пробирку добавить избыточное количество щелочи (до растворения осадка).
Записать наблюдения в таблицу «Оформление отчета». Составить уравнения реакций в молекулярном и ионном виде.
Опыт № 4. Получение гидроксида меди и изучение его свойств
Ход работы: Из имеющихся реактивов получить гидроксид меди (II). Указать цвет осадка. Нагреть полученное вещество.
Записать наблюдения в таблицу «Оформление отчета». Что произойдет с осадком при нагревании?
Составьте уравнения реакций в молекулярно и ионном виде.
Оформление отчета
| Название работы. Условия проведения. | Наблюдения. | Уравнения реакции. Вывод. |
Выводы по работе (ответить на вопросы).
Какими химическими свойствами обладают металлы. Указать, металлы, которые могут вытеснять водород из растворов кислот и металлы которые могут вытеснять другие металлы из растворов их солей.
Список литературы:
Ерохин Ю.М. Химия: учеб. для студ. учреждений сред. проф. образования / Ю.М. Ерохин.- М.: Академия,2011. с. 170-360. — ISBN 978-5-7695 -8350-6
Задания 7. Характерные химические свойства оснований, амфотерных гидроксидов, кислот и солей
В пробирку с раствором соли X добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1. KOH
- 2. HCl
- 3. Cu(NO3)2
- 4. K2SO3
- 5. Na2SiO3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
- Ответ: 42
- При реакции между двумя солями неорганических кислот газ образуется только при смешении горячих растворов нитритов и солей аммония вследствие образования термически неустойчивого нитрита аммония. Например,
- NH4Cl + KNO2 =to=> N2 + 2H2O + KCl
- Однако в списке нет как нитритов, так и солей аммония.
- Значит, одна из трех солей (Cu(NO3)2, K2SO3 и Na2SiO3) реагирует либо с кислотой (HCl), либо с щелочью (NaOH).
- Среди солей неорганических кислот только соли аммония выделяют газ при взаимодействии с щелочами:
- NH4+ + OH = NH3 + H2O
Солей аммония, как мы уже сказали, в списке нет. Остается только вариант взаимодействия соли с кислотой.
К солям среди указанных веществ относятся Cu(NO3)2, K2SO3 и Na2SiO3. Реакция нитрата меди с соляной кислотой не протекает, т.к. не образуется ни газа, ни осадка, ни малодиссоциирующего вещества (воды или слабой кислоты). Силикат натрия реагирует с соляной кислотой, однако благодаря выделению белого студенистого осадка кремниевой кислоты, а не газа:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
Остается последний вариант — взаимодействие сульфита калия и соляной кислоты. Действительно, в результате реакции ионного обмена между между сульфитом и практически любой кислотой образуется неустойчивая сернистая кислота, которая мгновенно распадается на бесцветный газообразный оксид серы (IV) и воду.
При добавлении вещества X к раствору соли Y выделился бесцветный газ, окрашивающий мокрую лакмусовую бумажку в синий цвет. Выберите из предложенного списка вещества X и Y, которые соответствуют наблюдениям эксперимента.
- 1. Cu(OH)2
- 2. NH4Cl
- 3. Ba(OH)2
- 4. Na2SO3
- 5. H2SO4
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
- Сокращенному ионному уравнению
- 2H+ + CO32- = CO2 + H2O
- соответствует взаимодействие между:
- 1) карбонатом рубидия и серной кислотой
- 2) гидрокарбонатом калия и соляной кислотой
- 3) карбонатом магния и серной кислотой
- 4) карбонатом калия и бромоводородной кислотой
- 5) карбонатом натрия и уксусной кислотой
- Запишите в таблицу номера выбранных веществ в порядке возрастания номеров.
Решение
В пробирку с концентрированным раствором вещества X добавили небольшое количество вещества Y, в результате чего не растворимое в воде вещество Y растворилось. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1. CuSO4
- 2. Mg
- 3. NaOH
- 4. Al(OH)3
- 5. CaCO3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
- Реакция ионного обмена протекает между:
- 1) железом и соляной кислотой
- 2) оксидом железа (III) и алюминием
- 3) сульфидом натрия и хлоридом меди (II)
- 4) бромидом натрия и хлором
- 5) соляной кислотой и нитратом серебра
- Запишите в таблицу номера выбранных веществ в порядке возрастания номеров.
Решение
В пробирку с раствором щелочи (вещества X) добавили раствор вещества Y. В результате реакции наблюдали выделение голубого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) сульфат железа (II)
- 2) гидроксид натрия
- 3) сульфат меди (II)
- 4) соляная кислота
- 5) гидроксид аммония
- Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
В пробирку с раствором щелочи (вещества X) добавили раствор вещества Y. В результате произошла реакция, которую описывает сокращенное ионное уравнение OH- + H+ = H2O. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) сульфид калия
- 2) угольная кислота
- 3) серная кислота
- 4) гидроксид бария
- 5) гидроксид натрия
- Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
При комнатной температуре концентрированная серная кислота растворяет металл (вещество X) и взаимодействует с раствором вещества Y с выделением бесцветного газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) карбонат натрия
- 2) железо
- 3) алюминий
- 4) карбонат магния
- 5) цинк
- Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
При взаимодействии растворов одних веществ образуется бурый осадок (пара веществ X), а при взаимодействии растворов других веществ образуется белый творожистый осадок (пара веществ Y). Из предложенного перечня выберите две пары веществ, которые могут вступать в описанные реакции.
- 1) нитрат серебра и хлорид натрия
- 2) гидроксид натрия и нитрат железа (III)
- 3) карбонат калия и азотная кислота
- 4) серная кислота и аммиак
- 5) хлорид калия и ортофосфорная кислота
- Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
- Из предложенного перечня выберите две пары веществ, взаимодействие которых в водном растворе приводит к образованию осадка.
- 1) серная кислота и гидроксид лития
- 2) гидрокарбонат натрия и гидроксид натрия
- 3) гидроксид натрия и хлорид бария
- 4) гидроксид калия и хлорида алюминия
- 5) сульфат меди и сульфида калия
- Запишите в таблицу номера выбранных веществ в порядке возрастания номеров.
Решение
Сокращенное ионное взаимодействие H+ + OH- = H2O соответствует взаимодействию раствора щелочи (вещества X) раствором вещества Y. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) гидроксид лития
- 2) гидроксид магния
- 3) иодоводородная кислота
- 4) фтороводородная кислота
- 5) сероводородная кислота
- Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Через колбу с раствором электролита (вещества X) пропустили газ Y, который поглотился раствором, при этом никаких признаков реакции не наблюдалось. Из предложенного перечня выберите вещества X и Y, которые соответствуют условию задания.
- 1. CO2
- 2. CaCO3
- 3. NH3
- 4. AlCl3
- 5. BaCl2
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
В результате взаимодействия соляной кислоты с раствором вещества X образуется газообразное вещество. При пропускании этого газообразного вещества через раствор вещества Y выпал белый осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) карбонат кальция
- 2) карбонат калия
- 3) гидроксид кальция
- 4) гидроксид калия
- 5) аммиак
- Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Гидроксид натрия может реагировать с веществом X с образованием как кислой, так и средней солей, а с веществом Y — с образованием комплексной соли. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) сульфит калия
- 2) гидроксид магния
- 3) гидроксид алюминия
- 4) хлорид лития
- 5) оксид серы (IV)
- Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Соляная кислота реагирует с раствором вещества X без проявления каких-либо признаков реакции, а с веществом Y — с выделением бесцветного газа с резким запахом. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) карбонат бария
- 2) гидроксид цинка
- 3) сульфит бария
- 4) гидроксид бария
- 5) сульфат бария
- Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Вещества X и Y не растворимы в воде. При добавлении разбавленной серной кислоты к веществу X оно растворяется, а при добавлении серной кислоты к веществу Y — растворение сопровождается выделением газа. Из предложенного перечня выберите вещества X и Y, которые вступают в описанные реакции.
- 1. Zn(OH)2
- 2. Ca(OH)2
- 3. Zn
- 4. Ag
- 5. Cu
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Вещество X, 1 моль которого при полной диссоциации в растворе образует наибольшее количество ионов, взаимодействует с веществом Y с образованием белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) хлорид меди (II)
- 2) нитрат серебра
- 3) хлорид лития
- 4) иодид серебра
- 5) хлорид железа (III)
- Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
При взаимодействии раствора кислородсодержащей соли X с бескислородной солью Y выпадает осадок белого цвета. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1. Fe2(SO4)3
- 2. KOH
- 3. NaCl
- 4. BaCl2
- 5. PbSO4
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Вещество X, 1 моль которого при полной диссоциации в растворе образует наибольшее количество ионов натрия, взаимодействует с веществом Y с образованием белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) гидроксид натрия
- 2) фосфат кальция
- 3) нитрат натрия
- 4) нитрат кальция
- 5) карбонат натрия
- Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Вещество X растворяется как в растворе серной кислоты, так и в растворе гидроксида натрия, а вещество Y реагирует с этими растворами с образованием осадков в обоих случаях. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1. Zn(NO3)2
- 2. Pb(NO3)2
- 3. Al(OH)3
- 4. FeCl3
- 5. FeCl2
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
- В пробирку с раствором соли аммония Х добавили раствор вещества Y.
- В результате реакции наблюдали образование белого осадка.
- Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) нитрат аммония
- 2) хлорид аммония
- 3) хлороводород
- 4) сульфат магния
- 5) карбонат аммония
- Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
- В пробирку с раствором вещества X добавили кислоту Y. В результате произошла реакция, которую описывает сокращённое ионное уравнение
- H+ + HCO−3 = H2O + CO2↑
- Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) угольная кислота
- 2) фтороводородная кислота
- 3) бромоводородная кислота
- 4) карбонат калия
- 5) гидрокарбонат аммония
- Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
В пробирку с раствором соли Х добавили раствор вещества Y. В результате реакции наблюдали образование белого осадка. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) гидрокарбонат бария
- 2) гидроксид натрия
- 3) нитрат аммония
- 4) бромид лития
- 5) сероводород
- Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
В пробирку с раствором соли Х добавили раствор вещества Y. В результате реакции образовалось слабое растворимое основание и выделился осадок. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) сульфат лития
- 2) хлорид кальция
- 3) карбонат аммония
- 4) гидроксид бария
- 5) гидроксид калия
- Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
- В пробирку с раствором соли X добавили раствор вещества Y. В результате произошла реакция, которую описывает сокращённое ионное уравнение
- H2PO4− + 2OH− = PO43− + 2H2O
- Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) дигидрофосфат аммония
- 2) дигидрофосфат кальция
- 3) дигидрофосфат калия
- 4) гидроксид бария
- 5) гидроксид натрия
- Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
- В пробирку с раствором вещества X добавили раствор щёлочи Y.
- В результате произошла реакция, которую описывает сокращённое ионное уравнение
- HS– + OH– = S2– + H2O
- Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) гидросульфид аммония
- 2) гидросульфид калия
- 3) сероводородная кислота
- 4) гидроксид стронция
- 5) гидроксид калия
- Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
В пробирку с раствором соли Х добавили раствор вещества Y. В результате реакции наблюдали образование белого осадка. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) нитрат натрия
- 2) аммиак
- 3) бромоводород
- 4) хлорид алюминия
- 5) оксид серы(IV)
- Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение






