- Щелочные металлы
- Химические свойства щелочных металлов
- 2. Реакция щелочных металлов с кислородом:
- 3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 4. Реакция щелочных металлов с кислотами
- 5. Взаимодействие щелочных металлов с аммиаком
- 6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
- 7. Качественная реакция на катионы щелочных металлов – окрашивание пламени в следующие цвета:
- 2.2.1. Характерные химические свойства щелочных металлов
- Взаимодействие щелочных металлов с неметаллами
- с кислородом
- с галогенами
- с азотом
- с фосфором
- с водородом
- с серой
- с водой
- с галогенпроизводными углеводородов (реакция Вюрца):
- со спиртами и фенолами
- Щелочные металлы в химии
- Физические свойства щелочных металлов
- Получение щелочных металлов
- Химические свойства щелочных металлов
- Качественные реакции
- Примеры решения задач
- I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- Урок 6: Щелочные металлы — 100urokov.ru
- Представители щелочных металлов
- Строение атомов щелочных металлов
- Изменение химических свойств щелочных металлов
- Внешний вид и физические свойства щелочных металлов
- Нахождение в природе щелочных металлов
- Обнаружение ионов металлов в соединениях
- Качественные реакции
- Обнаружение катионов лития
- Обнаружение катиона натрия
- Обнаружение катиона калия
- Обнаружение катионов рубидия, цезия
- Обнаружение ионов франция
- Химические свойства щелочных металлов
- Реакция с простыми неметаллами
- Взаимодействие с водой
- Взаимодействие с сильными кислотами
- Специфические химические свойства лития
- Получение щелочных металлов
- Применение соединений щелочных металлов
- Неорганическая химия
- Соединения щелочных металлов
Щелочные металлы.
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева:
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
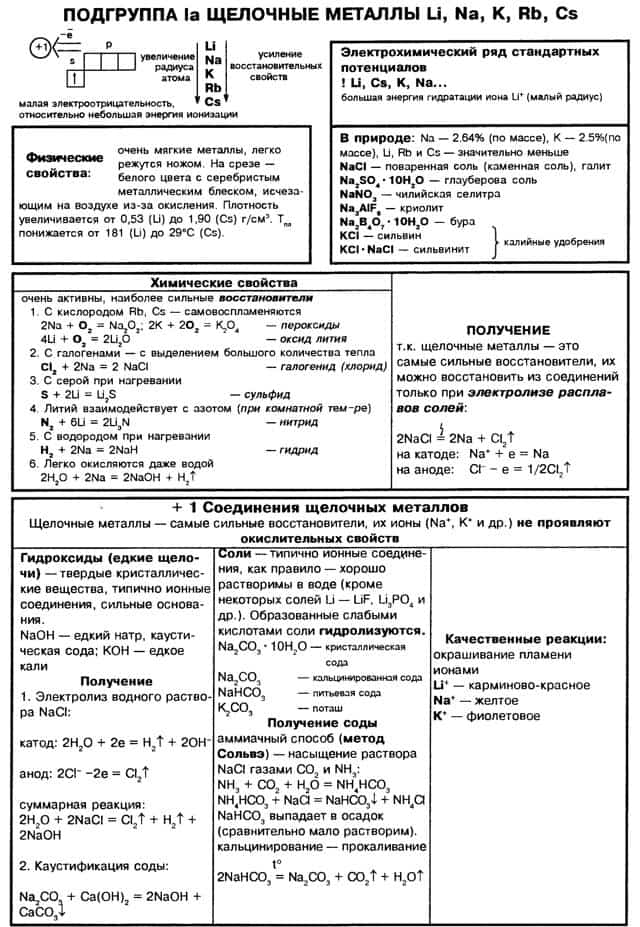
Основная характеристика щелочных металлов: В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1.
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО). Далее таблица свойств щелочных металлов:
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы.
Многие минералы содержат в своём составе металлы главной подгруппы I группы.
Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16].
В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O. Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий: При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды: Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода: Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды: 3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов: При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами. Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей): 4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Беловато-розовый |
| Cs | Фиолетово-красный |
- Получение щелочных металлов 1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
- Соединения щелочных металлов. Гидроксиды
катод: Li+ + e → Li анод: 2Cl- — 2e → Cl2 2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов: катод: Na+ + e → Na анод: 4OH- — 4e → 2H2O + O2 Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород. Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
Щелочные металлы
Чтобы поделиться, нажимайте
К щелочным металлам относятся литий, натрий, калий, рубидий, цезий и франций. В периодической системе они расположены в главной подгруппе I группы. Все щелочные металлы имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1.
Поэтому щелочные металлы являются сильными восстановителями. Радиусы их атомов возрастают от лития к францию. Электрон внешнего слоя с возрастанием радиуса атома находится все дальше от ядра, силы притяжения ослабевают и, следовательно, увеличивается способность к отдаче этого электрона, т. е. химическая активность.
В электрохимическом ряду напряжений металлов все щелочные металлы стоят левее водорода.
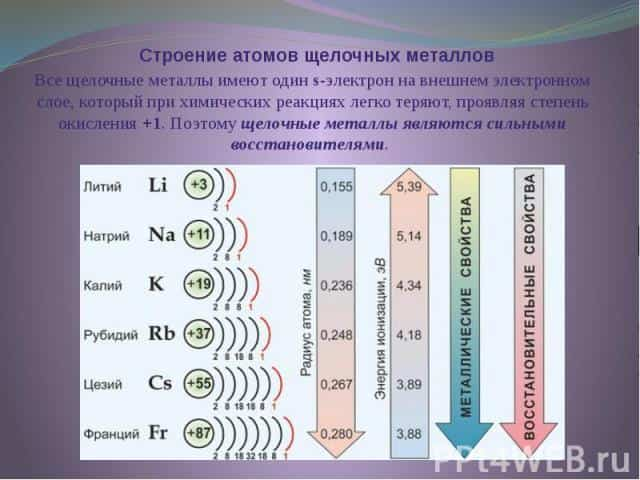
Это типичные металлы, в твердом состоянии хорошо проводят электрический ток. Они легкоплавки, быстро окисляются на воздухе, поэтому их хранят без доступа воздуха и влаги, чаще всего под керосином. Щелочные металлы образуют соединения с преимущественно ионной связью.
Оксиды щелочных металлов – твердые гигроскопичные вещества, легко взаимодействующие с водой. При этом образуются гидроксиды – твердые вещества, хорошо растворимые в воде. Соли щелочных металлов, как правило, тоже хорошо растворяются в воде.
Химические свойства щелочных металлов
2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH + H2
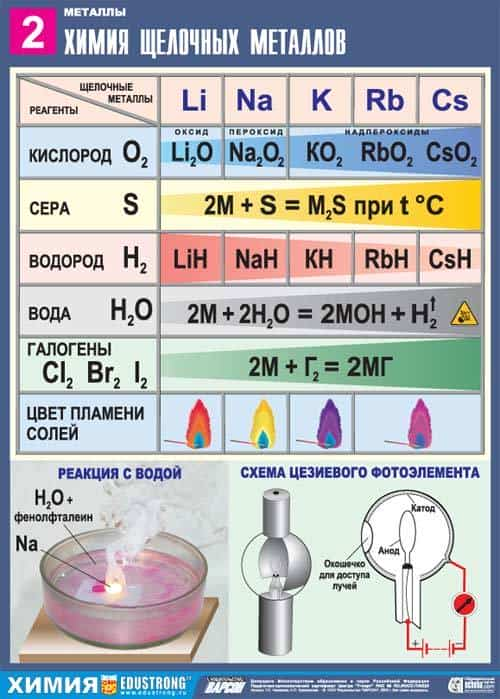
2. Реакция щелочных металлов с кислородом:
- 4Li + O2 → 2Li2O (оксид лития)
- 2Na + O2 → Na2O2 ( пероксид натрия)
- K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 2Li + Cl2 → 2LiCl (галогениды)
- 2Na + S → Na2S (сульфиды)
- 2Na + H2 → 2NaH (гидриды)
- 6Li + N2 → 2Li3N (нитриды)
- 2Li + 2C → Li2C2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
7. Качественная реакция на катионы щелочных металлов – окрашивание пламени в следующие цвета:
- Li+ – карминово-красный
- Na+ – желтый
- K+, Rb+ и Cs+ – фиолетовый
2.2.1. Характерные химические свойства щелочных металлов
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
- Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
- Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
- 4Li + O2 = 2Li2O
- Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
- 2Na + O2 = Na2O2,
- а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
- K + O2 = KO2
- Rb + O2 = RbO2
с галогенами
- Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
- 2Li + Br2 = 2LiBr бромид лития
- 2Na + I2 = 2NaI иодид натрия
- 2K + Cl2 = 2KCl хлорид калия
с азотом
- Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
- 6Li + N2 = 2Li3N нитрид лития
- 6K + N2 = 2K3N нитрид калия
с фосфором
- Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
- 3Na + P = Na3Р фосфид натрия
- 3K + P = K3Р фосфид калия
с водородом
- Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
- Н2 + 2K = 2KН-1 гидрид калия
- Н2 + 2Rb = 2RbН гидрид рубидия
с серой
- Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
- S + 2K = K2S сульфид калия
- S + 2Na = Na2S сульфид натрия
- Взаимодействие щелочных металлов со сложными веществами
с водой
- Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
- 2HOH + 2Na = 2NaOH + H2↑
- 2K + 2HOH = 2KOH + H2↑
- Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
- ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
- 2CH3OH + 2К = 2CH3OК + H2↑
- метилат калия
- 2C6H5OH + 2Na = 2C6H5ONa + H2
- фенолят натрия
Щелочные металлы в химии
К щелочным металлам относятся металлы IA группы Периодической системы Д.И. Менделеева – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
На внешнем энергетическом уровне щелочных металлов находится один валентный электрон. Электронная конфигурация внешнего энергетического уровня щелочных металлов – ns1.
В своих соединениях они проявляют единственную степень окисления равную +1. В ОВР являются восстановителями, т.е. отдают электрон.
Физические свойства щелочных металлов
- Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).
- В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
- Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
- Щелочные металлы обладают высокой тепло- и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки
Получение щелочных металлов
- Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
- 2LiCl = 2Li + Cl2↑
- 2NaCl = 2Na + Cl2↑
Любой щелочной металл можно получить восстановлением соответствующего галогенида (хлорида или бромида), применяя в качестве восстановителей Ca, Mg или Si. Реакции проводят при нагревании (600 – 900С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
- 2MeCl + Ca = 2Mе↑ + CaCl2,
- где Ме – металл.
- Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
- 2Li2O + Si + 2CaO = 4Li + Ca2SiO4
- Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
- KOH + Na = K + NaOH
Химические свойства щелочных металлов
Все щелочные металлы активно взаимодействуют с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий. Уравнение реакции в общем виде:
- 2Me + H2O = 2MeOH + H2↑
- где Ме – металл.
- Щелочные металлы взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
- 4Li + O2 = 2Li2O
- 2Na + O2 =Na2O2
- K + O2 = KO2
Все щелочные металлы при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.). Например:
- 2Na + Cl2 =2NaCl
- 6Li + N2 = 2Li3N
- 2Li +2C = Li2C2
- 2K + S = K2S
- 2Na + H2 = 2NaH
- Щелочные металлы способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
- 2Li + 2NH3 = 2LiNH2 + H2↑
- Взаимодействие щелочных металлов с солями происходит по следующему принципу –вытесняют менее активные металлы (см. ряд активности металлов) из их солей:
- 3Na + AlCl3 = 3NaCl + Al
- Взаимодействие щелочных металлов с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
- Щелочные металлы реагируют с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
- 2Na + 2C2H5OH = 2C2H5ONa + H2↑
- 2K + 2C6H5OH = 2C6H5OK + H2↑
- 2Na + 2CH3COOH = 2CH3COONa + H2↑
Качественные реакции
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами: Li+ окрашивает пламя в красный цвет, Na+ — в желтый, а K+, Rb+, Cs+ — в фиолетовый.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
- Литий Li,
- Натрий Na,
- Калий K,
- Цезий Cs,
- Рубидий Rb
- Франций Fr
- Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
- Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Литий
- Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
- Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Na2CO3 + 2C = 2Na + 3CO
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.:
- KCl + Na = K + NaCl
- KOH + Na = K + NaOH
- В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
- Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Качественные реакции — окрашивание пламени солями щелочных металлов
Цвет пламени:
Li — карминно-красныйNa — желтыйK — фиолетовыйRb — буро-красныйCs — фиолетово-красный
С кислородом
4Li + O2 = 2Li2O
- Натрий образует пероксид:
2Na + O2 = Na2O2
- Калий образует надпероксид:
- K + O2 = KO2
- С галогенами (F, Cl, Br, I)
- Щелочные металлы образуют галогениды:
- 2Li + F2 = 2LiF
- 2Na + Cl2 = 2NaCl
- 2K + I2 = 2KI
- С водородом
- Щелочные металлы образуют гидриды:
- 2Na + H2 = 2NaH
- С серой
- Щелочные металлы образуют сульфиды:
- 2Na + S = Na2S
- С азотом
- При комнатной температуре взаимодействует только литий:
- 6Li + N2 = 2Li3N
- Остальные щелочные металлы
реагируют с азотом при
нагревании: - 6Na + N2 = 2Na3N
- С углеродом
- Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
- 2Na + 2C → Na2C2 (t = 150-200 °C)
- С фосфором
- Щелочные металлы активно
реагируют с фосфором образуя фосфиды: - 3Na + P → Na3P
- С водой
- Щелочные металлы реагируют с водой при обычных
условиях: - 2Na + 2H2O = 2NaOH + H2
- Видео Взаимодействие щелочных металлов с водой
- С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
2K + H2SO4(разб) = K2SO4 +
H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 8Na + 5H2SO4(конц) = 4Na2SO4 +
H2S + 4H2O; - с разбавленной азотной
- 8Na + 10HNO3(разб) = 8NaNO3 + NH4NO3 + 3H2O;
- с концентрированной азотной
- 8Na + 10HNO3(конц) =
8NaNO3 + N2O + 5H2O. - 2СH3COOH + 2Li → 2CH3COOOLi + H2↑
- С солями
- В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
- 3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.
Урок 6: Щелочные металлы — 100urokov.ru
- План урока:
- Представители щелочных металлов
- Строение атомов щелочных металлов
- Изменение химических свойств щелочных металлов
- Внешний вид и физические свойства щелочных металлов
- Нахождение в природе
- Качественные реакции
- Химические свойства щелочных металлов
- Получение щелочных металлов
- Применение соединений щелочных металлов
Представители щелочных металлов
Щелочные металлы – это группа высокоактивных металлов. Название происходит от продукта взаимодействия этих веществ с водой, в результате которой образуется щелочь (сложное химическое соединение). Найти в природе такие металлы, сделать из них изделие или просто хранить в виде слитка невозможно. Эти металлы сразу окисляются кислородом воздуха.
К щелочным металлам относятся: литий, натрий, калий, рубидий, цезий, франций.
Строение атомов щелочных металлов
В таблице Менделеева щелочные металлы расположены в первой группе. Такое положение не случайно, а отражает строение атома и химические свойства.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра.
Ядро и электроны притягиваются за счет электростатического напряжения. Соответственно, чем меньше у электрона силы сопротивления, тем ближе он будет к ядру. Электроны с большей энергией способны отдаляться на периферию атома.
По мере смены периодом, количество электронов и энергетических уровней будет увеличиваться. Общий параметр атомов всех щелочных металлов является 1 электрон на внешнем энергетическом уровне.
Изменение химических свойств щелочных металлов
По мере продвижения от первого до последнего периода, в атомах щелочных металлов происходит увеличение количества атомов и электронных облаков. Чем дальше атом оказался от ядра, тем меньше притяжение между ними.
За счет этого, отдаленный (последний) электрон проще отсоединить от атома. Легкость отщепления электронов определяет реакционную способность.
Отщепление электрона приводит к окислению собственного атома и восстановлению окислителя.
Таким образом, восстановительные свойства щелочных металлов увеличиваются сверху вниз в группе. Самый активный металл – цезий.
Внешний вид и физические свойства щелочных металлов
Щелочные металлы обладают всеми характерными свойствами: серебристый цвет (исключение: цезий – золотистого цвета) металлический блеск, электро- и теплопроводность, ковкость, пластичность.
Особенным качеством является мягкость и легкость за счет низкой плотности вещества. Эти металлы можно резать ножом, разминать руками (в перчатках) и ломать.
Нахождение в природе щелочных металлов
Из-за высокой реакционной активности, щелочные металлы не встречаются в природе в виде самородков или чистых залежей. Обнаружить их можно в составе солей. Многие природные минералы содержат ион щелочного металла в своей структуре.
Таблица. Минералы, в состав которых входят ионы щелочных металлов
Как видно из таблицы, чем выше активность элемента, тем ниже его встречаемость в природе. Элемент последнего периода первой группы – франций – вообще не встречается в природе даже в составе минералов. Этот элемент является радиоактивным и является промежуточным продуктом распада Урана-235. Его общее содержание в земной коре оценивается в 380 граммов.
Обнаружение ионов металлов в соединениях
Самый простой способ определения иона металла – окраска пламени. Для соли каждого металла характерен свой цвет:
- Литий – красный,
- Калий – фиолетовый,
- Натрий – желтый,
- Рубидий – розовый,
- Цезий – синий.
Соли франция такой проверке не подвергаются.
Для такой проверки важно, чтобы в пламени не было других примесей, меняющий цвет, иначе проверка будет недостоверна.
Качественные реакции
Обнаружение катионов лития
Обнаружить ионы металлов в соли можно с помощью качественной реакции.
- Для обнаружения катионов лития используют фосфорную кислоту. Получившийся белый фосфат лития растворим только в концентрированной азотной кислоте и солях аммония:
- 3Li+ + PO43- = Li 3РО 4↓
- В растворимых солях литий можно обнаружить с помощью фторида аммония. При реакции образуется белый нерастворимый осадок фторида лития:
- Li+ + F- = LiF↓
Обнаружение катиона натрия
Ионы натрия можно обнаружить реакцией с комплексной солью гексагидроксостибатом (V). При низких температурах и в нейтральной среде образуется мелкокристаллическая белая соль натрия:
Na+ + [Sb (OH)6]– = Na[Sb(OH)6] ↓
Эту реакцию проводят на предметном стекле. За образованием и формой кристаллов наблюдают под микроскопом или бинокуляром.
Обнаружение катиона калия
В кислой и нейтральной среде ионы калия образуют двойную комплексную соль с гексанитрокабальтатом натрия (III). Эта соль нерастворима в воде и имеет желтый цвет:
2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6] ↓+ 2Na+
Особенность реакции в ее медленном течении. Реакционную смесь оставляют на несколько часов. Для ускорения реакции можно тереть стеклянной палочкой по стенке пробирки. Это приводит к формированию статического электричества, что усиливает притяжение ионов друг к другу.
Еще одним способом обнаружения катионов калия служит реакция с гидротартратом натрия NaHC4H4O6. В этом случае образуется соль белого цвета. Реакцию можно ускорить потиранием стеклянной палочной о поверхность пробирки:
K+ + NaHC4H406= KHC4H4O6↓ + Na+.
Обнаружение катионов рубидия, цезия
Катионы рубидия и цезия – высокоактивные ионы, поэтому не обнаруживаются качественными реакциями. Все соединения прозрачные и хорошо растворимы в воде. Основными способами их обнаружения в составе соли служит осаждение органическими ароматическими растворами. Способа разделения цезия и рубидия из смеси в настоящее время нет.
Обнаружение ионов франция
Как радиоактивный металл, франций не входит в состав обычных солей. Его обнаружение проводится методом спектрометрии и радиационных приборов.
Химические свойства щелочных металлов
Все металлы являются восстановителями, поэтому они вступают в реакцию с различными окислителями. К таким относятся простые неметаллы и сложные соединения, обладающие окислительными свойствами.
Реакция с простыми неметаллами
Щелочные металлы активно вступают в реакции с галогенами. При этом образуется соответствующий галогенид. С серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов реагируют только при нагревании:
- 2Na + Cl2→ 2NaCl
- 2К + S К2S
- 2Rb + H2 2RbH
- 3Na + P Na3P
- В реакции с кислородом щелочные металлы образуют пероксиды (кроме лития), повторное окисление которых приводит к образованию оксидов:
- 2Na + О2 = Na2О2
- 2 Na2О2 + О2 = 2Na2О
- Специальных условий для окисления металлов кислородом не требуется, поэтому щелочные металлы хранят под слоем парафина, вазелина или масла без доступа кислорода.
Взаимодействие с водой
Реакция щелочных металлов с водой происходит с выделением большого количества тепла. Выделяющийся в ходе реакции водород может воспламеняться, что в некоторых случаях приводит к взрыву.
Взаимодействие с сильными кислотами
- В реакциях щелочных металлов с кислотами образуются соответствующие соли. Особенных проявлений свойств щелочных металлов здесь нет:
- 8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
- 8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
Специфические химические свойства лития
- В некоторых реакциях литий проявляет отличные от остальных щелочных металлов свойства. Например, это единственный металл, реагирующий с азотом без нагревания:
- 6Li + N2 = 2Li3N
- Нитрид лития подвергается необратимому гидролизу.
- Li3N + 3H2O → 3LiOH + NH3↑
- В реакции с лития с кислородом образуется оксид лития:
- 4Li + О2 = 2Li2О
Получение щелочных металлов
Получить щелочные металлы в чистом виде можно только электролизом расплавов их солей:
- NaCl Na+ + Cl–;
- катод (–) (Na+): Na+ + е = Na0,
- анод (–) (Cl–): Cl– – е = Cl0, 2Cl0 = Cl2;
- 2NaCl = 2Na + Cl2 .
- Если использовать раствор соли, катионы металла будут сразу вступать в реакцию с образованием щелочей:
- NaCl Na+ + Cl–,
- H2O Н+ + ОН–;
- катод (–) (Na+; Н+): H+ + е = H0, 2H0 = H2
- (2H2O + 2е = H2 + 2OH–),
- анод (+) (Cl–; OН–): Cl– – е = Cl0, 2Cl0 = Cl2;
- 2NaCl + 2H2O = 2NaOH + Cl2 + H2 .
Применение соединений щелочных металлов
Основные области применения данных солей – медицина, кулинария, строительство, химическая промышленность.
Наиболее используемый щелочной металл – натрий. Он служит катализатором синтеза металлов, служит теплоносителем в атомных реакторах.
Хлорид натрия – соединение, используемое в каждом доме. Это безопасная соль, используемая в кулинарии. Так же, хлорид натрия применяется в медицине для приготовления физиологических растворов.
Литий и его щелочи служат основой изготовления щелочных батареек. Длительное время это был единственный способ создания портативных энергоносителей.
Калий и натрий используются для изготовления мыла в качестве омыляющего компонента.
Соли калия используются в сельском хозяйстве в качестве удобрения.
Калий, рубидий и натрий используются в атомной промышленности и атомной энергетике. Эти металлы служат катализаторами многих реакций.
- Литий добавляется во многие сплавы для улучшения металлических свойств.
- Соединения лития, рубидия и цезия используют при изготовлении цветных стекол.
- Франций пока не имеет практического применения в связи с высокой радиоактивностью.
Неорганическая химия
Общая характеристика
К щелочным металлам относятся s-элементы I-ой группы Периодической системы — литий, натрий, калий, рубидий,цезий и франций. .
Литий имеет два стабильных изотопа -6Li (мольная доля в естественном элементе 0,073) и 7Li (0,927), натрий — один изотоп 23Na, калий — 39К (0,931) и 41К (0,069).
Изотоп калия с массовым числом 40 (40К, мольная доля 0,0002) — радиоактивный, -распад. У рубидия два стабильных изотопа — 85Rb (0,7215) и 87Rb (0,2785), у цезия — один 133Cs.
Франций стабильных изотопов не имеет, массовое число наиболее долгоживущего — 223.
Все щелочные металлы — электронные аналоги, внешний уровень имеет строение ns1. По сравнению с элементами других подгрупп соответствующего периода щелочные металлы имеют наиболее низкие энергии ионизации и наибольшие радиусы атомов и ионов.
В группе энергия ионизации уменьшается от лития к цезию, а радиус атома наоборот, возрастает. В соединениях проявляют степень окисления +1 и в свободном виде на Земле не встречаются.
Мольная доля лития в земной коре 0,0002, натрия — 0,024 (один из наиболее распространенных элементов), калия 0,014, рубидия — 0,00007. Содержание цезия около 10-10, франций получен только искусственно.
Важнейшие минералы щелочных металлов — NaCl -каменная соль, или галит, Na2SO4*10H2O — глауберова соль или мирабилит, Na2B2O7*10H2O — бура, Na3AlF6 -криолит, KCl — сильвин, NaCl*KCl — сильвинит, KCl*MgCl2*6H2O — карналлит, KCl*MgSO4*3H20 — каинит.
Простые вещества.
Все щелочные металлы не имеют аллотропных и полиморфных модификаций и образуют по одному простому веществу.
Физические свойства.
В виде простых веществ — мягкие, серебристо белые металлы, цезий имеет золотисто-желтый цвет. Плотности лития, натрия и калия меньше плотности воды ( 1 г/см3), температура плавления плавно уменьшается от лития (180оС) к цезию (28оС). Так же изменятся и температура кипения — от 1337оС у лития до 668оС у цезия. Твердость щелочных металлов мала — они легко режутся ножом.
В видимой области спектра в парах щелочные металлы имеют интенсивные линии излучения: натрий — желтую, литий — карминово-красную, калий — фиолетовую, рубидий — красную, цезий — голубую. Это позволяет распозновать эти металлы с помощью пламенной фотометрии.
Щелочные металлы исключительно реакционноспособны и проявляют сильные восстановительные свойства. Уже при комнатной температуре они реагируют со многими неметаллами. С кислородом литий образует оксид:
4Li + O2 = 2Li2O
Остальные щелочные металлы образуют пероксиды и надпероксиды (супероксиды), например:
2Na + O2 = Na2O2 2K + 2O2 = K2O4
В атмосфере фтора и хлора щелочные металлы самовоспламеняются, образуя галогениды:
Na + Cl2 = 2NaCl
С жидким бромом литий и натрий реагируют замедленно, остальные — о взрывом. С иодом взаимодействие протекает спокойно.
С водородом щелочные металлы реагируют при нагревании (200-400oC), при этом образуютсяионные гидриды:
2Na + Н2 = 2NaН
разлагающиеся водой с выделением водорода:
2NaН + 2Н2О = 2NaОН + Н2
С азотом щелочные металлы реагируют при нагревании, образуя нитриды состава Ме3N. Литий реагирует с азотом воздуха уже при комнатной температуре, покрываясь слоем красноватого нитрида:
6Li + N2 = 2Li3N
Щелочные металлы реагируют с водой:
2Ме + 2Н2О = 2МеОН + Н2
литий — спокойно, натрий — энергично, калий и остальные — со взрывом — воспламеняется выделяющийся водород. Рубидий и цезий реагируют не только с жидкой водой, но и со льдом.
С кислотами щелочные металлы образуют соли, часто эти реакции сопровождаются взрывами.
Со спиртами щелочные металлы реагируют спокойно, часто для завершения реакции необходимо нагревание:
2Ме + С2Н5ОН = 2С2Н5ОМе + Н2
При взаимодействии лития и натрия с алюминие, оловом, ртутью образуются интерметаллические соединения. Широко распространена амальгама натрия NanHgm. Между собой щелочные металлы образуют сплавы, широкое применение имеет сплав натрия и калия, обладающий высокой теплоемкостью.
Получение щелочных металлов
Основным способом получения щелочных металлов является электролиз расплавов их соединений. Для получения лития электролизу подвергают расплав эвтектическуй смеси хлоридов лития и калия.
Натрий получают электролизом расплава хлорида или гидроксида, калий — электролизом расплава смеси хлоридов натрия и калия. Смеси солей используют для понижения температуры электролиза.
Реакции электролиза хлоридов и гидроксидов в общем виде выглядят так:
2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О + О2
Кромe электролиза щелочные металлы можно получить и восстановлением оксидов и гидроксидов, например оксид лития восстанавливают кремнием при нагревании:
2Li2O + Si = Li + SiO2
Расплавленный гидроксид калия восстанавливают жидким натрием:
KOH + Na = NаOH + K
Гидроксиды рубидия и цезия восстанавливают металлическим кальцием в вакууме при нагревании:
RbOH + Ca = Rb + CaO CsOH + Ca = Cs + CaO
Хранят щелочные металлы в атмосфере инертного газа, под слоем сухого керосина или обезвоженного масла. Большие количества щелочных металлов хранят в герметичной железной таре (бочке).
Применение
Щелочные металлы используют в качестве восстановителей, в качестве жидких теплоносителей, например, в ядерных реакторах, в органическом синтезе. Литий применяется производстве сплавов в качестве легирующей добавки. Пары натрия используют для наполнения газоразрядных ламп уличного освещения, которые дают свет с оранжевым оттенком.
Соединения щелочных металлов
Гидриды
Гидриды щелочных металлов — соединения с ионным типом связи, сильные восстановители. Водой разлагаются с выделением водорода
2МеН + 2Н2О = 2МеОН + Н2
При нагревании в вакууме разлагаются:
2МеН = 2Ме + Н2
пр этом устойчивость гидридов уменьшается от лития к цезию. Рaсплавы гидридов проводят электрический ток.
Гидриды лития и натрия испльзуют для получения алюмогидридов, гидрид алюминия вводится в реакцию в виде эфирного раствора:
NaН + AlН3 = Na[AlH4]
Алюмогидриды лития и натрия используются в качестве восстановителей, напримеp, в органическом синтезе.
Карбиды
Карбиды щелочных металлов имеют состав Ме2С2 . Бесцветные кристаллические вещества. Обладают высокой химической активностью. При непосредственном взаимодействии простых веществ образуется толькр карбид лития, остальные — при взаимодействии металла и ацетилена.Водой разлагаются с выделением ацетилена:
Ме2С2 + 2Н2О = 2МеОН + С2Н2 Нитриды
Из нитридов щелочных металлов наиболее устойчив гидрид лития, который медленно образуется при взаимодействии с азотом уже при комнтной температуре и быстро — при 250oC. Водой нитрид лития разлагается с выделением аммиака:
Li3N + 3Н2О = 3LiОН + NН3
Нитриды остальных щелочных металлов получают при взаимодействии паров металла с азотом в тлеющем электрическом разряде.
При взаимодействии расплавленных щелочных металлов с аммиаком образуются амиды, например:
2Na + 2NН3 = 2NaNН2 + Н2
В жидком аммиаке щелочные металлы растворяются, образуя темно-синие, хорошо проводящие электрический ток растворы.
Оксиды, пероксиды, озониды
При сгорании при атмосферном давлении литий дает только оксид Li2O , натрий — пероксид Na2O2 , остальные — надпероксиды Ме2O4 или МеO2 . Оксид натрия можно получить только косвенным путем, например:
Na2O2 + 2Na = 2Na2O 2NaОН(твердый) + 2Na = 2Na2O + Н2 5NaN3 + 2NaNО3 = 3Na2O + 8N2
Оксиды щелочных металлов обладают высокой реакионной способностью, проявляют сильно выраженные основные свойства, энергично взаимодействуют с водой, образуя гидроксиды.
Пероксиды и надпероксиды — твердые вещеста, сильные окислители. При контакте с водой разлагаются:
Na2O2 + 2Н2О = 2NaOН + Н2O2 2NaO2 + 2Н2О = 2NaOН + Н2O2 + O2
Озониды натрия, калия, рубидия и цезия получают действием озона на твердые гидроксиды:
4МеOН + 4О3 = 4МеО3 + 2Н2О + O2
Озониды еще более сильные окислители, чем пероксиды и надпероксиды. Бурно реагируют с водой и разбавленной серной кислотой:
4МеO3 + 2Н2О = 4МеOН + 5O2 4КO3 + 2Н2SО4 = 2R2SО4 + 2Н2О + 5O2 Гидроксиды
Твердые, бесцветные, гигроскопические, хорошо растворимые в воде вещества. Растворение в воде сопровождаетсявыделением большого количества теплоты. В водном растворе почти полностью диссоциированы, сильные основания. Часто гидроксиды щелочных металлов называют едкими щелочами. Термически устойчивы до температур более 1000oC
Едкие щелочи жадно поглощают из воздуха водяные пары и углекислый газ, превращаясь в сиропообразную массу.Расплавы едких щелочей разрушают стекло и платину, поэтому щелочи плавят в железных тиглях.
Получают щелочи электролизом водных растворов хлоридов:
2NaСl + 2Н2О = 2NaOН + Н2 + Cl2
или обменными реациями карбоната металла и гидроксида кальция:
Rb2CO3 + Ca(OН)2 = 2RbOН + CaCO3
Наиболее широкое применение находит гидроксид натрия — для осушения газов, в органическом синтезе, в производстве искусственного волокна.






