- Способы добычи
- Немного о названии
- Физические свойства металла
- Области и особенности применения
- Сплавы меди
- Отрасли промышленности
- Роль в организме человека
- Свойства меди – химические, физические и уникальные целебные
- Медь
- СТРУКТУРА
- СВОЙСТВА
- Запасы и добыча
- ПРОИСХОЖДЕНИЕ
- Применение меди
- Область применения меди
- Сплавы меди и их применение
- Использование меди в медицине
- Применение и маркировка меди
- Соединения меди
- Гидроксид меди применение
- Оксид меди применение
- Физические и химические свойства меди
- Интересное о меди
- Физические свойства
- Химические свойства
- Области применения меди
- 1.2 Свойства меди и области её применения
- 1.3 Сырье для получения меди
О том, какое великое значение имел этот химический элемент в истории человечества и планеты, можно догадаться уже по названиям исторических эпох. После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
Медь является одним из семи металлов, которые стали известны человечеству еще в древности. Если верить историческим данным, знакомство древних людей с этим металлом произошло примерно девять тысяч лет назад.
Найденные вещицы были датированы стыком восьмого и седьмого тысячелетий до нашей эры. Помимо самих изделий, на месте раскопок был обнаружен шлак, что говорит о производившихся выплавках металла из руды.
Получение меди из руды было относительно доступно. Поэтому несмотря на свою высокую температуру плавления, этот металл в числе первых был быстро и широко освоен человечеством.
Способы добычи
- В природных условиях этот химический элемент существует в двух формах:
- Любопытным фактом является следующее: медные самородки в природе попадаются гораздо более часто, чем золотые, серебряные и железные.
- Природные соединения меди — это:
- оксиды;
- углекислые и сернистые комплексы;
- гидрокарбонаты;
- сульфидные руды.
Рудами, имеющими наибольшее распространение, являются медный блеск и медный колчедан.
Меди в этих рудах содержится всего один-два процента. Первичная медь добывается двумя основными способами:
- гидрометаллургическим;
- пирометаллургическим.
Пирометаллический способ включает в себя комплекс процессов. Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере.
Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия.
По ее окончании чистота полученного металла составляет практически сто процентов.
Процесс получения меди гидрометаллургическим способом делится на два этапа.
- Вначале сырье выщелачивается при помощи слабого раствора серной кислоты.
- На заключительном этапе металл выделяется непосредственно из упомянутого в первом пункте раствора.
Данный метод используется при переработке только бедных руд, так как, в отличие от предыдущего способа, при его проведении невозможно попутно извлечь драгоценные металлы. Именно поэтому приходящийся на этот способ процент так невелик по сравнению с другим методом.
Немного о названии
Химический элемент Cuprum, обозначаемый символом Cu, получил свое название в честь небезызвестного острова Кипр. Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Физические свойства металла
При контакте с воздухом этот металл становится желтовато-розового цвета. Этот неповторимый золотисто-розовый оттенок обусловливается возникновением на поверхности металла оксидной пленки. Если эту пленку удалить, медь приобретет выразительный розовый цвет с характерным ярким металлическим блеском.
Удивительный факт: тончайшие медные пластинки на просвет имеют вовсе не розовый, а зеленовато-голубой или, иначе говоря, морской цвет.
В форме простого вещества медь обладает следующими характеристиками:
- удивительной пластичностью;
- достаточной мягкостью;
- тягучестью.
Помимо упомянутых физических характеристик, этот химический элемент обладает высокой электропроводностью. Эта особенность главным образом определила применение металлической меди.
Среди основных свойств этого металла стоит отметить его высокую теплопроводность. По показателям электропроводности и теплопроводности медь является одним из лидеров среди металлов. Более высокими показателями по этим параметрам обладает только один металл — серебро.
Нельзя не принимать во внимание тот факт, что показатели электро- и теплопроводности меди относятся к разряду базовых свойств. Они сохраняются на высоком уровне лишь пока металл находится в чистом виде. Уменьшить эти показатели возможно добавлением примесей:
- мышьяка;
- железа;
- олова;
- фосфора;
- сурьмы.
Помимо всего прочего, металлическая медь характеризуется невероятной прочностью, высокой температурой плавления, а также высокой температурой кипения. Данные действительно впечатляют. Температура плавления меди превышает одну тысячу градусов Цельсия! А температура кипения составляет 2570 градусов Цельсия.
Этот металл относится к группе металлов-диамагнетиков. Это значит, что его намагничивание, как и у ряда других металлов, происходит не по направлению внешнего магнитного поля, а против него.
Еще одной немаловажной характеристикой можно назвать отличную устойчивость этого металла к коррозии. В условиях высокой влажности окисление железа, например, происходит в несколько раз быстрее, чем окисление меди.
Данный элемент является малоактивным. При контакте с сухим воздухом в обычных условиях медь не начинает окисляться. Влажный воздух, напротив, запускает окислительный процесс, при котором образуется медный карбонат (II), являющийся верхним слоем патины. Практически моментально этот элемент реагирует с такими веществами, как:
Кислоты, не обладающие окислительными свойствами, не способны оказывать на медь влияние. Кроме того, она никак не реагирует при контакте с такими химическими элементами, как:
Кроме уже отмеченных химических свойств, для меди характерна амфотерность. Это значит, что в земной коре она способна образовать катионы и анионы. Соединения этого металла могут проявлять как кислотные свойства, так и основные — это напрямую зависит от конкретных условий.
Области и особенности применения
В древние времена металлическая медь использовалась для изготовления самых разных вещей. Умелое применение этого материала позволило древним людям обзавестись:
- дорогой посудой;
- украшениями;
- инструментами, имеющими тонкое лезвие.
Сплавы меди
Говоря о применении меди, нельзя не упомянуть о ее значении в получении различных сплавов, в основу которых ложится именно этот металл. К таким сплавам относятся:
Помимо бронзы и латуни, этот химический элемент участвует в создании сплавов с другими металлами, среди которых алюминий, золото, никель, олово, серебро, титан, цинк. Медные сплавы с неметаллами, такими как кислород, сера и фосфор, используются гораздо реже.
Отрасли промышленности
Ценные свойства медных сплавов и чистого вещества способствовали их использованию в таких отраслях, как:
- электротехника;
- электромашиностроение;
- приборостроение;
- радиоэлектроника.
Еще одна область использования этого металла — ювелирная отрасль. В основном он применяется в форме сплавов с золотом. Изделия из медно-золотого сплава характеризуются повышенной прочностью, высокой стойкостью. Такие изделия на протяжении долгого времени не деформируются и не истираются.
Соединения металлической меди выделяются высокой биологической активностью. В мире флоры этот металл имеет важное значение, так как он участвует в синтезе хлорофилла. Участие данного элемента в этом процессе позволяет обнаружить его в числе компонентов минеральных удобрений для растений.
Роль в организме человека
Но составляя насыщенное этим элементом меню, не следует забывать о том, что переизбыток его соединений может привести к отравлению организма. Поэтому, насыщая организм этим полезным веществом, очень важно не переусердствовать. И касается это не только количества потребляемых продуктов.
К примеру, пищевое отравление может вызвать использование медной посуды. Приготовление пищи в такой посуде крайне не рекомендуется и даже воспрещается. Связано это с тем, что в процессе кипячения в пищу поступает значительное количество этого элемента, что может привести к отравлению.
В запрете на медную посуду есть одна оговорка. Использование такой посуды не представляет опасности в том случае, если ее внутренняя поверхность имеет оловянное покрытие. Только при выполнении этого условия использование медных кастрюлек не несет угрозы пищевого отравления.
Помимо всех перечисленных отраслей применения, распространение этого элемента не обошло стороной и медицину.
В сфере лечения и поддержания здоровья он применяется в качестве вяжущего вещества и антисептика.
Этот химический элемент входит в состав капель для глаз, которые используются при лечении такого заболевания, как конъюнктивит. Кроме того, медь является немаловажным компонентом различных растворов от ожогов.
Источник: https://tokar.guru/metally/metallicheskaya-med-opisanie-elementa-svoystva-i-primenenie.html
Свойства меди – химические, физические и уникальные целебные
Особые природные свойства меди и простота ее обработки обусловили то, что данным металлом человек научился пользоваться еще в глубокой древности.
Древние греки называли этот элемент халкосом, на латинском она именуется cuprum (Сu) или aes, а средневековые алхимики именовали этот химический элемент не иначе как Марс или Венера. Человечество давно познакомилось с медью за счет того, что в природных условиях ее можно было встретить в виде самородков, имеющих зачастую весьма внушительные размеры.
Легкая восстанавливаемость карбонатов и окислов данного элемента поспособствовала тому, что именно его, по мнению многих исследователей, наши древние предки научились восстанавливать из руды раньше всех остальных металлов.
Сначала медные породы просто-напросто нагревали на открытом огне, а затем резко охлаждали. Это приводило к их растрескиванию, что давало возможность выполнять восстановление металла.
Рекомендуем ознакомиться
Освоив столь нехитрую технологию, человек начал постепенно развивать ее. Люди научились вдувать при помощи мехов и труб в костры воздух, затем додумались устанавливать вокруг огня стены. В конце концов, была сконструирована и первая шахтная печь.
Многочисленные археологические раскопки позволили установить уникальный факт – простейшие медные изделия существовали уже в 10 тысячелетии до нашей эры! А более активно медь начала добываться и использоваться через 8–10 тысяч лет. Именно с тех пор человечество применяет этот уникальный по многим показателям (плотность, удельный вес, магнитные характеристики и так далее) химический элемент для своих нужд.
В наши дни медные самородки встречаются крайне редко. Медь добывают из различных медных руд, среди которых можно выделить следующие:
- борнит (в нем купрума бывает до 65 %);
- медный блеск (он же халькозин) с содержанием меди до 80 %;
- медный колчедан (иначе говоря – халькоперит), содержащий порядка 30 % интересующего нас химического элемента;
- ковеллин (в нем Cu бывает до 64 %).
Также купрум добывают из малахита, куприта, иных оксидных руд и еще без малого из 20 минералов, содержащих ее в различных количествах.
В простом виде описываемый элемент представляет собой металл розовато-красного оттенка, характеризуемый высокими пластичными возможностями. Природный купрум включает в себя два нуклида со стабильной структурой.
Радиус положительно заряженного иона меди имеет следующие значения:
- при координационном показателе 6 – до 0,091 нм;
- при показателе 2 – до 0,060 нм.
А нейтральный атом элемента характеризуется радиусом 0,128 нм и сродством к электрону 1,8 эВ. При последовательной ионизации атом имеет величины от 7,726 до 82,7 эВ.
Купрум является переходным металлом, поэтому он имеет переменные степени окисления и малый показатель электроотрицательности (1,9 единиц по шкале Полинга).
Теплопроводность меди (коэффициент) равняется 394 Вт/(м*К) при температурном интервале от 20 до 100 °С. Электропроводность меди (удельный показатель) составляет максимум 58, минимум 55,5 МСм/м.
Более высокой величиной характеризуется лишь серебро, электропроводность других металлов, в том числе и алюминия, ниже.
Медь не может вытеснять водород из кислот и воды, так как в стандартном потенциальном ряду она стоит правее водорода.
Описываемый металл характеризуется гранецентрированной кубической решеткой с величиной 0,36150 нм.
Кипит медь при температуре 2657 градусов, плавится при температуре чуть больше 1083 градусов, а ее плотность равняется 8,92 грамм/кубический сантиметр (для сравнения – плотность алюминия равняется 2,7).
Другие механические свойства меди и важные физические показатели:
- давление при 1628 °С – 1 мм рт. ст.;
- термическая величина расширения (линейного) – 0,00000017 ед.;
- при растяжении достигается предел прочности равный 22 кгс/мм2;
- твердость меди – 35 кгс/мм2 (шкала Бринелля);
- удельный вес – 8,94 г/см3;
- модуль упругости – 132000 Мн/м2;
- удлинение (относительное) – 60 %.
Магнитные свойства меди в какой-то мере уникальны. Элемент полностью диамагнитен, показатель его магнитной атомной восприимчивости составляет всего лишь 0,00000527 ед. Магнитные характеристики меди (впрочем, как и все ее физические параметры – вес, плотность и пр.
) обуславливают востребованность элемента для изготовления электротехнических изделий.
Примерно такие же характеристики имеются и у алюминия, поэтому они с описываемым металлом составляют «сладкую парочку», используемую для производства проводниковых деталей, проводов, кабелей.
Многие механические показатели меди изменить практически нереально (те же магнитные свойства, например), а вот предел прочности рассматриваемого элемента можно улучшить посредством выполнения наклепа. В данном случае он повысится примерно в два раза (до 420–450 МН/м2).
Купрум в системе Менделеева включен в группу благородных металлов (IB), находится он в четвертом периоде, имеет 29 порядковый номер, имеет склонность к комплексообразованию. Химические характеристики меди не менее важны, чем ее магнитные, механические и физические показатели, будь то ее вес, плотность либо иная величина. Поэтому мы будем говорить о них подробно.
Химическая активность купрума мала. Медь в условиях сухой атмосферы изменяется незначительно (можно даже сказать, что почти не изменяется). А вот при повышении влажности и наличии в окружающей среде углекислого газа на ее поверхности обычно формируется пленка зеленоватого оттенка.
В ней присутствует CuCO3 и Cu(OH)2, а также различные сернистые медные соединения. Последние образовываются из-за того, что в воздухе практически всегда есть некоторое количество сероводорода и сернистого газа. Указанную зеленоватую пленку именуют патиной.
Она защищает от разрушения металл.
Если медь нагреть на воздухе, начнутся процессы окисления ее поверхности. При температурах от 375 до 1100 градусов в результате окисления образуется двухслойная окалина, а при температуре до 375 градусов – оксид меди. При обычной же температуре обычно наблюдается соединение Cu с влажным хлором (итог такой реакции – появление хлорида).
С иными элементами группы галогенов медь также взаимодействует достаточно легко. В парах серы она загорается, высокий уровень сродства она имеет и к селену.
Зато с углеродом, азотом и водородом Сu не соединяется даже при повышенных температурах.
При контакте оксида меди с серной кислотой (разбавленной) получается сульфат и чистая медь, с иодоводородной и бромоидоводородной кислотой – иодид и бромид меди соответственно.
Если же оксид соединить с той или иной щелочью, результатом химической реакции станет появление купрата. А вот самые известные восстановители (оксид углерода, аммиак, метан и другие) способны восстановить купрум до свободного состояния.
Практический интерес представляет способность этого металла вступать в реакцию с солями железа (в виде раствора). В этом случае фиксируется восстановление железа и переход Cu в раствор. Данная реакция применяется для снятия с декоративных изделий напыленного слой меди.
В одно- и двухвалентных формах медь способна создавать комплексные соединения с высоким показателем устойчивости. К таким соединениям относят аммиачные смеси (они представляют интерес для промышленных предприятий) и двойные соли.
Главная сфера применения алюминия и меди известна, пожалуй, всем. Из них делают разнообразные кабели, в том числе и силовые. Способствует этому малое сопротивление алюминия и купрума, их особые магнитные возможности.
В обмотках электрических приводов и в трансформаторах (силовых) широко используются медные провода, которые характеризуются уникальной чистотой меди, являющейся исходным сырьем для их выпуска.
Если в такое чистейшее сырье добавить всего лишь 0,02 процента алюминия, электропроводимость изделия уменьшится процентов 8–10.
Сu, имеющий высокую плотность и прочность, а также малый вес, прекрасно поддается механической обработке.
Это позволяет производить отличные медные трубы, которые демонстрируют свои высокие эксплуатационные характеристики в системах подачи газа, отопления, воды.
Во многих европейских государствах именно медные трубы используются в подавляющем большинстве случаев для обустройства внутренних инженерных сетей жилых и административных строений.
Мы много сказали об электропроводимости алюминия и меди. Не забудем и об отличной теплопроводности последней. Данная характеристика дает возможность использовать медь в следующих конструкциях:
- в тепловых трубках;
- в кулерах персональных компьютеров;
- в отопительных системах и системах охлаждения воздуха;
- в теплообменниках и многих других устройствах, отводящих тепло.
Плотность и небольшой вес медных материалов и сплавов обусловили и их широкое применение в архитектуре.
Понятно, что плотность меди, ее вес и всевозможные химические и магнитные показатели, по большому счету, мало интересуют обычного человека. А вот целебные свойства меди хотят узнать многие.
Древние индийцы применяли медь для лечения органов зрения и различных недугов кожных покровов. Древние греки излечивали медными пластинками язвы, сильную отечность, синяки и ушибы, а также и более серьезные болезни (воспаления миндалин, врожденную и приобретенную глухоту). А на востоке медный красный порошок, растворенный в воде, применялся для восстановления сломанных костей ног и рук.
Лечебные свойства меди были хорошо известны и россиянам. Наши предки излечивали с помощью этого уникального металла холеру, эпилепсию, полиартриты и радикулиты. В настоящее время для лечения обычно используются медные пластинки, которые накладываются на специальные точки на теле человека. Целебные свойства меди при такой терапии проявляются в следующем:
- защитный потенциал организма человека возрастает;
- инфекционные болезни не страшны тем, кто лечится медью;
- наблюдается снижение болевых ощущений и снятие воспалительных явлений.
Источник: http://tutmet.ru/med-lechebnye-himicheskie-svojstva-plotnost-jelektroprovodnost.html
Медь

Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы.
Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления.
Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
СТРУКТУРА
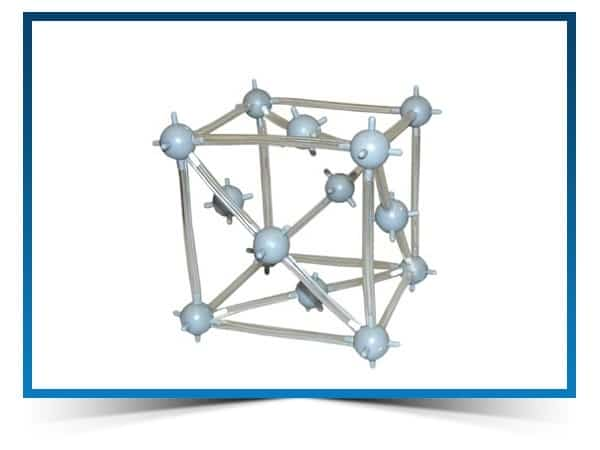
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура — кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12.
Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов.
Поверхность часто покрыта плёнками «медной зелени» (малахит), «медной сини» (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА

Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов.
Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света.
Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Запасы и добыча

Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Медь получают из медных руд и минералов.
Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2.
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
ПРОИСХОЖДЕНИЕ

Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн.
Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.
Наиболее известные месторождения самородной меди — Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
Источник: http://mineralpro.ru/minerals/copper/
Применение меди
Медь находится на втором месте по популярности среди всех цветных металлов. Основной источник получения меди – это медная руда, которую добывают в многочисленных месторождениях сланца и песчаника. Чистый металл имеет красно-розовый цвет и характеризуется высокими показателями тепло- и электропроводности. К примеру, по уровню теплопроводности она лучше железа в 6 раз.
Область применения меди
Как в форме чистого металла, так и в сочетании со сплавами медь применяется в разных промышленных областях.Ее свойства позволяют активно применять этот металл электротехники. Свыше 50% добытого металла используется для производства всевозможных электроприборов и электропередач.
Высокие показатели электро- и теплопроводности обуславливают широкое использование меди в строительной отрасли. Как известно, металл отличается устойчивостью к отрицательному действию коррозии и ультрафиолетовых лучей, также не деформируется в условиях резких колебаний температурного режима.
Самым популярным продуктом из меди являются провода. Для их изготовления применяется максимально чистый металл, потому что дополнительные примеси в значительной степени уменьшают показатель токопроводимости.
К примеру, если в готовом продукте будет присутствовать свыше 0,02% алюминия, то способность продукта проводить ток падает на 10%.
Такую проволоку применяют в:
- электротехнике
- электроэнергетике
- автомобилестроении
- судостроении
- производстве кабеля и проводов.
Высокий показатель теплопроводности меди позволяет использовать ее в различных теплообменниках и теплоотводных приборах. Именно из меди создают кулера для системных блоков, радиаторы отопления, трубы, кондиционеры и другие механизмы. Несмотря на довольно высокую стоимость медных труб, их достоинства неоспоримы:
- не боятся ультрафиолетового излучения
- устойчивы к образованию коррозии
- не реагируют на температурные перепады. Поэтому монтаж можно проводить даже в условиях низких температур воздуха.
Вследствие высокого показателя механической прочности, а также возможности механической обработки специалисты создают бесшовные медные трубы, имеющие круглое сечение.
Они предназначены для транспортировки жидких веществ или газов в системах газо- и водоснабжения, кондиционирования и отопления.Пожалуй, самым первым материалом, из которого сделали кровельное покрытие, была медь.
Такой вариант кровли характеризуется долгим периодом эксплуатации — около 200 лет. Через определенное время кровля из меди окисляется, вследствие чего формируется пленка патины. Она защищает
поверхность меди от неблагоприятного действия ультрафиолета, низкой температуры, влажности и других погодных явлений.
Сплавы меди и их применение
Медь и ее сплавы широко используются в процессе возведения линий электропередач и устройств разного типа связи. Сплавы применяют в электромашиностроительной отрасти, в создании разных приборов, при изготовлении холодильников, вакуум-аппаратов.
Примерно половина всей меди используется на нужды электропромышленности. На базе меди получено огромное количество сплавов с разными металлами, например, Zn, Sn, Al, Be, Ni, Mn, Pb, Ti, Ag, Au.
Существуют сплавы и с неметаллами, например, с фосфором, серой, кислородом и другими.

- оловянные. Содержат от 4 до 33 % Sn
- свинцовые. В них содержится примерно 30 % Pb
- алюминиевые. Содержат от 5 до 11 % Al
- кремниевые. В таких сплавах присутствует 4-5 % Si
- сурьмяные бронзы, которые востребованы в производстве подшипников, теплообменников и прочих материалов в виде листа, прутков и труб для химической, бумажной и пищевой промышленности.
Разные сплавы меди с хромом, а также вольфрамовый порошковый сплав применяются для изготовления электродов и электроконтактов. Сложно представить себе химическую промышленность и машиностроение без латуни — сплава меди с цинком (до 50 % Zn). Чаще всего в небольших количествах тут присутствуют и другие элементы, например, Al, Si, Ni, Mn. Сплавы меди с фосфором (6-8 %) применяют как припои.
Использование меди в медицине
Применение меди в медицинской отрасли можно встретить довольно часто. Согласно нормам традиционной медицины — медь это крайне важный элемент жизнедеятельности человека. В нашем организме медь присутствует в объеме 2*10-4 % от общего веса человека.
Каждый день вместе с пищей мы употребляем примерно 60 мг меди, однако усваивается лишь 2 мг, но именно это количество и является суточной нормой для взрослого человека. Медь крайне важна в процессе биосинтеза гемоглобина, а также в поддержании уровня сахара, холестерина и мочевой кислоты.
Чтобы сердечно-сосудистая система, головной мозг, пищеварительный тракт работали как положено, необходима медь. При хроническом недостатке меди в организме человека развиваются следующие болезни:
- анемия
- остеопороз
- глаукома
- псориаз
- атрофируется сердечная мышца
- человек быстро устает, теряет вес
- в организме накапливается холестерин.
Самыми богатыми продуктами, содержащими медь, являются:
- шампиньоны
- картофель
- печень трески
- цельное зерно
- устрицы и каракатицы.
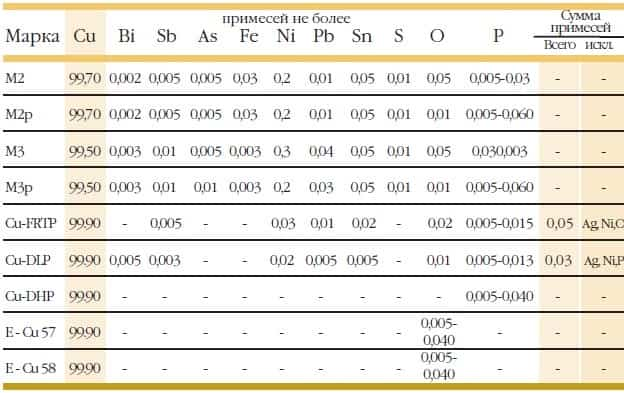
Применение и маркировка меди
Чтобы выяснить конкретный состав, по классификации ГОСТ 859-2001, имеется особая таблица с характеристиками и маркировками.
Наиболее востребованной является катодная медь или медные полуфабрикаты, другими словами катанка, прокат, слитки и предметы из медных сплавов.
Особенности и сфера использования металла, по данным таблицы ГОСТ 859-2001, определяются согласно процентному содержанию разных примесей. Разные марки меди содержат от 10 до 50 разных примесей. Чаще всего наблюдается разделение на две группы:
- сплав, в котором содержится минимальное количество кислорода (до 0,011 %). Этот сплав имеет высокую чистоту. Обозначение по ГОСТ 859-2001 – М00, М01, медь М3. Применяются главным образом для создания токопроводников или сплавов высокой степени чистоты
- рафинированный металл, в котором содержится примесь фосфора для общего применения. Обозначения по ГОСТ 859-2001 – М1ф, М2р, М3р. Из такого металла создают трубы, горячекатаные и холоднокатаные листы, фольга.
- М0, М00 – применяется для создания электропроводников и изделий высокой частоты. Они делаются только под заказ и отличаются более высокой стоимостью
- М001б, М001бф – из них делают медную проволоку небольшого сечения, электрические шины, проводку
- медь М1 (М1р, М1ре, М1ф) – это отличные проводники тока, прокатные материалы и высококачественные бронзы, имеющие максимально низкое количество олова. Из такой меди создают прутья и электроды для электрической сварки чугуна и прочих плохо свариваемых металлов
- медь М2 (М2к, М2р). Она подходит для создания изделий для криогенной техники, литого проката для обработки давлением.
- медь М3 (М3р, М3к) применяется в процессе создания прессованных полуфабрикатов и плоского проката. Кроме этого, из нее делают проволоку для электромеханической сварки медных и чугунных предметов.
Соединения меди
Далее рассмотрим наиболее востребованные соединения меди и их применение. Начнем с фунгицидов. Свыше сотни лет они применяются для борьбы с ложномучнисторосяными и несовершенными грибами, которые являются причиной пятнистости вегетативных органов растений.
Фунгициды на основе меди и сегодня являются основными в системе антирезистентной программы к системным фунгицидам.Пестициды, изготовленные на основе меди, очень востребованы в целях защиты садов и виноградников от вредителей и болезней. Очень популярен сульфат меди.
Применение это вещества происходит повсеместно и в различных областях. Сульфат меди(II) является наиболее важной солью меди. Он является исходным материалом для синтеза многих веществ. Безводный сульфат меди используют в качестве индикатора влажности.
В лабораторных условиях он отвечает за осушку этанола и ряда других соединений.
Однако, наибольший объем медного купороса CuSO4 расходуется для борьбы с вредителями в сельскохозяйственной отрасли.
Гидроксид меди применение
Гидроксид меди, также ка и сульфат является отличным фунгицидом. Он защищается растения от различных болезней, как грибковых, так и бактериальных. Плюсы использования гидроксида меди:
- широкий перечень инфекций, на которые действует соединение
- можно использовать практически для всех видов растений
- питательные вещества меди обеспечивают долгий срок хранения овощей и фруктов
- низкое содержание меди вследствие насыщения препаратов ионами Cu++
- устойчив к осадкам
- не оказывает негативного действия на природу
- невысокая стоимость.
Оксид меди применение
Оксид меди — CuO очень востребован в процессе изготовления стекла и эмалей. Он придает готовым изделиям зелёный и синий оттенок. Также оксид меди незаменим в производстве медно-рубинового стекла.
В лабораторных условиях он используется для выявления восстановительных качеств различных соединений. Вещество способно восстановить оксид до металлической меди.
При этом наблюдается переход чёрного цвета оксида меди в розовый оттенок меди.
Источник: http://mining-prom.ru/cvetmet/med/96/
Физические и химические свойства меди
Свойства меди, которая в природе встречается и в виде достаточно крупных самородков, люди изучили еще в древние времена, когда из этого металла и его сплавов делали посуду, оружие, украшения, различные изделия бытового назначения.
Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки.
Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь.
Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.
э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет.
Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения. При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К. Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот. Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.
Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.
Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным.
Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения.
Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности. Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
Химические свойства
Химические свойства меди определяются тем, какое положение она занимает в таблице Менделеева, где она имеет порядковый номер 29 и располагается в четвертом периоде. Что примечательно, она находится в одной группе с благородными металлами. Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.
В условиях невысокой влажности медь практически не проявляет химическую активность. Все меняется, если изделие поместить в условия, характеризующиеся высокой влажностью и повышенным содержанием углекислого газа.
В таких условиях начинается активное окисление меди: на ее поверхности формируется зеленоватая пленка, состоящая из CuCO3, Cu(OH)2 и различных сернистых соединений.
Такая пленка, которая называется патиной, выполняет важную функцию защиты металла от дальнейшего разрушения.
Окисление начинает активно происходить и тогда, когда изделие подвергается нагреву. Если металл нагреть до температуры 375 градусов, то на его поверхности формируется оксид меди, если выше (375-1100 градусов) — то двухслойная окалина.
Медь достаточно легко реагирует с элементами, которые входят в группу галогенов. Если металл поместить в пары серы, то он воспламенится. Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Внимание заслуживает взаимодействие оксида меди с различными веществами. Так, при его взаимодействии с серной кислотой образуется сульфат и чистая медь, с бромоводородной и иодоводородной кислотой — бромид и иодид меди.
Иначе выглядят реакции оксида меди с щелочами, в результате которых образуется купрат. Получение меди, при котором металл восстанавливается до свободного состояния, осуществляют при помощи оксида углерода, аммиака, метана и других материалов.
Медь при взаимодействии с раствором солей железа переходит в раствор, при этом железо восстанавливается. Такая реакция используется для того, чтобы снять напыленный медный слой с различных изделий.
Одно- и двухвалентная медь способна создавать комплексные соединения, отличающиеся высокой устойчивостью. Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции. Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами.
Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой.
Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара. Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.
Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло. Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Металлические конструкции, в которых использованы медные элементы, отличаются не только небольшим весом, но и исключительной декоративностью. Именно это послужило причиной их активного использования в архитектуре, а также для создания различных интерьерных элементов.
Шина электротехническая медная
Источник: http://met-all.org/cvetmet-splavy/med/fizicheskie-i-himicheskie-svojstva-medi.html
1.2 Свойства меди и области её применения
В периодической системе элементов
Д.И.Менделеева медь расположена в I
группе 4-го периода, её порядковый номер
29. Атомная масса 63,54. Как элемент первой
группы медь одновалентна.
В этом состоянии
она широко представлена в рудных
минералах, штейнах, шлаках и других
продуктах пирометаллургии.
В продуктах
их окисления в природе и в технологических
процессах более устойчивым является
двухвалентное состояние.
Температура плавления меди 10830С. Температура кипения – 23250С.
Медь – мягкий, вязкий и ковкий металл
красного цвета, легко поддается
механической обработке. Легко прокатывается
в тонкие листы и вытягивается в проволоку.
Важнейшее свойство — электропроводность
(уступает только серебру). Примеси
снижают электропроводность, поэтому в
электротехнике применяют медь высокой
степени чистоты.
-
Также медь отличается высокой
теплопроводностью. -
В химическом отношении медь малоактивна,
хотя может непосредственно соединяться
с кислородом, серой, галогенами и
некоторыми другими элементами. -
При обычной температуре и сухом воздухе
медь остается инертной, но во влажном
воздухе, содержащем СО2, медь
окисляется и покрывается защитной
пленкой основного карбоната СuCO3·Cu(OH)2,
являющегося ядовитым веществом.
В растворах соляной и серной кислот в
отсутствии окислителя медь не растворяется.
В кислотах, одновременно являющихся
окислителями (азотная или горячая
концентрированная серная), медь
растворяется легко.
При высоких температурах в
пирометаллургических процессах
устойчивыми соединениями меди являются
Cu2O и Cu2S.
Медь и её сульфид Cu2S являются
хорошими коллекторами (растворителями)
золота и серебра, что делает возможным
их высокое попутное извлечение при
производстве меди.
Важное свойство меди – образовывать
сплавы с другими металлами. Это бронзы
(Cu + Sn), латуни (Cu + Zn) медно-никелевые
сплавы.
В современных бронзах в качестве присадок
используют алюминий, кремний, бериллий,
свинец. Применяются эти бронзы для
изготовления ответственных деталей и
литых изделий.
Например, бериллиевые бронзы (2% Ве) по
механическим свойствам превосходят
многие сорта стали и имеют хорошую
электропроводность. Алюминиевые бронзы
(5-10% Al) очень прочны и идут на изготовление
авиационных двигателей.
В специальные латуни, кроме цинка,
добавляют алюминий, железо, кремний,
никель. Латуни идут на изготовление
радиаторов, труб, гибких шлангов,
патронных гильз, художественных изделий.
Из медно-никелевых сплавов наиболее
известны мельхиор (применяется в
кораблестроении, т.к. устойчив к
воздействию морской воды) и нейзильбер
– стоек в растворах солей и органических
кислот (изготавливают медицинские
инструменты).
Около 50% всей меди использует
электропромышленность. Также медь
используется в машиностроении, ракетной
технике, при производстве строительных
материалов, в транспорте, химической
промышленности, сельском хозяйстве.
1.3 Сырье для получения меди
Кларк меди, т.е. её содержание в земной
коре, равен 0,01%. Однако она образует
многочисленные месторождения. Характерным
для меди является наличие в природе
всех 4-х типов руд. Однако основным медным
сырьем являются сульфидные руды. Из
сульфидных руд в настоящее время
выплавляют 85-90% всей первичной меди.
В России медные руды добывают на Урале
– Кировград, Красноуральск, Медногорск,
Гай и др., в Заполярье – на Кольском
полуострове и на Таймыре.
Источниками получения меди являются
руды, продукты их обогащения — концентраты
— и вторичное сырье. На долю вторичного
сырья в настоящее время приходится
около 40 % от общего выпуска меди.
Медные руды практически полностью
относятся к полиметаллическим.
Монометаллических руд меди в природе
нет. Ценными спутниками меди в рудном
сырье являются около 30 элементов.
Важнейшие из них: цинк, свинец, никель,
кобальт, золото, серебро, металлы
платиновой группы, сера, селен, теллур,
кадмий, германий, рений, индий, таллий,
молибден, железо.
Известно более 250 медных минералов.
Большинство из них встречаются редко.
Наибольшее промышленное значение имеет
небольшая группа минералов, состав
которых приведен в таблице 2.
Таблица 2 – Промышленные медные минералы
| минерал | химическаяформула | содержание меди,% |
| Сульфидные минералы | ||
| халькопирит | CuFeS2 | 34,5 |
| ковеллин | CuS | 66,4 |
| халькозин | Cu2S | 79,8 |
| борнит | Cu5FeS4 | 63,3 |
| Окисленные минералы | ||
| малахит | CuCO3·Cu(OH)2 | 57,4 |
| азурит | CuCO3· 2Cu(OH)2 | 55,1 |
| куприт | CuO | 88,8 |
| хризоколла | CuSiO3·2H2O | 36,2 |
| самородная медь | Cu, Ag, Au, Fe, Bi и др. | до 100 |
Бóльшая часть медных руд добывается в
настоящее время открытым способом. В
России на долю подземной добычи приходится
около 30%.
В современной практике обычно разрабатывают
руды с содержанием 0,8-1,5% меди, иногда
выше. Но для крупных месторождений
вкрапленных руд минимальное содержание
меди, пригодное для разработки, составляет
0,4-0,5%. Если в породе содержится меньше
указанного количества меди, её переработка
нерентабельна.
Ценность медных руд значительно
повышается из-за наличия в них благородных
металлов и ряда редких – селена, теллура,
рения, висмута и др.
Вследствие низкого содержания меди в
руде и комплексного характера руд сырье
предварительно подвергают флотационному
обогащению.
При обогащении медных руд
основным продуктом являются медные
концентраты, содержащие до 55% Cu (чаще
10-30%). Также получают пиритные концентраты
и концентраты других цветных металлов,
например цинковый.
Флотационные
концентраты представляют собой тонкие
порошки с частицами крупностью 74 мкм и
влажностью 8-10%.
Медные руды и концентраты имеют одинаковый
минералогический состав и отличаются
лишь количественным соотношениями
между различными минералами.
Физико-химические основы их металлургической
переработки совершенно одинаковы.
Источник: https://studfile.net/preview/6331714/page:3/