Каждый класс
веществ образован веществами со сходными свойствами. Эти вещества имеют схожее
строение и состав.
Все неорганические
вещества делят
на простые и сложные. Простые вещества состоят из
атомов одного химического элемента. К простым веществам относятся металлы:
медь, железо, натрий и другие; неметаллы: сера, фосфор, кислород,
хлор; инэртные, или благородные газы: аргон,
криптон, гелий, неон.
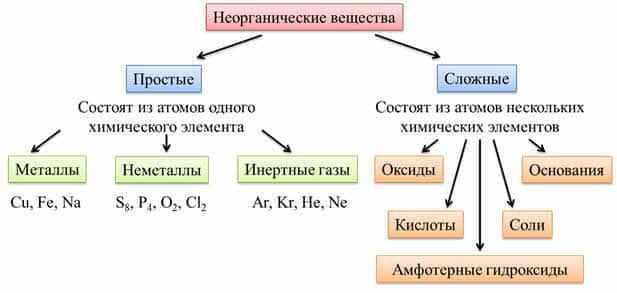
Сложные вещества
состоят из атомов нескольких химических элементов. К сложным
веществам относятся оксиды, основания, амфотэрные
гидроксиды, кислоты и соли.
Оксиды – это
сложные вещества, которые состоят из двух химических элементов, один из которых
кислород. Общая формула оксидов: э-эм-о-эн, где эм и эн – индэксы.
Степень окисления кислорода в оксидах равна минус двум.
Оксиды делят на две группы: солеобразующие
и несолеобразующие (индифферентные).
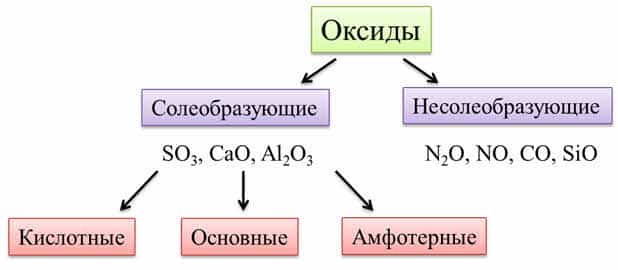
Солеобразующие
оксиды
образуют гидроксиды и соответствующие соли. Например, к солеобразующим оксидам
относятся оксид серы шесть, оксид кальция, оксид алюминия.
Несолеобразующие
оксиды
не образуют гидроксидов и солей. К таким оксидам относятся: оксид азота один,
оксид азота два, оксид углерода два, оксид кремния два.
Оксиды бывают кислотные,
амфотэрные и основные. Кислотным оксидам соответствуют
кислотные гидроксиды, основным оксидам соответствуют основные
гидроксиды.
Например: оксиду
натрия соответствует основный гидроксид – гидроксид натрия, в реакции этого
гидроксида с соляной кислотой образуется соль – хлорид натрия.
Оксиду алюминия
соответствует амфотэрный гидроксид – гидроксид алюминия, этот гидроксид с
азотной кислотой образует соль – нитрат алюминия.
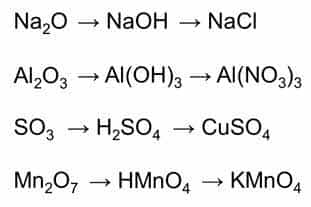
- Оксиду серы шесть
соответствует кислотный гидроксид – серная кислота, эта кислота с гидроксидом
меди два образует соль – сульфат меди два. - Оксиду марганца
семь соответствует кислотный гидроксид – марганцовая кислота, которая в реакции
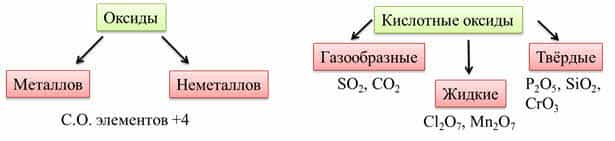
с гидроксидом калия образует соль – перманганат калия. - Кислотные оксиды образованы
элементами металлами и неметаллами со степенью окисления
больше, чем плюс четыре. - Кислотным оксидам
соответствуют кислоты:
оксиду углерода четыре соответствует угольная кислота, оксиду серы шесть
соответствует серная кислота, оксиду фосфора пять соответствует фосфорная
кислота.
Для этих оксидов
характерен ковалентный характер связи между элементами. В основном у кислотных
оксидов молекулярная кристаллическая решётка. Они могут быть газообразными,
жидкими и твёрдыми. Например: оксид серы четыре, оксид углерода
четыре – газы, оксид хлора семь, оксид марганца семь – жидкости, оксид фосфора
пять, оксид кремния четыре, оксид хрома шесть – твёрдые.
Основные оксиды – это
оксиды, гидраты которых являются основаниями. Все основные оксиды являются
оксидами металлов. Например: оксиду натрия соответствует гидроксид
натрия, оксиду кальция соответствует гидроксид кальция, оксиду железа два соответствует
гидроксид железа два.
Амфотэрные оксиды – это оксиды,
которым соответствуют амфотэрные гидроксиды. Все амфотэрные оксиды являются
оксидами металлов. Например: оксид алюминия, оксид хрома три, оксид железа три,
оксид свинца четыре, оксид олова четыре. Так оксиду цинка соответствует амфотэрный
гидроксид – гидроксид цинка, оксиду алюминия соответствует амфотэрный гидроксид
– гидроксид алюминия.
Оксиды широко
распространены в природе. Так, большая часть Земли покрыта Мировым океаном,
который образован оксидом водорода, в атмосфере содержится оксид углерода
четыре; оксид кремния четыре является основой многих минералов и горных пород,
таких как кварц, аметист, яшма; оксид алюминия – корунд, известные и его
разновидности – рубин и сапфир.

Основания – это сложные
вещества, состоящие из катионов металлов и гидроксогруппы. Общая формула оснований
– металл –о-аш.
К основаниям
относятся: гидроксид натрия, гидроксид кальция, гидроксид железа три, гидроксид
калия и другие. Для оснований характерен ионный тип связи, а значит, и ионная
кристаллическая решётка, поэтому основания – это твёрдые вещества.
По числу
гидроксогрупп
различают однокислотные основания (как гидроксид натрия), двухкислотные
(как гидроксид железа два), трёхкислотные (как гидроксид никеля
три).
По растворимости в
воде
различают растворимые в воде основания – щёлочи, которые являются
сильными основаниями. К ним относятся: гидроксид натрия, гидроксид бария и
другие. Нерастворимые в воде основания – это слабые основания. К
ним относятся: гидроксид меди два, гидроксид железа два.
- Щёлочи являются твёрдыми
веществами. - В реакции сульфата
меди два с гидроксидом натрия образуется нерастворимое основание – гидроксид
меди два и соль – сульфат натрия. - При добавлении гидроксида
натрия к сульфату железа два образуется также нерастворимое основание –
гидроксид железа два и соль – хлорид натрия.
Есть основания,
где в составе не ионы металла, а катион аммония. Раствор аммиака используют как
нашатырный спирт, основания используют для штукатурки стен.
- Кислоты – это
сложные вещества, которые состоят из атомов металла и кислотных остатков. - Кислоты могут быть
образованы не только атомами неметаллов, как соляная кислота, сернистая,
азотная кислоты, но и атомами металлов в высшей степени окисления: как например
марганцовая кислота. - По количеству
атомов водорода
(основности) различают одноосновные кислоты (такие как соляная
кислота, азотная), двухосновные (такие как сероводородная, дихромовая
кислоты), трёхосновные (как фосфорная кислота). - По содержанию
атомов кислорода
различают кислородсодержащие кислоты (или оксокислоты), как азотная
кислота, хромовая кислота, так и бескислородные, как сероводородная,
соляная. - По летучести
кислоты
бывают летучие, которые легко испаряются или выветриваются из
раствора: это такие кислоты, как соляная, бромоводородная, азотная,
сероводородная; к нелетучим кислотам относятся серная, фосфорная
кислота и другие.
Кислоты бывают сильные
и слабые. Сильные кислоты практически полностью диссоциируют на
ионы. К таким кислотам относятся: азотная, серная, соляная, хлорная. Слабые
кислоты диссоциируют незначительно, к таким кислотам относятся: сернистая,
сероводородная, фосфорная кислоты.
К кислотам-окислителям
относятся: азотная кислота, серная, то есть в этих кислотах есть
элемент-окислитель. К кислотам-неокислителям относится
большинство кислот, в которых окислителем является ион водорода.
Для кислот
характерен ковалентный тип связи и молекулярная кристаллическая решётка.
При обычных
условиях
кислоты могут быть в газообразном состоянии: как соляная и
сероводородная, в жидком состоянии, как азотная, серная кислоты.
Кислоты могут быть и в твёрдом состоянии, как кремниевая кислота.
- Амфотэрные
гидроксиды
– это сложные вещества, имеющие свойства кислот и оснований, поэтому
формулы амфотэрных гидроксидов можно записать в форме оснований и в форме
кислот.
Их образуют
элементы, проявляющие переходные свойства металлов и неметаллов. Эти соединения
образуют большинство дэ-элементов со степенью окисления плюс три, плюс четыре,
иногда плюс два; эти соединения могут образовывать и пэ-элементы: бериллий,
алюминий, олово, свинец.
К амфотэрным
гидроксидам относятся гидроксид цинка, гидроксид алюминия, гидроксид железа
три, гидроксид бериллия.
Амфотэрные
гидроксиды практически нерастворимы в воде. Например, при растворении хлорида
железа три с гидроксидом натрия образуется бурый осадок – гидроксид железа три.
При растворении
сульфата алюминия с гидроксидом натрия образуется белый осадок – гидроксид
алюминия. Полученные гидроксиды являются амфотэрными гидроксидами.
- Таким образом, к
гидроксидам относятся основания, амфотэрные гидроксиды и
кислородсодержащие кислоты. - Соли – это
сложные вещества, которые состоят из катионов металла или аммония и кислотных
остатков. - Соли бывают средними,
кислыми, основными. - Средние соли – это продукты
полного замещения атомов водорода в кислоте атомами металлов: например,
хлорид калия, нитрат алюминия, сульфат меди два, сульфит натрия.
Кислые соли – это продукты
неполного замещения атомов водорода в молекулах многоосновных кислот атомами
металла. Например: гидрокарбонат натрия, дигидрофосфат калия, гидрофосфат
калия, гидросульфат натрия.
Основные соли – это продукты
неполного замещения гидроксидных групп в молекулах многокислотных оснований
кислотными остатками. Например: гидроксохлорид меди два, дигидроксонитрат
алюминия, гидроксохлорид железа два.
- Для солей
характерен ионный характер связи и ионная кристаллическая решётка, поэтому это
твёрдые вещества. - Соли применяются в
быту: например, перманганат калия используют как дезинфицирующее средство,
широко используют алебастр и побелку, при приготовлении пищи используют поваренную
соль.
Таким образом,
вещества делят на простые и сложные. К простым веществам относятся металлы,
неметаллы, инэртные газы. К сложным веществам относятся оксиды, основания,
амфотэрные гидроксиды, кислоты и соли.
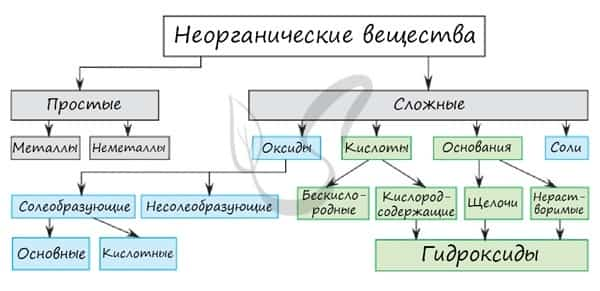
Классификация неорганических веществ
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
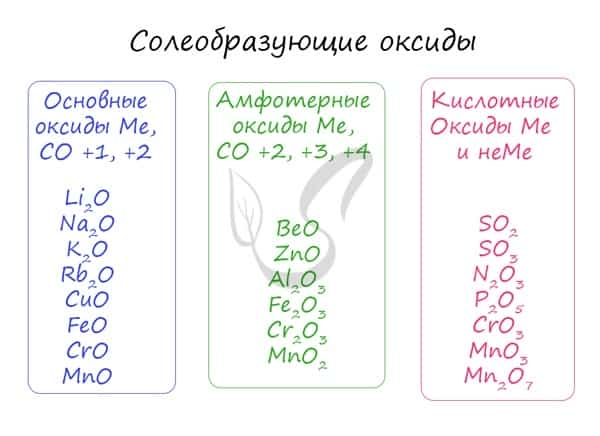
- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
- Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
- SO3 + H2O → H2SO4 (сохраняем СО серы +6)
- SO2 + H2O → H2SO3 (сохраняем СО серы +4)
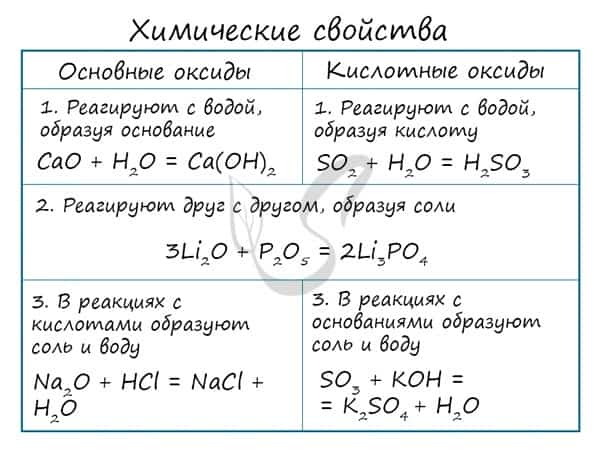
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO. Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют. Li2O + H2O → LiOH (основный оксид + вода → основание) Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль) Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода) Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3. С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами. Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль) ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль) ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции) Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции) 
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7. Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.
- Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
- Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
- FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.
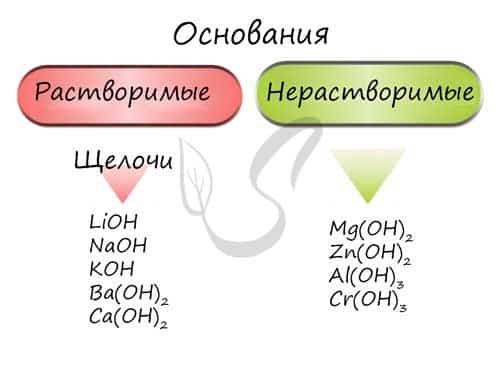
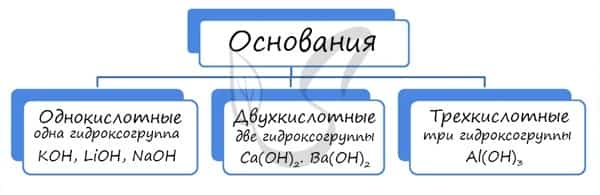
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
- Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
- LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
- KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
- В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли и воды, так и с основаниями — с образованием комплексных солей.
- Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
- Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
- При нагревании до высоких температур комплексные соли не образуются.
- Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
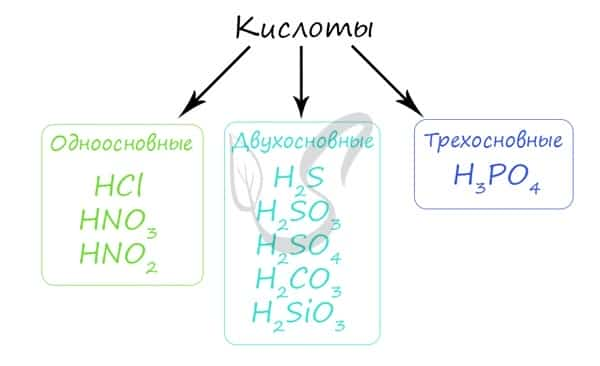
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
- H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
- Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
- Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
- Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде — виде газа и воды.
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
- Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь ?
- K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
- K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4] (тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)
Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода), то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
- Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
- MgCl2 + LiOH → Mg(OH)2↓ + LiCl
- K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
- Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
- KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)
Химия. 11 класс
Изучаемые вещества классифицируют с учётом состава, строения, свойств и других критериев. Основными классами простых веществ являются металлы и неметаллы, сложных — оксиды, кислоты, основания и соли. Их состав, свойства и способы получения вы изучали ранее. В данном параграфе вспомним принципы номенклатуры и классификации веществ (рис. 6).
Неорганические вещества принято делить на классы (рис. 6.1). В каждом из классов объединяют вещества, сходные по составу, строению, свойствам.
Согласно одной из общепринятых классификаций, различают простые (металлы и неметаллы) и сложные вещества. Важнейшими классами сложных неорганических веществ являются оксиды, кислоты, основания и соли.
Как вам известно, основания и кислородсодержащие кислоты имеют общее название — гидроксиды.
§ 3.1
§ 3.2
§ 3.3
§ 3.4
§ 3.5
Металлы — простые твёрдые при комнатной температуре вещества (за исключением жидкой ртути), обладающие пластичностью и теплопроводностью, высокой электропроводностью. Полированные поверхности металлов всегда блестящие.
Неметаллы — простые твёрдые, жидкие или газообразные при комнатной температуре вещества. В твёрдом состоянии они, как правило, непластичные или даже хрупкие, плохо проводят тепло и электрический ток.
Оксиды — сложные вещества, состоящие из двух элементов, один из которых кислород (ЭхОу).
Оксиды металлов при нормальных условиях — твёрдые вещества. Оксиды неметаллов при этих же условиях могут быть в твёрдом, жидком и газообразном состояниях.
Кислород в оксидах проявляет степень окисления –2: (оксид углерода(IV), (оксид кальция).
Напомним: если атомы элемента могут существовать в разных положительных степенях окисления, эту степень в названиях или формулах оксидов, оснований, солей указывают римскими цифрами. Их ставят в скобках после названия соответствующего элемента, например: оксид железа(III), гидроксид железа(II), хлорид железа(II).
Различают солеобразующие (кислотные, амфотерные, осно́вные) и несолеобразующие оксиды (рис. 7).
К кислотным относятся оксиды, которым соответствуют кислоты. Кислотные оксиды реагируют со щелочами с образованием соли и воды:
Кислотным оксидам соответствуют кислородсодержащие кислоты: оксиду соответствует кислота (степени окисления углерода одинаковы в оксиде и кислоте).
К осно́вным относятся оксиды, которым соответствуют основания. Основные оксиды реагируют с кислотами с образованием соли и воды:
Основным оксидам соответствуют основания. Например, оксиду соответствует основание .
Амфотерные оксиды реагируют и с кислотами, и со щелочами:
- (при сплавлении).
- Реакции амфотерных оксидов со щелочами могут протекать не только при сплавлении, но и в растворе:
Соединение относят к классу комплексных соединений. Дополнительные сведения о таких соединениях приведены в конце данного параграфа, а также в материале о свойствах амфотерных оксидов и гидроксидов в главе II и металлов в главе VII.
- К несолеобразующим оксидам относят При комнатной температуре они не реагируют ни с кислотами, ни со щелочами.
- Кислотами называют сложные вещества, содержащие атомы водорода и кислотные остатки, причём атомы водорода способны замещаться атомами металлов.
- Кислоты также определяют как электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только катионы водорода H+:
- В таблицах 1 и 2 приведён состав и дана классификация кислот по различным признакам.
- Таблица 1. Названия некоторых кислот и их солей
| Бескислородные кислоты | Кислородсодержащие кислоты(гидроксиды) | ||||
| Химическая формула | Название кислоты | Название соли | Химическая формула | Название кислоты | Название соли |
| HI | Йодоводородная | Йодид | HNO3 | Азотная | Нитрат |
| HBr | Бромоводородная | Бромид | HNO2 | Азотистая | Нитрит |
| HCl | Хлороводородная | Хлорид | Н2SO4 | Серная | Сульфат |
| HF | Фтороводородная | Фторид | H2SO3 | Сернистая | Сульфит |
| H2S | Сероводородная | Сульфид | H3PO4 | Фосфорная | Фосфат |
| H2CO3 | Угольная | Карбонат | |||
| Н2SiO3 | Кремниевая | Силикат | |||
| НСlO4 | Хлорная | Хлорная |
Таблица 2. Классификация кислот
| Признак классификации | Классификационные группы | Примеры |
| По происхождению | Неорганические (минеральные) | НCl, H2SO4, HNO3 |
| Органические (карбоновые) | HCOOH, CH3COOH, C17H35COOH | |
| По наличию атомов кислорода | Кислородсодержащие | H3PO4, H2SO4, H2CO3 |
| Бескислородные | HCl, H2S, HF | |
| По числу атомов водорода, способных замещаться атомами металлов | Одноосно́вные | HNO3, HF, НCl, CH3COOH |
| Многоосно́вные (двухосно́вные, трёхосно́вные) | H2SO4, H2SO3, H2CO3, H3PO4 | |
| По силе (способности диссоциировать на ионы в водном растворе) | Сильные | H2SO4, HNO3, НCl, HClO4 |
| Слабые | H2S, H2SiO3, CH3COOH |
- Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп ОН: гидроксид натрия NaOH, гидроксид железа(II) Fe(OH)2.
- Основания — это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы ОН–:
- Все основания реагируют с кислотами, образуя соль и воду (реакция нейтрализации):
- В основе классификации оснований лежат следующие признаки.
1. Число групп ОН. По числу групп ОН, приходящихся на один атом металла, различают однокислотные (NaOH, KOH, LiOH) и многокислотные (Mg(OH)2, Ca(OH)2, Fe(OH)2) основания.
2. Растворимость в воде. Гидроксиды металлов — твёрдые вещества. Водный раствор аммиака — гидрат аммиака (NH3 · H2O) — также обладает основными свойствами и диссоциирует с образованием гидроксид-ионов.
Для того чтобы подчеркнуть это свойство, формулу гидрата аммиака часто записывают в привычном для оснований виде — NH4OH. По растворимости в воде неорганические основания делят на растворимые (щёлочи) и нерастворимые.
Щёлочи — это растворимые в воде основания. К щелочам относят растворимые гидроксиды всех элементов IА-группы и щёлочноземельных металлов: стронция, бария, радия, включая малорастворимый гидроксид кальция.
- Амфотерные гидроксиды Zn(OH)2, Be(OH)2, Al(OH)3, подобно соответствующим им оксидам, реагируют как с кислотами, так и со щелочами. Взаимодействие со щелочами возможно в расплавах и растворах:
- (сплавление);
- (раствор).
- Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
- С точки зрения теории электролитической диссоциации солями называют сложные вещества, при диссоциации которых образуются катионы металлов и анионы кислотных остатков:
- К солям относят также соединения, содержащие ион аммония и кислотный остаток (хлорид аммония NH4Cl, сульфат аммония (NH4)2SO4 и др.)
В основе систематических названий солей лежат названия кислотного остатка и металла с указанием в скобках римскими цифрами степени окисления атомов металла, если она может иметь разные значения. Например, MgSO4 — сульфат магния, FeCl2 — хлорид железа(II), Fe2(SO4)3 — сульфат железа(III).
В зависимости от полноты замещения атомов водорода в кислотах различают средние и кислые соли.
Кислые соли могут образовывать многоосно́вные кислоты (Н2SO4, Н2СO3, Н2S, Н3РO4) при частичном замещении атомов водорода в их молекулах. Наличие в составе кислой соли атомов водорода отражается в названии, например NaHCO3 — гидрокарбонат натрия (питьевая сода), Са(НСО3)2 — гидрокарбонат кальция, NaH2PO4 — дигидрофосфат натрия, NaHSO4 — гидроcульфат натрия.
На следующей схеме показана возможность полного и неполного замещения.
При неполном замещении гидроксогрупп в основании на кислотные остатки образуются осно́вные соли. В качестве примера основных солей можно привести Al(OH)2NO3. Эту соль можно рассматривать как продукт замещения одной группы ОН в основании Al(OH)3 на кислотный остаток .
Отдельную группу солей образуют так называемые комплексные соединения. В курсе химии 11-го класса вы встретитесь с некоторыми из таких соединений: Na2[Zn(OH)4] — тетрагидроксоцинкат натрия, K3[Al(OH)6] — гексагидроксоалюминат калия. Они содержат комплексные ионы, которые в химических формулах заключают в квадратные скобки.
Соли, в состав которых входят молекулы воды, называют кристаллогидратами, а вода — кристаллизационной: FeSO4 · 7H2O (железный купорос, или гептагидрат сульфата железа(II)), Na2SO4 · 10H2O (глауберова соль, или декагидрат сульфата натрия).
Из курса органической химии вам известны соли карбоновых кислот (ацетат натрия СН3СООNa, стеарат калия C17H35COOK) и соли аминов (хлорид метиламмония СН3NH3Cl, гидросульфат фениламмония С6Н5NH3HSO4).
Классификация неорганических веществ. Металлы. Неметаллы
⇐ ПредыдущаяСтр 20 из 44Следующая ⇒
Неорганические вещества по составу делят на простые и сложные.
Простые вещества состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом.
Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гндроксиды, соли.
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (—2),
Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобрадующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды, кислоты соответственно.
Основания— это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-ОН).
Общая формула оснований: М(ОНу, где у — число гидроксогрупп, равное степени окислении металла М (как правило, +1 и +2). Основания делятся на растворимые (щелочи) и нерастворимые (подробнее в § 21).
Кислоты — это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Общая формула кислот: НхАс, где Ас — кислотный остаток (от английского «acid» — кислота), х — число атомов водорода, равное заряду иона кислотного остатка (подробнее см. § 20).
Амфотерные гидроксиды— это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме кислот, и в форме оснований (см. также § 22).
Соли — это сложные вещества, состоящие из катионов металла и анионов кислотных остатков. Такое определение относится к средним солям.
- Средние соли— это продукты полного замещения ато мое водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
- Кислыесоли— это продукты неполного замещения атомов водорода в молекулах мноеоосновных кислот атомами металла.
- Основные соли— это продукты неполно/о замещения гидрокеогрупп в многокислотных основаниях кислотны ми остатками.
- Помимо средних, кислых, основных солей вы встречались с солями более сложного строения.
В периодической системе элементы, которые в виде простых в-в проявляют св-ва металлов, находятся в I, II, III (кроме бора) группах, в побочных подгруппах всех групп. Металлы по численности превосходят неметаллы.
От периода к периоду число металлов, составляющих главные подгруппы, увеличивается. Это связано с тем, что от периода к периоду радиус атома , как правило, увеличивается, поэтому внешние электроны становятся более свободными.
Это в значительной мере и определяет, будет элемент металлом или нет. Например, во втором периоде имеется только два металла – литий и бериллий; в состав третьего периода входит три металла – натрий, магний, алюминий.
Эту закономерность среди элементов главных подгрупп можно продолжить.
Особенностью строения атомов металлов является небольшое число электронов во внешнем электронном слое, как правило, не превышающее трёх. Все элементы побочных подгрупп – металлы, они имеют на внешнем слое, как правило, 1-2 электрона, это во многом определяет их св-ва.
Атомы металлов, имеющие обычно большие радиусы и малое число электронов во внешнем электронном слое, находятся в главных подгруппах I и II групп. Они наиболее активны, т.е.их атомы легко отдают электроны и являются хорошими восстановителями. В качестве примера можно привести схему строения (электронные формулы) некоторых металлов.
11Na 2, 8, 1; 19K 2, 8, 8, 1; 20Ca 2, 8, 8, 2
1s22s22p63s1 1s22s22p63s23p63s1 1s22s22p63s23p63s2
Итак, строение атомов металлов определяет их св-ва как восстановителей. (Восстановители – это элементы, повышающие его степень окисления в процессе р-ции. Это происходит вследствие отдачи электронов окислителями.)
- Восстановительные св-ва металлов проявляются в р-циях: а) с неметаллами; б) с кислотами; в) с водой; г) с солями.
- а) Многие металлы реагируют с галогенами, кислородом, серой и другими простыми веществами-неметаллами.
- 2Ca + O2 = 2CaO
- Cu + Cl2=CuCl2
- Fe + S = FeS
- б) Металлы, стоящие в ряду напряжений до водорода, реагируют с растворами соляной и серной кислот с выделением водорода. В этих р-циях металлы выступают как восстановители, а ион водорода как окислитель:
- Zn + 2HCl = ZnCl2 + H2
- Mg + H2SO4(p-p) = MgSO4 + H2
- в) Реакция с водой, приводящая к образованию щелочи, характерна для щелочных металлов, кальция, бария и других металлов, основания которых растворимы в воде:
- 2Na +2H2O =2NaOH + H2
- Ca + 2H2O = Ca(OH)2 + H2
- г) В р-цию замещения с солями металлы вступают в соответствии с рядом напряжений.
- Fe + CuCl2 =Cu + FeCl2
- В этих р-циях восстановителем является вступающий в реакцию, а окислителем – катион, который входит в состав соли.
Реакции металлов как с простыми, так и со сложными в-вами относятся к о.-в. р-циям. Их сущность можно выразить в общем виде:
Ме –n.е = Ме n+
В таблице ПС хим элементов неметаллы находятся в главных подгруппах VI, V, IV групп, бор принадлежит III группе.
К неметаллам также относят и особое семейство инертных элементов VIII группы. В виде простых в-в они называются газами, состоят из одиночных атомов, находятся в воздухе.
В соответствии с периодическим законом в периоде от элемент к элементу неметаллические св-ва усиливаются; в группе же по мере увеличения порядкового номера атомов наблюдается ослабление неметаллических св-в элементов.
В связи с этим от периода к периоду число неметаллов сокращается.
Эта закономерность объясняется тем, что радиус атома увеличивается, внешние электроны становятся более свободными, что в значительной мере и определяет, будет элемент металлом или нет.
- На внешнем электронном слое у неметаллов находиться от 3-х до 8-ми электронов. Например, у бора на внешнем электронном слое находится три электрона:
- у углерода – четыре:
- И так от группы к группе число внешних электронов увеличивается вплоть до 8-ми у неона:
Т.о., номер группы равен числу электронов, находящихся на внешнем электронном слое. Это определяет и значение высшей степени окисления элементов. Так у бора она равна+3, у углерода — +4 и т.д.
В одном и том же периоде по мере увеличения порядковых (атомных) номеров увеличиваются заряды атомных ядер, число электронов на внешнем слое.
Число электронных слоёв в атомах остаётся постоянным, а радиус атома уменьшается за счёт притяжения электронов к ядрам, заряд которых возрастает.
- Сравним строение атомов подгруппы кислорода: 8О 2,6(1s22s22p4);
- 16S 2,8,6,(1s22s22p63s23p4).
- Вывод: у металлов одной и той же подгруппы по мере увеличения порядковых номеров увеличиваются заряды атомных ядер, число электронных слоёв в атомах, радиус атома за счёт увеличения электронных слоёв: остаётся постоянным число электронов на внешнем слое атомов.
Усиление неметаллических св-в у элементов происходит закономерно в зависимости от способности атомов принимать электроны от других атомов. Таких возможностей больше у тех элементов, у которых больше заряд атомного ядра, больше электронов во внешнем слое и меньше радиус атома.
Это подтверждает изменение о.-в. св-в простых в-в, образованных химическими элементами подгруппы кислорода.
В подгруппе по мере увеличения атомного номера происходит уменьшение электроотрицательности элементов.
Атомы кислорода и серы, как простых веществ-окислителей могут принимать два электрона от других атомов, при этом их внешний электронный слой будет завершенным, таким же, как у инертного газа неона.
Нет (кроме F фтора) более сильного окислителя, чем кислород. В качестве окислителя он выступает в реакциях с металлами, неметаллами и сложными в-вами.
Степень окисления кислорода уменьшается от 0 до -2.
Сера тоже окислитель, но менее сильный, чем кислород. У неё электроотрицательность атомов существенно меньше, чем у кислорода, поэтому для этого элемента характерен больший разброс значений степеней окисления (-2, 0, +4, +6).
Доверь свою работу кандидату наук!
Дата добавления: 2015-04-21; просмотров: 26; Нарушение авторских прав
⇐ Предыдущая15161718192021222324Следующая ⇒






