- Радиус атома
- Период, группа и электронная конфигурация
- Длина связи
- Металлические и неметаллические свойства
- Основные и кислотные свойства
- Восстановительные и окислительные свойства
- Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
- Высшие оксиды и летучие водородные соединения (ЛВС)
- Периодический закон
- 1. Периодическая система химических элементов Д.И. Менделеева
- 2. Радиус атома
- Изменение металлических и неметаллических свойств в таблице Менделеева
- Что такое металлические и неметаллические свойства
- Как изменяются металлические свойства в периодической системе
- Как изменяются неметаллические свойства в периодической системе
- Видео
- Самая удобная и увлекательная подготовка к ЕГЭ
- Общая характеристика металлов главных подгрупп I±III групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
- Химические элементы — металлы
- Характеристика переходных элементов ± меди, цинка, хрома, железа по их положению в Периодической системе химических элементов Д. И. Менделеева и особенностям строения их атомов
- Общая характеристика неметаллов главных подгрупп IV±VII групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
- Химические элементы – неметаллы
- Свойства атомов элементов – неметаллов
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
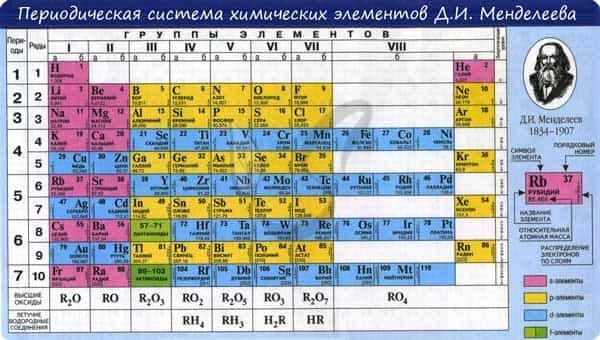
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
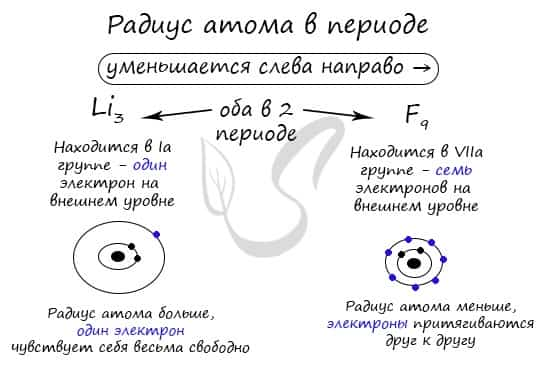
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
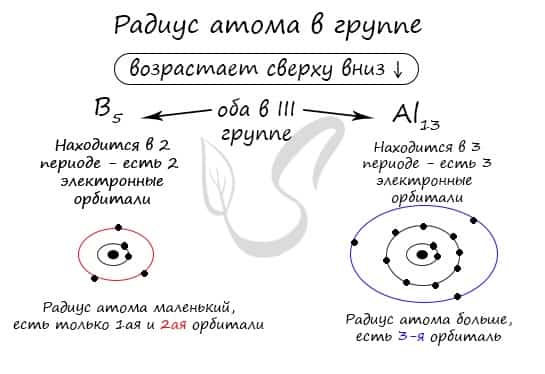
В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1, индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже ?
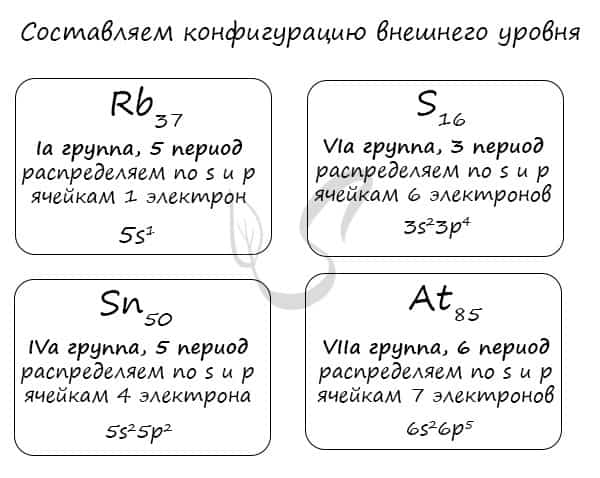
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
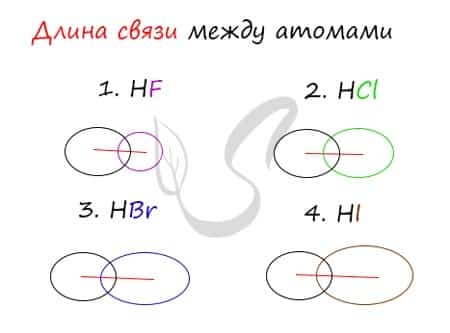
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
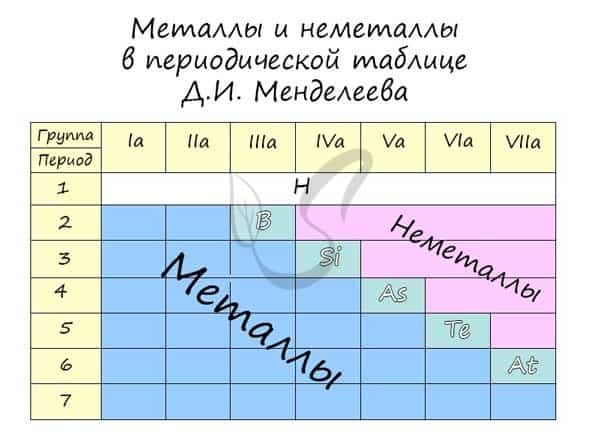
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.
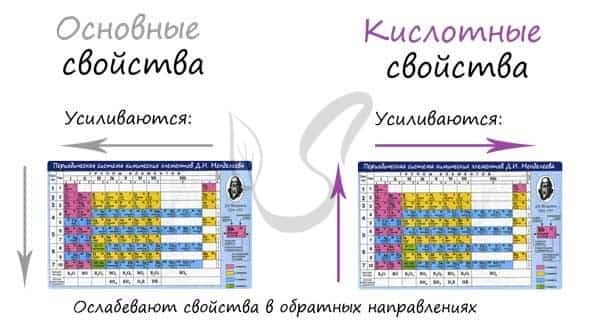
Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить ?
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации — количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
Периодический закон
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
В формулировке Дмитрия Ивановича Менделеева периодический закон звучал так: «Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы.
» Периодическое изменение свойств элементов Менделеев связывал с атомной массой.
Понимание периодичности изменения многих свойств позволило Дмитрию Ивановичу определить и описать свойства веществ, образованных еще не открытыми химическими элементами, предсказать природные рудные источники и даже места их залегания.

Более поздние исследования показали, что свойства атомов и их соединений зависят в первую очередь от электронного строения атома. А электронное строение определяется свойствами атомного ядра. В частности, зарядом ядра атома.
Поэтому современная формулировка периодического закона звучит так:
«Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов«.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
Периоды – это горизонтальные ряды элементов с одинаковым количеством заполняемых электронных уровней. Номер периода обозначает число энергетических уровней в атоме элемента. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
1. Периодическая система химических элементов Д.И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
- Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
- В периодах слева направо возрастает число электронов на внешнем уровне.
- Как следствие,
- В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
| Пример. Выберите три элемента малых периодов и расположите эти элементы в порядке уменьшения металлических свойств. 1) Li 2) Ca 3) Cs 4) N 5) S |
| Ответ: 154 |
| Пример. Выберите три элемента одного периода и расположите эти элементы в порядке уменьшения неметаллических свойств. 1) Be 2) Ba 3) Mg 4) N 5) F |
| Ответ: 541 |
В первом периоде имеются два элемента – водород и гелий. При этом водород условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами.
Как и щелочные металлы, водород является восстановителем. Отдавая один электрон, водород образует однозарядный катион H+.
Как и галогены, водород – неметалл, образует двухатомную молекулу H2 и может проявлять окислительные свойства при взаимодействии с активными металлами:
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементы с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до ртути Hg), а после первого переходного элемента лантана La следуют 14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
В Периодической системе каждый элемент расположен в строго определенном месте, которое соответствует его порядковому номеру.
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные, или подгруппы А и побочные, или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
- Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
- В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
- В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все элементы I и II групп главных подгрупп (литий, бериллий, натрий и др.).
У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-VIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали. К ним относятся элементы побочных подгрупп.
Из строения атомов и электронных оболочек вытекают следующие закономерности:
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
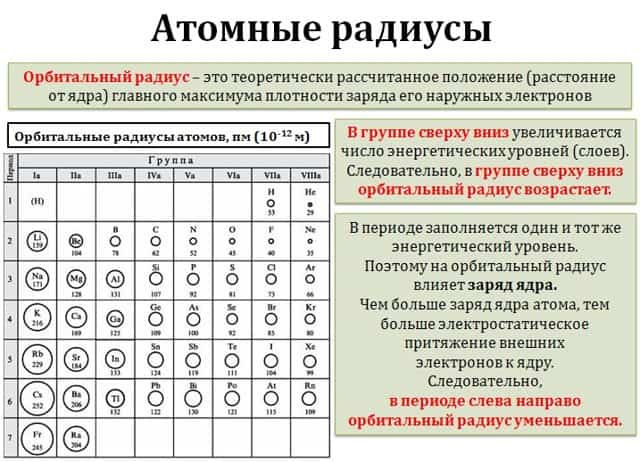
2. Радиус атома
Рассмотрим, как меняется атомный радиус. Вообще, атомный радиус – понятие довольно сложное и неоднозначное. Различают радиусы атомов металлов и ковалентные радиусы неметаллов.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.
- Мы говорим про орбитальный радиус изолированного атома .
- Орбитальный радиус – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
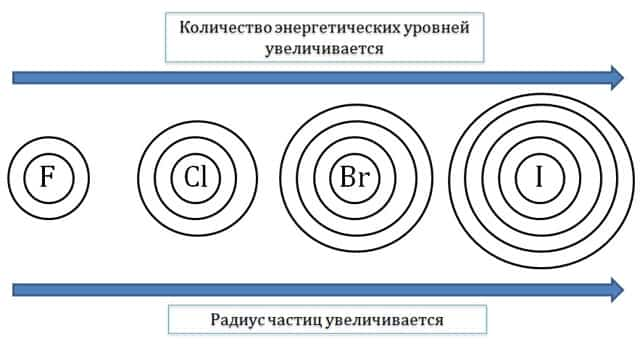
- Орбитальный радиус завит в первую очередь от числа энергетических уровней, заполненных электронами.
- Чем больше число энергетических уровней, заполненных электронами, тем больше радиус частицы.
- Например, в ряду атомов: F – Cl – Br – I количество заполненных энергетических уровней увеличивается, следовательно, орбитальный радиус также увеличивается.
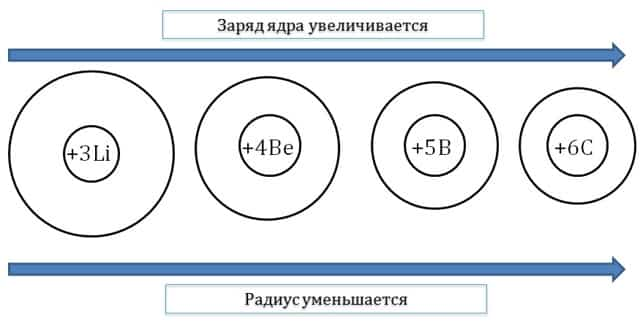
- Если количество заполняемых энергетических уровней одинаковое, то радиус определяется зарядом ядра частицы.
- Чем больше заряд ядра, тем сильнее притяжение валентных электронов к ядру.
- Чем больше притяжение валентных электронов к ядру, тем меньше радиус частицы. Следовательно:
- Чем больше заряд ядра атома (при одинаковом количестве заполняемых энергетических уровней), тем меньше атомный радиус.
- Например, в ряду Li – Be – B – C количество заполненных энергетических уровней, заряд ядра увеличивается, следовательно, орбитальный радиус также уменьшается.
В группах сверху вниз увеличивается число энергетических уровней у атомов. Чем больше количество энергетических уровней у атома, тем дальше расположены электроны внешнего энергетического уровня от ядра и тем больше орбитальный радиус атома.
В главных подгруппах сверху вниз увеличивается орбитальный радиус.
В периодах же число энергетических уровней не изменяется. Зато в периодах слева направо увеличивается заряд ядра атомов. Следовательно, в периодах слева направо уменьшается орбитальный радиус атомов.
В периодах слева направо орбитальный радиус атомов уменьшается.
| Пример. Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке увеличения радиуса атома 1) O 2) Se 3) F 4) S 5) Na |
|
Решение: В одной группе Периодической системы находятся элементы кислород O, селен Se и сера S. В группе снизу вверх атомный радиус уменьшается, а сверху вниз – увеличивается. Следовательно, правильный ответ: O, S, Se или 142. Ответ: 142 |
Рассмотрим закономерности изменения радиусов ионов: катионов и анионов.
Катионы – это положительно заряженные ионы. Катионы образуются, если атом отдает электроны.
Радиус катиона меньше радиуса соответствующего атома. С увеличением положительного заряда иона радиус уменьшается.
Например, радиус иона Na+ меньше радиуса атома натрия Na:
Анионы – это отрицательно заряженные ионы. Анионы образуются, если атом принимает электроны.
- Радиус аниона больше радиуса соответствующего атома.
- Радиусы ионов также зависят от числа заполненных энергетических уровней в ионе и от заряда ядра.
- Например, радиус иона Cl– больше радиуса атома хлора Cl.
Изоэлектронные ионы – это ионы с одинаковым числом электронов. Для изоэлектронных частиц радиус также определяется зарядом ядра: чем больше заряд ядра иона, тем меньше радиус.
Например: частицы Na+ и F‒ содержат по 10 электронов. Но заряд ядра натрия +11, а у фтора только +9. Следовательно, радиус иона Na+ меньше радиуса иона F ‒.
Еще одно очень важное свойство атомов – электроотрицательность (ЭО).
Электроотрицательность – это способность атома смещать к себе электроны других атомов при образовании связи. Оценить электроотрицательность можно только примерно. В настоящее время существует несколько систем оценки относительной электроотрицательности атомов. Одна из наиболее распространенных – шкала Полинга.
По Полингу наиболее электроотрицательный атом – фтор (значение ЭО≈4). Наименее элекроотрицательный атом –франций (ЭО = 0,7).
- В главных подгруппах сверху вниз уменьшается электроотрицательность.
- В периодах слева направо электроотрицательность увеличивается.
- 1) Mg 2) P 3) N 4) O 5) Ti
Химические свойства простых веществ определяются не только электроотрицательностью, но и особенностями строения (химической связью, кристаллической решеткой и др.). Поэтому лишь с некоторой степенью упрощения можно сказать, что электроотрицательность определяет окислительные и восстановительные свойства простых веществ.
- Окислительные свойства — это способность принимать электроны.
- В главных подгруппах сверху вниз уменьшаются окислительные свойства простых веществ.
- В периодах слева направо окислительные свойства простых веществ увеличиваются.
- Важно отметить, что эти закономерности работают только в некоторых рядах, чаще всего для похожих по строению веществ.
- Восстановительные свойства — это способность отдавать электроны.
- В главных подгруппах сверху вниз увеличиваются восстановительные свойства простых веществ.
- В периодах слева направо восстановительные свойства простых веществ уменьшаются.
А что насчет побочных подгрупп? В них расположены металлы. И как сравнивать восстановительные свойства металлов в главных подгруппах и в побочных подгруппах? Примерно сравнить восстановительные свойства простых веществ-металлов позволяет ряд активности металлов.
Слева направо восстановительные свойства металлов уменьшаются.
Итак, резюмируем свойства элементов и простых веществ.
Периодически меняются не только свойства элементов и простых веществ, но и свойства сложных соединений. Рассмотрим закономерности изменения свойств высших оксидов и гидроксидов химических элементов 3 периода.
- основные свойства высших оксидов и гидроксидов химических элементов увеличиваются справа налево в периоде
- кислотные свойства высших оксидов и гидроксидов химических элементов увеличиваются справа налево в периоде
- Аналогично изменяются свойства в главных подгруппах.
- основные свойства высших оксидов и гидроксидов химических элементов увеличиваются сверху вниз в главных подгруппах
- кислотные свойства высших оксидов и гидроксидов химических элементов увеличиваются снизу вверх в главных подгруппах
- Водород образует два типа бинарных соединений — солеобразные гидриды с металлами и летучие водородные соединения с неметаллами.
- Все летучие водородные соединения — газы (кроме воды) при нормальных условиях.
- Свойства летучих водородных соединений изменяются нетипично.
- Кислотные свойства водородных соединений неметаллов усиливаются от NH3 к HI
- Основные свойства водородных соединений усиливаются от HI к аммиаку NH3
- Тренажер по теме «Периодический закон» — 10 вопросов, при каждом прохождении новые.
Изменение металлических и неметаллических свойств в таблице Менделеева
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании.
По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают.
Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот.
Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои.
Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора.
Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
- фтор;
- кислород;
- азот;
- хлор;
- бром.
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов.
У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон.
У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий.
Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать.
Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее.
Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее).
Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе).
Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк.
Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах.
Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее.
Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Самая удобная и увлекательная подготовка к ЕГЭ
- Перечислим закономерности изменения свойств, проявляемые в пределах периодов:
- — металлические свойства уменьшаются;
- — неметаллические свойства усиливаются;
- — степень окисления элементов в высших оксидах возрастает от $+1$ до $+7$ ($+8$ для $Os$ и $Ru$);
- — степень окисления элементов в летучих водородных соединениях возрастает от $–4$ до $–1$;
- — оксиды от основных через амфотерные сменяются кислотными оксидами;
- — гидроксиды от щелочей через амфотерные сменяются кислотами.
Д. И. Менделеев в $1869$ г. сделал вывод — сформулировал Периодический закон, который звучит так:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
Систематизируя химические элементы на основе их относительных атомных масс, Менделеев уделял большое внимание также свойствам элементов и образуемых ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы — группы.
Иногда, в нарушение выявленной им закономерности, Менделеев ставил более тяжелые элементы с меньшими значениями относительных атомных масс.
Например, он записал в свою таблицу кобальт перед никелем, теллур перед йодом, а когда были открыты инертные (благородные) газы, — аргон перед калием.
Такой порядок расположения Менделеев считал необходимым потому, что иначе эти элементы попали бы в группы несходных с ними по свойствам элементов, в частности щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон — в группу щелочных металлов.
Д. И. Менделеев не мог объяснить эти исключения из общего правила, не мог объяснить и причину причину периодичности свойств элементов и образованных ими веществ. Однако он предвидел, что эта причина кроется в сложном строении атома, внутреннее строение которого в то время не было изучено.
В соответствии с современными представлениями о строении атома, основой классификации химических элементов являются заряды их атомных ядер, и современная формулировка периодического закона такова:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Периодичность в изменении свойств элементов объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов.
Именно число энергетических уровней, общее число расположенных на них электронов и число электронов на внешнем уровне отражают принятую в Периодической системе символику, т.е.
раскрывают физический смысл номера периода, номера группы и порядкового номера элемента.
Строение атома позволяет объяснить и причины изменения металлических и неметаллических свойств элементов в периодах и группах.
Периодический закон и Периодическая система химических элементов Д. И.
Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы.
Эти два важнейших значения Периодического закона и Периодической системы дополняет еще одно, которое заключается в возможности прогнозировать, т.е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов.
Общая характеристика металлов главных подгрупп I±III групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Химические элементы — металлы
- Большинство химических элементов относят к металлам — $92$ из $114$ известных элементов.
- Все металлы, кроме ртути, в обычном состоянии — твердые вещества и имеют ряд общих свойств.
- Металлы — это ковкие, пластичные, тягучие вещества, имеющие металлический блеск и способны проводить тепло и электрический ток.
- Атомы элементов-металлов отдают электроны внешнего (а некоторые и предвнешнего) электронного слоя, превращаясь в положительные ионы.
- Это свойство атомов металлов, как вы знаете, определяется тем, что они имеют сравнительно большие радиусы и малое число электронов (в основном от $1$ до $3$ на внешнем слое).
- Исключение составляют лишь $6$ металлов: атомы германия, олова, свинца на внешнем слое имеют $4$ электрона, атомы сурьмы и висмута — $5$, атомы полония — $6$.
Для атомов металлов характерны небольшие значения электроотрицательности (от $0.7$ до $1.9$) и исключительно восстановительные свойства, т.е. способность отдавать электроны.
Вы уже знаете, что в Периодической системе химических элементов Д. И. Менделеева металлы находятся ниже диагонали бор — астат, а также выше ее, в побочных подгруппах. В периодах и главных подгруппах действуют известные вам закономерности в изменении металлических, а значит, восстановительных свойств атомов элементов.
Химические элементы, расположенные вблизи диагонали бор — астат ($Be, Al, Ti, Ge, Nb, Sb$), обладают двойственными свойствами: в одних своих соединениях ведут себя как металлы, в других проявляют свойства неметаллов.
В побочных подгруппах восстановительные свойства металлов с увеличением порядкового номера чаще всего уменьшаются.
Это можно объяснить тем, что на прочность связи валентных электронов с ядром у атомов этих металлов в большей степени влияет величина заряда ядра, а не радиус атома. Величина заряда ядра значительно увеличивается, притяжение электронов к ядру усиливается. Радиус атома при этом хотя и увеличивается, но не столь значительно, как у металлов главных подгрупп.
Простые вещества, образованные химическими элементами — металлами, и сложные металлосодержащие вещества играют важнейшую роль в минеральной и органической «жизни» Земли. Достаточно вспомнить, что атомы (ионы) элементов металлов являются составной частью соединений, определяющих обмен веществ в организме человека, животных.
Например, в крови человека найдено $76$ элементов, из них только $14$ не являются металлами. В организме человека некоторые элементы- металлы (кальций, калий, натрий, магний) присутствуют в большом количестве, т.е. являются макроэлементами.
А такие металлы, как хром, марганец, железо, кобальт, медь, цинк, молибден присутствуют в небольших количествах, т.е. это микроэлементы.
Особенности строения металлов главных подгрупп I–III групп.
Щелочные металлы — это металлы главной подгруппы I группы. Их атомы на внешнем энергетическом уровне имеют по одному электрону. Щелочные металлы — сильные восстановители. Их восстановительная способность и химическая активность возрастают с увеличением порядкового номера элемента (т.е. сверху вниз в Периодической таблице).
Все они обладают электронной проводимостью. Прочность связи между атомами щелочных металлов уменьшается с увеличением порядкового номера элемента. Также снижаются их температуры плавления и кипения. Щелочные металлы взаимодействуют со многими простыми веществами — окислителями.
В реакциях с водой они образуют растворимые в воде основания (щелочи).
Щелочноземельными элементами называются элементы главной подгруппы II группы. Атомы этих элементов содержат на внешнем энергетическом уровне по два электрона. Они являются восстановителями, имеют степень окисления $+2$.
В этой главной подгруппе соблюдаются общие закономерности в изменении физических и химических свойств, связанные с увеличением размера атомов по группе сверху вниз, также ослабевает и химическая связь между атомами.
С увеличением размера иона ослабевают кислотные и усиливаются основные свойства оксидов и гидроксидов.
Главную подгруппу III группы составляют элементы бор, алюминий, галлий, индий и таллий. Все элементы относятся к $p$-элементам.
На внешнем энергетическом уровне они имеют по три $(s^2p^1)$ электрона, чем объясняется сходство свойств. Степень окисления $+3$. Внутри группы с увеличением заряда ядра металлические свойства увеличиваются.
Бор — элемент-неметалл, а у алюминия уже металлические свойства. Все элементы образуют оксиды и гидроксиды.
Характеристика переходных элементов ± меди, цинка, хрома, железа по их положению в Периодической системе химических элементов Д. И. Менделеева и особенностям строения их атомов
Большинство элементов-металлов находится в побочных группах Периодической системы.
В четвертом периоде у атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, так как он имеет меньшую энергию, чем $3d$-подуровень. $K, Ca — s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами $3d$-подуровень.
Рассмотрим, какие силы действуют на электрон, который добавляется в атом при возрастании заряда ядра. С одной стороны, притяжение атомным ядром, что заставляет электрон занимать самый нижний свободный энергетический уровень. С другой стороны, отталкивание уже имеющимися электронами.
Когда на энергетическом уровне оказывается $8$ электронов (заняты $s-$ и $р-$орбитали), их общее отталкивающее действие так сильно, что следующий электрон попадает вместо расположенной по энергии ниже $d-$орбитали на более высокую $s-$орбиталь следующего уровня. Электронное строение внешних энергетических уровней у калия $…
3d^{0}4s^1$, у кальция — $…3d^{0}4s^2$.
Последующее прибавление еще одного электрона у скандия приводит к началу заполнения $3d$-орбитали вместо еще более высоких по энергии $4р$-орбиталей. Это оказывается энергетически выгоднее.
Заполнение $3d$-орбитали заканчивается у цинка, имеющего электронное строение $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{10}4s^2$. Следует отметить, что у элементов меди и хрома наблюдается явление «провала » электрона.
У атома меди десятый $d$-электрон перемещается на третий $3d$-подуровень.
Электронная формула меди $…3d^{10}4s^1$. У атома хрома на четвертом энергетическом уровне ($s$-орбиталь) должно быть $2$ электрона. Однако один из двух электронов переходит на третий энергетический уровень, на незаполненную $d$-орбиталь, его электронная формула $…3d^{5}4s^1$.
Таким образом, в отличие от элементов главных подгрупп, где происходит постепенное заполнение электронами атомных орбиталей внешнего уровня, у элементов побочных подгрупп заполняются $d$-орбитали предпоследнего энергетического уровня. Отсюда и название: $d$-элементы.
Все простые вещества, образованные элементами подгрупп Периодической системы, являются металлами.
Благодаря большему числу атомных орбиталей, чем у элементов-металлов главных подгрупп, атомы $d$-элементов образуют большое число химических связей между собой и потому создают более прочную кристаллическую решетку.
Она прочнее и механически, и по отношению к нагреванию. Поэтому металлы побочных подгрупп — самые прочные и тугоплавкие среди всех металлов.
Известно, если атом имеет более трех валентных электронов, то элемент проявляет переменную валентность. Это положение относится к большинству $d$-элементов. Максимальная их валентность, как у элементов главных подгрупп, равна номеру группы (хотя есть и исключения). Элементы с равным числом валентных электронов входят в группу под одним номером $(Fe, Co, Ni)$.
У $d$-элементов изменение свойств их оксидов и гидроксидов в пределах одного периода при движении слева направо, т.е. с увеличением их валентности, происходит от основных свойств через амфотерные к кислотным. Например, хром имеет валентности $+2, +3, +6$; а его оксиды: $CrO$ — основной, $Cr_{2}O_3$ — амфотерный, $CrO_3$ — кислотный.
Общая характеристика неметаллов главных подгрупп IV±VII групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Химические элементы – неметаллы
Самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не утратила своей значимости и в настоящее время.
Неметаллы —это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Это определение оставляет в стороне элементы VIII группы главной подгруппы — инертные, или благородные, газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам.
Они являются теми объектами, которые разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные, или благородные, газы («благородство» выражается в инертности) иногда относят к неметаллам, но формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур.
Так, гелий Не переходит в жидкое состояние при $t°= –268,9 °С$.
Инертность в химическом отношении у этих элементов относительна. Для ксенона и криптона известны соединения с фтором и кислородом: $KrF_2, XeF_2, XeF_4$ и др. Несомненно, в образовании этих соединений инертные газы выступали в роли восстановителей.
Из определения неметаллов следует, что для их атомов характерны высокие значения электроотрицательности. Она изменяется в пределах от $2$ до $4$. Неметаллы — это элементы главных подгрупп, преимущественно $р$-элементы, исключение составляет водород — s-элемент.
Все элементы-неметаллы (кроме водорода) занимают в Периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор $F$, а основанием — диагональ $B — At$.
Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в главных подгруппах I и VII групп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов, имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация $1s^1$), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления $+1$. Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов.
С другой стороны, атому водорода, как и атомам галогенов, до завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления — $1$ в гидридах (соединениях с металлами, подобных соединениям металлов с галогенами — галогенидам). Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
Свойства атомов элементов – неметаллов
У атомов неметаллов преобладают окислительные свойства, т.е. способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах.
Фтор — самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, т.е. проявлять восстановительные свойства.
Конфигурация внешнего электронного слоя.
| В периоде: — заряд ядра увеличивается; — радиус атома уменьшается; — число электронов на внешнем слое увеличивается; — электроотрицательность увеличивается; — окислительные свойства усиливаются; — неметаллические свойства усиливаются. | В главной подгруппе: — заряд ядра увеличивается; — радиус атома увеличивается; — число электронов на внешнем слое не изменяется; — электроотрицательность уменьшается; — окислительные свойства ослабевают; — неметаллические свойства ослабевают. |
Другие неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами; в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
Химических элементов-неметаллов всего $16$! Совсем немного, если учесть, что известно $114$ элементов. Два элемента-неметалла составляют $76%$ массы земной коры. Это кислород ($49%$) и кремний ($27%$). В атмосфере содержится $0.03%$ массы кислорода в земной коре. Неметаллы составляют $98.5%$ массы растений, $97.6%$ массы тела человека.
Неметаллы $C, H, O, N, S, Р$ — органогены, которые образуют важнейшие органические вещества живой клетки: белки, жиры, углеводы, нуклеиновые кислоты. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элементами-неметаллами (кислород $О_2$, азот $N_2$, углекислый газ $СО_2$, водяные пары $Н_2О$ и др.).
Водород — главный элемент Вселенной. Многие космические объекты (газовые облака, звезды, в том числе и Солнце) более чем наполовину состоят из водорода. На Земле его, включая атмосферу, гидросферу и литосферу, только $0.88%$. Но это по массе, а атомная масса водорода очень мала. Поэтому небольшое содержание его только кажущееся, и из каждых $100$ атомов на Земле $17$ — атомы водорода.






