- Общая характеристика элементов VIIa группы
- Природные соединения
- Простые вещества — F2, Cl2, Br2, I2
- Галогеноводороды
- Химия. 11 класс
- Химические свойства галогенов | Дистанционные уроки
- Обсуждение: «Химические свойства галогенов»
- 2.3.1. Химические свойства водорода и галогенов
- Взаимодействие водорода с простыми веществами
- с металлами
- с неметаллами
- Взаимодействие водорода со сложными веществами
- с оксидами металлов
- c оксидами неметаллов
- c кислотами
- c солями
- Химические свойства галогенов
- Взаимодействие галогенов с простыми веществами
- Взаимодействие галогенов с неметаллами
- водородом
- фосфором
- серой
- Взаимодействие галогенов с металлами
- Реакции галогенов со сложными веществами
- Реакции замещения с галогенами
- Взаимодействие галогенов с водой
- Взаимодействие галогенов с растворами щелочей
- Химические свойства галогенов — урок. Химия, 9 класс
- Химические свойства галогенов
- Химические свойства галогенов
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
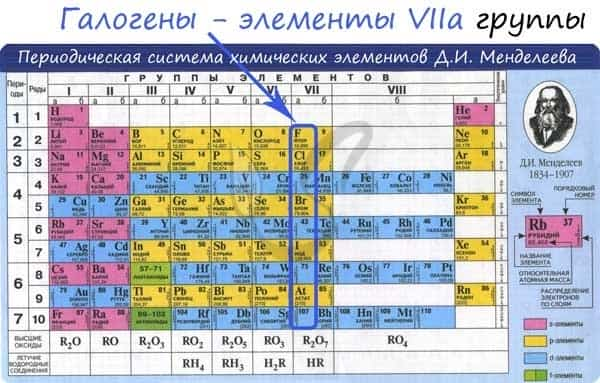
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F — 2s22p5
- Cl — 3s23p5
- Br — 4s24p5
- I — 5s25p5
- At — 6s26p5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.
Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит

Простые вещества — F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
- NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
- Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
- HF → F2 + H2
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl

- В лабораторных условиях галогены могут быть получены следующими реакциями.
- HCl + MnO2 → MnCl2 + Cl2 + H2O
- HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
- Химические свойства
- Реакции с металлами
- Al + F2 → AlF3
- Cu + Cl2 → CuCl2
- Na + Br2 → NaBr
- Реакции с неметаллами
- F2 + H2 → HF (в темноте со взрывом)
- Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность ?
- Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F-)
- Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод — Br-)
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
- KCl + F2 → KF + Cl2
- KBr + Cl2 → KCl + Br2
- KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)

Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
- Получение
- В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
- H2 + Cl2 → HCl
- В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
- NaCl + H2SO4 → NaHSO4 + HCl↑
- CaF2 + H2SO4 → CaSO4 + HF
- PBr3 + H2O → HBr↑ + H3PO3
- H2S + I2 → S + HI
- Химические свойства
- Кислотные свойства
- Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
- Na2O + HCl → NaCl + H2O
- ZnO + HI → ZnI2 + H2O
- KOH + HCl → KCl + H2O (реакция нейтрализации)
- С солями
- Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
- AgNO3 + HCl → AgCl + HNO3
- Li2CO3 + HBr → LiBr + H2CO3
- Восстановительные свойства
- В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
- HI + MnO2 → I2 + MnI2 + H2O
- HI + H2SO4 → I2 + H2S + H2O
- HI + O2 → H2O + I2
- HI + Br2 → HBr + I2
- HBr + H2SO4 → Br2 + SO2 + H2O
- Реакция с оксидом кремния
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты. Mg + HBr → MgBr2 + H2↑ Zn + HCl → ZnCl2 + H2↑ 

Cr(OH)3 + HCl → CrCl3 + H2O

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
Химия. 11 класс
Перейти к основному содержанию
Profil
Галогены как химические элементы
К галогенам относят пять элементов VIIА-группы периодической системы: фтор F, хлор Сl, бром Вr, йод I и астат At.
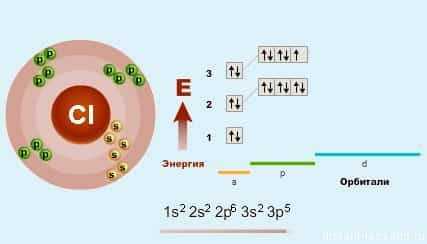
Атомы галогенов содержат по 7 электронов на внешнем электронном слое, общая электронная конфигурация которого ns2np5, то есть галогены являются р-элементами (Приложение 1). Электронно-графические схемы внешнего электронного слоя атомов фтора и хлора выглядят следующим образом:
9F
17Cl
При этом на внешнем электронном слое у атома фтора четыре орбитали, а атомы остальных галогенов содержат ещё пять незаполненных d-орбиталей.
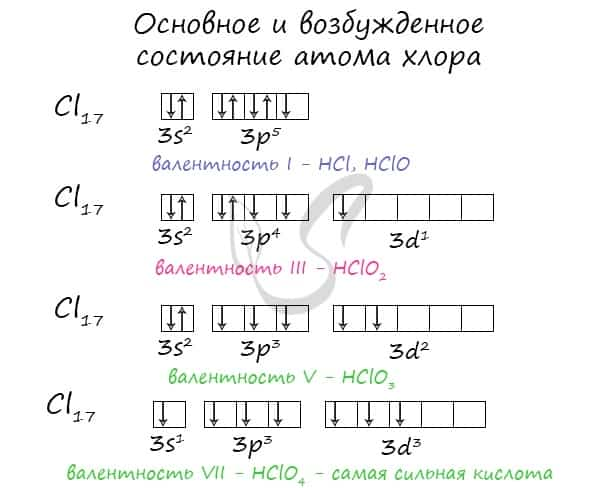
Фтор как самый электроотрицательный элемент в соединениях проявляет только отрицательную степень окисления –1. Характерные для других элементов степени окисления (–1, +1, +3, +5, +7) можно объяснить возможностью распаривания электронов внешнего электронного слоя. В случае атомов хлора это выглядит так:
Cl Степени окисления +1, –1, 0
Cl** Степень окисления +5
Cl* Степень окисления +3
Cl*** Степень окисления +7
Примерами соединений с различными степенями окисления хлора могут служить известные вам вещества: (галит), (бертолетова соль), (хлорная кислота).
В природе галогены существуют в виде соединений с другими элементами (табл. 21, рис. 68). Фтор и хлор принадлежат к двадцати самым распространённым элементам в земной коре.
Таблица 21. Химические элементы галогены
| Элемент | Радиус атома, нм | χ | Степени окисления | Природные соединения |
| Фтор 9F | 0,071 | 4,0 | –1, 0 | CaF2 (флюорит, плавиковый шпат);Na3[AlF6] (криолит);Са5[РО4]3F (фторапатит) |
| Хлор 17Cl | 0,099 | 3,0 | –1, 0, +1, +3, +5, +7 | NaCl (каменная соль, галит);KCl (сильвин);Смесь NaCl и KCl (сильвинит);KMgCl3 · 6H2O (карналлит) |
| Бром 35Br | 0,114 | 2,8 | –1, 0, +1, +3, +5, +7 | NaBr, KBr, MgBr2 — в отложениях хлоридов; в морской воде в виде бромид-ионов |
| Йод 53I | 0,133 | 2,5 | –1, 0, +1, +3, +5, +7 | KIO3 (йодат калия) — в залежах чилийской селитры, в подземных буровых водах, в морских водорослях |
Пропустить Оглавление
Химические свойства галогенов | Дистанционные уроки
- или подгруппа фтора
- Фтор, хлор, бром, йод и астат
- Общее электронное строение:
- nS2 np5
- И, как всегда, все не так просто, как хотелось бы…
Как уже было замечено в предыдущих лекциях (подгруппа кислорода) у первого элемента — F (фтора) все соответствует общей формуле — на внешнем уровне 7 электронов. А вот у хлора (Cl) — элемента 3-го периода появляется свободная d-орбиталь и возможность распаривать на нее электроны.
Благодаря этой возможности — распаривать электроны p-подуровня на d-подуровень, для всех элементов кроме фтора (!!!) возможны степени окисления +1, +3, +5 и +7.
Итак, выводы:
- Валентность элементов:
- валентность фтора = 1,
- валентность хлора и остальных галогенов — 1,3,5 и 7
- Степени окисления:
- степень окисления фтора = -1 — типичный неметалл, самый сильный неметалл — просто КОРОЛЬ неметаллов — самый верхний в группе и самый левый в периоде.;
- степень окисления хлора и остальных галогенов = -1 (минимальная степень окисления), +1 , +3, +5 и +7 (максимальная степень окисления) в минимальной с.о. элементы будут проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства галогенов
- Фтор — F2 — светло-желтый газ;
- Хлор Cl2 — желто-зеленый газ;
- Бром — Br2 — бурая жидкость;
- Йод — J2 — темно-фиолетовые кристаллы, металлический блеск.
Химические свойства галогенов
Фтор — самый активный неметалл, нет веществ, с которыми он не вступал бы в реакции, он НИКОГДА не проявляет положительные степени окисления. Это КОРОЛЬ неметаллов.
- 1. Взаимодействие с водородом:
- F2 + H2 = 2HF — плавиковая кислота
- 2. Взаимодействие с металлами:
- F2 + 2Li = 2LiF — фторид лития (галогениды)
- 3. Взаимодействие с неметаллами:
F2 + O2 = OF2 (кислород здесь проявляет с.о. +2)
- 4.Окислительный свойства:
- Сl2 + H2S = S + 2HCl
- 5. Взаимодействие с водой:
- раствор HF — плавиковая кислота
Cl2 + H2O ↔ HCl + HClO — оксокислоты хлора - Не смотря на то, что эти реакции написаны для фтора и хлора, естественно, они применимы и к брому, и к йоду (кроме взаимодействия с кислородом — там придется элементы поменять местами).
- Как и во всех других группах, химические свойства соединений галогенов подчиняются законам периодичности:
- сверху вниз в подгруппе восстановительные свойства усиливаются.
- сила кислот сверху вниз увеличивается
- с увеличением степени окисления элемента в оксосоединениях усиливаются окислительные свойства.
Отдельно мы разберем Кислоты хлора — их немало, и их названия, а тем более называния солей, желательно знать наизусть
[TESTME 34]
Обсуждение: «Химические свойства галогенов»
(Правила комментирования)
2.3.1. Химические свойства водорода и галогенов
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов.
Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов.
Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
- Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
- Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
- При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
- В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген.
Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике.
Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ.
Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены.
К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
- При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
- Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
- Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
- Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5).
При этом происходит образование пентафторида фосфора:
- При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
- При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
- Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
- Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
- Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
- Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
- Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
- Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
- а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Химические свойства галогенов — урок. Химия, 9 класс
Галогены относятся к химически активным веществам. В реакциях с металлами и большинством неметаллов, а также со сложными веществами галогены проявляют сильные окислительные свойства. Наиболее активен в химических реакциях фтор. С увеличением молекулярной массы активность галогенов снижается.
Взаимодействие с металлами
- При взаимодействии галогенов с металлами образуются соли: фториды, хлориды, бромиды, иодиды.
- Фтор реагирует со всеми металлами (даже с золотом и платиной), с большинством — при обычных условиях:
- Ca+F2=CaF2,
- 2Au+3F2=t2AuF3.
- Остальные галогены реагируют с металлами при нагревании:
- 2Fe+3Cl2=t2FeCl3,
- Cu+Br2=tCuBr2,
- 2Al+3I2=t2AlI3.
Взаимодействие с водородом
- В реакциях галогенов с водородом образуются газообразные галогеноводороды.
- Фтор взаимодействует с водородом со взрывом с образованием фтороводорода:
- H2+F2=2HF.
- Смесь хлора с водородом взрывается только при поджигании или освещении. В результате реакции образуется хлороводород:
- H2+Cl2=t2HCl.
- Бром начинает реагировать с водородом только при нагревании, и реакция происходит без взрыва. Продукт реакции — бромоводород:
- H2+Br2=t2HBr.
- Реакция иода с водородом идёт медленно даже при нагревании. Иод с водородом образуют газ иодоводород:
- H2+I2=t2HI.
- На примере этих реакций прослеживается снижение химической активности веществ в ряду: фтор — хлор — бром — иод.
- Все галогеноводороды хорошо растворяются в воде. Их растворы представляют собой кислоты:
- HF — плавиковая, HCl — соляная, HBr — бромоводородная, HI — иодоводородная.
Сила кислот в этом ряду увеличивается. Самая слабая из них — плавиковая кислота, самая сильная — иодоводородная.
Вытеснение галогенов друг другом из солей
- В реакциях галогенов с галогенидами проявляется следующая закономерность: более активный галоген вытесняет менее активный из его солей. Так, хлор взаимодействует с водными растворами бромидов и иодидов, выступая в этих реакциях окислителем:
- 2KBr−1+Cl02=Br02+2KCl−1,
- 2NaI−1+Cl02=I02+2NaCl−1.
- Бром способен вытеснить иод из иодидов, а с хлоридами не реагирует:
- 2KI−1+Br02=I02+2KBr−1.
- У иода способность вытеснять другие галогены отсутствует, так как его окислительные свойства в ряду галогенов самые слабые.
- Реакции фтора с водными растворами солей невозможны по причине его взаимодействия с водой.
Химические свойства галогенов
Химические свойства галогенов добавить в закладки
К данным химическим элементам относят элементы VII группы главной подгруппы – фтор, хлор, бром, йод.
Отличительными особенностями галогенов является резко выраженные свойства неметаллов, или металлоидов. На внешнем энергетическом уровне у данных элементов семь электронов, то есть он считается не завершенным. В связи с этим они могут активно присоединять электроны для его завершения.
Химическая активность галогенов ослабевает сверху вниз в группе и с увеличением атомного радиуса – от фтора к йоду. Таким образом, самым сильным окислителем является фтор, его степень окисления всегда равна -1. У остальных галогенов могут быть степени окисления в пределах от -1 до +7.
Рассмотрим химические свойства галогенов на определенных примерах.
- При взаимодействии с металлами галогены образуют соли. Реакции происходят в зависимости от степени активности того или иного элемента.
- Фтор, как сильнейший окислитель, реагирует с металлами в нормальных условиях, а при высоких температурах способен взаимодействовать даже с неактивными металлами – серебром, золотом, платиной. Алюминий и цинк способны гореть в атмосфере фтора. Ca + F2 → CaF2 Zn + F2 → ZnF2
- Другие галогены взаимодействуют с металлами при высоких температурах. К примеру, при высыпании в колбу с хлором измельченной в порошок сурьмы частички ее воспламеняются на лету, производя впечатление «огненного дождя». Колба наполняется при этом тяжелым белым дымом хлористой сурьмы. 2Sb + 3Cl2 → 2SbCl3 Медь, взятая в виде пучка тонкой проволоки и предварительно нагретая на воздухе, при погружении в хлор раскаляется и сгорает, наполняя колбу бурым дымом. Бурый дым представляет собой частички хлорной меди. Cu + Cl2 → CuCl2 Йод также вступает в реакции с металлами. Если растертый в ступке йод смешать с порошком алюминия, то через некоторое время сама собой начнется реакция соединения. Активизируется процесс в присутствии воды. 2Al + 3I2 → 2AlI3 Реакция сопровождается появлением пламени. Продукт реакции – йодистый алюминий получается в виде тяжелого дыма, окрашенного примешивающимися к нему парами йода в фиолетовый цвет.
- Галогены взаимодействуют с некоторыми неметаллами – водородом, серой, фосфором, кремнием. С кислородом и азотом непосредственно не реагирует.
- Фтор, при обычных условиях, реагирует практически со всеми неметаллами с выделением тепла. С водородом реакция протекает с взрывом. F2 + H2 → 2HF + Q 2F2 + Si → SiF4 ↑ + Q
- Другие галогены реагируют с неметаллами при нагревании. С водородом соединяется бром, образуя бромистый водород. В соединениях с водородом и металлами бром является одновалентным. Br2 + H2 → 2HBr
- При нагревании фтор может окислять другие галогены. Например, при взаимодействии фтора и хлора образуется при комнатной температуре бесцветный токсичный тяжелый газ с сильным раздражающим запахом – фторид хлора (I).
Cl2 + F2 → 2ClF
- Галогены способны восстанавливать менее активные галогены из растворов галогенидов металлов. В эти реакции не вступает фтор, так как из-за высокой активности в растворе начинает немедленно реагировать с водой.
2KI + Br2 → 2KBr + I2 2HBr + Cl2 → 2HCl + Br2
- Взаимодействие со сложными веществами.
- Галогены могут взаимодействовать с щелочными растворами. Реакции протекают по-разному при высоких и низких температурах. При взаимодействии хлора со щелочами на холоде образуется смесь хлоридов и гипохлоритов.
- Cl2 + 2KOH → KCl + KClO + H2O
- В горячем растворе щелочи происходит реакция, при которой образуются хлорид калия и хлорат калия или бертоллетова соль.
- 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
- Реакция с водой сопровождается выделением атомарного водорода.
2F2 + 2H2O → 4HF + O2↑
Взаимодействие хлора с водой протекает в два этапа. Во-первых, хлор реагирует с водой с образованием хлорной и хлорноватистой кислоты.
H2O + Cl2 → HCl + HClO
- Галогены могут взаимодействовать с щелочными растворами. Реакции протекают по-разному при высоких и низких температурах. При взаимодействии хлора со щелочами на холоде образуется смесь хлоридов и гипохлоритов.
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Химические свойства галогенов
- Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к иоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
- 2Al + 3F2 = 2AlF3 + 2989 кДж,
- 2Fe + 3F2 = 2FeF3 + 1974 кДж.
- Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
- Н2 + F2 = 2HF + 547 кДж,
- Si + 2F2 = SiF4(г) + 1615 кДж.
- При нагревании фтор окисляет все другие галогены по схеме
- Hal2 + F2 = 2НalF
- где Hal = Cl, Br, I, причем в соединениях HalF степени окисления хлора, брома и иода равны +1.
- Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
- Хе + F2 = XeF2 + 152 кДж.
- Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
- 3F2 + ЗН2О = OF2↑ + 4HF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
- 2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж,
- 2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж,
- Si + 2Cl2 = SiCl4(Ж) + 662 кДж,
- Н2 + Cl2 = 2HCl(г)+185кДж.
- Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
- Cl2 + hν → 2Cl,
- Cl + Н2 → HCl + Н,
- Н + Cl2 → HCl + Cl,
Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов (hν), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
- СН3-СН3 + Cl2 → СН3-СН2Cl + HCl,
- СН2=СН2 + Cl2 → СН2Cl — СН2Cl.
- Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
- Cl2 + 2HBr = 2HCl + Br2,
- Cl2 + 2HI = 2HCl + I2,
- Cl2 + 2KBr = 2KCl + Br2,
- а также обратимо реагирует с водой:
- Cl2 + Н2О = HCl + HClO — 25 кДж.
- Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
- Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
- Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде),
- 3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
- Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
- Для примера приведем реакции взаимодействия брома с кремнием и водородом:
- Si + 2Br2 = SiBr4(ж) + 433 кДж,
- Н2 + Br2 = 2HBr(г) + 73 кДж.
- Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
- Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
- I2 + I− → I−3.
- Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к иоду. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат реагирует с металлами (например с литием):
- 2Li + At2 = 2LiAt — астатид лития.
- С водородом, образуя астатоводород:
- H2 + At2 = 2HAt.
- Билет 37.