- Металлическая химическая связь — характеристика, способы образования и свойства
- Характерные кристаллические решетки
- Физические свойства металлов
- Металлическая связь
- Металлическая связь. Свойства металлической связи
- Механизм металлической связи
- Характерные кристаллические решётки
- Другие свойства
- Особенности металлов. Металлическая химическая связь
- Атомы металлов
имеют ряд особенностей: - ·
На внешнем слое у них от одного до трёх электронов; - ·
У них сравнительно большие радиусы атомов; - ·
Атомы металлов имеют достаточное количество свободных орбиталей.
Например, у атома
натрия один электрон на третьем энергетическом уровне. А на третьем
энергетическом уровне всего девять орбиталей (одна эс, три пэ и пять дэ
орбиталей).
Когда атомы
металлов сближаются, то их свободные орбитали перекрываются и валентные
электроны одного атома могут перемещаться на свободные орбитали другого атома.
При этом, в кристалле металла постоянно идут два противоположных процесса:
атом, который отдал электроны превращается в катион, а
свободные электроны при этом, притягиваясь к положительным ионам металлов вновь
превращают их в нейтральные атомы.
Поэтому в
металлах постоянно идёт превращение атомов в ионы и наоборот, а частицы,
из которых состоят кристаллы металла, называют атом-ионами.
Поэтому в узлах
кристаллической решётки металлов находятся как нейтральные атомы, так и катионы
металла. Образовавшиеся при этом электроны перемещаются внутри кристалла
металла и являются общими для всех атомов и ионов металла, связывая их между
собой.
Таким образом, металлическая
связь – это химическая связь, между атомами в металлическом кристалле
посредством обобществления валентных электронов.
Металлическая связь
характерная для металлов и сплавов и объясняет ряд физических свойств металлов:
ковкость, пластичность, тепло- и электропроводность металлов, металлический
блеск.
Особенностью
этой химической связи является то, что она не имеет направленности в
пространстве, она является коллективной, как и ионная, потому что в ней
принимают участие все атомы металла.
Сходство
металлической связи с ковалентной заключается в том, что при её
образовании электроны обобществляются, но в металлической связи эти
электроны связывают все атомы металла в кристалле, а в
ковалентной связи связываются только находящиеся рядом атомы.
Водородная
связь осуществляется между положительно заряженным атомом водорода одной
молекулы и отрицательно заряженным атомом другой молекулы. Причем, чаще всего
отрицательно заряженным атомом являются наиболее электроотрицательные элементы:
фтор, кислород, азот, реже хлор и сера.
Схематично
водородную связь показывают тремя точками. Образование водородной связи
объясняется электростатическим взаимодействием между молекулами. При этом
возникает донорно-акцэпторное взаимодействие свободной орбитали атома водорода
и орбитали с неподелённой парой электронов электроотрицательного атома. Из-за
этого, водородная связь обладает направленностью.
Благодаря
водородной связи молекулы объединяются в ассоциаты, как, например, димеры
уксусной кислоты.
- Водородные связи
также определяют кристаллическую структуру льда, в которой каждый атом
кислорода связан с четырьмя атомами водорода – двумя ковалентными и двумя
водородными связями. - Кристаллическая
структура льда
Водородная связь
объясняет такое алхимическое правило, как «подобное растворяется в
подобном», когда возникают связи между молекулами растворителя и молекулами
растворённого вещества. Вещества метиловый спирт, этанол, уксусная кислота,
этиленгликоль, глицерин неограниченно растворимы в воде.
Водородная
связь в молекуле аммиака обуславливает его возможность легко сжижаться и вновь
переходить в газообразное состояние с поглощением теплоты. Поэтому аммиак
используют как хладагент в холодильных установках.
Водородная
связь слабее ковалентной, поэтому она характерна для веществ в
твёрдом и жидком состояниях.
Некоторые
аномальные свойства веществ объясняются наличием водородной связи. Например,
высокие температуры кипения воды, фтороводорода и аммиака по сравнению с
аналогичными веществами, образованными элементами этих же групп других
периодов, объясняются образованием ассоциатов за счёт водородных связей.
Водородная
связь наиболее распространена в природе. Эта связь объясняет аномальные
свойства воды, такие как высокие температуры кипения и плавления, высокую
теплоёмкость и диэлектрическую проницаемость. Благодаря своей структуре лёд
имеет меньшую плотность, чем жидкая вода, поэтому лёд находится на поверхности
воды и глубокие водоёмы не промерзают до дна.
Светло-голубой
цвет чистой воды и толстого льда также обусловлен водородными связями. Ещё водородная
связь объясняет образование кристаллов в виде изморози и снежинок.
Водородная
связь возникает и между атомами одной молекулы. Это так называемая внутримолекулярная
водородная связь. Она возникает в молекулах органических веществ,
которые имеют группы атомов: о-аш, эн-аш, эн-аш-два и другие.
Внутримолекулярная
водородная связь
Водородная связь
характерна для большинства органических соединений, например, для белков,
нуклеиновых кислот. Вторичная структура молекулы ДНК объясняется наличием
внутримолекулярной водородной связи. Благодаря ей полипептидная цепь закручена
в спираль, и её витки удерживаются от раскручивания.
Но водородная
связь непрочная, поэтому белки разрушаются – денатурируют. Денатурация
может быть обратимой и необратимой.
Обратимая
денатурация белков обусловлена влиянием механического воздействия.
Например, многие работники шахт, дорожных служб, горняки, стекловары,
металлурги, врачи-рентгенологи, работники химических производств постоянно
подвергаются какому-то механическому воздействию. Поэтому для компенсации
вредного воздействия условий труда на организм, им предоставляются определённые
льготы.
Необратимую
денатурацию вы можете наблюдать при варке яиц, мяса, рыбы и других белковых
продуктов. Например, если к раствору куриного яйца прилить этилового спирта или
соли тяжёлого металла, то можно будет наблюдать выпадение осадка вследствие
денатурации белка. Аналогичным действие обладает и никотин, который
воздействует на белковые молекулы.
- Денатурацию
белка вызывает этиловый спирт, соли тяжёлых металлов. - Таким образом,
молекулы могут взаимодействовать между собой и это взаимодействие называется
межмолекулярным. - Силы, которые
обеспечивают это взаимодействие, называются ван-дэр-ваальсовыми,
в честь голландского учёного Ван-дэр-Ваальса. - Межмолекулярное
взаимодействие, как и химическая связь, имеет электростатическую природу.
В молекуле возникают
противоположные полюса: положительные, где электронная плотность понижена и
отрицательные полюса, где электронная плотность повышена. Образовавшиеся
полярные молекулы притягиваются друг к другу.
Это межмолекулярное
взаимодействие может осуществляться между полярными молекулами,
между полярными и неполярными молекулами, а также
между неполярными молекулами.
Межмолекулярное
взаимодействие объясняет переход вещества из газообразного в жидкое, а затем и
в твёрдое. Межмолекулярное взаимодействие слабее, чем ковалентная связь,
поэтому связи между молекулами непрочные и легко разрываются. Из-за этого,
молекулярные вещества плавятся и кипят при низких температурах.
Энергия
межмолекулярного взаимодействия зависит от полярности молекулы и её размера.
Чем сильнее
межмолекулярное взаимодействие, тем выше у вещества температуры кипения и
плавления. Например, кислород из-за более прочного межмолекулярного
взаимодействия кипит при более высокой температуре, чем азот. Углеводороды с
большей молярной массой кипят при более высокой температуре, чем
низкомолекулярные углеводороды.
- Межмолекулярные
связи возникают между молекулами в молекулярной кристаллической решётке. - Например,
молекулярные кристаллические решётки имеют: водород, азот, кислород, сера, йод,
вода, углекислый газ, благородные газы и многие органические вещества. - Для веществ с
молекулярной кристаллической решёткой характерны низкие температуры плавления и
кипения, небольшая твёрдость и лёгкая сжижаемость.
Нагревание
некоторых молекулярных кристаллов, как йода, углекислого газа, приводит к переходу
вещества из твёрдого состояния в газообразное, минуя жидкую фазу.
Этот процесс называется возгонкой, или сублимацией.
- Многие
органические вещества вообще не плавятся, потому что прочность связей между
молекулами в сумме оказывается выше прочности связей внутри молекулы. - Если попробовать
расплавить такие вещества, как крахмал, цэллюлоза или вата, то они начнут
разрушать раньше, чем плавиться.
Реакционная
способность молекулярных веществ зависит от прочности внутримолекулярных
связей, потому что при химическом взаимодействии разрываются
внутримолекулярные связи. Парафин – непрочное вещество, связи между
молекулами слабые, но это вещество химически устойчиво.
Таким образом, металлическая
связь осуществляется за счёт обобществления электронов, межмолекулярное
взаимодействие осуществляется между любыми молекулами и объясняет переход
вещества из газообразного в жидкое, а затем в твёрдое. Водородная связь
осуществляется между положительно заряженным атомом водорода одной молекулы и
отрицательно заряженным атомом другой молекулы.
Металлическая химическая связь — характеристика, способы образования и свойства
Время на чтение: 11 минут
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов — металлическую, ионную и водородную, свойственную кристаллам льда.
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
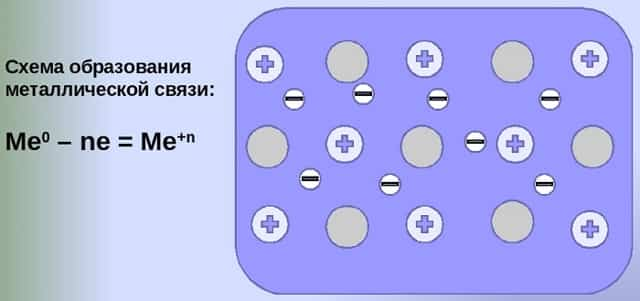
- Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
- Me — ne⁻ ⇆ Me,
- здесь n — число электронов, участвующих в образовании связи, как правило, от 1 до 3.
- В левой части уравнения — атом металла, отдающий электроны, в правой — образовавшийся в результате ион.
- Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
- Схемы формирования связи на примере атомов различной валентности:
- K — e⁻ ⇆ K;
- Cu — 2e⁻ ⇆ Cu;
- Al — 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
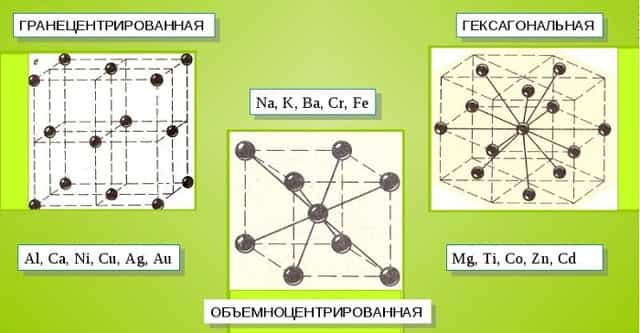
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni — в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
- хорошая электропроводность, благодаря наличию условно свободного электронного облака;
- высокая проводимость тепла;
- низкая реакционная способность или инертность;
- пластичность — большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
- При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
- Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
Их общие черты:
- участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
- металл высвобождает электроны и становится катионом;
- соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью — поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Физические свойства металлов


Средняя оценка: 4.2
Всего получено оценок: 283.
Средняя оценка: 4.2
Всего получено оценок: 283.
Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е.
способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней.
Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.
Рис. 1. Электрохимический ряд напряжений металлов.
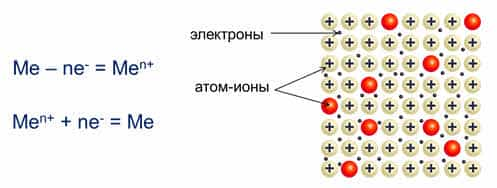
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
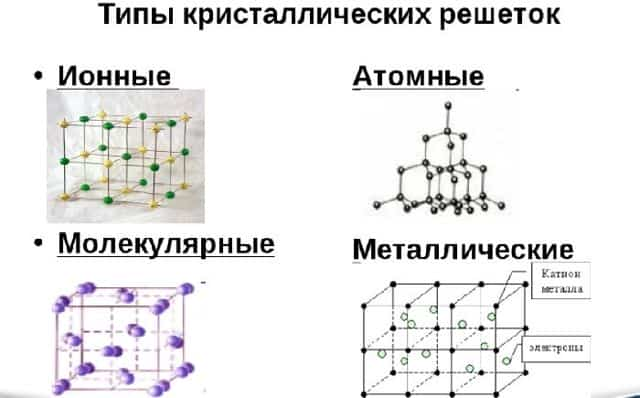 Рис. 2. Виды кристаллических решёток.
Рис. 2. Виды кристаллических решёток.
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество.
Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии.
Особенности металлов и их использование представлены в таблице физических свойств металлов.
| Свойства | Особенности | Примеры | Применение |
| Металлический блеск | Способность отражать солнечный свет | Наиболее блестящими металлами являются Hg, Ag, Pd | Изготовление зеркал |
| Плотность | Лёгкие – имеют плотность меньше 5 г/см3 | Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см3 | Изготовление облицовки, деталей самолётов |
| Тяжёлые – имеют плотность больше 5 г/см3 | Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см3 | Использование в сплавах | |
| Пластичность | Способность изменять форму без разрушений (можно раскатать в тонкую фольгу) | Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn | Формовка, сгибание труб, изготовление проволоки |
| Твёрдость | Мягкие – режутся ножом | Na, K, In | Изготовление мыла, стекла, удобрений |
| Твёрдые – сравнимы по твёрдости с алмазом | Самый твёрдый – хром, режет стекло | Изготовление несущих конструкций | |
| Температура плавления | Легкоплавкие – температура плавления ниже 1000°С | Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C) | Производство радиотехники, жести |
| Тугоплавкие – температура плавления выше 1000°С | Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С) | Изготовление ламп накаливания | |
| Теплопроводность | Способность передавать тепло другим телам | Лучше всего проводят ток и тепло Ag, Cu, Au, Al | Приготовление пищи в металлической посуде |
| Электропроводность | Способность проводить электрический ток за счёт свободных электронов | Передача электричества по проводам |
 Рис. 3. Примеры применения металлов.
Рис. 3. Примеры применения металлов.
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки.
Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые.
Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.2
Всего получено оценок: 283.
А какая ваша оценка?
Гость завершил
Тест «Соня Ростова»с результатом 9/10
Гость завершил
Тест «Мастер и Маргарита»с результатом 12/16
Гость завершил
Тест «Соня Ростова»с результатом 3/10
Гость завершил
Тест СССР в 1964-1985с результатом 5/15
Гость завершил
Тест «Мастер и Маргарита»с результатом 14/16
Гость завершил
Тест «Маленький принц»с результатом 11/14
Гость завершил
Тест «Медный всадник»с результатом 11/11
Гость завершил
Тест «Николай Болконский»с результатом 10/10
Гость завершил
Тест «Налим»с результатом 9/10
Гость завершил
Тест «Очарованный странник»с результатом 12/16
Гость завершил
Тест «Николай Болконский»с результатом 6/10
Гость завершил
Тест «Медный всадник»с результатом 7/11
Гость завершил
Тест «Ионыч»с результатом 10/10
Гость завершил
Тест «Андрей Болконский»с результатом 9/10
Гость завершил
Тест «Мертвые души»с результатом 7/19
Не подошло? Напиши в х, чего не хватает!
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
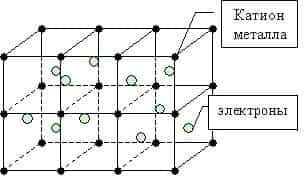
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
 металлическая связь
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
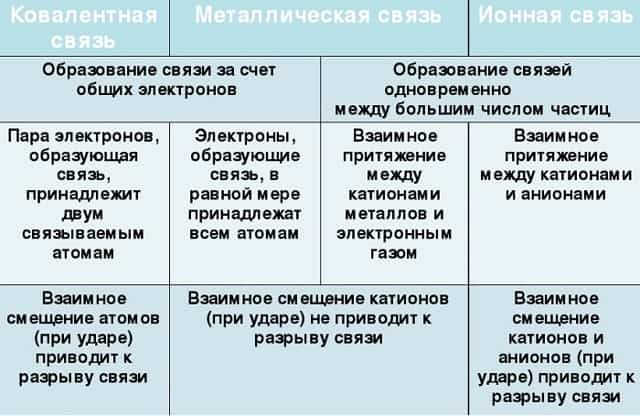
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.
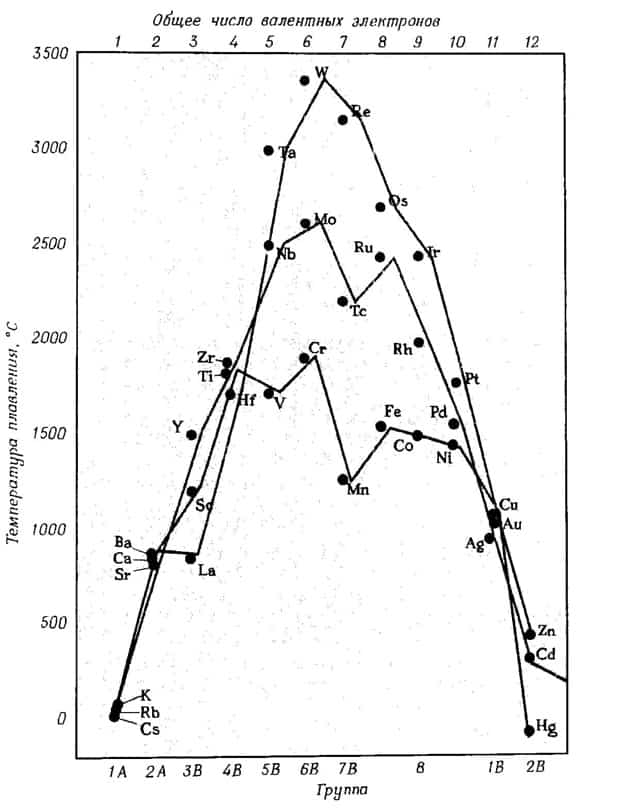 зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Металлическая связь. Свойства металлической связи
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
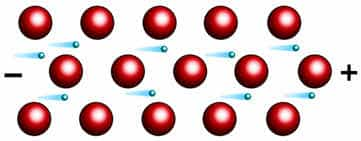
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов.
Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами.
Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали.
Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях.
Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Особенности металлов. Металлическая химическая связь
В одной из предыдущих частей мы уже говорили, что металлы характеризуются металлическими свойствами, то есть способностью отдавать электроны, а чуть позднее, это было вот тут, упомянули о том, что говорить о металлической связи мы можем тогда, когда эта самая связь образуется между атомами химических элементов металлов.Сегодня мы попробуем раскрыть большую часть первоначальных сведений, касающихся металлической связи, что, кстати, позволит понять в том числе и природу физических свойств металлов, поэтому наберитесь терпения, возможно, будет интересно!
Различные металлические воплощенияРазличные металлические воплощения
Начнём мы несколько издалека, а именно с определения химии (неожиданно). Я не удивлю Вас, если скажу, чтоХимия — это наука о веществах, их свойствах и превращениях.Попробуем коротко раскрыть смысл, заложенный в данном определении. Для этого мы должны прийти к единой точки зрения относительно таких понятий, как вещества и их свойства.
Вещество — это то, из чего состоит физическое тело. И вне всяких сомнений металлы непосредственно относятся к веществам, положенным в основу огромного количества физических тел, так железо (Fe) или медь (Cu) являются веществом для таких физических тел, как гвоздь или проволока. Но мы идём дальше.
А как определить, что такое свойства вещества? Давайте размышлять. Например, у меня есть различные свойства. Рост, вес, возраст и т.д. Совокупность всех моих свойств в конечном итоге отличает меня от Вас. Понимаете? Проводя аналогию с веществами, можно сказать, чтоСвойства вещества — это то, что отличает одни вещества от других.
Физические свойства металлов.Физические свойства металлов.
И если физические свойства металлов нам из нашей повседневной практики известны достаточно хорошо, то вопрос о том, чем могут быть обусловлены эти свойства, я думаю, большинству из нас не покажется столь уж простым. Дело в том, что в химии существует понимание: свойства вещества обусловлены, во-первых, составом вещества, во-вторых, его строением.
Свойства любого вещества обусловлены его составом и строениемСвойства любого вещества обусловлены его составом и строением
И состав и строение в каждом конкретном случае по понятным причинам может значительно изменяться, внося свои существенные коррективы в итоговый результат, но наша задача выделить в этом общее, характерное для металлов!Общую составляющую состава мы уже коротко обсудили, она включает в себе систему, состоящую из атомов химических элементов металлов, объединённых химической связью, что коротко может быть описано как Ме — Ме.Чтобы добраться до общего, характеристического для металлов по части строения, нам вновь придётся поразмышлять. Итак, если металлы характеризуются металлическими свойствами, то есть, способностью отдавать электроны, то возникает логичный вопрос: кому они отдают электроны? Представьте, если я хочу отдать электроны, и Вы хотите отдать электроны, как мы можем найти общий язык?Как выяснилось, атомы химических элементов металлов при образовании химической связи между собой отдают электроны в общее пользование, а в некотором роде освобождают эти электроны, и последние заполняют собой межузловое пространство металлической кристаллической решётки.
Схема металлической кристаллической решёткиСхема металлической кристаллической решётки
Таким образом мы вводим новое для нас понятие:
Кристаллическая решётка — совокупность упорядоченно расположенных в пространстве структурных единиц твёрдого вещества.
Структурные единицы, входящие в состав кристаллической решётки называются узлами. Для удобства работы нашего представления узлы кристаллической решётки соединяют воображаемыми линиями.
В узлах же металлической кристаллической решётки находятся так называемые атом-ионы. Почему?Дело в том, что освобождая электроны, или отдавая электроны в общее пользование для всей металлической кристаллической решётки, атом металла (Ме) перестаёт быть атомом и приобретает положительный заряд , то есть, становится ионом (катионом).
Схема металлической химической связиСхема металлической химической связи
Данный процесс обратим. (Стрелочка, направленная как в одну сторону, так и в другую, — символ обратимости). То есть, в действительности происходит беспокойный переход атома металла в состояние иона (катиона) с освобождением электронов и наоборот.
Почему же при отдаче электронов атом металла приобретает положительный заряд? Дело в том, что в случае отдачи электронов совокупный отрицательный заряд электронной оболочки уменьшается, а положительный заряд ядра остаётся неизменным и начинает преобладать над отрицательным зарядом электронной оболочки, что приводит к совокупному положительному заряду всей частицы, то есть к состоянию иона (катиона).
Переход атома кальция (Ca) в состояние иона (катиона) кальцияПереход атома кальция (Ca) в состояние иона (катиона) кальция
Теперь мы наконец-то готовы определить, что же такое металлическая связь:
Металлическая связь — это химическая связь, образованная за счёт обобществлённых (свободных) электронов, между атом-ионами металлов.
Именно наличием в межузловом пространстве металлической кристаллической решётки свободных обобществлённых электронов и объясняются все физические свойства металлов, такие как электропроводность, металлический блеск, ковкость и так далее.Возможно, поподробнее мы об этом когда-нибудь и поговорим. А на этом у меня всё. Спасибо. Пока.