Восстановление оксидов металлов оксидом углерода принято описывать уравнением реакции (6.6), согласно которому для восстановления 1 моля оксида необходим 1 моль СО. Однако такая запись уравнения реакции не совсем корректна, так как после полного восстановления оксида газовая фаза содержит 100% СО2 и является окислительной по отношению к любому металлу.
Окисления восстановленного металла можно избежать, если образовавшаяся в результате реакции газовая фаза по отношению к металлу будет восстановительной. Для этого СО потребуется в большем количестве, а процесс восстановления будет описываться уравнением реакции
Расход восстановителя будет минимальным, если газовая фаза из 1 моля СО2 и (n-1) моля СО будет равновесной для реакции (6.6), то есть
Из уравнения (6.13) получим
Для легковосстановимых оксидов константы равновесия реакции (6.6) имеют большие значения, поэтому минимальный расход восстановителя близок к стехиометрическому.
Для оксидов второй группы константы равновесия реакции (6.6) близки к единице. При этом минимальный расход газообразного восстановителя существенно отличается от стехиометрического. Например, константа равновесия реакции восстановления FeO при 1000К равна 0,624. Согласно уравнению (6.14) для восстановления 1 моля оксида потребуется 2,6 моля СО.
Для трудно восстановимых оксидов константы равновесия реакции (6.6) очень малы. Поэтому минимальный расход восстановителя является очень высоким.
Например, для полного восстановления 1 моля MnO при 1000К потребуется 1,4•106 молей СО. Такой большой расход восстановителя обычно обеспечить не удается, поэтому на практике процесс восстановления с использованием газообразных восстановителей может быть реализован только для оксидов первой и второй групп.
Полученные выше выводы справедливы также при восстановлении оксидов металлов водородом и другими газами.
ВОССТАНОВЛЕНИЕ ОКСИДОВ МЕТАЛЛОВ УГЛЕРОДОМ.
Общая характеристика реакций восстановления оксидов углеродом. В научно-технической литературе восстановление оксидов углеродом принято называть прямым восстановлением, а восстановление оксидом углерода – косвенным или не прямым восстановлением.
В связи с несовершенством контакта между кусковыми материалами возможность непосредственного взаимодействия между углеродом и твердыми оксидами ограничена. Поэтому реакции прямого восстановления протекают преимущественно с участием газовой фазы и представляют собой результат последовательного протекания реакций косвенного восстановления
и взаимодействия углекислого газа с углеродом
Результат последовательного протекания реакций (7.1) и (7.2) можно описать уравнением
Согласно закону Гесса
Изменение энтальпии реакции (7.1) может быть как отрицательной, так и положительной величиной. В первом случае оно обычно не велико и не превышает 172130 Дж/моль. Поэтому реакции прямого восстановления обычно являются эндотермическими.
При низких температурах восстановление оксидов углеродом может также протекать по реакции
Однако при температурах более 950 – 1000оС углекислый газ взаимодействует с углеродом по реакции (7.2) и практически полностью превращается в СО.
Температура начала восстановления оксида. Система, в которой протекают реакции (7.1) и (7.2) состоит из пяти веществ, связанных между собой двумя уравнениями реакций. Следовательно, количество независимых компонентов системы k = 3. При отсутствии растворов количество находящихся в равновесии фаз f = 4, а число степеней свободы системы
C = k + n – f = 3 + 2 – 4 = 1.
Это означает, что однозначно охарактеризовать систему можно, указав температуру или давление.
При постоянном давлении количество степеней свободы системы становится равным нулю. Это означает, что система из чистых металла, оксида, углерода, СО и СО2 может находиться в состоянии равновесия только при одной температуре, которая определяется составом газовой фазы.
Сказанное выше показано на рисунке 7.1. Из рисунка видно, что при постоянном давлении реакции (7.1) и (7.2) могут одновременно находиться в равновесном состоянии только при одной температуре Тр.
Рассмотрим процессы, которые протекают в системе при температурах отличных от Тр.
Из рисунка 7.1 видно, что при Т >Тр в системе нет газовой фазы, которая удовлетворяла бы условиям равновесия реакций (7.1) и (7.2) одновременно.
Допустим, что при температуре Т1 реакция (7.1) находится в состоянии равновесия. При этом состав равновесной газовой фазы для реакции (7.1) отвечает точке б. Но газовая смесь такого состава не является равновесной по отношению к углероду, так как содержание СО2 в газовой фазе выше равновесного для реакции (7.2), которое соответствует точке в на рисунке.
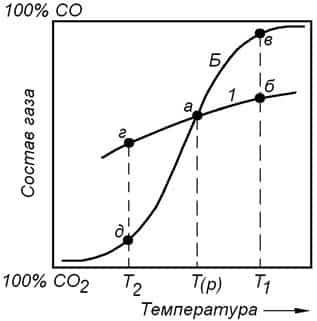
Рисунок 7.1 – Зависимость состава равновесной газовой фазы от температуры для экзотермической реакции косвенного восстановления и реакции С + СО2 = 2СО при постоянном давлении
В этих условиях реакция (7.2) протекает в направлении образования дополнительного количества оксида углерода и (%СО) в общей для двух реакций газовой фазе увеличивается.
При этом газовая фаза перестанет отвечать условиям равновесия реакции косвенного восстановления, которая будет протекать в направлении восстановления оксида и образования дополнительного количества СО2. Результатом одновременного протекания реакций (7.1) и (7.
2) будет процесс, который описывается уравнением реакции прямого восстановления (7.3).
Сказанное выше можно представить следующей схемой
При наличии в исходном состоянии избытка углерода оксид металла будет полностью восстановлен и часть углерода останется не использованной. При этом равновесие в системе будет достигнуто, когда состав газовой фазы будет соответствовать точке в на рисунке 7.1.
При умеренных температурах в составе равновесного газа может находиться существенное количество СО2. Это означает, что восстановление оксида протекает как по реакции (7.3), так и по реакции (7.4).
При недостатке углерода он будет полностью израсходован и часть оксида останется не восстановленной. При этом равновесие в системе будет достигнуто, когда состав газовой будет соответствовать точке б.
При Т
3. Восстановление элементов из их окислов [1969 Щербаков В.П. — Основы доменного производства]
Восстановительный процесс — это химическое взаимодействие, в результате которого от окислов отнимается кислород. Восстановителями в доменной печи являются окись углерода, твердый углерод и водород. Назначение доменной плавки заключается в том, чтобы отнять кислород от окислов железа и ряда других элементов, содержащихся в шихтовых материалах.
Хорошее развитие процессов восстановления было бы невозможно без противотока газа и шихты.
Печные газы отдают тепло шихте, что обеспечивает протекание химических реакций, и удаляют газообразные продукты восстановления. На рис. 75 представлена кривая изменения температуры газа 1 и шихты 2 по высоте доменной печи.
Рис. 75. Изменение температур газа и шихты по высоте доменной печи
С повышением температуры химическое сродство металлов к кислороду снижается, а к углероду возрастает, вследствие чего при соответствующих температурах он может служить восстановителем.
Это используется в доменной плавке, где основными восстановителями являются твердый углерод и его окись. Углерод поступает в доменную печь с коксом и природным газом.
Содержание метана (Сн4) в природном газе составляет 95 — 97%, а содержание углерода в коксе 85 — 87%.
Восстановление элементов в доменной печи происходит двумя путями: газами (окись углерода, водородом) и твердым углеродом. В первом случае восстановление называется непрямым (косвенным), а во втором — прямым.
Основные закономерности процесса восстановления железа из его окислов были выявлены акад. А. А. Байковым. Он установил последовательность превращений при восстановлении от высших окислов до металлического железа, которую можно представить в следующем виде:
- Fe2О3 → Fe3О4 → FeO → Fe.
- Косвенное восстановление окисью углерода начинается при температурах 300 — 400°С и происходит по таким реакциям;
- 3Fe2О3 + СО = 2Fe3О4 + СО2 + 37,137 Мдж (8 870 ккал);
- Fe3О4 + СО = 3FeO + СО2 — 20,892 Мдж (4990 ккал);
- FeO + СО = Fe + CО2+ 13,607 Мдж (3250 ккал).
- Общий тепловой эффект непрямого восстановления железа является положительным.
- Восстановление водородом начинается при 300°С и протекает по такой же схеме, но все реакции сопровождаются поглощением тепла:
- 3Fe2О3 + Н2 = 2Fe3О4 + Н2О — 21,813 Мдж (5210 ккал);
- Fe3О4 + H2 = 3FeО + H2О — 62,216Мдж (14 860 ккал);
- FeO + Н2 = Fe + Н2О — 27,717 Мдж (6620 ккал).
- При восстановлении окислов железа твердым углеродом происходит большое поглощение тепла:
- 3Fe2О3 + С = 2Fe3О4 + CO — 104,328 Мдж (24840 ккал);
- Fe3О4 + С = 3FeO + CO — 190,008 Мдж (45 240 ккал);
- FeO + C = Fe +CO — 153,308 Мдж (36 740 ккал).
Первая реакция начинается при температуре 390 — 400°С, а вторая и третья — при 700 — 800°С. Взаимодействие твердых окислов с твердым углеродом кокса возможно только в точках их соприкосновения, т. е. реакционная поверхность значительно меньше, чем в случае восстановления газами.
Однако если окись железа находится в жидкой фазе, то взаимодействие окиси с твердым углеродом протекает более интенсивно, так как жидкая фаза как бы омывает куски кокса (так же как и газ, содержащий окись углерода, или водород омывает куски агломерата или руды).
Следует также учитывать, что твердый углерод в виде сажистого углерода откладывается в порах железной руды или агломерата, что резко увеличивает реакционную поверхность и способствует протеканию восстановительных процессов.
Восстановление окислов железа по высоте доменной печи проиллюстрировано на рис. 76.
Рис. 76. Восстановление железа по высоте доменной печи: а — магнитогорская; б — завода 'Запорожсталь'
Агломерат или железная руда могут содержать силикаты железа. Такие соединения первоначально взаимодействуют с окисью кальция, имеющей большое сродство к кремнезему, в результате чего получаются силикаты кальция. Выделяющаяся при этом закись железа восстанавливается твердым углеродом со значительной, в конечном итоге, затратой тепла.
- Чем больше в шихте содержится силикатов железа, тем больше расходуется горючего на выплавку чугуна. Чаще всего встречается силикат в виде Fe2SiО4, восстановление железа из которого происходит по реакциям:
- Fe2SiО4 + 2СаО = Са2 SiО4 + 2FeO + 92,148 Мдж (21 940 ккал);
- 2FeO + 2C = 2Fe +2СО — 308,616 Мдж (73 480 ккал).
Эти реакции начинают хорошо протекать при температуре 800 — 850°С. Силикаты железа могут восстанавливаться окисью углерода в незначительных количествах.
Непрямое восстановление сопровождается выделением небольшого количества тепла и требует много СО, получить которую можно только путем сжигания угле- рода в печи.
При прямом восстановлении расходуется меньшее количество углерода, но требуется много тепла, которое можно получить в основном при сжигании углерода и путем нагрева дутья.
Таким образом, в доменной печи в первом случае при получении необходимого количества окиси углерода выделяется тепло и во втором — получение тепла связано с образованием окиси углерода.
Поэтому минимальный расход углерода на восстановление в целом может быть тогда, когда лучше используется восстановительная энергия газов в печи, что достигается оптимальным распределением в первую очередь шихтовых материалов на колошнике и хорошим качеством агломерата (отсутствие мелочи, достаточная прочность, хорошая восстановимость).
Процессы восстановления могут протекать быстро и медленно. Это зависит от ряда условий, в том числе от качества сырых материалов. Скорость восстановления зависит прежде всего от качества железной руды или агломерата.
Под качеством необходимо понимать величину кусков, пористость, содержание трудновосстановимых окислов, пустой породы и т. д. Чем больше размер куска руды или агломерата, тем больше затрачивается времени на его восстановление. На рис.
77 показана зависимость между размером кусков руды и степенью восстановления.
Рис. 77. Зависимость между величиной куска и степенью восстановления
Однако не только величина куска, но и его пористость (в большей степени) влияет на скорость восстановления. Чем более пориста руда, тем лучше ее восстановимость (агломерат является более пористым сырьем, чем руда).
Чем больше в агломерате силикатов железа и его закиси, тем резче снижается восстановимость. Объясняется это тем, что с увеличением содержания FeO температура размягчения агломерата понижается, что приводит к образованию «тестообразных» масс, закрывающих поры и ухудшающих доступ газа к окислам.
Такое явление может происходить и у руд, если температура их размягчения низкая.
На рис. 78 представлены зависимости степени восстановления от содержания в агломерате закиси железа.
Как видно из диаграммы, агломерат при температуре 1100°С восстанавливается хуже, чем при 1000°С (при одинаковом содержании FeO).
Это вызвано тем, что в данном случае агломерат при более высокой температуре размягчается, теряет пористость и окислы контактируют с газом только на поверхности куска.
Рис. 78. Зависимость степени восстановления агломерата от содержания в нем закиси железа
Скорость восстановительных процессов во многом зависит от состава газа-восстановителя. Увеличение содержания в газовой смеси углекислоты и паров воды тормозит восстановление.
Чем больше в отходящем из доменной печи газе додержится углекислоты, тем более полно была использована его восстановительная способность.
Однако не следует забывать, что в состав отходящих газов входит и СО2, выделившаяся вследствие разложения карбонатов (в частности, известняка).
Поэтому применение офлюсованного агломерата, помимо прочих преимуществ, позволяет освободить печь от дополнительного количества углекислоты.
Азот — инертный газ. Он непосредственно в процессе не участвует, а лишь увеличивает общее количество газа, проходящего через столб шихты, и разбавляет газ-восстановитель, что является отрицательным фактором.
Поэтому определенное обогащение вдуваемого кислородом воздуха позволяет снизить содержание азота в газе и увеличить количество окиси углерода. Однако, не участвуя непосредственно в процессах восстановления, азот является основным переносчиком тепла по высоте доменной печи.
Поэтому резкое уменьшение его содержания во вдуваемом воздухе (например, путем значительного обогащения дутья кислородом без проведения дополнительных специальных мероприятий) приведет к недостатку тепла в верхних частях доменной печи и к протеканию основных реакций только на нижних горизонтах. В результате материалы придут к горну неподготовленными.
Одновременно с железом в доменной печи восстанавливаются и переходят частично или полностью в чугун Si, Mn, S, Р и другие элементы.
Некоторые элементы в виде окислов или соединений входят в состав шихты, некоторые из них специально вводят в шихту для получения их в составе чугуна.
В частности, для получения марганцовистых чугунов в шихту вводят марганцевую руду, в которой могут содержаться следующие окислы марганца: перекись Мn2O, окись Мn2О3, закись-окись Мn3О4 и закись МnО.
Перекись и окись марганца относятся к непрочным соединениям и при воздействии на них окиси углерода отдают часть своего кислорода: первая — при температуре 565°С и вторая — при 1090°С. Закись марганца восстанавливается только твердым углеродом, что сопровождается большим поглощением тепла.
- Восстановление марганца проходит по схеме:
- 2МnO2 + СО = ЗМn2O3 + + СO2 + 277,556 Мдж (54 170 ккал);
- 3Мn2О3 + СО = 2Мn3О4 + СO2 + 170,235 Мдж (40 660 ккал);
- Мn3O4 + СО = 3МnО + СO2 + 51,916 Мдж (12 400 ккал);
- МnO + С = Мn + СО — 287,381 Мдж (68640 ккал).
- Окончательное восстановление марганца из его закиси сопровождается затратой тепла, примерно в два раза большей, чем восстановление железа из его закиси. Значительная часть закиси марганца, не успев восстановиться, соединяется с кремнекислотой и образует трудновосстановимое соединение — силикат марганца:
- MnO + SiO2 = MnSiO3,
- восстановление марганца из которого начинается при температуре не ниже 1300°С твердым углеродом и сопровождается большим поглощением тепла. При этом кремнекислота соединяется с окисью кальция по реакции
- MnSiО3 + CaO + 0 = Mn + CaSiO3 + CO — 229,068 Мдж (54 540 ккал).
Раньше марганцевая руда при выплавке мартеновских чугунов потреблялась в больших количествах. Марганец частично соединяется с серой с образованием соединения MnS, которое удаляется со шлаком. Добавка марганцевой руды в шихту может преследовать и другие цели. При выплавке ферромарганца, или зеркального чугуна, марганец является составной частью ферросплава.
Некоторые заводы, главным образом на Юге страны, и сейчас выплавляют мартеновские чугуны с несколько повышенным содержанием марганца. Это объясняется повышенным содержанием серы в южных коксах.
Помимо того, что восстановление марганца требует большой затраты тепла, вместе с марганцевой рудой вносится также дополнительно пустая порода в виде кремнезема и глинозема, что увеличивает количество шлака. В отличие от железа марганец переходит не полностью в чугун и, восстановившись, может испаряться и уноситься газами.
При высоких температурах, особенно в нижних горизонтах печи, во время выплавки ферромарганца испарение может происходить довольно интенсивно, чему способствует также большая скорость газов. Если железо при выплавке обычных чугунов распределяется между чугуном и колошниковой пылью, то марганец распределяется между чугуном, пылью и шлаком, куда его переходит чуть ли не половина.
Все это делает невыгодным использование марганцевой руды при выплавке обычных чугунов.
Следующим элементом, который обязательно присутствует в чугуне, является кремний. Окислы кремния находятся во всех видах сырья, применяемого в доменной плавке (даже в золе кокса). Окислы или другие соединения кремния в шихту доменных печей, как правило, при выплавке передельных чугунов специально не добавляют.
Кремнийсодержащие породы, такие как кварциты, применяют только при выплавке доменного ферросилиция, а чистый кварц — при выплавке высококремнистого ферросилиция в электропечах.
Кремний образует соединения не только с кислородом, но и с железом, марганцем и другими элементами.
Восстановление кремния в доменной печи происходит твердым углеродом и сопровождается очень большим поглощением тепла:
SiO2 + 2C = Si + 2СО — 635,096 Мдж (151 690 ккал).
Чем выше содержания кремния в чугуне, тем больше расходуется горючего. На каждый процент кремния (свыше 0,7%) в чугуне необходимо около 0,1 т дополнительного расхода кокса на 1 т чугуна.
Восстановление кремния в присутствии железа начинается при температуре 1050°С, а без железа — при 1360°С. В противоположность марганцу кремний лучше восстанавливается при более кислых шлаках, так как образует кислые окислы.
К вредным примесям относятся сера, фосфор и мышьяк. Сера вносится в доменную печь рудами (агломератом), добавками, заменителями руд и коксом.
Заводы Юга располагают относительно чистыми по сере рудами, но большое количество серы в южных коксах делает весьма высоким содержание ее в шихте доменных печей.
В руде и флюсе сера может быть в виде пирита (FeS2) или сульфатов (CaSO4 и BaSO4), в коксе может быть в свободном виде, в соединении с углеродом или в виде сульфатов и сульфидов в золе кокса.
Сера распределяется между чугуном, шлаком, газом и пылью примерно так, как указано в табл. 14. Как видно из таблицы, большая часть серы остается в шлаке.
Сера может улетучиваться в виде паров, сернистого газа (SO2), сероводорода (H2S) и других газообразных соединений. С увеличением температуры процесс улетучивания серы из ряда ее соединений возрастает. Улетучивание сульфатной серы происходит следующим путем:
- CaSO4 + 4C = CaS + 4CO;
- CaS + 3CaSO4 = 4 CaO + 4SO2.
- Однако если бы образующиеся в печи сернистые газы уносились из печи вместе с колошниковым газом полностью, то было бы очень легко бороться с серой в доменной печи.
Сернистое газообразное соединение SO2 при движении в печи вместе с газами быстро восстанавливается твердым углеродом и водородом, образуя соединения CS, CS2, COS, HS и H2S. Из этих соединений сера жадно поглощается шихтой, образуя сернистое железо и сернистый кальций, которые вместе с шихтой опускаются в низ печи.
Таблица 14
Распределение серы между чугуном, шлаком, колошниковой пылью и газом при различных условиях работы доменной печи
Вследствие того, что большая часть серы остается в доменной печи, получение чугуна, требуемого по сере состава, возможно только при таком составе шлака, который сможет поглотить основную ее массу, предупредив ее переход в чугун.
Фосфор и мышьяк ведут себя в доменной печи примерно одинаково. Они переходят в чугун почти полностью, за исключением тех количеств, которые могут улетучиться.
Так как эти элементы вносятся в печь шихтовыми материалами в виде различных соединений (мышьяк в условиях СССР редко встречается), то они вначале восстанавливаются, а затем растворяются в чугуне.
Так, например, восстановление фосфора из фосфата кальция происходит с помощью углерода и кремнекислоты при очень большом поглощении тепла:
2(СаО)3 · Р2O5 + 3SiO2 = 3(СаО)2 · SiO2 + 2Р2O5 — 920,98 Мдж (219 280 ккал);
2Р2O5 + 1 ОС = 4Р + 10CО — 1928,64 Мдж (459 200 ккал).
Восстановленный фосфор энергично испаряется и немедленно соединяется с восстановившимся железом. Поэтому он практически с газами не выносится.
Очень нежелательной примесью железных руд является цинк. Он в железных рудах встречается в виде сернистого соединения — сфалетита (цинковой обманки) или в виде кремне- и углекислых солей.
Эти соединения под действием окиси кальция превращаются в окись цинка, которая восстанавливается газами при температуре более 450°С. Восстановленный цинк в чугун не переходит и, не доходя до горна, испаряется.
Часть цинка уносится газами, а часть конденсируется, оседая на кусках шихты или на стенках шихты. Последнее приводит к разрушению огнеупорной кладки и образованию настылей.
Хорошо восстанавливаются в доменной печи никель и медь. Ванадий и хром восстанавливаются, но несколько труднее, и процессы восстановления их протекают примерно по такой же схеме, как и при восстановлении марганца. Хром, никель и медь, восстановившись, полностью переходят в чугун.
В условиях доменной плавки ванадий и титан переходят в чугун частично. Свинец очень хорошо восстанавливается, но в чугуне не растворяется, а из-за высокого удельного веса скапливается на лещади и способствует ее разрушению.
Окислы кальция, магния и алюминия в доменной печи не восстанавливаются, а полностью переходят в шлак.
По конкурентной цене ботинки нитрил у нас на сайте.
Формально-кинетические закономерности восстановления оксидов металлов газами
Количественный анализ кинетических закономерностей топохимических реакций, том числе реакций, очень сложен. Однако, рассмотрев несколько идеализированных случаев восстановления, можно выяснить влияние ряда факторов на кинетику рассматриваемого процесса.
Упражнение 1. На основе общих положений химической кинетики обратимых адсорбционно-химических реакций получить кинетическое уравнение для описания скорости процесса восстановления в кинетическом режиме.
Решение.
Если процесс не лимитируется сложной в кинетическом описании кристаллохимической стадией зарождения новой фазы, то обратимую реакцию восстановления можно представить схемой
где и – константы скорости прямой и обратной реакций.
При равновесии или
- имеем (2)
- Полученное уравнение показывает, что скорость процесса определяется величиной реакционной поверхностью, температурой и давлением газа на реакционной поверхности.
- Если диффузия газа к поверхности реакционной не затруднена (кинетический режим), то ,
- где – парциальное давление газа-восстановителя в объеме реактора,
- и уравнение (2) принимает вид:
- (2а)
- Следует отметить, что при более строгом выводе данного уравнения с учетом адсорбционно-десорбционных явлений, получаются более сложные зависимости.
Упражнение 2. Исходя из допущения о сферической форме частиц оксида металла, получить кинетическое уравнение зависимости степени восстановления оксида от времени для процесса, протекающего в кинетическом режиме.
Решение.
Если исходный оксид состоит из частиц сферической формы с начальным радиусом ro и имеет массу mo, то к моменту времени t произойдет изменение массы и радиуса , где m и r – масса материала и радиус частиц к моменту времени t. Тогда степень восстановления α исходного оксида . Для каждой из частиц , где – плотность вещества.
- Подставляя массы в выражение для , получаем и . (3)
- Скорость процесса V, выраженная через изменение количества (моль) исходного вещества в единицу времени
- , (4)
- где M– молярная масса вещества.
- Сравнивая полученное выражение с уравнением (2а) для скорости процесса в кинетическом режиме и учитывая в последнем , получим
- и . (5)
При постоянных значениях температуры (k), давления, а значит, и , а также молярного объема скорость уменьшения размера непрореагировавшей части исходного оксида постоянна, то есть . После интегрирования этого уравнения от 0 до t и от ro до r получаем или .
- Записав отношение размера непрореагировавшей части исходного оксида к начальному размеру через степень восстановления приходим к уравнению
- . (6)
- Это уравнение, приведенное к форме
- , (6а)
известно как закономерность модели сжимающегося объема или как уравнение Мак-Кевана. Оно предполагает быстрое образование границы раздела фаз с последующим линейным во времени продвижением реакционной зоны в объем сферического зерна.
- Для полного завершении восстановления ( ) требуется время
- . (7)
- Оно, как видно, уменьшается с уменьшением размера частиц материала, с ростом температуры, что соответствует увеличению константы скорости, с увеличением фактического парциального давления газа-восстановителя в объеме реактора, что соответствует увеличению .
Дополнение.
Упражнение 2а. Исходя из допущения о кубической форме частиц оксида металла, получить кинетическое уравнение зависимости степени восстановления оксида от времени для процесса, протекающего в кинетическом режиме.
Решение.
Если исходный оксид состоит из частиц кубической формы с начальным размером ребра куба ro и имеет массу mo, то к моменту времени t произойдет изменение массы и размера , где m и r – масса материала и размер частиц к моменту времени t. Для каждой из частиц , где – плотность вещества. Подставляя массы в выражение для степени восстановления исходного оксида
- получаем и . (3а)
- Скорость процесса V, выраженная через изменение количества (моль) исходного вещества в единицу времени
- , (4а)
- где M– молярная масса вещества.
- Сравнивая полученное выражение с уравнением (2а) для скорости процесса в кинетическом режиме и учитывая в последнем поверхность куба , получим
- и . (5а)
- Интегрируем (5а) и получаем:
- или .
- Так как , то и получаемуравнение Мак-Кеванав форме
- , (6а’)
- где .
Упражнение 3. На основе общих положений диффузионной кинетики получить кинетическое уравнение для описания скорости процесса газового восстановления оксида металла в диффузионном режиме. Исходя из допущения о сферической форме частиц соединения, получить кинетическое уравнение зависимости степени превращения от времени для процесса, протекающего в диффузионном режиме.
Решение.
Если в процессе восстановления продукт оказывается малопористым, плотным, то имеются значительные диффузионные торможения, и процесс может осуществляться в диффузионном режиме. Адсорбционно – кристаллохимические реакции идут быстро, и поэтому в порах на границе раздела фаз устанавливается давление, близкое к равновесному , и соответствующая ему концентрация газа .
- На наружной поверхности частично прореагировавшего зерна устанавливается концентрация , соответствующая давлению в объеме газа при отсутствии внешнедиффузионных торможений.
- Скорость диффузии газа через слой оксида в соответствии с законом Фика
- . (8)
- Для процесса со сферической формой частиц , (9)
- где – радиус сферы в слое оксида, изменяющийся от ro до r за время t.
- При решении этого уравнения возможны несколько различных допущений.
- В первом приближении для квазистационарного процесса градиент концентрации может быть заменен отношением приращений .
- Тогда . (10)
- Введя в данное выражение скорость из выражения
- , (4)
- получим (11)
- Разделим переменные и проинтегрируем
- .
- Тогда , (12)
- то есть толщина слоя изменяется во времени по параболическому закону . Введя с помощью уравнения (3), приходим к уравнению
- , (13)
которое известно как уравнение Яндера. Оно является приближенным для частиц сферической формы, так как связь толщины слоя с радиусом непрореагировавшей части частицы малого размера оказывается более сложной.
- Более строгий учет сферической симметрии может быть выполнен следующим образом.
- Уравнение (9) запишем в виде .
- Интегрируя в приближении независимости скорости диффузионного потока от x ,
- получаем или . (14)
- Сопоставление уравнений (14) и
- , (4)
- дает выражение для линейной скорости перемещения реакционной зоны
- , (15)
- из которого видна более сложная, чем из (10) зависимость линейной скорости от размера r непрореагировавшей части оксида. На начальном этапе, когда
сферическая симметрия частиц не проявляется, то есть линейная скорость, как и в предыдущем случае, обратно пропорциональна толщине оксидного слоя ( ). Затем при с дальнейшим утолщением слоя продукта диссоциации (с уменьшением r) линейная скорость возрастает.
- Интегрирование уравнения (14) и введение степени превращения через отношение (3) приводит к кинетическому уравнению
- . (16)
- Это уравнение, приведенное к форме
- , (16а)
- известно как уравнение Кранка, Гистлинга и Браунштейна.
- Это уравнение более точное по сравнению с уравнением Яндера, так как было учтено изменение объема сферы по ходу реакции.
- Из уравнения (16) время полного завершения восстановления оксида ( )
- . (17)
- Сравнение с уравнением (7) для времени завершения процесса в кинетическом режиме приводит качественно к тем же выводам.
- Однако для процесса в диффузионном режиме следует отметить более сильное влияние размера зерен оксида и менее сильное влияние температуры, так как к сильному уменьшению за счет экспоненциального роста с ростом температуры добавляется некоторое увеличение с ростом величины T, находящейся в числителе уравнения (17).
- Пример 10.В таблице представлены экспериментальные данные по кинетике восстановления оксида никеля водородом (α – степень восстановления):
| Время t, час | ||||||
| α,% | 1200°С | 0,055 | 0,12 | 0,236 | 0,306 | 0,437 |
| 1300°С | 0,11 | 0,25 | 0,447 | 0,632 | 0,764 | |
| 1400°С | 0,27 | 0,414 | 0,765 | 0,989 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения со временем. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
Решение.
Представим данные опыта графически (рис.1).
- Видно, что в условиях опытов временная зависимость давления продукта имеет монотонный характер, и автокаталитический период отсутствует.
- Проверим применимость для описания кинетики процесса уравнения Мак-Кевана
- , которое можно представить уравнением ,
- где
- Результаты вычисления функции Y даны в таблице.
| t, час | ||||||
| Y | 1200°С | 0,019 | 0,042 | 0,086 | 0,115 | 0,174 |
| 1300°С | 0,038 | 0,091 | 0,179 | 0,283 | 0,382 | |
| 1400°С | 0,100 | 0,163 | 0,383 | 0,778 |
На рис 2 представлены значения функции Y в зависимости от времени при температурах опытов. Линии проведены с помощью одной из расчетно-графических программ ЭВМ, показаны уравнения линий и коэффициенты корреляции переменных.
Видно, что требуемая уравнением Мак-Кевана линейность функции выполняется достаточно удовлетворительно. Можно заключить, что процесс протекает в кинетическом режиме.
- Проверим применимость для описания кинетики процесса уравнения Яндера
- , которое можно представить уравнением ,
- где
- Результаты вычисления функции даны в таблице.
| t, час | ||||||
| Z | 1200°С | 0,0003 | 0,0017 | 0,0074 | 0,0131 | 0,0304 |
| 1300°С | 0,0015 | 0,0084 | 0,0321 | 0,0803 | 0,1459 | |
| 1400°С | 0,0099 | 0,0266 | 0,1466 | 0,6047 |
На рис 3 представлены значения функции Z в зависимости от времени при температурах опытов. Видно, что требуемая уравнением Яндера линейность функции не выполняется.
- Можно без проверки полагать, что и уравнение Кранка, Гистлинга и Браунштейна
- , которое как и уравнение Яндера описывает кинетику процесса в диффузионном режиме, также будет не применимым для представленных опытов.
- Степень восстановления характеризует скорость процесса. Поэтому уравнение Аррениуса можно записать в виде ,
- где E – кажущаяся энергия активации, а в константу входит коэффициент пропорциональности между константой скорости и степенью восстановления .
Для вычисления энергии активации представим уравнение Аррениуса графически в координатах . Вычисленные значения этих величин при заданной продолжительности восстановления представлены в таблице и графически (рис. 4)
| T,°С | T, K | 1/T | |||
| 0,000679 | -1,260 | -0,921 | -0,627 | -0,514 | -0,360 |
| 0,000636 | -0,959 | -0,602 | -0,350 | -0,199 | -0,117 |
| 0,000598 | -0,569 | -0,383 | -0,116 | -0,005 |
Найденные обобщенные константы скорости процесса восстановления, входящие в уравнения Мак-Кевана при температурах опытов, представим в таблице:
| T, K | K | 1/T | lgK |
| 0,020 | 0,000679 | -1,6990 | |
| 0,047 | 0,000636 | -1,3279 | |
| 0,116 | 0,000598 | -0,9355 |
На основании данных таблицы построим график в координатах , который соответствует уравнению Аррениуса . Здесь E – кажущаяся энергия активации гетерогенного процесса.
На графике приведено уравнение прямой линии и коэффициент корреляции переменных.
Вычисленное из углового коэффициента прямой кажущаяся энергия активации составляет . Такое значение энергии активации характерно для гетерогенных процессов, протекающих в кинетическом режиме.
Линии проведены с помощью расчетно-графической программы ЭВМ, показаны уравнения линий и коэффициенты корреляции переменных.
Характерна практически проявляющаяся параллельность прямых при продолжительности процесса 2…6 час. Это позволяет вычислить для данного временного интервала средний угловой коэффициент, который равен –6413, и кажущуюся энергию активации: . Кстати, кажущаяся энергия активации, найденная для всего временного интервала 1…8 час, равна 127,5 кДж и мало отличается от 122,6 кДж.
Механизм и кинетика восстановления газом твердых оксидов металлов
Доверь свою работу кандидату наук!
В зависимости от вида газообразного продукта восстановления в доменной печи различают прямое и косвенное восстановление. в первом случае продуктом является СО, а во втором СО2 или Н2О.
- FeO + CO = Fe+CO2
- СО2+С=2СО
- FeO+ С = Fe+CO
Обычно принимают в согласии с экспериментальными данными, что косвенное восстановление соответствует умеренным температурам (до 900-1000°С), а прямое – высоким.
В зоне умеренных температур восстановление Fe203 и Fe304 практически заканчивается, а восстановление FeO не заканчивается.
Поэтому восстановление Fe203 и Fe304 в основном проходит непрямым путем, а восстановление FeO и прямым и непрямым путем..
В шихтовых материалах окислы железа иногда находятся в виде сложных соединений и твердых растворов. В общем случае активность железа в окислах и соединениях и растворах снижается, а в равновесной газовой смеси доля восстановителя СО и Н2 должна расти. При низких температурах восстановление силикатов железа окисью углерода практически не идет. Они восстанавливаются в основном прямым путем
- Fe2SiO4 + 2C = 2Fe+SiO2+2CO.
- В области высоких температур возможна следующая схема восстановления силикатов железа.
- Fe2SiO4 = 2FeО+SiO2.
- 2FeO + 2CO = 2Fe+2CO2
- 2СО2+2С=4СО
- Fe2SiO4 + 2C = 2Fe+SiO2+2CO.
При этом расходуется 3150 кДж/кг железа. В случае прямого восстановления вюстита расходуется 2730 кДж/кг железа. Таким образом, для восстановления силикатов железа требуется дополнительный расход горючего.
- Механизм процесса восстановления
- Сегодня нет единой трактовки механизма восстановления окислов в доменной печи.
- Наиболее исследован процесс восстановления куска руды в области умеренных температур.
- В пространстве между кусками руды и в крупных порах течет газ-восстановитель.
· Для контакта с реакционной поверхностью газу-восстановителю нужно диффундировать по микропорам куска, а также через слой образовавшихся твердых продуктов восстановления внутрь куска. Газообразные продукты тем же путем отводятся из зоны реакции. Для описания диффузии через граничный слой газа толщиной l используется коэффициент массопередачи.
b = D/l, где D – коэффициент диффузии газа восстановителя
Коэффициент диффузии газов 1 и 2 в бинарной смеси
- где t – температура, °С
- р – давление , кПа
- М1 и М2 – молекулярные массы газов
- s1 и s2 — диаметры молекул газа , Å.
- При диффузии в порах удары молекул о стенки поры, будут чаще, чем столкномения молекул такое движение называется кнудсеновским или молекулярным, коэффициент кнудсеновской диффузии
- Dk = 8/3d(RT/2pM)1/2
- где d – эффективный размер поры.
· Далее необходима адсорбция газа-восстановителя на поверхности твердой фазы. На этой поверхности протекает реакция восстановления, включающая отнятие кислорода от окисла, образование и рост зародышей продуктов восстановления – магнетита, вюстита и железа.
· Последующее наращение слоя продуктов реакции происходит в результате твердофазных реакций и диффузии в твердой фазе. Диффузия преимущественно протекает по вакансиям кристаллической решетки вюстита.
Движущей силой на каждом этапе является отклонение от положения равновесия. Например, для диффузии — это разность концентраций (или давления) реагентов в начале и в конце диффузионного пути. Важное значение имеет определение лимитирующей стадии.
По С.Т. Ростовцеву критерием является показатель S = (ka/Db)1/2×r0
- где r0 – исходный размер окисного шара.
- k – константа скорости химической реакции
- a – удельная поверхность пор
- D – коэффициент диффузии газа через поры
- b – удельный объем пор.
- если S40 – процесс идет в диффузионном режиме скорость лимитируется подводом газа-восстановителя к реакционной поверхности.
- В промежуточной области при низких температурах – кинетический режим, при высоких – диффузионный.
Восстановление оксидов металлов газами
Рассмотрим вначале восстановление чистых оксидов на примере реакции косвенного восстановления углеродом
Допустим, что в системе отсутствует твердый углерод, т.е. реакция Белла—Будуара 2СО = Ств + С02 заторможена. Примем также, что конденсированные фазы чистые (яМс = 1; яМс0 = 1). Тогда
где %С02, %СО — процентные содержания (массовые) С02, СО в газовой атмосфере, состоящей только из этих газов. Число компонентов 4-1 = 3, число фаз 3. Поэтому С=3 + 2- 3 = 2. Следовательно, равновесие в системе можно изменять изменением двух параметров: р и Т.
Но, как видно из (2.33), общее давление р не влияет на равновесие, т.е. содержание СО и С02, поскольку реакция протекает без изменения числа молей или объема газа. Уравнение (2.34) также не содержит р.
Как принято в таких случаях, правило фаз можно применять в виде С = К + 1 — Ф. Тогда для реакции (2.33) С= 1, т.е. К2 33, или равновесный состав газовой смеси, зависит только от Т. Характер этой зависимости, согласно уравнению Вант-Гоффа (2.
7), определяется знаком теплового эффекта реакции (2.33). Ее можно представить в виде разности двух реакций:
Энтальпия реакции (2.35) (реакции догорания) отрицательна, поэтому знак АН2 33 зависит от знака и абсолютной величины энтальпии реакции окисления металла (2.
36), так как АН2 34 = АН2 35 — — АН2 36. Если в итоге АН2 33 < 0, то по принципу Ле-Шателье повышение температуры смещает реакцию (2.
33) влево, если АН2 33 > О, то, наоборот, с повышением Гбыстрее идет прямая реакция.
Уравнение изотермы реакции (2.33) имеет вид
где (%С02/%С0)' — отношение фактического содержания С02 и СО в газовой фазе. Чем более отрицательна эта разность, тем быстрее идет восстановление. На рис. 2.
9, который иллюстрирует зависимость равновесного содержания СО от Т, рассчитываемую по уравнениям (2.34) и изобары реакции (см. (2.
8)), область 1 — область устойчивого существования металла ((%СО)' > (%СО)), а область 2 — оксида ((%СО)' < (%СО)).
Рис. 2.9
то К2 33 тем меньше, чем больше стандартное сродство металла к кислороду (-AG^36 » 0). Поэтому у трудновосстановимых оксидов (МпО, ТЮ2, А1203, СаО и др.) и линия равновесия расположена высоко. Они устойчивы практически при любых температурах и составах газа. Восстановление газами, в том числе и СО, для них малоэффективно. У легковосстановимых оксидов (Cu20, PbO, Fe203 и др.
) кривые равновесия расположены низко (ЛГ233 » 1). Для оксидов FeO, Fe304, W03, Мп304 и др. К2 33 близко к единице, поэтому содержание СО и С02 сопоставимы, т.е. легко создать как восстановительную, так и окислительную атмосферу.
Восстановление газами, в том числе карботермическое, широко применяется для многих оксидов второго и третьего типов, например в металлургии железа, меди, никеля и др.
Реакции восстановления металлов в реальных условиях протекают, когда оксид и металл образуют взаимные растворы или растворяются в других веществах. Поэтому
и равновесный состав (К2 33 = const) зависит не только от Т, но и от состава растворов, т.е. от аМе и яМеС). Следовательно, возрастает число степеней свободы системы. Растворение металла, т.е. уменьшение аМс, вызывает убыль%СО, необходимого для восстановления,— ускоряется прямая реакция, а уменьшение яМе0, наоборот, приводит к возрастанию%СО.






