- Фактура покрытия
- Олово-висмут (лужение)
- Никелирование
- Оксидирование
- Немецкие инженеры освоили 3D-печать нанометрового масштаба
- Эксперимент: как в домашних условиях покрыть деталь медью, никелем, латунью и алюминием при помощи электролиза
- Что потребуется:
- Процесс электролиза меди, никеля, латуни и алюминия
- Смотрите видео
- Электролитические и химические покрытия
- Гальванизация | это… Что такое Гальванизация?
- Гальванические покрытия
- Электролиз
- Принцип электролиза
- Гальваническое покрытие
- Электроочистка
- Добыча металлов
- Анодирование
- Применение электролиза в производстве металлов: в чем заключается процесс и его применения
- Определение электролиза
- В чём заключается процесс
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- Активные металлы
- Менее активные металлы и неактивные металлы
- Практическое применение в производстве
- Видео
Порошковые полимерные краски различаются по цвету, по типу пленкообразователя и по получаемой в результате нанесения фактуре поверхности покрытия
Показать больше меньше
Мы предоставляем богатые возможности по кастомизации боксов. Вы можете выбрать форму, размеры и расположения отверстий, добавить необходимую фурнитуру, выбрать тип и цвет покрытия бокса и многое другое.
Цвет: RAL 5015
Эпоксидные порошковые краски составляют около 75% объема производства всех термореактнвных красок.
Эпоксидные порошковые краски обладают по сравнению с термопластичными порошковыми красками лучшей адгезией, термостойкостью, повышенной твердостью и блеском, более высокой химической стойкостью, их, можно наносить тонким слоем.
Эпоксидные порошковые покрытия отличаются высокой влагостойкостью, устойчивостью к перепаду температур, способностью к сохранению электроизоляционных свойств.
Эпоксидные порошковые краски предназначаются для защиты изделий электротехнической и радиоэлектронной промышленности — электродвигателей, конденсаторов, трансформаторов, электроприборов и др., для защиты химического оборудования, деталей мотоциклов, автобусов, тракторов, магистральных трубопроводов, для покрытия рулонного металла.
Полиэфирные порошковые краски обладают хорошими защитными и декоративными свойствами.
Эпоксидно-полиэфирные порошковые краски получают путем комбинирования эпоксидных и полиэфирных порошковых красок с последующим добавлением различных пигментов, наполнителей и модификаторов.
Фактура покрытия
Различия складываются из дисперсионного состава, величины частиц у порошковых красок. Допустимый размер частиц находится в пределах 5 — 350 мкм. В зависимости от методов нанесения краски допустимый размер варьируется.
Поверхность окрашенного изделия различается по глянцевости — способности отражать свет и по фактурности — величине неровностей покрытия.
В зависимости от требуемого состояния поверхности окрашенных порошковой краской изделий различаемых по глянцевости (матовости) и фактурности (шагрень, текстурированная, молотковая, муар и т.п.
), меняются требования к качеству состояния поверхности перед покраской.
Глянцевые ровные покрытия подчеркивают все дефекты поверхностного слоя, такие как царапины, выемки, риски и т.п.
Крупнофактурные — молотковые порошковые краски, наоборот, скрывают видимые дефекты, из-за чего они популярны при окраске дверей, ворот, скамеек, мебели и других изделий, требующих декоративности при сохранении простоты в изготовлении и минимальных объемах зачистки производственных дефектов перед окраской.


Под действием электрического тока в материал обрабатываемого изделия начинают проникать частицы металла и образуется защитное покрытие покрытие. Толщина слоя будет одинаковой на всей площади изделия.
В результате нанесения химического покрытия изначальный материал приобретает новые физические свойства, которыми не обладал — от антикоррозийных до электропроводности.
Антикоррозийные покрытия применяются для исключения появления ржавчины и разъедания металла, а декоративное нанесение позволяет сделать поверхность более привлекательной.
Гальванизация — это метод покрытия одного металла каким-либо другим путём электролиза. Процесс представляет собой электрохимический метод нанесения металлического покрытия на материал, проводящий электрический ток.
Показать больше меньше
Нанесение цинка или его сплава на металлическое изделие для придания его поверхности определённых физико-химических свойств, в первую очередь высокого сопротивления коррозии. Гальваническое цинкование — наиболее распространённый и экономичный процесс металлизации, применяемый для защиты железа и его сплавов от атмосферной коррозии.
производимое путем электрохимического процесса в специальном барабане (для мелких деталей и крепежа) или в ванной (более крупные детали). Гальваническое цинкование может иметь несколько цветов: радужный, голубой, белый и матовый белый.
Толщина цинкового покрытия при гальваническом цинковании составляет 10-20 мкм, поэтому гальваническое покрытие носит в основном декоративный характер.

Олово-висмут (лужение)
Нанесение тонкого слоя олова на поверхности изделий (листов, ленты, проволоки и др.) из металла (стали, меди) для защиты их от коррозии.
Покрытие представляют собой один из самых безвредных соединений олова и обладает высокими антикоррозионными свойствами, применяемостью практически во всех отраслях металлообработки.
При введении в электролит блескообразующей добавки, покрытие характеризуется высокими декоративными свойствами.

Никелирование
Подвергаются преимущественно изделия из стали и сплавов на основе меди и алюминия. Никелирование применяется для защиты изделий от коррозии (в атмосферных условиях, в растворах щёлочей, солей и слабых органических кислот), повышения износостойкости деталей, а также в защитно-декоративных целях. Чаще никелирование (матовое) производится электролитическим способом.

Оксидирование
Покрытие на алюминии и стали, которое применяют для защиты деталей от коррозии и истирания, а также для декоративной отделки полированных или окрашенных поверхностей; для специальных целей, связанных с особыми свойствами (электрическая и тепловая изоляция, большая пористость и высокая степень адсорбции и др.). Данные покрытия обладают значительной износостойкостью (особенно при отрицательной температуре). Из-за черного цвета изделия (цвет крыла ворона) оксидирование стали называть воронением.



Чтобы сделать гравировку нами используется гравировально-фрезерный станок с ЧПУ, способный создавать не только надписи, но и полноценные объемные изображения (3D). Также имеется возможность производить гравировку с затиркой эмалью. Гравировка на заказ активно пользуется спросом у разработчиков радио и телекоммуникационной аппаратуры, в медицине и музыкальном оборудовании.
Гравировка предназначена для любых металлических поверхностей, покрашенных или с нанесенной химической защитой(гальваника). В последнее время гравировка на металле получила широкое распространение наряду с классической шелкографией(метод фотопереноса).
Показать больше меньше


У вас есть огромные возможности кастомизации своего бокса – от выбора формы, расположения и размера отверстий до выбора цвета и типа покрытия,
У вас есть огромные возможности кастомизации своего бокса – от выбора формы, расположения и размера отверстий до выбора цвета и типа покрытия, такжы вы можете подобрать необходимую фурнитуру – ножки, замки, ручки и многое другое:
У вас есть огромные возможности кастомизации своего бокса – от выбора формы, расположения и размера отверстий до выбора цвета и типа покрытия, такжы вы можете подобрать необходимую фурнитуру – ножки, замки, ручки и многое другое:
У вас есть огромные возможности кастомизации своего бокса – от выбора формы, расположения и размера отверстий до выбора цвета и типа покрытия, такжы вы можете подобрать необходимую фурнитуру – ножки, замки, ручки и многое другое:
У вас есть огромные возможности кастомизации своего бокса – от выбора формы, расположения и размера отверстий до выбора цвета и типа покрытия, такжы вы можете подобрать необходимую фурнитуру – ножки, замки, ручки и многое другое:
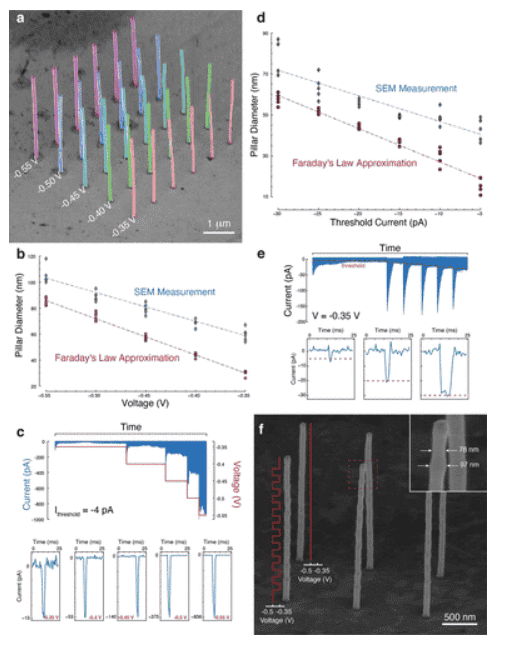
Немецкие инженеры освоили 3D-печать нанометрового масштаба
Используя процесс, похожий на гальванику, исследователи из Ольденбургского университета напечатали на 3D-принтере структуры в масштабе 25 нанометров.

Гальванизация представляет собой метод покрытия одного металла каким-либо другим путем электролиза.
Инженеры работали с медной солью и крошечным соплом (всего 1,6 нанометра). Такого размера достаточно для одновременного размещения двух ионов меди.
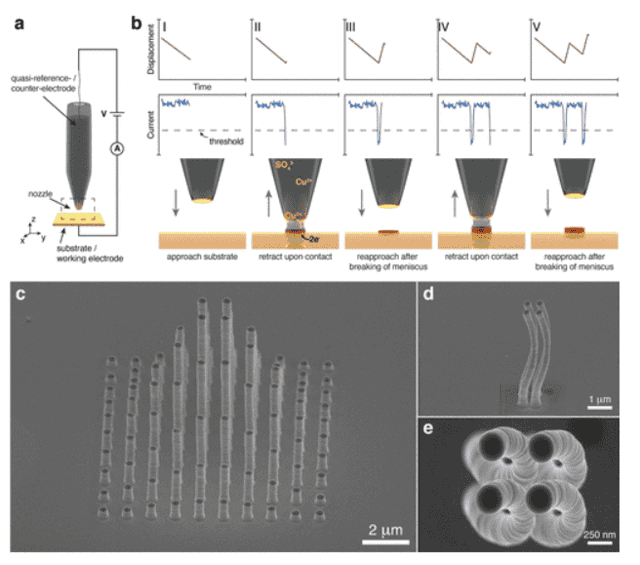 Схема печатной установки. Сопло, содержащее раствор электролита, размещено над проводящей подложкой. Подложка и сопло перемещаются друг относительно друга с помощью пьезоэлектрических нанопозиционеров / pubs.acs.org
Схема печатной установки. Сопло, содержащее раствор электролита, размещено над проводящей подложкой. Подложка и сопло перемещаются друг относительно друга с помощью пьезоэлектрических нанопозиционеров / pubs.acs.org
Однако крошечные сопла подвержены засорению. Чтобы решить проблему, команда создала систему управления с обратной связью, которая измеряет электрический ток между рабочей зоной и внутри сопла. Точной работы сопла получилось достичь за счет интегрированной системы микро- и нанопозиционирования, которая сочетает в себе микродвигатели и точное перемещение в наномасштабе с пьезоактивами.
 Контроль напряжения и процесса печати / pubs.acs.org
Контроль напряжения и процесса печати / pubs.acs.org
В 25-нанометровом масштабе разместили менее 200 атомов меди.
Напечатанные с помощью 45-нм сопла наклонные и выступающие элементы / pubs.acs.org
Инженеры отмечают, что ценность их метода в том, что до сегодняшнего дня наноразмерная 3D-печать рассматривалась как альтернативный метод для производства электроники и нанооптики, датчиков и наноробототехники. По их словам, электрохимические методы позволяют производить металлические проводники без примесей с превосходными электрическими и механическими свойствами, однако истинное наноразмерное разрешение (
Эксперимент: как в домашних условиях покрыть деталь медью, никелем, латунью и алюминием при помощи электролиза

Медь, никель, латунь и алюминий обладают стойкостью к коррозии, поэтому их тонкий слой на поверхности стали может защитить ее от появления ржавчины. Нанести один металл на другой можно методом электролиза. Но он работает не всегда. Давайте проверим его на предложенных металлах.
Что потребуется:
- образцы металлов;
- уксус;
- соль;
- блок питания постоянного тока;
- пластиковые емкости.
Процесс электролиза меди, никеля, латуни и алюминия
Для электролиза необходимо подготовить электролит. В его качестве применяется уксус. Процесс выполняется в пластиковой емкости, так как она является диэлектриком. В уксус добавляется соль для лучшей проводимости.
Для меднения необходимо согнуть из медной проволоки 2 электрода, опустить их в электролит и подключить провода к питанию.
Спустя 20 мин электрод на плюсовой клемме очистится от окиси, которая перейдет на отрицательный.
Теперь если подключить к минусовому проводу стальной предмет, то он покроется равномерным аккуратным слоем меди.
Для никелирования повторяется аналогичное действие с двумя электродами уже из этого металла. Через 20 минут к минусовому проводу цепляется стальная деталь. Она также покроется слоем никеля.
Если же повторить эксперимент с латунью, то ничего не получится. На стальной детали появится только окись. Выглядеть, как латунная она не будет.
Не работает и перенос алюминия на сталь. При электролизе электролит только загрязниться, станет темно-серым. Сама же деталь вообще останется неизменной.
Смотрите видео
Электролитические и химические покрытия
Электролитическое (гальваническое) покрытие — это процесс нанесения металла на поверхность детали путём кристаллизации его из раствора соответствующей соли (электролита) в результате прохождения через соль электрического тока. На рис12.1 — показана простейшая схема электролитического осаждения металла. Ванну 1 заполняют электролитом 4; при пропускании через него постоянного тока молекулы раствора расщепляются на положительно заряженные частицы — катионы, которые перемещаются к отрицательному электроду 3 (катоду), где осаждаются, превращаясь в нейтральные атомы, и отрицательно заряженные частицы — анионы, перемещающиеся к положительному электроду 2 (аноду), где также теряют свой заряд и превращаются в нейтральные атомы.
При многих процессах катодом служит обрабатываемая деталь, анодом -либо металл, соль которого находится в растворе, либо металл, который нерастворим в электролите.
Хромирование. Хромовые покрытия применяют для восстановления размеров изношенных деталей, а также в качестве антикоррозийного и декоративного покрытия. Хромовые покрытия отличаются высокой твердостью, хорошей износостойкостью, превышающей в 2-3 раза износостойкость закаленной стали 45, хорошей сцепляемостью почти с любыми металлами, высокой кислотостойко-стыо и теплостойкостью.
- К недостаткам хромирования относят ограничение толщины покрытия (до 0,3), так как при большей толщине слой хрома отслаивается и теряет износостойкие свойства; относительно низкую производительность процесса (до 0,03 мм/ч) из-за малых значений выхода металла по току; высокую стоимость процесса.
- Хромирование слагается из подготовительных операций, собственно хромирования и заключительных операций после наложения хрома.
- Подготовительные операции имеют такую последовательность:
- 1) предварительная механическая обработка (шлифование и при необходимости полирование) изношенной поверхности детали с целью придания этой поверхности правильной геометрической формы и доведения её до нужных размеров с учётом припуска на хромовое покрытие;
- 2) очистка деталей от окислов шлифовальной шкуркой и предварительное обезжиривание промывкой в растворителях — дихлорэтане, уайт-спирите, бензине и др.;
3) установка детали в подвесном приспособлении с целью правильного базирования её относительно анода и для соединения с контактами токопрово-дящих шин;
4) изоляция мест, не подлежащих хромированию, покрытием этих мест ца-пон — лаком в смеси с нитроэмалью в соотношении 1:2, либо нанесением пленки из перхлорвинилового пластика толщиной 0,3-0,5 мм, либо применением клея БФ и др.;
5) окончательное обезжиривание детали (эта операция должна выполняться весьма тщательно, так как тончайшая жировая плёнка изолирует поверхность детали от электролита. Наилучшие результаты обеспечивает электрохимическое обезжиривание с подвеской детали на катоде.
В качестве электролита используют щелочной раствор следующего состава (в г/л): едкий натр — 10, кальцинированная сода — 2,5, тринатрийфосфат — 2,5, эмульгатор ОП-7 — 2-5.
Обезжиривание протекает при температуре раствора 70-80°С, плотности тока 5-10 А/дм2, длительности процесса 1-2 мин);
6) анодная обработка (декапирование), выполняемая с целью удаления с поверхности детали тончайших пленок окислов (эта операция осуществляется путём погружения детали вместе с подвеской в ванну для хромирования, но при включении обратного тока, т. е. анодом служит деталь.
Процесс сводится к электролитическому растворению металла и одновременно к механическому отрыву окислов выделяющимся кислородом.
После завешивания детали в ванну ее предварительно прогревают без тока 1-2 мин, а затем ведут анодную обработку в течение 30—45 с при плотности тока 30-35 А/дм2).
После анодной обработки деталь, не вынимая из ванны, переключают на катод и наносят покрытие.
Хромирование. При хромировании в качестве электролита используют водный раствор хромового ангидрида (Сг03). Процесс хромирования удовлетворительно протекает в присутствии ионов S04 с применением нерастворимых (свинцово-сурьмянистых) анодов (95 % свинца и 5 % сурьмы).
Серная кислота в электролите играет роль катализатора, способствуя осаждению хрома. Соотношение между концентрацией хромового ангидрида и серной кислотой (Cr03/H2S04) должно находиться в пределах от 90 до 120. В этом случае обеспечивается наибольший выход по току хрома.
Осталивание — процесс электролитического осаждения железа. Осталива-ние намного производительнее и экономичнее хромирования, так как скорость осаждения металла составляет 0,3-0,5 мм/ч, а выход по току достигает 85-90 %, т.е. в 5-6 раз выше, чем при обычном хромировании.
Сцепляемость железного покрытия с поверхностью стальной детали достаточно высокая (400-450 МПа). К недостаткам процесса относится снижение усталостной прочности деталей, достигающее 30 % при покрытии стальных деталей.
Это обусловлено наличием растягивающих внутренних напряжений в покрытии.
Осталивание применяют для наращивания поверхностей деталей под неподвижные посадки, для восстановления деталей с большим износом (до 2-3 мм), а также с целью получения подслоя в 1-3 мм для тонкого хромового покрытия (0,02-0,03 мм).
Процесс осталивания обычно протекает в хлористых электролитах, основным компонентом которых является хлористое железо РеС12 -4Н20. Концентрация хлористого железа в электролитах может быть в пределах от 200 до 700 г/л.
Наиболее стабилен в работе электролит средней концентрации, содержащий (400 ± 20) г/л РеС12 -4Н20, (2 ± 0,2) г/л НС1 и (10 ± 2) г/л МпС12 -4Н20.
Наличие соляной кислоты необходимо для устойчивой работы ванны; хлористый марганец способствует повышению сцепляемости покрытия с основным металлом.
При осталивании деталь является катодом. В качестве анода используют низкоуглеродистую сталь марки 08 или 10. В процессе электролиза анод постепенно растворяется. Концентрация соляной кислоты при работе ванны снижается, поэтому необходимо периодически контролировать состав электролита с добавлением концентрированной соляной кислоты.
Качество покрытия (твердость, износостойкость, вязкость) зависит от состава и температуры электролита, плотности тока. Мелкозернистые и вязкие покрытия получаются при малой плотности тока и высокой температуре; с увеличением плотности тока, снижении температуры электролита и уменьшении концентрации хлористого железа твердость покрытия возрастает.
Технологический процесс осталивания мало, чем отличается от хромирования.
При подготовке детали к осталиванию не всегда требуется предварительное её шлифование: при наращивании значительного слоя деталь обычно не шлифуют.
Другие подготовительные операции (обезжиривание, изоляция мест, не подлежащих осталиванию, вторичное обезжиривание, анодная обработка) принципиально те же, что и при хромировании.
В процессе осталивания выделяется большое количество вредных газов, поэтому требуются мощные вентиляционные установки.
Гальванизация | это… Что такое Гальванизация?
- ГАЛЬВАНИЗАЦИЯ — (по им. итальянск. физика Гальвани, 1737 1798). То же что электризация, т. е. лечение больного гальваническим током. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ГАЛЬВАНИЗАЦИЯ или ГАЛЬВАНИЗИРОВАНИЕ 1) применение … Словарь иностранных слов русского языка
- гальванизация — воскрешение, гальванизирование Словарь русских синонимов. гальванизация см. воскрешение Словарь синонимов русского языка. Практический справочник. М.: Русский язык. З. Е. Александрова … Словарь синонимов
- гальванизация — и, ж. galvanisation f. Использование постоянного электрического тока в технических или медицинских целях. БАС 2. || перен. Оживление, возбуждение. Этот спектакль < Принцесса Турандот > был дивный спектакль, совсем не та гальванизация, которую… … Исторический словарь галлицизмов русского языка
- ГАЛЬВАНИЗАЦИЯ — в медицине метод электротерапии; лечение постоянным током небольшой силы и напряжения. Применяется при заболеваниях периферической нервной системы (радикулитах, плекситах, невритах), артритах травматического, ревматического, обменного… … Большой Энциклопедический словарь
- ГАЛЬВАНИЗАЦИЯ — ГАЛЬВАНИЗАЦИЯ, гальванизации, мн. нет, жен. (спец.). Действие по гл. гальванизировать. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
- ГАЛЬВАНИЗАЦИЯ — ГАЛЬВАНИЗАЦИЯ, и, жен. Применение с лечебной целью постоянного электрического тока небольшой силы и напряжения. | прил. гальванизационный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
- гальванизация — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN galvanisation The act of coating iron or steel with zinc, either by immersion in a bath of molten zinc or by deposition from a solution of zinc sulphate, to give protection… … Справочник технического переводчика
- гальванизация — и; ж. Применение постоянного электрического тока в технических и медицинских целях. ◁ Гальванизационный, ая, ое. * * * гальванизация (мед.), метод электротерапии; лечение постоянным током небольшой силы и напряжения. Применяется при заболеваниях… … Энциклопедический словарь
- гальванизация — galvanizacija statusas T sritis fizika atitikmenys: angl. galvanization vok. Galvanisation, f; Galvanisierung, f rus. гальванизация, f pranc. galvanisation, f … Fizikos terminų žodynas
- Гальванизация в физиотерапии — Гальванизация это воздействие на организм с лечебно профилактическими целями постоянным непрерывным электрическим током малой силы и малого напряжения через контактно наложенные на тело больного электроды. Содержание 1 Механизм действия 2 … Википедия
Гальванические покрытия
Гальванизация — это метод покрытия одного металла каким-либо другим путём электролиза. Гальванизируют поверхности в декоративных целях (например, посеребрение). В промышленности же гальванизацию применяют для укрепления металлической поверхности изделий и защиты их от воздействия внешней среды, например от коррозии; обычно гальванизируют цинком(оцинковка), медью, хромом, никелем.
-
Гальваническое оцинкование стального крепежа, проволоки, лента, листовых материалов, сложно-профилированных деталей в т.ч с изоляцией внутренних и внешних поверхностей:
Единичные детали: Масса, кг до 200 Габаритные размеры, мм до1000х600х600 Серийные и массовые детали: Масса, кг до 30 Габаритные размеры, мм до 500х500х500 -
Гальваническое кадмирование стальных крепежа, проволоки, лент, листовых материалов, сложно-профилированных деталей в т.ч. с изоляцией внутренних и внешних поверхностей:
Единичные детали: Масса, кг до 200 Габаритные размеры, мм до 1000х600х600 Серийные и массовые детали: Масса, кг до 30 Габаритные размеры, мм до 500х500х500 -
Гальванические и химические защитные покрытия на алюминий и его сплавы (крепеж, проволока, ленты, листовые материалы, сложно-профилированные детали с любой резьбой в т.ч с изоляцией внутренних и внешних поверхностей) с пропиткой и без:
Масса, кг до 50 Габаритные размеры, мм до 1000х600х600
-
Оксидирование стальных крепежа, проволоки, лент, листовых материалов, сложно-профилированных деталей:
Масса, кг до 100 Габаритные размеры, мм до 500х500х600 -
Фосфатирование стального крепежа, проволоки, ленты, листовых материалов, сложно-профилированных деталей:
Масса, кг до 100 Габаритные размеры, мм до 600х600х600
-
Оловянирование (лужение) стальных и медных деталей (крепеж, проволока, контакты, ленты, листовые материалы, сложно-профилированные детали с любой резьбой, в т.ч. с изоляцией внутренних и внешних поверхностей), в т.ч. с оплавлением:
Масса, кг до 100 Габаритные размеры, мм до 600х600х600 -
Омеднение стальных деталей (крепеж, проволока, контакты, ленты, листовые материалы, сложно-профилированные детали с любой резьбой в т.ч. с изоляцией внутренних и внешних поверхностей):
Масса, кг до 100 Габаритные размеры, мм до 600х600х600
-
Электроизоляционные покрытия на алюминий и его сплавы (крепеж, проволока, ленты, листовые материалы, сложно-профилированные детали с любой резьбой, в т.ч с изоляцией внутренних и внешних поверхностей) с пропиткой и без:
Масса, кг до 20 Габаритные размеры, мм до 500х500х500
| По вопросам обращаться, отдел продаж: тел.: +7 (351) 255-21-69; факс: +7(351) 253-78-42 | Заказать услугу |
Электролиз
Электролиз — это метод разделения компонентов соединения при помощи электрического тока, проходящего через расплавленное соединение или раствор. Электролиз широко применяется в промышленности — для извлечения активных металлов из руд, для очистки металлов, для нанесения тонких металлических покрытий.
Принцип электролиза
При электролизе ток могут проводить только ионные соединения (основанные на ионных связях) — благодаря тому, что атомы в этих соединениях потеряли или приобрели электроны и обрели электрический заряд — превратились в ионы.
В растворе ионного соединения, например хлорида меди, ионы могут свободно передвигаться. В состав хлорида меди входят положительно заряженные ионы меди и отрицательно заряженные ионы хлора. С помощью электродов электрический ток подводится к раствору – электролиту.
Катод – это электрод с отрицательным зарядом, анод – электрод с положительным зарядом. Поскольку противоположные заряды притягиваются, то отрицательно заряженные ионы в электролите собираются вблизи анода, а положительно заряженные – вблизи катода.
При электролизе ионы обоих элементов собираются около электродов противоположного заряда, таким образом элементы разделяются.
Гальваническое покрытие
Электроочистка
Электроочистка — это электролитический метод очистки металлов. Например, медь с примесями служит анодом, а катод сделан из чистой меди. Электролит — раствор сульфата меди. Медь с анода растворяется в электролите в виде положительно заряженных ионов, которые затем перемешаются к катоду.
Добыча металлов
Электролиз помогает извлечь из руд очень активные металлы — натрий, алюминий. Алюминиевые руды — бокситы — состоят в основном из оксида алюминия. Для электролиза оксид алюминия растворяют в криолите. Внутри стенки электролизера покрыты углеродом, который играет роль катода. Ионы алюминия притягиваются к катоду, около которого образуется слой жидкого алюминия.
Анодирование
Вы сами можете путем электролиза разложить воду на водород и кислород, которые будут выделяться в виде пузырьков. Соберите оборудование так, как показано на рисунке. Имеющиеся вводе примеси проводят ток между грифелями карандашей — электродами. Положительные ионы водорода собираются возле отрицательного электрода, и пузырьки этого газа выделяются из воды. Около другого карандаша выделяются пузырьки кислорода. Пузырьков водорода больше, так как в каждой молекуле воды имеются два атома водорода и только один атом кислорода.
Применение электролиза в производстве металлов: в чем заключается процесс и его применения
Электролиз в промышленных масштабах используется для извлечения из металлосодержащих руд металлов и их очищения от примесей. При помощи этого физико-химического процесса на производстве получают медь и алюминий. Заряд химических источников тока (аккумуляторов) также происходит, благодаря протеканию этой реакции.
Определение электролиза
Химическая реакция, в результате которой на электродах происходит оседание компонентов из электролитических растворов веществ, и протекающая под действием электрического тока – вот что такое электролиз. Он включает в себя комплекс процессов окисления и восстановления, происходящих на электродах. Обязательным условием является движение постоянного тока от электрода к электроду.
В чём заключается процесс
Катод — определение и практическое применение
Технологический порядок электролиза, или ещё его называют гальванолизом, происходит по законам химии и физики. При этом берутся электропроводящие растворы (жидкости), в которых при помощи двух электродов организовано электрическое поле.
Внимание! Электроды имеют названия. Катод (К) – электрод, имеющий отрицательный потенциал, анод (А) – электрод с положительным потенциалом.
Ионы движутся упорядоченно через раствор, который носит название электролита.
При этом ионы, относящиеся к металлам, водороду (катионы) направляются к катоду, к аноду стремятся ионы, принадлежащие к кислотным остаткам или гидроксильной группы (анионы).
Катионы имеют положительный знак заряда, анионы – отрицательный. Пропускание электрического тока при электролизе может осуществляться, как через растворы, так и через расплавы электролитов.
Информация. При приготовлении электролита происходит диссоциация раствора на ионы. Это обусловлено взаимодействием растворителя на растворяемое вещество. Такая реакция называется первичной. Дальнейшее воздействие электрического тока на электролит вызывает вторичную реакцию гальванолиза.
Подобное разделение на первичность и вторичность позволило Майклу Фарадею обосновать законы, применяемые к гальванолизу.
Электролиз растворов
Использование воды для приготовления раствора электролита осложняет процесс. В растворах солей и щелочей вода ведёт себя при электролизе неоднозначно. Это проявляется в том, что H2O ведёт себя как окислитель, так и как восстановитель.
На катоде она получает электроны и восстанавливает атомы водорода до газообразной формы водорода. На аноде вода отдаёт отрицательно заряженные частицы, тогда атомы кислорода окисляются до газообразной формы кислорода.
Кислота, используемая в качестве раствора для электролита, лишена этой проблемы.
Катодные процессы
Катод, помещённый в растворы солей, притягивает к себе катионы металлов. Эти катионы выступают как окислители.
Важно! У отдельных металлов способности ионов окислять различны. Чтобы оценить способности окисления – восстановления, необходимо опираться на электрохимический ряд напряжений.
Электрохимический ряд металлов
У каждого металла (далее обозначен как М) свой электрохимический потенциал (ЭХП). Чем он меньше, тем восстановительные свойства выше, а окислительная способность у соответствующих ионов этого металла ниже.
ЭХП величина относительная, потому у отдельных ионов разная величина ЭХП. У водорода он равен нулю.
Во время процесса электролиза, протекающего в растворах солей, выявлены следующие замечания:
- когда в солях присутствуют активные М, то не они восстанавливаются на катоде, а водород;
- если М в электролите имеет среднюю активность, то на катоде разряжаются (восстанавливаются) оба: и водород, и М;
- при неактивном М на катоде восстанавливается только он, потому что его ион – более сильный окислитель, чем водородный ион.
Примерами таких процессов на катоде могут служить следующие реакции:
- при активном М: 2H2O +2ē → H2 + 2OH—;
- при М средней активности: Men+ + nē → Me0 и 2H+2O +2ē → H20 + 2OH—, где Ме – это растворённый металл;
- в случае неактивного М в солях: Men+ + nē → Me0.
Замечено, что, когда с катодом взаимодействуют водородные катионы H+, происходит их разряжение до молекул водорода — 2H+ + 2ē → H20
Анодные процессы
Плюс, поданный на анод, притягивает к себе анионы вместе с молекулами воды. В данном случае анод является окислителем, а восстановители – молекулы H2O или анионы кислотных остатков.
В процессе гальванолиза на аноде происходят следующие реакции:
- кислотные остатки, не содержащие кислорода, окисляются до нулевой степени окисления: неМеn- – nē = неМе0, где – неМе – это неметалл;
- при содержании в остатке кислорода окисляется вода и выделяет молекулы кислорода (молекулярный кислород О2): 2H2O-2 – 4ē → O20 + 4H+;
- в случае контакта с анодом гидроксид-иона последний также окисляется: 4O-2H– – 4ē → O20 + 2H2O, с выделением молекулярного кислорода.
Исключение. Фтор обладает электроотрицательностью более высокой, чем кислород. Поэтому электролиз растворов фторидов протекает с окислением молекул воды вместо фторид-ионов.
Суммарные процессы электролиза
Что получается в суммарной реакции гальванолиза, можно рассмотреть на примере хлорида натрия. При пропускании электрического тока на электродах происходит следующее:
- катод – на нём восстанавливается H – водород: 2H+2O +2ē → H20 + 2OH–;
- анод – на электроде происходит окисление хлорид-ионов: 2Cl– – 2ē → Cl20.
В этой реакции электролиза не принимают участия ионы натрия. Тем не менее, они входят в суммарное уравнение раствора хлорида натрия при электролизе. Оно имеет вид:
2H+2O + 2NaCl– → H20 + 2NaOH + Cl20.
Электролиз расплавов
Если сравнить гальванолиз расплавов и растворов, то в расплавах все М: активные, малоактивные и неактивные, реагируют на процесс электризации одинаково.
Внимание! Вода при электролизе расплавов в электролите отсутствует. Поэтому осложнений, связанных с её вмешательством, не возникает. Описание такой реакции можно рассмотреть на примере расплава NaCl (хлористого натрия).
- В этом случае на катоде происходит восстановление катионов Na:
- Na+ + ē → Na0.
- Анод вызывает окисление анионов Cl:
- 2Cl– – 2ē → Cl20.
- Общее уравнение гальванолиза расплава NaCl будет иметь вид:
- 2Na+Cl– → 2Na0 + Cl20.
Схема электролиза расплава NaCl
Электролиз с растворимыми электродами
В этом случае электролиз металлов осуществляется при помощи электродов, выполненных из того же М, который присутствует в электролите. Также электроды могут быть изготовлены из М активностью выше.
Важно! При протекании этого процесса на аноде восстанавливаются не анионы или молекулы H2O, а окисляется сам анод. Его частицы растворяются (окисляются) и восстанавливаются уже на катоде.
В случае с медным анодом при электролизе меди, где электролитом является сульфат меди, происходит следующее:
- ионы меди, входящие в раствор, восстанавливаются на катоде: Cu2+ + 2ē → Cu0;
- медный анод подвергается окислению своих частиц меди: Cu0 – 2ē → Cu2+.
Таким образом, если медную заготовку, имеющую примеси, использовать в качестве анода при гальванолизе в сульфате меди, то на катоде будет оседать медь в чистом виде. Анодный электрод при этом будет растворяться.
Электролиз с растворимыми анодами
Вот перечень некоторых металлов, которые могут быть растворимыми электродами:
- медь (Cu);
- серебро (Ag);
- цинк (Zn);
- кобальт (Co);
- олово (Sn);
- никель (Ni);
- кадмий (Cd).
На растворимом аноде в начальной стадии электролиза процессы проходят при минимальном стандартном потенциале на электроде. Если электролиз не остановить, то значение потенциала отклоняется в отрицательную сторону. Это вызвано поляризацией из-за пребывания на катоде электронов.
К сведению. Потенциалы электродов могут отклоняться от их изначального значения в ходе электролиза. Это явление называют поляризацией. Она бывает электрохимической и концентрационной.
Активные металлы
Это тот тип металлов, который легко вступает в реакции. В периодической таблице это элементы 1-й и 2-й группы. Так как металлические свойства у элементов становятся слабее в ряду слева направо, то к ним относятся:
- щелочные металлы: литий, калий, натрий, цезий, франций, рубидий;
- щелочноземельные элементы: бериллий, магний, кальций, стронций, барий, радий;
- алюминий.
Данные металлы имеют один или два валентных электрона и легко их отдают, являясь восстановителями. К отличительным особенностям активных металлов относятся:
- мягкость;
- лёгкость;
- низкая температура плавления.
При взаимодействии с кислородом (на воздухе) щелочных металлов возможно самовозгорание. Самовозгорание щелочноземельных металлов происходит при повышении температуры. При взаимодействии их с водой образуются щёлочь и водород, вступая в реакцию с кислотами, они образуют соли.
Менее активные металлы и неактивные металлы
Среднюю активность проявляют металлы, стоящие в ряду после алюминия Al и до водорода H2.
К неактивным относятся элементы, стоящие правее водорода: медь (Cu), ртуть (Hg), серебро (Ag), платина (Pt), золото (Au).
Таблица химической активности металлов
Практическое применение в производстве
Такой электрохимический процесс, как электролиз, примеры которого можно увидеть повсеместно, является неотъемлемой частью промышленности:
- получение химически чистого сырья: фтор, хлор, щёлочи, чистые водород и кислород и т.д.;
- применение электролиза в гидрометаллургии: переработка сырья с содержанием металлов;
- элекрорафинирование (применение растворимых анодов) для окончательной очистки металлов;
- электроэкстракция (использование нерастворимых анодов) для выделения нужных металлов из растворов;
- гальванические процессы: гальванопластика и гальваностегия.
Информация. Процессы электролиза не протекают бесконтрольно. В цепь электролизёра включают медный кулонометр. Единица измерений прибора – 1 Кл (кулон). В этом случае контролируется количество результата (продукта) анодных, катодных реакций при 100%-ном выходе по току, необходимому для прохождения реакций.
Гальваностегия – способ электрохимического покрытия металлических поверхностей другими металлами:
- сталь подвергают никелированию, хромированию, оцинкованию;
- медь покрывают серебром, никелем и иными металлами.
Поверхность основания обрабатывают так, чтобы покрытие держалось крепко и защищало конструкцию от влияния внешних факторов. В то же время изделиям придавался эстетический вид.
Гальванопластика позволяет получать точные копии заготовки, выполненные из благородных металлов. Широко используется при изготовлении матриц, копий со скульптур, ювелирных изделий, деталей сложной геометрии. При этом способе важно, чтобы заготовка отделилась от покрытия.
Украшения после гальванопластики
Электролиз открывает широкие возможности для работы с металлами и электролитами. При помощи этого процесса можно самостоятельно выполнять работы не только в области гальванотехники, но и получать чистые металлы в небольших количествах. При этом не стоит путать самопроизвольные химические реакции в гальванических элементах и реакции, протекающие в электролизёрах.






