- Основные группы металлов в промышленности
- Черные металлы
- Легкие цветные металлы
- Тяжелые цветные металлы
- Благородные металлы
- Редкоземельные и щелочные
- Классификация металлов по химическому составу
- Атомно — кристаллическое строение металлов
- Физические свойства металлов
- Электронное строение металлов и их особенности
- Кристаллическая решетка металлов
- Типы кристаллических решеток
- Кристаллическое строение сплавов
- Кристаллизация сплавов
- ответы на материаловедение 2 семестр. матвед экзамен. 1. Типы межатомных связей и их влияние на свойства материалов
- Электроматериаловедение
- Классификация электроматериалов. Диэлектрики
- Урок «Материаловедение. Типы атомных связей»
- Типы межатомных связей. Влияние на свойства материалов
- 3) Металлическая связь
- 4) Связь Ван – дер – Вальса
Металлы — один из самых распространенных веществ в материальной культуре человека.
Тысячелетиями медь, железо, серебро и золото были основным материалом для производства оружия, инструментов, ответственных частей транспорта и механизмов, деталей домашней утвари и украшений.
В XIX веке, с освоением технологии получения чугуна, металлы пришли в строительство и станкостроение. XX век был веком металлов.

Металлы
В нашу жизнь вошли алюминий, титан, бор и многие более редкие металлы. Используя их, человечество шагнуло в небо, космос и глубины океана. Металлы сделали возможным массовое производство домашней бытовой техники.
В конце XX века пластмассы и композитные вещества ощутимо потеснили металлы с лидирующих позиций.
Основные характеристики металлов — прочность, упругость и пластичность определяются их физико-химическими свойствами и атомным строением.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.
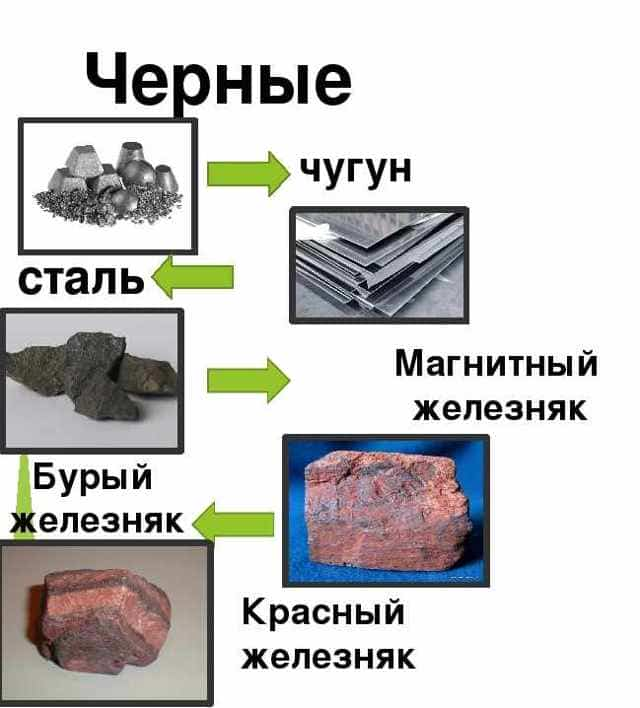
Черные металлы
Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.

Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
 Медь
Медь
 Олово
Олово
 Цинк
Цинк
 Свинец
Свинец
 Чистый никель
Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
 Золото и платина
Золото и платина
 Серебро
Серебро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
Иттрий
Сканидий
Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.
Щелочные металлы
Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой.Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д.
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.
Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным.
При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов.
Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
Главное отличие металлов от других элементов — это их электропроводность и магнитные свойства.
И хотя ученые создали неметаллические материалы, обладающие другим строением, но такими же свойствами, как у металлов и сплавов, они еще слишком дороги для массового применения. Многие химически чистые металлы обладают недостаточной прочностью для практических применений, чтобы исправить ситуацию, в технике и строительстве используют их сплавы.
Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Электронное строение металлов и их особенности
Внутреннее строение реальных металлов определяет их физико-химические параметры.
Кристаллическая решетка металлов
Все металлы в твердом фазовом состоянии имеют кристаллическое строение. Это пространственное образование из многократно повторяющихся первичных структур называют кристаллической решеткой.схема кристаллической решетки.
Кристаллическое строение металлов
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция равна по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, его параметры зависят от направления.
В реальном куске металлов, который состоит из множества кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. Усредненные параметры такого куска близки к изотропным.
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
Уникальная возможность железа заключается в том, что до 910°С оно имеет кубическую объемно-центрированную структуру, а при нагреве свыше этой температуры переходит к гранецентрированной.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода.
Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями.
Кристаллическое строение сплавов сложнее, чем металлов.
Строение сплавов
Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Физические свойства сплавов могут заметно меняться при изменении процентного соотношения составляющих.
Кристаллизация сплавов
Первичная кристаллизация — это затвердевание расплава с образованием кристаллических решеток. Пространственные атомные и молекулярные структуры, возникающие в ходе такого процесса, оказывают решающее влияние на свойства получаемого сплава.
Сначала в остывающем расплаве возникают центры кристаллизации, вокруг них в ходе процесса и нарастают кристаллы, многократно повторяя структуру центра. В качестве центров кристаллизации могут выступать:
- Первые образовавшиеся кристаллы в зонах локального охлаждения, чаще всего у стенок литейной формы.
- Частички неметаллических примесей.
- Тугоплавкие примеси, уже находящиеся в твердой форме.
Процесс кристаллизации металлов и сплавов
Кристаллы обычно растут в направлении роста градиента температуры. Если рост решеток не встречает физических препятствий, образуются ветвящиеся кристаллические структуры, напоминающие кораллы — дендриты. Если они растут из разных центров и встречаются в расплаве, то препятствуют росту друг друга и искажают свою форму.
Такие искаженные кристаллы – это кристаллиты, или зерна. Совокупность отдельных зерен срастается в поликристаллическое тело.Отдельные кристаллиты достигают размеров от одного до 10 000 микрон и по-разному развернуты в пространстве. На стыках отдельных кристаллитов образуется граничный слой, в котором кристаллические решетки разорваны.
Такие слои обладают измененными химическими и физическими свойствами.
Решетки кристаллитов могут обладать разными дефектами структуры:
- точечные;
- линейные;
- поверхностные;
Дефекты кристаллического строения металлов
Дефекты определяются отсутствием атома или группы атомов в вершинах или гранях кристаллической решетки, смещением этих атомов со своих мест или замещением атома или их группы атомами или молекулами примесей.
ответы на материаловедение 2 семестр. матвед экзамен. 1. Типы межатомных связей и их влияние на свойства материалов
Ковалентная связь характерна для многих кристаллических твердых тел. Примером может служить алмаз – кристаллическая модификация углерода с ковалентной связью. Углерод имеет четыре валентных электрона. Образование алмаза осуществляется при обобществлении по одному электрону четырьмя атомами.
Механическая прочность ковалентной связи обычно достаточно велика вследствие ее направленного характера.Ковалентные связи характерны для пластмасс.
Металлическая связь. Атомы металлов имеют небольшое количество (один или два) внешних (валентных) электронов, которые слабо связаны с ядром.
При сближении атомов электроны, находящиеся на внешних оболочках, теряют связь со своими атомами, они коллективизируются, т.е. становятся достоянием всех атомов данного металла, образуя «электронный газ».
Положительно заряженные ионы располагаются на таком расстоянии друг от друга, что силы притяжения между отрицательно заряженными электронами и положительно заряженными ионами уравновешиваются силами отталкивания между ионами.
Наличие электронного газа определяет свойства металла: высокие тепло– и электропроводность. Отсутствие сильных направленных связей между атомами определяет одно из важнейших свойств металлов – их пластичность, т.е. способность изменять форму без разрушения.
Поэтому при изготовлении металлопродукции широко применяют методы пластического деформирования – ковка, прокат, волочение.
Силы Ван–дер–Ваальса. Происхождение этих сил связано с тем, что атомы являются малыми диполями.
Среднее во времени пространственное распределение электронов в атоме симметрично относительно ядер, но в каждый конкретный момент центр отрицательных зарядов может не совпадать с ядром, имеющим положительный заряд, что и образует диполь. Взаимодействие диполей приводит к появлению сил притяжения.
Это взаимодействие несколько усиливается вследствие того, что наличие диполя, образованного одним атомом, способствует появлению диполя у соседнего атома.
Силы Ван–дер–Ваальса существуют между всеми атомами. Они слабы и оказываются важными только при отсутствии более сильных связей других типов, рассмотренных выше. Эти силы являются основными при взаимодействии больших органических молекул, являющихся основой полимеров.
2.Атомно-кристаллическое строение металлов.
Металлы являются кристаллическими веществами. В отличие от аморфных веществ, атомы в которых расположены хаотично, кристаллические тела характеризуются закономерным расположением атомов в пространстве, т.е. металлы имеют кристаллическую решетку.
Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой расположены атомы (ионы). Минимальный объем, многократное повторение которого в пространстве образует кристаллическую решетку, называется элементарной кристаллической ячейкой. На рис.2.
1 представлена кристаллическая решетка, жирными линиями обведена элементарная кристаллическая ячейка. Кристаллические решетки получают название в зависимости от типа элементарной кристаллической ячейки. Кристаллические решетки бывают простыми и сложными.
В простых кристаллических решетках на элементарную ячейку приходится один атом. В сложных кристаллических решетках на элементарную ячейку приходится несколько атомов.
Наиболее распространенными среди металлов являются кубическая объемноцентрированная (О.Ц.К.), кубическая гранецентрированная (Г.Ц.К.) и гексагональная плотноупакованная (Г.П.У.) кристаллические решетки.
В кубической объемноцентрированной кристаллической решетке атомы расположены в вершинах куба и один – в центре куба (рис.2.2,а). В такой кристаллической решетке на элементарную ячейку приходится 2 атома1.
Кубическую объемноцентрированную кристаллическую решетку имеют и др.
В кубической гранецентрированной кристаллической решетке атомы расположены в вершинах куба и в центре каждой грани (рис.2.2,б). На элементарную ячейку такой решетки приходится 4 атома2. Этот тип кристаллической решетки характерен для и др.
В гексагональной плотноупакованной кристаллической решетке (ГПУ – решетке) атомы расположены в вершинах и в центрах шестигранных оснований призмы, а также три атома находятся в средней плоскости призмы (рис.2.2,в).
На элементарную ячейку такой кристаллической решетки приходится шесть атомов3. Такую кристаллическую решетку имеют и др.
Некоторые металлы () имеют тетрагональную кристаллическую решетку (рис.2.3). Эта кристаллическая решетка характеризуется тем, что ребро с параллелепипеда не равно ребру основания а. Отношение этих параметров (с/а) характеризует степень тетрагональности кристаллической решетки. В зависимости от расположения атомов, тетрагональная решетка может быть простой (атомы расположены в вершинах призмы), объемноцентрированной (атомы расположены в вершинах и в центре призмы) и гранецентрированной (атомы расположены в вершинах и в центрах граней призмы).
Размеры кристаллических решеток характеризуются периодом решетки – расстоянием между ближайшими параллельными атомными плоскостями, образующими элементарную кристаллическую ячейку. Период решетки металлов составляет (17)А (1 ангстрем=10–10м).
Точечное расположение атомов в узлах кристаллической решетки является условным. В действительности атомы имеют определенные размеры и могут соприкасаться друг с другом. Размер атома характеризуется атомным радиусом – половиной расстояния между двумя соседними атомами.
3.Характреные свойства металлических материалов.
Физические свойства металлов.
Плотность — количество вещества, содержащееся в единице объема. Температура плавления — температура, при которой нагреваемый металл или сплав переходит из твердого в жидкое состояние.
- Удельная теплоемкость — количество теплоты, которое необходимо для повышения температуры единицы массы металла на 1° С.
- Теплопроводность — свойство металла проводить теплоту, определяемое коэффициентом теплопроводности.
- Тепловое расширение — способность металла увеличивать линейные размеры и объем при нагревании, характеризуемая коэффициентами линейного и объемного расширения.
Электропроводность — способность металла проводить электрический ток. Удельное электросопротивление — сопротивление металлического проводника, имеющего единицу длины и единицу площади поперечного сечения, прохождению электрического тока.
Механические свойства металлов — свойства, определяющие способность металла сопротивляться деформированию и разрушению.
Для определения механических характеристик металла образец может быть подвергнут растяжению, сжатию, сдвигу, кручению, изгибу или их совместному воздействию.Нагрузка на металл, возрастающая медленно, называется статической. Нагрузка, прикладываемая к металлу с большой скоростью, называется динамической.
Вид назначаемого механического испытания определяется условиями работы детали, в зависимости от которых испытания металла проводятся при пониженной, комнатной или высокой температуре. Основными характеристиками механических свойств металла являются прочность, упругость, пластичность, вязкость, твердость.
Пластичность — способность металла деформироваться без разрушения.
При растяжении пластические свойства металла характеризуются относительными удлинением и сужением образца, которые взаимосвязаны, так как удлинение образца сопровождается уменьшением площади его поперечного сечения. Относительное удлинение σ — отношение приращения длины образца после разрыва к его начальной длине, выраженное в процентах.
Относительное сужение ψ — отношение уменьшения площади поперечного сечения образца после разрыва к начальной площади поперечного сечения, выраженное в процентах.
Для оценки вязкости металла и установления его склонности к переходу в хрупкое состояние выполняют ударные испытания надрезанных образцов на маятниковом копре. При этом характеристикой вязкости является ударная вязкость KC=A / F0, где А — работа, затраченная на разрушение образца; F0 — площадь поперечного сечения образца в месте надреза.
- Твердость — сопротивление металла вдавливанию в него других, более твердых тел.
- Твердость по Бринеллю НВ — отношение усилия вдавливания в металл стального закаленного шарика диаметром 2,5; 5 или 10 мм к площади поверхности образовавшейся лунки.
- Твердость по Роквеллу HRC определяется вдавливанием алмазного конуса с углом при вершине 120° в испытуемый металл.
Технологические свойства металлов и сплавов характеризуют способность металлов и сплавов поддаваться различным способам горячей и холодной обработки (заполнять литейную форму, прокатываться, коваться, штамповаться, свариваться, обрабатываться резанием и т. д.).
Для определения пригодности для ковки и горячей объемной штамповки металлы испытывают на ковкость, которая оценивается сопротивлением деформированию и пластичностью.
Одни металлы обладают хорошей ковкостью в нагретом состоянии, например стали, другие (латунь в однофазном состоянии, алюминиевые сплавы) — в холодном. Для определения технологической пластичности стали используют различные методы, в том числе и метод осадки.
Часто технологические пробы проводят с учетом способа обработки давлением. Например, для горячей и холодной высадки выполняют испытания металла на высадку, для гибки — пробы на изгиб (перегиб), для листовой штамповки — испытания на штампуемость по глубине выдавливания лунки до разрушения и т. д.
При разработке технологического процесса учитывают совокупность физических, механических и технологических свойств металла.
4.Анизотропия кристаллов и изотропия кристаллических тел.
Анизотропия-
В кристаллических решетках атомная плотность по различным плоскостям неодинакова – на единицу площади разных атомных плоскостей приходится неодинаковое количество атомов. Например в объемноцентрированной кристаллической решетке плотность атомов в заштрихованном квадрате площадью .
(рис.2.4,а) равна 1, т.к. каждый из четырех атомов в этой плоскости принадлежит четырем элементарным ячейкам. В заштрихованном прямоугольнике той же кристаллической решетки на площадь (рис.2.4,б) приходится 2 атома. Вследствие этого свойства кристалла в различных плоскостях и направлениях кристаллической решетки будут неодинаковыми. Неодинаковость свойств по разным кристаллографическим направлениям называется анизотропией кристалла.
Технические металлы являются поликристаллическими веществами. Они состоят из большого количества мелких кристаллов, различно ориентированных по отношению друг к другу.
Эти кристаллы вследствие условий кристаллизации имеют неправильную форму и называются зернами или кристаллитами. Произвольность ориентации каждого зерна приводит к тому, что в разных направлениях свойства усредняются и становятся примерно одинаковыми, т.е.
поликристаллическое тело изотропно. Такое явление называется квазиизотропией (ложной изотропией). Она не наблюдается в том случае, если кристаллы имеют одинаковую ориентировку (текстуру) в каких–то направлениях.
Такая ориентированность создается в результате пластической деформации (см. ниже). В этом случае поликристаллический металл приобретает анизотропию свойств.
5.Идеальное и реальное строение материалов.
Под идеальным строением кристаллов подразумевается такое, при котором все атомы находятся строго в узлах кристаллической решетки. Теоретическая прочность такого кристалла чрезвычайно высока. Для осуществления пластического сдвига в таком кристалле (рис.2.
5) требуется приложить усилие, которое можно подсчитать по формуле:, где G – модуль сдвига (Юнга). Этот расчет был сделан Я.И. Френкелем в 20–х годах прошлого века. В соответствии с этой формулой теоретический предел прочности железа должен составлять примерно 13000МПа (для железа G=80000МПа). В действительности же, для реального металла эта величина примерно в 100 раз меньше. Такое несоответствие объясняется наличием в реальном металле дефектов кристаллического строения.
Электроматериаловедение
Все предметы / Материаловедение / Электроматериаловедение
Содержание статьи
Добавить страницу в закладки
Определение 1
Электроматериаловедение – это наука, которая изучает свойства и состояние материалов, а также связи между их строением, свойствами и составом.
Существуют следующие типы атомных связей в материалах:
- Ионная связь. Данный вид связи характерен для соединений, образованных разнородными атомами. Внешние электроны атомов одного элемента осуществляют переход на внешние орбиты атомов другого элемента, тем самым образуя устойчивые электронные конфигурации. Самым известными и наиболее распространенными представителями веществ с ионной связью являются стекло и поваренная соль.
- Ковалентная связь. Данный вид связи устанавливается в результате устойчивы соединений посредством обобщения определенных электронов. Такая связь характерна для большого количества кристаллических твердых тел, например, алмаза. Механическая прочность ковалентной связи велика, благодаря ее направленному действию.
- Металлическая связь. У атомов металлов имеется большое количество электронов, слабо связанных с ядром. В случае сближения атомов электроны, которые находятся во внешних оболочках теряют связь со своими атомами, в результате чего образуется электронный газ. Данный газ определяет свойства металла. Высокими теплопроводностью и электропроводностью, отсутствием направленных связей определяется пластичность металла, то есть его способность изменять свою форму без разрушения. По этой причине металлы способны выдерживать прокат, ковку и волочение.
Определение 2
Волочение металла – это способ обработки металла давлением, при котором заготовку фасонного или круглого профиля протягивают через фасонное или круглое отверстие, у которого сечение меньше, чем у заготовки.
Классификация электроматериалов. Диэлектрики
Электроматериалы классифицируются по следующим признакам:
- Применение. Согласно данному признаку электроматериалы делятся на конструкционные и электротехнические.
- Структура. Согласно данному признаку электроматериалы делятся на монокристаллические материалы — однородные по всему объему и поликристаллические, состоящие из большого количества кристаллических зерен, которые хаотически ориентированы в разных направлениях.
- Магнитные свойства. Согласно данному признаку электроматериалы делятся на слабомагнитные и сильно магнитные. В свою очередь слабомагнитные материалы делятся на диамагнетики, которым относятся медь, цинк, золото, серебро, инертные газы, водород, и парамагнетики, к которым относятся соли железа, кислород, алюминий, платина, щелочные металлы, алюминий. Сильномагнитные минералы делятся на ферромагнетики, к которым относятся никель, кобальт и железо, и ферриты, к которым относятся сплавы марганца и хрома.
- Электрические свойства или способность проводить электрический ток. Согласно данному признаку электроматериалы делятся на диэлектрики, проводники и полупроводники. У диэлектриков запрещенная зона настолько большая, что в обычных условиях у них не наблюдается электронная электропроводность. Полупроводники представляют собой материалы с узкой запрещенной зоной, которая преодолевается благодаря внешним энергетическим воздействиям. Проводники — материалы с заполненной электронами запрещенной зоной, вплотную прилегающей к зоне свободных энергетических уровней, в некоторых случаях перекрывается ею.
Диэлектрики широко используются в различных областях промышленности, они классифицируются по следующим признакам:
- Назначение. Согласно данному признаку диэлектрики делятся на изоляционные материалы, материалы для заполнения конденсаторов и активные диэлектрики, которые используются для производства миниатюрных радиоконденсаторов, варикондов позисторов, у которых сопротивление зависит от температуры.
- Агрегатное состояние. Согласно данному признаку диэлектрики могут твердеющими, твердыми, жидкими и в виде газа.
- Химический состав. Согласно данному признаку диэлектрики делятся на органические и неорганические.
- Структура. Согласно данному признаку диэлектрики делятся на материалы с молекулярной структурой, с ионной структурой и с доменной структурой. Материалы с молекулярной структурой делятся на неполярные, к которым относятся трансформаторное масло, все газы, фторопласт-4, полиэтилен и полярные, к которым относятся целлюлоза, поливинилхлорид, хлорированные дифенилы. Материалы с ионной структурой делятся на материалы с плотной упаковкой ионов, к которым относятся рутил, корунд, каменная соль, слюда, кварц, и материалы с неплотной упаковкой ионов, которым относятся микалекс, неорганические стекла, фарфор и т. п. К материалам с доменной структурой относятся титанат бария, сегнетова соль и другие вещества.
Урок «Материаловедение. Типы атомных связей»
- Поддубная Ольга Викторовна
- Преподаватель специальных дисциплин
- КГКП «Аксуский колледж черной металлургии» г.Аксу
Цели урока: формирование знаний по спец.
пердмету – материаловедение; организация работы по усвоению обучающихся основных понятий по теме «Типы атомных связей и их влияние на свойство металлов», предусмотренных учебной программой.
Задачи урока:
Развивающие:
- Изучение новой темы.
- Продолжить развитие умения анализировать, сопоставлять, сравнивать, выделять главное.
- Уметь устанавливать причинно-следственные связи, приводить примеры из жизни.
- Сформировать умения работы с учебной литературой.
Воспитательные:
- Вовлечь учащихся в активную учебную деятельность.
- Воспитывать интерес к предмету.
- Формирование информационной и языковой культуры.
Образовательные:
- Совершенствовать навыки чтения и применения.
- Дать представление о классификации руды; активизировать познавательную деятельность обучающихся через изучения предмета.
- Сабақтың түрі
- Тип урока: Урок усвоения нового материала.
- Оқу құралдары
- Средства обучения: презентация, учебно-справочная литература, видео — фильм, опорные конспекты, тестовые задания.
- Сабақтың мазмұны
- Содержание урока
- Организационный этап.
- -проверить готовность к уроку;
- — проверить наличие списочного состава;
- — проверить наличие учебных принадлежностей;
- — проверить внешний вид;
- — заполнить рапортичку и журнал отсутствующих.
- Оқушылардың жаңа материалды белсенді және саналы түрде игеруіне дайындығы
- Подготовка учащихся к активному и сознательному усвоению нового материала.
- Тема, цель.
- Исходя из темы урока, что вы уже услышали, как вы думаете, о чем пойдет речь на уроке?
- -Какие учебные задачи нам предстоит решить, какие компетенции сформировать?
- «Мозговой штурм» в течение 1 минуты определите для себя и заполните таблицу: что вы уже знаете, а что хотите узнать.
- Усвоение новых знаний
Материаловедение (от рус. материал и ведать) — раздел науки, изучающий изменения свойств материалов как в твёрдом, так и в жидком состоянии в зависимости от некоторых факторов.
- К изучаемым свойствам относятся:
- структура веществ,
- электронные,
- термические,
- химические,
- магнитные,
- оптические свойства этих веществ.
Материаловедение можно отнести к тем разделам физики и химии, которые занимаются изучением свойств материалов. Кроме того, эта наука использует структуру материалов.
Полностью…
Типы межатомных связей. Влияние на свойства материалов
Существует 4 вида связей:
1) Ионная связь – присуща химическим
соединениям, образованная элементами
с резко различающейся валентностью.
Так металлы, имея 1, 2 электрона на внешней
орбите, которые не прочно связаны с
ядром.
Вступая в реакцию с неметаллами,
металлы отдают электроны и превращаются
в ионы. Неметаллы принимают эти электроны,
превращаясь в отрицательные ионы =>
ионная связь обеспечивает электро –
статическое притяжение.
Na +Cl2 =>
NaCl
-1 +7 + —
Ионная связь жесткая и направленная => Все химические соединения прочные,
твердые, но очень хрупкие(низкая
пластичность). Ионная связь характерна
для окислов различных элементов.
2) Ковалентная связь – Устанавливается
в результате образования устойчивых
соединений путем обобществления
электронов группой атомов. Обобществление
электронов зависит от валентности
элемента и определяется по следующей
зависимости: A = 8 – N,
где А – число атомов обобществляющих
электрон, 8 – устойчивая электронная
конфигурация, N – валентность
элемента.
Ковалентная связь возникает между
атомами соседей, которые обобществляют
один из электронов соседа. Ковалентная
связь характерна для кристаллических
тел.
Пример – алмаз- кристаллическая
модификация углерода с ковалентной
связью. Образование алмаза возникает
при обобществлении по одному электрону
четырех атомов.
Ковалентная связь –
жесткая, направленная => прочная. Она
характерна для пластмасс.
3) Металлическая связь
Все металлы – кристаллические вещества.
Атомы имеют упорядоченное расположение
и образуют кристаллическую решетку.
Атомы удерживаются в ней за счет
металлической связи. Металлическая
связь обусловлена строением атома, на
внешнем орбите у металла 1-2 электрона,
они слабо связаны с ядром.
Для металла
характерны кристаллические решетки с
плотным расположением атомов => Внешние
оболочки соприкасаются и пересекаются.
Все валентные электроны обобществляются(общие
в пределах твердого тела) и образуют
электронный газ. Возникают пары атомов
превращающихся в разнозаряженных
атомов, которые связаны силами
электростатического напряжения.
Металлическая связь – гибкая, нежесткая.
Свойства металлов: высокая прочность,
пластичность, электропроводность,
теплопроводность.
Металлическая связь характерна всем
металлам и их сплавам => Металлы широко
применяются в производстве. В металлах
можно повысить прочность:
-
Изменением химического состава
-
Изменением строением металла в результате термической обработки
4) Связь Ван – дер – Вальса
Она
основана на том, что все атомы являются
диполями. Это связано с тем, что при
сближении атомов происходит поляризация,
что приводит к появлению сил притяжения.
Диполи возникают при смещении центров
отр. Заряженных электронов относительно
центров положительно заряженных
электронов. Сила ВДВ направленная.
-
Связь слабая и незаметна, она присутствует
в полимерах. -
Твердые вещества существуют в двух
состояниях: -
1) Аморфное – атомы располагаются
хаотично; -
2) Кристаллическое – атомы располагаются
упорядоченно;
Решетка характеризуется строением
элементарной ячейки— состоит
из мин. кол-ва атомов, расположенных
так, что повторное в пространстве
расположение атомов этой ячейки возможно
воспроизвести в кристаллическую решетку.
Существует 14 типов кристаллических
решеток. Для металлов характерны те
которые обеспечивают плотное расположение
атомов.
Кристаллическая решетка —
Упорядоченное расположение атомов в
пространстве, в котором каждый
атом имеет одинаковое число соседних
атомов, удаленных друг от друга на
периодически повторяющихся расстояниях.
Основные типы кристаллических решеток
металлов:
Параметры: Период решётки
(расстояние между атомами a
=d), d –
диаметр атома. 1/8·8 =1 атом на элемент,
ячейку. а
.
Условности:
-
Ребра;
-
Атомы соприкасаются;
-
Каждый атом принадлежит 8-ми решеткам;
Для химического соединения данный тип
решётки.
| 2 ) Кубич. объемно-центрир. решетка- [•] характерна для тугоплавких мет. a =1,21·d. 1/8·8 +1 =2. Feα, Ti, W, Nb. |
3 ) Кубическая гранецентрированная решетка- [X] 1/8·8 +1/2·6 =4. Характерна для пластичных мет. Cu, Feγ, Au. |
|
|






