- Положение в таблице Менделеева
- Алюминий
- Положение активных металлов в таблице Менделеева
- Свойства
- Тест по теме
- Оценка доклада
- Ряд активности металлов
- Ряд напряжений и химические свойства металлов
- Электрохимический ряд активности металлов | это… Что такое Электрохимический ряд активности металлов?
- История
- Теоретические основы
- Практическое использование ряда напряжений
- Таблица электрохимических потенциалов металлов
- Ссылки
- Литература
- Примечания
- Электрохимический ряд напряжений металлов (ЭРН)
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с водой
- Взаимодействие металлов с водными растворами солей
- Процесс термического распада нитратов
Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.

Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
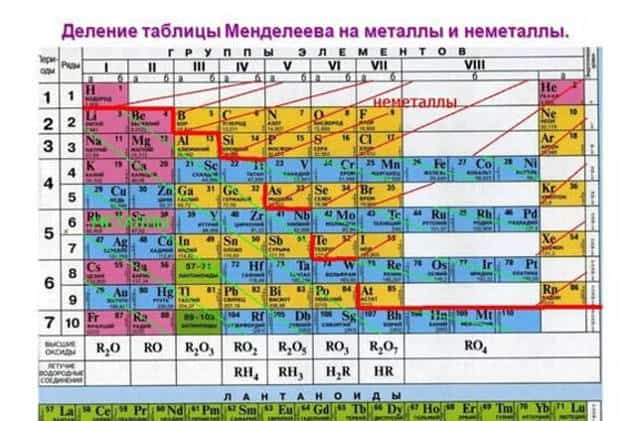
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
- Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s
- 2
- 3p
- 1
. В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
2Al2O3 = 4Al + 3O2↑
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3 и Al2O3. Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
- Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):
- 2Al + 6H2O = 2Al(OH)3 +3H2↑ (1)
- 2Al +3/2O2 = Al2O3 (2)
- 2Al + 3Cl2 = 2AlCl3 (3)
- 2Al + N2 = 2AlN (4)
- 2Al +3S = Al2S3 (5)
- 4Al + 3C = Al4C3 (6)
- 2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑ (7)
- 2Al +2NaOH +3H2O = 2Na + 3H2↑ (8)
Положение активных металлов в таблице Менделеева
К активным металлам относятся три группы элементов:
- щелочные металлы;
- щелочноземельные металлы;
- алюминий.
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr).
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
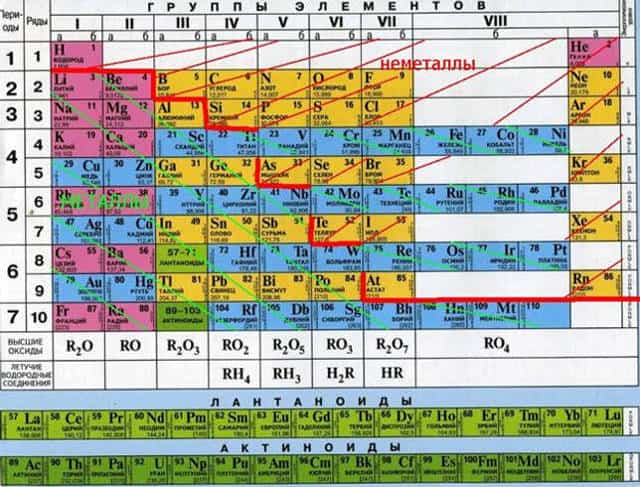
В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей.
Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий.
В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.

Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
| Реакция | Уравнение | Исключение |
| Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом | K + O2 → KO2 | Литий реагирует с кислородом только при высокой температуре |
| Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются | 2Ca + O2 → 2CaO | |
| Реагируют с простыми веществами, образуя соли | – Ca + Br2 → CaBr2; – 2Al + 3S → Al2S3 | Алюминий не вступает в реакцию с водородом |
| Бурно реагируют с водой, образуя щёлочи и водород | – 2Na + 2H2O → 2NaOH + H2; – Ca + 2H2O → Ca(OH)2 + H2 | Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки |
| Реагируют с кислотами, образуя соли |
– Ca + 2HCl → CaCl2 + H2; – 2K + 2HMnO4 → 2KMnO4 + H2 |
|
| Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью |
2Na + CuCl2 + 2H2O: – 2Na + 2H2O → 2NaOH + H2; – 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl |
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5 -
Илья Ударцев
5/5 -
Инесса Медведева
4/5 -
Александр Котков
5/5 -
Лидия Маслова
5/5 -
Александр Котков
5/5 -
Сергей Ефремов
2/5 -
Дима Мухтаров
5/5 -
Сергей Макаров
5/5 -
Александр Просто
5/5
Оценка доклада
Средняя оценка: 4.4. Всего получено оценок: 705.
| Поделитесь в соц.сетях: |
Ряд активности металлов
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления.
По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами.
Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
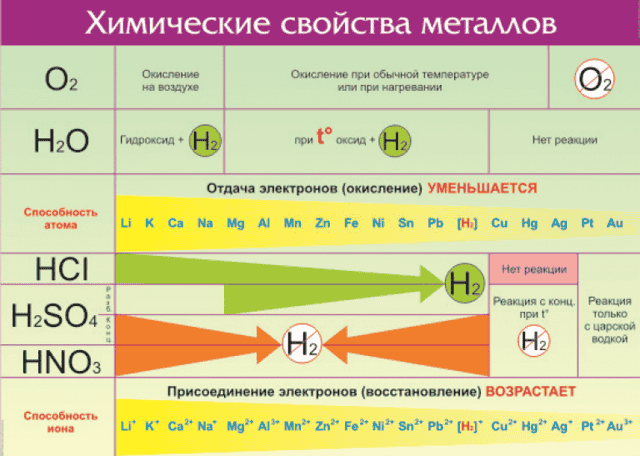
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций.
Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем.
Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
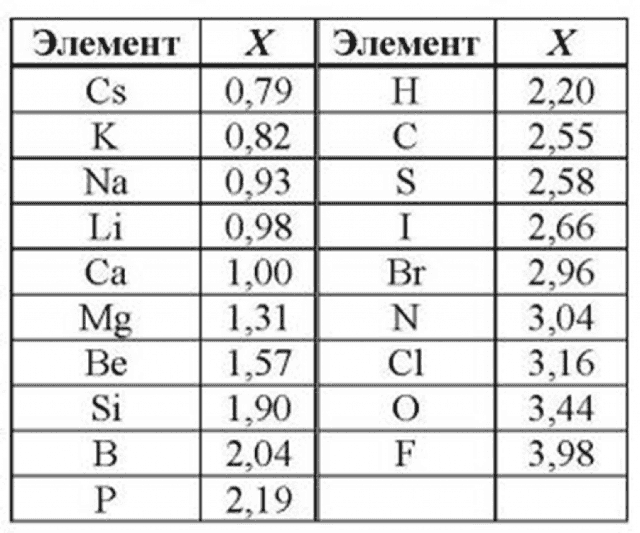
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
- Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
- Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее.
Пример реакции — Zn + Cu2+ → Zn2+ + Cu, которая протекает только в одном направлении.
Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является.
Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами.
Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
- 2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
- Fe + 2HCl = FeCl2 + H2↑
- Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью.
Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом.
Если извлечь их из керосина, то металлы практически мгновенно сгорают.
- Реакции кальция и натрия с водой при комнатной температуре выглядят так:
- 2Na + 2H2O = 2NaOH + H2↑
- Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
- 3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция.
Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла.
Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Ряд напряжений и химические свойства металлов
Изучая курс общей и неорганической химии мы с вами упустили очень важную тему, на который постоянно ссылаемся при изучении свойств простых веществ и их соединений, но ни разу не пояснили что это такое и почему именно так, а не иначе.
Речь сегодня пойдет про ряд напряжений и химические свойства металлов. Понять, что в заданиях ЕГЭ по химии нет прямого вопроса по этой теме, но без знания и понимая электрохимического ряда вы не сможете ответить на многие вопросы правильно.
Давайте разбираться вместе
Вы наверняка знаете, что атомы типичных металлов могут отдавать электроны (не принимать, а только отдавать, они – доноры). Поэтому металлы в виде простых веществ в химических реакциях играют роль восстановителей. В случае действия сильных окислителей и при соблюдении определенных условий (к примеру нагревании) практически любой металл может быть окислен до положительной степени окисления.
Различная восстановительная способность металлов дает возможность разместить их в так называемый ряд напряжений и как его еще называют электрохимический ряд металлов.
В этом ряду металлы располагаются в порядке уменьшения их восстановительных свойств и возрастания окислительных свойств соответствующих гидратированных катионов (посмотрите внимательно на таблицу, которые есть в любом справочнике)
Таким образом, мы видим, что в ряду напряжений слева располагаются металлы, которые вступая в реакцию с водными растворами будут проявлять сильные восстановительные свойства. Напротив, ионы, которые образуются при окислении этих металлов, будут проявлять слабые окислительные свойства. Поэтому такие металлы легко окисляются, а отвечающие им ионы трудно восстанавливаются.
Расположение металла в ряду напряжений определяет процесс окисления металла с образованием гидратированного иона, соответствующего низшей устойчивой в водном растворе степени окисления данного металла.
Данный металл может восстанавливать из растворов их соей металлы, которые расположены справа от него в ряду напряжений. Иными словами, металл левее вытесняет из солей металл, который находится правее него.
Металлы, расположенные в электрохимическом ряду правее водорода, не могут замещать его в молекулах кислот. Эти металлы хоть и реагируют с кислотами, которые обладают сильными окислительными свойствами, но в ходе реакции выделения водорода не будет (вспоминайте предыдущую нашу статью, какие продукты реакции будут в этом случае?).
Металлы, которые у нас расположены в ряду напряжений слева от водорода, могут вступать в реакции замещения с кислотами, вытесняя из последних водород. При этом помним, что ЭДС на основании которого и устанавливается расположение металла и водорода в ряду, измеряется в строго определенных условиях.

От чего же зависит положение металла в ряд?
- От энергии ионизации атома металла.
- От энергии гидратации, получаемого иона.
- От заряда иона.
- От размеров иона.
Рассмотрим теперь кто у нас в ряду напряжений из щелочных металлов стоит первым? Правильно, литий, но почему не цезий? Ведь, по логике он электрон отдает намного быстрее, чем литий.
Но мы с вами вспоминаем правило выше, которое вы должны запомнить очень хорошо: ряд напряжений отражает процесс окисления металла с образованием гидратированного иона.
Чем лучше и быстрее протекает процесс окисления, тем левее будет находится металл в электрохимическом ряду.
Вернемся к нашему коварному литию. В его случае имеет значение высокая энергия гидратации иона.
Маленький размер приводит к притягиванию отрицательных концов полярных молекул воды гораздо сильнее, нежели у более «громоздкого» цезия, так как расстояние между центрами отрицательного и положительного зарядов в случае лития будет меньше. В итоге общий процесс (отдача электронов с последующей гидратацией полученного иона) энергетически более выгоден у лития чем у цезия.
Окисление металлов водой и раствором щелочей
Вытеснять водород из воды в состоянии только те металлы, которые стоят в ряду напряжений перед кадмием, но тут есть нюансы: ввиду ограничений кинетических порядков (образование нерастворимой в воде оксидной пленки тех же амфотерных металлов) при комнатной температуре в реакцию с водой вступают только щелочные и щелочноземельные металлы.
А вот металлы, располагающиеся правее в ряду, могут восстанавливать водород до воды при нагревании. К примеру магний, измельченный в порошок, реагирует с горячей водой, а алюминий, тоже в виде порошка реагирует с кипящей водой.
А такие металлы как цинк и алюминий могут восстанавливать водород даже из раствора щелочи:
2Al+2NaOH+ 6H2O=2Na[Al(OH)4]+3H2
По какому же принципу тот или иной металл растворяется в щелочи? Как это можно определить?
- Металл должен быть сильным восстановителем и окисляться ионами водорода даже в малых концентрациях последних, находящихся в растворе щелочей.
- Ион металла в степени окисления до которой он окисляется ионами водорода, образует в щелочном растворе растворимое соединение.
Мы должны всегда помнить, что восстановительные свойства металлов в одной и безводной среде могут отличаться. А значит и порядок расположения металлов исходя из их восстановительной способности отличается. К примеру, в безводной среде сильным восстановителем будет цезий, а в водной среде – литий.
Электрохимический ряд активности металлов | это… Что такое Электрохимический ряд активности металлов?
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
История
Последовательность расположения металлов в порядке изменения их химической активности в общих чертах была известна уже алхимикам[1]. Процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом) рассматривались как проявление трансмутации элементов.
Поздние алхимики вплотную подошли к пониманию химической стороны взаимного осаждения металлов из их растворов.
Так, Ангелус Сала в работе «Anatomia Vitrioli» (1613) пришёл к выводу, что продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах.
Впоследствии Роберт Бойль предложил гипотезу о причинах, по которым один металл вытесняет другой из раствора на основе корпускулярных представлений[2].
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В 1798 году Иоганн Вильгельм Риттер указал, что ряд Вольта эквивалентен ряду окисления металлов (т. е. последовательности уменьшения их сродства с кислородом). Таким образом, Риттер высказал гипотезу о возникновении электрического тока вследствие протекания химической реакции[3].
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Последовательность металлов по их способности вытеснять друг друга, давно известная химикам, была в 1860-е и последующие годы особенно основательно и всесторонне изучена и дополнена Н. Н. Бекетовым. Уже в 1859 году он сделал в Париже сообщение на тему «Исследование над явлениями вытеснения одних элементов другими».
В эту работу Бекетов включил целый ряд обобщений о зависимости между взаимным вытеснением элементов и их атомным весом, связывая эти процессы с «первоначальными химическими свойствами элементов – тем, что называется химическим сродством»[4].
Открытие Бекетовом вытеснения металлов из растворов их солей водородом под давлением и изучение восстановительной активности алюминия, магния и цинка при высоких температурах (металлотермия) позволило ему выдвинуть гипотезу о связи способности одних элементов вытеснять из соединений с их плотностью: более лёгкие простые вещества способны вытеснять более тяжёлые («вытеснительный ряд Бекетова»).
Не отрицая значительных заслуг Бекетова в становлении современных представлений об ряде активности металлов, следует считать ошибочным бытующее в отечественной популярной и учебной литературе представление о нём как единственном создателе этого ряда.[5][6].
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности».
Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода.
Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов.
Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование (щелочных и щёлочноземельных металлов отражает явление диагонального сходства.
Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда.
Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu2+/Eu[источник не указан 228 дней] до +1,691 В у пары Au+/Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au+.
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
- Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении.
- Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
- Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
- При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Таблица электрохимических потенциалов металлов
| Li | Li+ | -3,0401 | реагирует с водой | выделяется водород |
| Cs | Cs+ | -3,026 | ||
| Rb | Rb+ | -2,98 | ||
| K | K+ | -2,931 | ||
| Ra | Ra2+ | -2,912 | ||
| Ba | Ba2+ | -2,905 | ||
| Fr | Fr+ | -2,92 | ||
| Sr | Sr2+ | -2,899 | ||
| Ca | Ca2+ | -2,868 | ||
| Eu | Eu2+ | -2,812 | ||
| Na | Na+ | -2,71 | ||
| Sm | Sm2+ | -2,68 | ||
| Md | Md2+ | -2,40 | реагирует с кислотами | |
| La | La3+ | -2,379 | ||
| Y | Y3+ | -2,372 | ||
| Mg | Mg2+ | -2,372 | ||
| Ce | Ce3+ | -2,336 | ||
| Pr | Pr3+ | -2,353 | ||
| Er | Er3+ | -2,331 | ||
| Ho | Ho3+ | -2,33 | ||
| Nd | Nd3+ | -2,323 | ||
| Tm | Tm3+ | -2,319 | ||
| Sm | Sm3+ | -2,304 | ||
| Pm | Pm3+ | -2,30 | ||
| Fm | Fm2+ | -2,30 | ||
| Dy | Dy3+ | -2,295 | ||
| Tb | Tb3+ | -2,28 | ||
| Lu | Lu3+ | -2,28 | ||
| Gd | Gd3+ | -2,279 | ||
| Es | Es2+ | -2,23 | ||
| Ac | Ac3+ | -2,20 | ||
| Dy | Dy2+ | -2,2 | ||
| Pm | Pm2+ | -2,2 | ||
| Cf | Cf2+ | -2,12 | ||
| Sc | Sc3+ | -2,077 | ||
| Am | Am3+ | -2,048 | ||
| Cm | Cm3+ | -2,04 | ||
| Pu | Pu3+ | -2,031 | ||
| Er | Er2+ | -2,0 | ||
| Pr | Pr2+ | -2,0 | ||
| Eu | Eu3+ | -1,991 | ||
| Lr | Lr3+ | -1,96 | ||
| Cf | Cf3+ | -1,94 | ||
| Es | Es3+ | -1,91 | ||
| Th | Th4+ | -1,899 | ||
| Fm | Fm3+ | -1,89 | ||
| Np | Np3+ | -1,856 | ||
| Be | Be2+ | -1,847 | ||
| U | U3+ | -1,798 | ||
| Al | Al3+ | -1,700 | ||
| Md | Md3+ | -1,65 | ||
| Ti | Ti2+ | -1,63 | конкурирующие реакции: и выделение водорода, и выделение металла в чистом виде | |
| Hf | Hf4+ | -1,55 | ||
| Zr | Zr4+ | -1,53 | ||
| Pa | Pa3+ | -1,34 | ||
| Ti | Ti3+ | -1,208 | ||
| Yb | Yb3+ | -1,205 | ||
| No | No3+ | -1,20 | ||
| Ti | Ti4+ | -1,19 | ||
| Mn | Mn2+ | -1,185 | ||
| V | V2+ | -1,175 | ||
| Nb | Nb3+ | -1,1 | ||
| Nb | Nb5+ | -0,96 | ||
| V | V3+ | -0,87 | ||
| Cr | Cr2+ | -0,852 | ||
| Zn | Zn2+ | -0,763 | ||
| Cr | Cr3+ | -0,74 | ||
| Ga | Ga3+ | -0,560 | ||
| Ga | Ga2+ | -0,45 | ||
| Fe | Fe2+ | -0,441 | ||
| Cd | Cd2+ | -0,404 | ||
| In | In3+ | -0,3382 | ||
| Tl | Tl+ | -0,338 | ||
| Co | Co2+ | -0,28 | ||
| In | In+ | -0,25 | ||
| Ni | Ni2+ | -0,234 | ||
| Mo | Mo3+ | -0,2 | ||
| Sn | Sn2+ | -0,141 | ||
| Pb | Pb2+ | -0,126 | ||
| H2 | H+ | |||
| W | W3+ | +0,11 | низкая реакционная способность | выделение металла в чистом виде |
| Ge | Ge4+ | +0,124 | ||
| Sb | Sb3+ | +0,240 | ||
| Ge | Ge2+ | +0,24 | ||
| Re | Re3+ | +0,300 | ||
| Bi | Bi3+ | +0,317 | ||
| Cu | Cu2+ | +0,338 | ||
| Po | Po2+ | +0,37 | ||
| Тс | Тс2+ | +0,400 | ||
| Ru | Ru2+ | +0,455 | ||
| Cu | Cu+ | +0,522 | ||
| Te | Te4+ | +0,568 | ||
| Rh | Rh+ | +0,600 | ||
| W | W6+ | +0,68 | ||
| Tl | Tl3+ | +0,718 | ||
| Rh | Rh3+ | +0,758 | ||
| Po | Po4+ | +0,76 | ||
| Hg | Hg22+ | +0,7973 | ||
| Ag | Ag+ | +0,799 | ||
| Pb | Pb4+ | +0,80 | ||
| Os | Os2+ | +0,850 | ||
| Hg | Hg2+ | +0,851 | ||
| Pt | Pt2+ | +0,963 | ||
| Pd | Pd2+ | +0,98 | ||
| Ir | Ir3+ | +1,156 | ||
| Au | Au3+ | +1,498 | ||
| Au | Au+ | +1,691 |
Ссылки
Литература
- Корольков Д.В. Основы неорганической химии. — М.:Просвещение, 1982. — 271 с.
Примечания
- ↑ Рабинович В. Л. Алхимия как феномен средневековой культуры. — М.: Наука, 1979
- ↑ Пути познания / Головнер В.Н. Взгляд на мир глазами химика
- ↑ Штрубе В. Пути развития химии: в 2-х томах. Том 2. От начала промышленной революции до первой четверти XX века
- ↑ Беляев А.И. Николай Николаевич Бекетов – выдающийся русский физико-химик и металлург. М., 1953
- ↑ Леенсон И. А. Ряд активности металлов Бекетова: миф или реальность? // Химия в школе. — 2002. — № 9. — С. 90-96.
- ↑ Мчедлов-Петросян Н. О.Труды Н. Н. Бекетова и ряд активности металлов // Вестник Харьковского национального университета. — 2003. — № 596. — Химия. Вып. 10 (33). — С. 221-225.
Электрохимический ряд напряжений металлов (ЭРН)
| Li | K | Ba | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | Hg | Ag | Pt | Au |
Ряд напряжений металлов широко используется в неорганической химии. В частности, результаты многих реакций и даже возможность их осуществления зависят от положения некоторого металла в ЭРН. Обсудим этот вопрос подробнее.
Взаимодействие металлов с кислотами
Металлы, находящиеся в ряду напряжений левее водорода, реагируют с кислотами — неокислителями. Металлы, расположенные в ЭРН правее Н, взаимодействуют только с кислотами — окислителями (в частности, с HNO3 и концентрированной H2SO4).
- Пример 1. Цинк расположен в ЭРН левее водорода, следовательно, способен реагировать практически со всеми кислотами:
- Zn + 2HCl = ZnCl2 + H2
- Zn + H2SO4 = ZnSO4 + H2
- Пример 2. Медь находится в ЭРН правее Н; данный металл не реагирует с «обычными» кислотами (HCl, H3PO4, HBr, органические кислоты), однако вступает во взаимодействие с кислотами-окислителями (азотная, концентрированная серная):
- Сu + 2HCl ≠
- Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
- Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
Обращаю внимание на важный момент: при взаимодействии металлов с кислотами-окислителями выделяется не водород, а некоторые другие соединения. Подробнее об этом можно почитать здесь!
Взаимодействие металлов с водой
- Металлы, расположенные в ряду напряжений левее Mg, легко реагируют с водой уже при комнатной температуре с выделением водорода и образованием раствора щелочи.
- Пример 3.
Натрий, калий, кальций легко растворяются в воде с образованием раствора щелочи:
- 2Na + 2H2O = 2NaOH + H2
- 2K + 2H2O = 2KOH + H2
- Ca + 2H2O = Ca(OH)2 + H2
Металлы, расположенные в ряду напряжений от водорода до магния (включительно), в ряде случаев взаимодействуют с водой, но реакции требуют специфических условий. Например, алюминий и магний начинают взаимодействие с Н2О только после удаления оксидной пленки с поверхности металла. Железо не реагирует с водой при комнатной температуре, но взаимодействует с парами воды. Кобальт, никель, олово, свинец практически не взаимодействуют с H2O не только при комнатной температуре, но и при нагревании.
Металлы, расположенные в правой части ЭРН (серебро, золото, платина) не реагируют с водой ни при каких условиях.
Взаимодействие металлов с водными растворами солей
- Речь пойдет о реакциях следующего типа:
- металл (*) + соль металла (**) = металл (**) + соль металла (*)
- Хотелось бы подчеркнуть, что звездочки обозначают в данном случае не степень окисления, не валентность металла, а просто позволяют различить металл № 1 и металл № 2.
- Для осуществления подобной реакции необходимо одновременное выполнение трех условий:
- соли, участвующие в процессе, должны растворяться в воде (это легко проверить, пользуясь таблицей растворимости);
- металл (*) должен находиться в ряду напряжений левее металла (**);
- металл (*) не должен реагировать с водой (что тоже легко проверяется по ЭРН).
- Пример 4. Рассмотрим несколько реакций:
- Zn + CuSO4 = ZnSO4 + Cu
- Fe + CuS ≠
- Pb + FeSO4 ≠
- K + Ni(NO3)2 ≠
- Первая реакция легко осуществима, все перечисленные выше условия выполнены: сульфат меди растворим в воде, цинк находится в ЭРН левее меди, Zn не реагирует с водой.
Вторая реакция невозможна, т. к. не выполнено первое условие (сульфид меди (II) практически не растворяется в воде). Третья реакция неосуществима, поскольку свинец — менее активный металл, нежели железо (находится правее в ЭРН). Наконец, четвертый процесс НЕ приведет к осаждению никеля, поскольку калий реагирует с водой; образовавшийся гидроксид калия может вступить в реакцию с раствором соли, но это уже совершенно другой процесс.
Процесс термического распада нитратов
Напомню, что нитраты — это соли азотной кислоты. Все нитраты разлагаются при нагревании, но вот состав продуктов разложения может быть разным. Состав определяется положением металла в ряду напряжений.
- Нитраты металлов, расположенных в ЭРН левее магния, при нагревании образуют соответствующий нитрит и кислород:
- 2KNO3 = 2KNO2 + O2
- В ходе термического разложения нитратов металлов, расположенных в ряду напряжений от Mg до Cu включительно, образуются оксид металла, NO2 и кислород:
- 2Cu(NO3)2 = 2CuO + 4NO2 + O2
- Наконец, при разложении нитратов наименее активных металлов (расположенных в ЭРН правее меди) образуются металл, диоксид азота и кислород:
- Hg(NO3)2 = Hg + 2NO2 + O2