- Азотная кислота — строение и химические свойства
- 1. Типичные свойства кислот:
- 2. Специфические свойства азотной кислоты как окислителя
- Окислительные свойства азотной кислоты | Дистанционные уроки
- Обсуждение: «Окислительные свойства азотной кислоты»
- Азотная кислота: получение и химические свойства
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
- В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
- NH3 + O2 → (кат. Pt) NO + H2O
- KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
- Кислотные свойства
- CaO + HNO3 → Ca(NO3)2 + H2O
- HNO3 + NaOH → NaNO3 + H2O
- Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑
- Термическое разложение
- Реакции с неметаллами
- Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.
- HNO3(конц.) + C → CO2 + H2O + NO2
- HNO3(конц.) + S → H2SO4 + NO2 + H2O
- HNO3(разб.) + S → H2SO4 + NO + H2O
- HNO3(конц.) + P → H3PO4 + NO2 + H2O
- Реакции с металлами
- Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
- Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
- С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
- Al + HNO3(конц.) ⇸ (реакция не идет)
- При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
- Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте. HNO3 → (hv) NO2 + H2O + O2
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
- Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
- Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
- В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
- MgO + HNO3 → Mg(NO3)2 + H2O
- Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O
- Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + N2O + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
- Реакции с металлами, основаниями и кислотами
- Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
- Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
- AgNO3 + KCl → AgCl↓ + KNO3
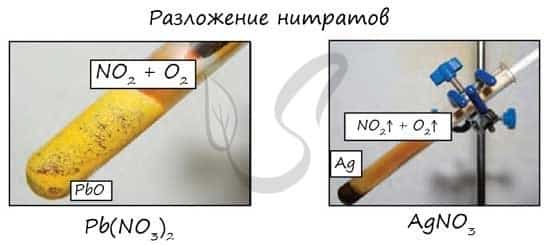
- Разложение нитратов
- Pb(NO3)2 → (t) PbO + NO2 + O2
- NaNO3 → (t) NaNO2 + O2
- Cu(NO3)2 → (t) CuO + NO2 + O2
- PtNO3 → (t) Pt + NO2 + O2
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.
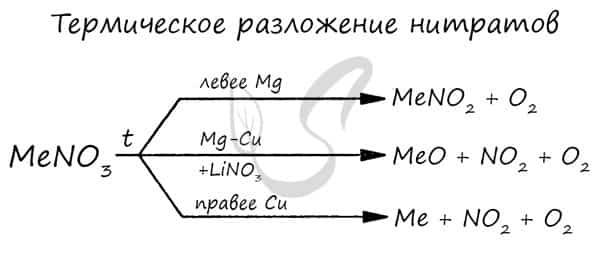
Азотная кислота — строение и химические свойства
Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде. ткип. = 83oC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
- 4HNO 3 = 4NO 2 + 2H 2 O + O 2 .
- Азотная кислота ядовита.
В растворе — сильная кислота; нейтрализуется щелочами, гидратом аммиака, реагирует с основными оксидами и гидроксидами, солями слабых кислот. Сильный окислитель; реагирует с металлами, неметаллами, типичными восстановителями.
Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th, U; не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. Не разрушает диоксид кремния.
Смесь концентрированных HNO3 и HCl («царская водка») обладает сильным окислительным действием (превосходит чистую HNO 3 ), переводит в раствор золото и платину. Еще более активна смесь концентрированных HNO3 и HF.
M r = 63, 01; d = 1, 503 (25) ; t пл = -41, 6 o C; t кип +82,6 o C (разл.).


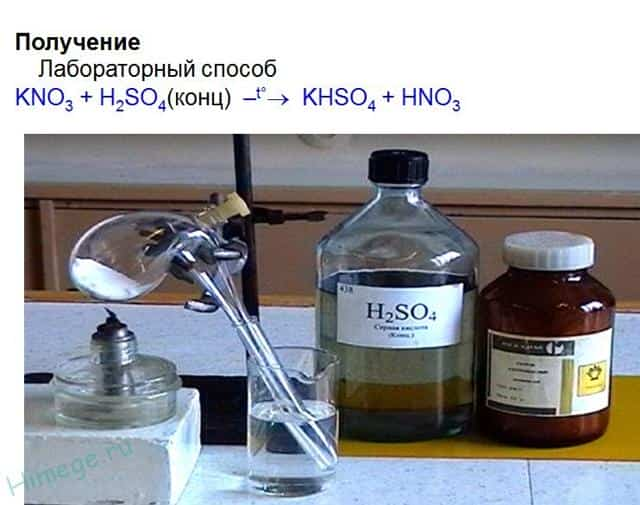
1. Типичные свойства кислот:
- 1) Взаимодействует с основными и амфотерными оксидами:
- 2HNO 3 + CuO = Cu(NO 3 ) 2 + H 2 O
- 6HNO 3 + Al 2 O 3 = 2Al(NO 3 ) 3 + 3H 2 O
- 2) С основаниями, амфотерными гидроксидами:
- HNO 3 + NaOH = NaNO 3 + H 2 O
- 2HNO 3 + Zn(OH) 2 = Zn(NO 3 ) 2 + 2H 2 O
- 3) Вытесняет слабые кислоты из их солей:
- 2HNO 3 + Na 2 CO 3 = 2NaNO 3 + H 2 O + CO 2
- 2HNO 3 + Na 2 SiO 3 = H 2 SiO 3 ↓+ 2NaNO 3
2. Специфические свойства азотной кислоты как окислителя
1) Взаимодействие азотной кислоты с металлами В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода.
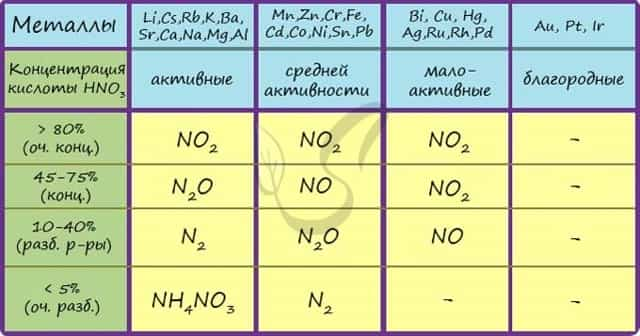
Глубина восстановления нитрат-иона зависит от концентрации кислоты и от положения металла в электрохимическом ряду напряжений металлов. Возможные продукты взаимодействия металлов с азотной кислотой приведены в таблице ниже.
Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты .
-
-
- 4 HN +5 O 3( конц .) + Cu 0 = Cu +2 (NO 3 ) 2 + 2 N +4 O 2 + 2 H 2 O
- N +5 + 1e → N +4 2 окислитель, пр-с восстановления
- Cu 0 – 2e → Cu +2 1 восстановитель, пр-с окисления
- 8 HN +5 O 3( разб .) + 3 Cu 0 = 3 Cu +2 (NO 3 ) 2 + 2 N +2 O + 4 H 2 O
- N +5 + 3e → N +2 2 окислитель, пр-с восстановления
- Cu 0 – 2e → Cu +2 3 восстановитель, пр-с окисления
- 2) Проявляет окислительные свойства при взаимодействии с неметаллами:
- S + 6HNO 3 (конц) = H 2 SO 4 + 6NO 2 + 2H 2 O;
- B + 3HNO 3 = H 3 BO 3 + 3NO 2 ;
- 3P + 5HNO 3 + 2H 2 O = 5NO + 3H 3 PO 4 .
- 3) Азотная кислота окисляет сложные вещества:
- 6HI + 2HNO 3 = 3I 2 + 2NO + 4H 2 O;
- FeS + 12HNO 3 = Fe(NO 3 ) 3 + H 2 SO 4 + 9NO 2 + 5H 2 O.
- 4) Ксантопротеиновая реакция: Азотная кислота окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук – «ксантопротеиновая реакция»).
Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляют концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака (в щелочной среде) окраска переходит в оранжевую.
Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка. 
- 5) Окислительные свойства «царской водки»:
- Смесь концентрированных азотной и соляной кислот в объемном соотношении 1 : 3 обладает еще большей окислительной активностью, они могут растворять даже золото и платину:
- HNO 3 + 4HCl + Au = H[AuCl 4 ] + NO + 2H 2 O;
- 4HNO 3 + 18HCl + Pt = 3H 2 [PtCl 6 ] + 4NO + 8H 2 O
4HNO 3 = 4NO 2 + 2H 2 O + O 2 (комн., на свету).
HNO 3 + H 2 O = NO 3 – + H 3 O + .
HNO 3 (разб.) + NaOH = NaNO 3 + H 2 O ,
HNO 3 (разб.) + NH 3 · H 2 O = NH 4 NO 3 + H 2 O.
- 2HNO 3 (2-3%-я) + 8H 0 (Zn, разб. H 2 SO 4 ) = NH 4 NO 3 + 3H 2 O,
- 2HNO 3 (5%-я) + 8H 0 (Mg, разб. H 2 SO 4 ) = N 2 O ↑ + 5H 2 O,
- HNO 3 (30%-я) + 3H 0 (Zn, разб. H 2 SO 4 ) = NO 2 ↑ H 2 O,
HNO 3 (60%-я) + 2H 0 (Zn, разб. H 2 SO 4 ) = HNO 2 + H 2 O. (кат Pd)
2HNO 3 (конц.) +Ag = AgNO 3 + NO 2 ↑ + H 2 O.
- 8HNO 3 (разб.) + 3Cu = 3Cu(NO 3 ) 2 + 2NO↑ + 4H 2 O
- 10HNO 3 (разб.) + 4Mg = 4Mg(NO 3 ) 2 +N 2 O↑ + 5H 2 O (примесь H 2 )
- 12HNO 3 (разб.) + 5Sn — t —5Sn(NO 3 ) 2 + N 2 ↑ + 6H 2 O (примесь NO)
30HNO 3 (оч. разб.) + 8Al = 8Al(NO 3 ) 3 + 3 NH 4 NO 3 + 9H 2 O (примесь H 2 )
12HNO 3 (оч. разб.) + 5Fe = 5Fe(NO 3 ) 2 + N 2 ↑ + 6H 2 O (0-10 o C),
4HNO 3 (разб.) + Fe = Fe(NO 3 ) 3 + NO↑ + 2H 2 O.
4HNO 3 (конц., гор.) + Hg = Hg(NO 3 ) 2 + 2NO 2 ↑ + 2H 2 O,
8HNO 3 (разб., хол) + 6Hg = 3Hg 2 (NO 3 ) 2 + 2NO ↑ + 4H 2 O.
6HNO 3 (конц.) + S = H 2 SO 4 + 6NO 2 ↑ + 2H 2 O (кип.),
2HNO 3 (конц.) + 6HCl(конц.) = 2NO↑ + 3Cl 2 ↑ + 4H 2 O (100-150 o C).
HNO 3 (конц.) + 4HCl(конц.) + Au = H[AuCl 4 ] + NO↑ + 2H 2 O.
4HNO 3 (конц.) + 18HCl(конц.) + 3Pt = 3H 2 [PtCl 6 ] + 4NO↑ + 8H 2 O
4HNO 3 (конц.) + 18HF(конц.) + 3Si = 3H 2 [SiF 6 ] + 4NO↑ + 8H 2 O.
4HNO 3 (дымящ.) + P 4 O 10 = 2N 2 O 5 + 4HPO 3 (в атмосфере O 2 +O 3 )
Окислительные свойства азотной кислоты | Дистанционные уроки
Окислительные свойства азотной кислоты.
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.

- автор статьи — Саид Лутфуллин
- Азотная кислота – в любом виде (и разбавленная, и концентрированная) является сильным окислителем.
Причем, разбавленная восстанавливается глубже, чем концентрированная.
Окислительные свойства обеспечиваются азотом в высшей степени окисления +5
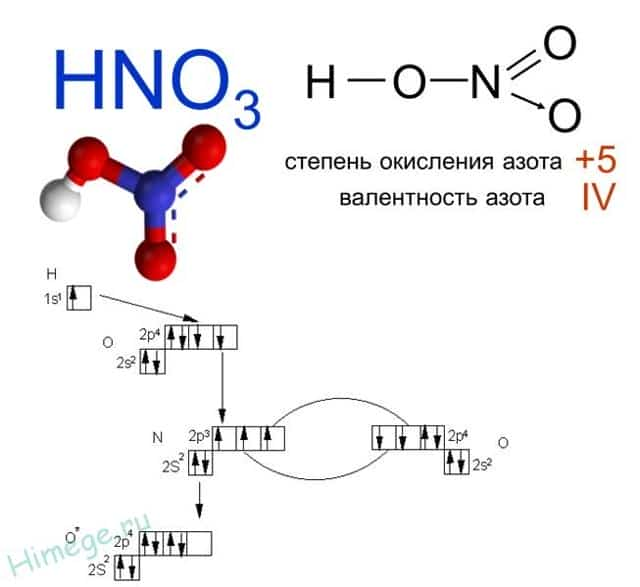
Какая валентность у азота в этом соединении? Вопрос очень хитрый, многие отвечают на него корректно. У азота в азотной кислоте валентность IV.
Атом азота не может образовать больше ковалентных связей, посмотрите на электронную диаграмму:
- Три связи с каждым атомом кислорода, и четвертая как бы распределяется, образуется полуторная связь. Таким образом, валентность азота IV, а степень окисления +5
- Первое самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии с металлами никогда не выделяется
- Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
- HNO3 + Ме → нитрат + H2O + продукт восстановленного азота
- Два нюанса:
1. Алюминий, железо и хром с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
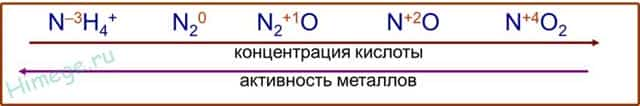
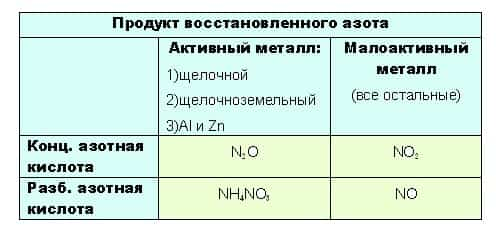
- Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:
- Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
(Не все конечно, такие реакции вообще что угодно дать могут, но в ЕГЭ образуются только эти).
Определить какой именно продукт будет образовываться можно чисто логически:
- до таких низких степеней окисления как -3 или +1, с образованием продуктов NH4NO3 или N2O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn. Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N2O, а при взаимодействии с разб. азотной кислотой NH4NO3.
- 4Ba + 10HNO3(конц.) → 4Ba(NO3)2 + 5H2O + N2O↑
- 4Ba + 10HNO3(разб.) → 4Ba(NO3)2 + 3H2O + NH4NO3
- 8Li + 10HNO3(конц.) → 8LiNO3 + 5H2O + N2O↑
- 8Li + 10HNO3(разб.) → 8LiNO3 + 3H2O + NH4NO3
- 8Al + 30HNO3(конц.) (t)→ 8Al(NO3)3 + 15H2O + 3N2O↑
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3
Остальные металлы восстанавливают азотную кислоту до +2 или +4, с образованием продуктов соответственно: NO или O2.
Разбавленная кислота восстанавливается глубже
- при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO. Ну а с конц. азотной NO2:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 4H2O + 2NO↑
- Fe + 6HNO3(конц.) (t)→ Fe(NO3)3 + 3H2O + 3NO2↑
- Fe + 4HNO3(разб.) → Fe(NO3)3 + 2H2O + NO↑
- (обратите внимание, что железо окисляется до высшей степени окисления)
- Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
- 3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO↑
- Если тяжело сразу понять всю логичность выбора, вот таблица:
- Азотная кислота окисляет неметаллы до высших оксидов.
- Так как неметаллы – не такие сильные восстановители, как активные металлы, азот может восстановиться только до +4, образовав NO2 или NO соответственно.
- При окислении неметаллов концентрированной азотной кислотой образуется бурый газ (NO2), а если кислота разбавленная, то образуется NO. Схемы реакций следующие:
- неметалл + HNO3(разб.) → соединение неметалла в высшей степени окисления + NO
- неметалл + HNO3(конц.) → соединение неметалла в высшей степени окисления + NO2
- C + 4HNO3(конц.) → CO2↑ + 2H2O + 4NO2↑
- 3C + 4HNO3(разб.) → 3CO2↑ + 2H2O + 4NO↑
- (угольная кислота не образуется, так как она не стабильна)
- P + 5HNO3(конц.) → H3PO4 + H2O + 5NO2↑
- 3P + 5HNO3(разб.) + 2H2O → 3H3PO4 + 5NO↑
- B + 3HNO3(конц.) → H3BO3 + 3NO2↑
- B + HNO3(разб.) + H2O → H3BO3 + NO↑
S + 6HNO3(конц.) → H2SO4 + 2H2O + 6NO2↑
S + 2HNO3(разб.) → H2SO4 + 2NO↑
- концентрированная азотная кислота окисляет сероводород. Окисление идет глубже при нагревании:
2HNO3(конц.) + H2S → S↓ + 2NO2 + 2H2O
H2S + 8HNO3(конц.) → H2SO4 + 8NO2↑ + 4H2O
- концентрированная азотная кислота окисляет сульфиды до сульфатов:
CuS + 8HNO3(конц.) → CuSO4 + 4H2O + 8NO2↑
- азотная кислота настолько сурова, что может окислить даже ГАЛОГЕН. Только один – иод. Разбавленная восстанавливается глубже: до +2, концентрированная до +4. А вот иод окисляется не до высшей степени окисления +7 (слишком круто), а до +5, образуя иодноватую кислоту HIO3:
10HNO3(конц.) + I2 (t)→ 2HIO3 + 10NO2↑ + 4H2O
10HNO3(разб.) + 3I2 (t)→ 6HIO3 + 10NO↑ + 2H2O
- концентрированная азотная кислота реагирует с хлоридами и фторидами. Только следует понимать, что с фторидами и хлоридами протекает обычная реакция ионного обмена с вытеснением галогеноводорода и образованием нитрата:
NaCl(тв.) + HNO3(конц.) → HCl↑ + NaNO3
NaF(тв.) + HNO3(конц.) → HF↑ + NaNO3
- А вот с бромидами и иодидами (и с бромоводородами, и с иодоводородами) протекает ОВР. В обоих случаях образуется свободный галоген, а азот восстанавливается до NO2:
8HNO3(конц.) + 6KBr(тв.) → 3Br2 + 4H2O + 6KNO3 + 2NO2↑
4HNO3(конц.) + 2NaI(тв.) → 2NaNO3 + 2NO2↑ + 2H2O + I2↓
- Образовавшийся иод окисляется дальше до иодноватой кислоты, поэтому реакцию можно записать сразу:
- 7HNO3(конц.) + NaI → NaNO3 + 6NO2↑ + 3H2O + HIO3
- То же самое происходит при взаимодействии с иодо- и бромоводородами:
- 2HNO3(конц.) + 2HBr → Br2 + 2NO2↑ + 2H2O
- 6HNO3(конц.) + HI → HIO3 + 6NO2↑ + 3H2O
Реакции с золотом, магнием, медью и серебром
Обсуждение: «Окислительные свойства азотной кислоты»
(Правила комментирования)
Азотная кислота: получение и химические свойства
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
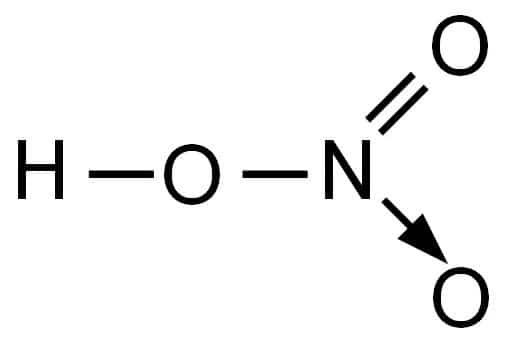
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
- Например, азотная кислота взаимодействует с оксидом меди (II):
- CuO + 2HNO3 → Cu(NO3)2 + H2O
- Еще пример: азотная кислота реагирует с гидроксидом натрия:
- HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
- Например, азотная кислота взаимодействует с карбонатом натрия:
- 2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
- 4. Азотная кислота частично разлагается при кипении или под действием света:
- 4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами.
При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5.
Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
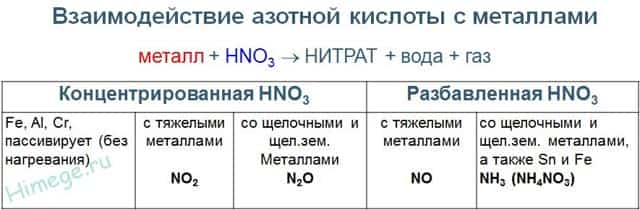
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
- Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
- Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
- Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
- HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
- Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
- 4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
- С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
- 10HNO3 + 4Ca → 4Ca(NO3)2 + N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
- 8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
- С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
- 12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
- При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
- 10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
- Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
- 10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
- 5HNO3 + P → H3PO4 + 5NO2 + H2O
- 5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
- Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
- 4HNO3 + C → CO2 + 4NO2 + 2H2O
- Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
- 10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7.
Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
- Например, азотная кислота окисляет оксид серы (IV):
- 2HNO3 + SO2 → H2SO4 + 2NO2
- Еще пример: азотная кислота окисляет иодоводород:
- 6HNO3 + HI → HIO3 + 6NO2 + 3H2O
- Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
- Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
- 2HNO3 + H2S → S + 2NO2 + 2H2O
- При нагревании до серной кислоты:
- 2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
- 8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
- Соединения железа (II) азотная кислота окисляет до соединений железа (III):
- 4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.

Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.






