- Относительная атомная и молекулярная масса
- Как найти массовую долю элемента в веществе
- Пример 1
- Пример 2
- Как вычислить массовую долю вещества в растворе
- Пример
- Вопросы для самопроверки:
- Рд 52.18.286-91 методика выполнения измерений массовой доли водорастворимых форм металлов (меди, свинца, цинка, никеля, кадмия, кобальта, хрома, марганца) в пробах почвы атомно-абсорбционным анализом
- СОДЕРЖАНИЕ
- 1. сущность метода анализа
- Блок-схема атомно-абсорбционного спектрофотометра
- Таблица 1
- 1 а . НОРМЫ ПОГРЕШНОСТИ ИЗМЕРЕНИЙ
- Таблица 1а
- 2. СРЕДСТВА ИЗМЕРЕНИЙ, ОБОРУДОВАНИЕ, MATEРИАЛЫ И РЕАКТИВЫ
- Олимпиадные задания для 11 класса
- Металлы как химические элементы | Химическая энциклопедия
- Таблица молярных масс химических элементов
- Таблица молярных масс химических элементов (1 часть):
- Таблица молярных масс химических элементов (2 часть):
- Таблица молярных масс химических элементов (3 часть):
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
- Как найти массовую долю растворенного вещества, расскажет формула:
- где
— обозначение массовой доли;
-
— масса вещества;
-
— масса раствора.
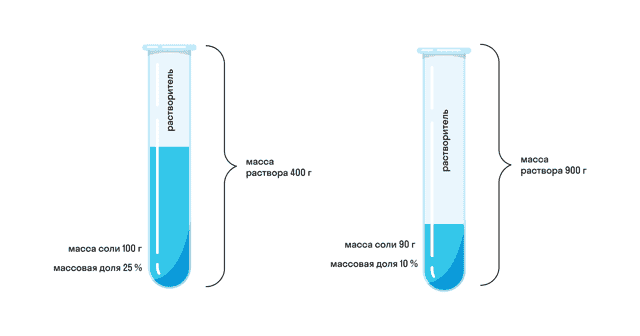
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
-
— количество атомов искомого элемента;
-
— относительная атомная масса элемента;
-
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Численно относительная молекулярная масса вещества равна его молярной массе, что удобно использовать в расчетах. Но путать эти два понятия не стоит. Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
- m(O) = 8 − 4,8 = 3,2 г
- Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
- Зная массы каждого компонента оксида, сделать расчет несложно:
-
или
.
-
или
.
- Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
- Решение:
- В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
-
, значит
.
- Согласно таблице Менделеева относительная атомная масса водорода равна единице.
- Ar(H) = 1.
- Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
- Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
- Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
-
или
.
- Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
Указание массовой доли вещества — один из способов выражения концентрации раствора.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
- Решение:
- Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
- m(р–ра) = 500 × 1,13 = 565 г.
- Дальше вспомним, как находить массовую долю растворенного вещества:
-
, а значит
.
- Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
- m(Э) = 0,13 × 565 = 73,45 г.
- Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
-
Как обозначается массовая доля и в чем она выражается?
-
В чем разница между молекулярной массой вещества и его молярной массой?
-
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
-
Как рассчитать массовую долю вещества в растворе?
-
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Рд 52.18.286-91 методика выполнения измерений массовой доли водорастворимых форм металлов (меди, свинца, цинка, никеля, кадмия, кобальта, хрома, марганца) в пробах почвы атомно-абсорбционным анализом
- РУКОВОДЯЩИЙ ДОКУМЕНТ
- МЕТОДИЧЕСКИЕ УКАЗАНИЯ
- Методика выполнения измерений массовой доли водорастворимых форм металлов (меди, свинца, цинка, никеля, кадмия, кобальта, хрома, марганца) в пробах почвы атомно-абсорбционным анализом
РД 52.18.2 86-91
- ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР ПО ГИДРОМЕТЕОРОЛОГИИ
- Москва 1991
- РУКОВОДЯЩИЙ ДОКУМЕНТ
| МЕТОДИЧЕСКИЕ УКАЗАНИЯ Методика выполнения измерений массовой доли водорастворимых форм металлов (меди, свинца, цинка, никеля, кадмия, кобальта, хрома, марганца) в пробах почвы атомно-абсорбционным анализом | РД 52.18.2 8 6-91 |
Дата введения 01.04.91
СОДЕРЖАНИЕ
ЛИСТ РЕГИСТРАЦИИ ИЗМЕНЕНИЙ РД 52.18.286-91 |
- Настоящие методические указания устанавливают порядок выполнения измерений массовой доли водорастворимых форм тяжелых металлов (меди, свинца, цинка, никеля, кадмия, кобальта, хрома, марганца) в пробах почвы и предназначены для использования в лабораториях Общегосударственной службы наблюдения и контроля загрязнения природной среды и научно-исследовательских учреждениях Государственного комитета СССР по гидрометеорологии.
- Оптимальный диапазон определяемых атомно-абсорбционным анализом концентраций металлов при атомизации распылением раствора в пламя:
- медь — 0,2 — 5,0 мкг/мл;
- свинец — 1,0 — 20,0 мкг/мл;
- цинк — 0,05 — 1,00 мгк/мл;
- никель — 0,3 — 5,0 мкг/мл;
- кадмий — 0,05 — 2,00 мкг/мл;
- кобальт — 0,5 — 5,0 мкг/мл;
- хром — 0,5 — 10,0 мкг/мл;
- марганец — 0,1 — 3,0 мкг/мл.
- Термины, использованные в настоящих методических указаниях и пояснения к ним, приведены в приложении.
1. сущность метода анализа
1.1 Сущность метода анализа заключается в обработке проб почвы при комнатной температуре бидистиллированной водой и определении в полученном, растворе водорастворимых соединений металлов атомно-абсорбционным анализом.
1.2 Метод атомно-абсорбционного анализа основан на свойстве атомов металлов поглощать в основном состоянии свет определенных длин волн, который они испускают в возбужденном состоянии. Необходимую для поглощения резонансную линию чаще всего получают от лампы с полым катодом, изготовленным из определяемого элемента.
- В атомно-абсорбционной спектроскопии, так же как и в молекулярной, допускает закон Ламберта-Бугера-Бера:
- А = k · C (1)
- где А — величина, характеризующая поглощение света (оптическая плотность, абсорбция), мБ или %;
- k — коэффициент поглощения;
- С — концентрация определяемого элемента, мкг/мл.
- Величина поглощения света пропорциональна содержанию определяемых элементов, на чем и основано их количественное определение.
1.3. Блок-схема атомно-абсорбционного спектрофотометра приведена на черт. 1.
Анализируемый раствор 9 в виде аэрозоля из распылителя 8 вводят в пламя горелки 3 (пламя ацетилен-воздух, температура от 2000 до 3000 °С). В пламени происходит испарение растворителя, плавление и испарение пробы почвы, термическая диссоциация молекул и образование свободных атомов, которые могут поглощать излучение внешнего источника света 2.
Световой поток от лампы проходит через пламя горелки 3 и монохроматор 4.
Монохроматор выделяет узкую спектральную линию (обычно 0,2-2,0 нм), в которой находится измеряемая спектральная линия определяемого элемента. Атомы исследуемого элемента поглощают световой поток лампы.
Выходящий световой поток с помощью фотоумножителя 5 превращается в электрический сигнал и после усилителя 6 регистрируется гальванометром 7.
1.4. Оптимизация аппаратурных условий атомно-абсорбционного анализа
1.4.1. Оптимизации подлежат:
- ток лампы;
- рабочая высота пламени;
- соотношение горючего газа и окислителя;
- ширина спектральной щели.
Блок-схема атомно-абсорбционного спектрофотометра
- 1 – источник питания; 2 – лампа с полым катодом; 3 – пламя (зона атомизации); 4 – монохроматор; 5 – фотоумножитель; 6 – усилитель; 7 – гальванометр; 8 – распылитель; 9 – анализируемый раствор.
- Черт. 1
1.4.1.1. При увеличении тока лампы (но не более максимального) улучшается воспроизводимость, но уменьшается время жизни лампы, особенно для легколетучих элементов. Поэтому высокие токи лампы следует применять при очень низких концентрациях вблизи предела обнаружения, вызывающего абсорбцию, эквивалентную двойной флуктуации фона.
1.4.1.2. Оптимальная высота пламени для воздушно-ацетиленового пламени 5-13 мм.
1.4.1.3. Соотношение горючее/окислитель влияет на окислительно-восстановительные свойства пламени, на его собственное поглощение и эмиссию.
Легкоатомизирующиеся элементы (медь, свинец, цинк, никель, кадмий, кобальт, марганец) определяются в окислительном воздушно-ацетиленовом пламени, которое обычно более прозрачно, характеризуется меньшими шумами и боолее высокой температурой.
Хром определяется в восстановительном воздушно-ацетиленовом пламени. Оптимальное давление и расход окислителя и восстановителя зависят от конструкции распылителя и обычно указаны фирмой — изготовителем прибора.
1.4.1.4. Спектральная ширина щели составляет 0,1-2,0 нм. Как правило, используют максимальную спектральную ширину щели, при которой меньше дрейф установленной длины волны и в спектральный интервал не попадают посторонние линии.
При наличии в спектре источника линий, близких к резонансной, следует работать с малой спектральной шириной щели. Так, для меди рекомендуемая ширина спектральной щели — 0,7 нм, для цинка — 0,7-2,0 нм, для никеля — 0,1-0,2 нм.
1.5 . Методы устранения мешающих влияний при атомно-абсорбционном анализе
1.5.1. Атомно-абсорбционный анализ позволяет с хорошей селективностью определять медь, свинец, цинк, никель, кадмий, кобальт, хром, марганец, однако он не свободен от мешающих влияний.
1.5.2. Вo избежание различного светопоглощения, которое может исказить результаты определения металлов, в рабочие растворы следует добавлять 2-3 капли концентрированной азотной кислоты,
1.5.3. Неспецифическое поглощение и рассеяние света могут вызвать растворенные соли при их большом содержании (свыше 5000 мкг/мл). Это явление обычно наблюдается при определении металлов, у которых длина аналитической резонансной линии менее 300 нм. Устранить его можно разбавлением раствора, если позволяет концентрация измеряемого элемента, или использованием корректировки фона.
Если используемый спектрофотометр не позволяет осуществить корректировку фона, необходимо оптическую плотность (абсорбцию) уменьшить на величину фона, измеренного на близкое к аналитической не резонансной спектральной линии.
Аналитические длины волн при определении исследуемых элементов приведены в табл. 1
Таблица 1
| Металл | Аналитическая длина волны, нм |
| Кадмий | 228,3 |
| Кобальт | 240,7 |
| Медь | 324,7 |
| Марганец | 279,5 |
| Никель | 332,0 |
| Свинец | 283,3 |
| Хром | 359,9 |
| Цинк | 213,9 |
1 а . НОРМЫ ПОГРЕШНОСТИ ИЗМЕРЕНИЙ
Методика выполнения измерений обеспечивает выполнение измерений с погрешностью в соответствии с таблицей 1а
Таблица 1а
| Наименование определяемого металла | пдк , млн-1 | Диапазон концентраций, млн-1 | Значение составляющей погрешности, % | |||
| Случайная, Р=0,68 | Неисключенная систематическая (показатель правильности), Р=0,95 Δс | Погрешность методики, Р=0,95 Δ m | ||||
| Показатель сходимости | Показатель воспроизводимости | |||||
| Медь | Не уст. |
|
7,0 | 10,0 | 4,0 | 20,0 |
| Свинец | Не уст. | 11,0 | 17,0 | 21,0 | 41,0 | |
| Цинк | Не уст. | 14,0 | 21,0 | 12,0 | 43,0 | |
| Никель | Не уст. | п.о | 16,0 | 8,0 | 34,0 | |
| Кадмий | Не уст. | 9,0 | 14,0 | 24,0 | 38,0 | |
| Кобальт | Не уст. | 7,0 | 10,0 | 15,0 | 26,0 | |
| Хром | Не уст. | 7,0 | 10,0 | 13,0 | 25,0 | |
| Марганец | Не уст. | 5,0 | 7,0 | 3,0 | 14,0 |
Раздел 1а. (Введен дополнительно. Изм. № 1)
2. СРЕДСТВА ИЗМЕРЕНИЙ, ОБОРУДОВАНИЕ, MATEРИАЛЫ И РЕАКТИВЫ
2.1. Средства измерений
2.1.1. Весы аналитические типа BЛP-200 г — по ГОСТ 24104.
2.1.2. Атомно-абсорбционный спектрофотометр типа C115-1М (производство СССР), ААС-1 или ААС-3 (производство ГДР), Хитачи-30 (производство Японии) или другие.
2.1.3. Колбы мерные вместимостью 1000 мл — по ГОСТ 1770 – 6 шт.
2.1.4. Пипетки калиброванные с делениями — по ГОСТ 20292:
- — вместимостью 1 мл — 10 шт.;
- — вместимостью 2 мл — 10 шт.;
- — вместимостью 5 мл — 10 шт.;
- — вместимостью 10 мл — 10 шт.
2.1.5. Пробирки градуированные вместимостью 20 мл — по ГОСТ-10515 – 50 шт.
2.1.6. Цилиндры мерные вместимостью 250 мл — по ГОСТ 1770 – 2 шт.
2.2. Оборудование, материалы
2.2.1. Шкаф сушильный лабораторный типа СНОЛ-2,5·2,5·2,5/2М-МО1 – по ТУ 16-531-099 – 1 шт.
2.2.2. Аквадистиллятор типа ДЭ-4-2 д.А0.000.736 ПС – по ТУ 61-1-72 – 1 шт.
Олимпиадные задания для 11 класса
- Олимпиадные задания для 11 класса
- Задание № 1.
- Используя метод электронного баланса, составьте уравнение реакции:
- KMnO4+H2S+H2SO4→MnSO4+S+ K2SO4+…
- Определите окислитель и восстановитель. (5 баллов)
- Задание №2.
Массовая доля металла в его гидроксиде составляет 52,3%. Определить формулу гидроксида. Составить два уравнения способов его получения и уравнения, иллюстрирующие его свойства. (5 баллов)
- Задание № 3.
- Составьте все возможные изомеры гегсана и запишите их структурные формулы.
- (3 балла)
Задача 4. Такие разные шарики.
В вашем распоряжении четыре воздушных шарика, но надуты они не воздухом, а четырьмя разными газами – водородом, кислородом, углекислым газом, и природным газом, метаном, формула которого CH4. К каждому шарику присоединена трубочка с зажимом, позволяющим постепенно выпускать газ из шарика. Объемы шариков одинаковы.
1. Какими физическими методами можно различить эти шарики? Ответ желательно подтвердить численными характеристиками газов.
2. Какими химическими методами, можно определить каждый из этих газов? Если это возможно, ответ подтвердите уравнениями химических реакций.
(10 баллов)
Задача 5. Три прибора
На рисунке представлены три прибора, которые химики используют для разделения смесей веществ. В вашем распоряжении есть следующие смеси: воды и соли (раствор), воды и измельченного мела, воды и бензина, воды и растительного масла, воды и спирта (раствор), воды и железных опилок, воды и сахарного песка (раствор).
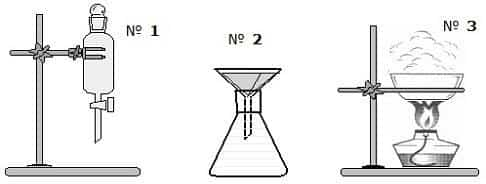
- a) Для каждого рисунка укажите, как называются составные части этих приборов.
- b) Как называются способы разделения смесей с помощью приборов №2 и №3?
- c) Укажите, какие из перечисленных смесей можно разделить с помощью каждого прибора.
d) Какую смесь из перечисленных нельзя разделить этими способами? Какой способ вы можете предложить для ее разделения?
- (11 баллов)
- ОТВЕТЫ:
- Задание № 1.
-
Составлен электронный баланс:
2 │ Mn+7 + 5e → Mn+2
5 │ S-2 – 2e →S0
-
Расставлены коэффициенты в уравнении реакции:
2KMnO4 + 5H2S + 3H2SO4 = 5S + 2 MnSO4 + K2SO4 + 8 H2O
-
Указано, что Mn+7 (KMnO4 за счет Mn+7) – окислитель, процесс восстановления
- S-2 (H2S за счет S-2) – восстановитель, процесс окисления
- Задание № 2.
- Составлена формула гидроксида в общем виде, выражена массовая доля металла. Ме(ОН)х; ω(Ме)=М(Ме):(М(Ме)+17х)=0,523
Произведены расчеты методом перебора валентности металла. Если валентность Ме равна 1,то 0,523у=у+17, где у –молярная масса Ме. У=18,65. Металла с такой молярной массой не существует. Х=2; 0,523у=у+34; у=36,3. Такого Ме не существует. Х=3; 0,523у=у+51; у=55,95. Такую молярную массу имеет железо, для него характерна валентность 3. Значит, формула гидроксида Fe(OH)3.
- Составлены уравнения реакций, с помощью которых можно получить Fe(OH)3: FeCl3+3KOH=3KCl+Fe(OH)3↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
- Составлены уравнения , подтверждающие свойства нерастворимого и амфотерного гидроксида: 2Fe(OH)3=Fe2O3+3H2O; Fe(OH)3+3HCl=FeCl3+3H2O; Fe(OH)3+3KOH=K3Fe(OH)6 или Fe(OH)3+KOH t= KFeO2+2H2O
- Задание №3.
- Минимум 4 изомера
Металлы как химические элементы | Химическая энциклопедия
Подавляющее большинство (93 из 117) известных в настоящее время химических элементов относится к металлам. Атомы различных металлов имеют много общего в строении, а образуемые ими простые и сложные вещества имеют схожие свойства (физические и химические).
Положение в периодической системе и строение атомов металлов.
В периодической системе металлы располагаются левее и ниже условной ломаной линии, проходящей от бора к астату (см. таблицу ниже). К металлам относятся почти все s-элементы (за исключением Н, Не), примерно половина р-элементов, все d— и f-элементы (лантаниды и актиниды).
У большинства атомов металлов на внешнем энергетическом уровне содержится небольшое число (до 3) электронов, только у некоторых атомов р-элементов (Sn, Pb, Bi, Ро) их больше (от четырех до шести).
Валентные электроны атомов металлов слабо (по сравнению с атомами неметаллов) связаны с ядром.
Поэтому атомы металлов относительно легко отдают эти электроны другим атомам, выступая в химических реакциях только в качестве восстановителей и превращаясь при этом в положительно заряженные катионы:
Me — пе– = Меn+.
В отличие от неметаллов для атомов металлов характерны только положительные степени окисления от +1 до +8.
Легкость, с которой атомы металла отдают свои валентные электроны другим атомам, характеризует восстановительную активность данного металла. Чем легче атом металла отдает свои электроны, тем он более сильный восстановитель.
Если расположить в ряд металлы в порядке уменьшения их восстановительной способности в водных растворах, мы получим известный нам вытеснительный ряд металлов, который называется также электрохимическим рядом напряжений (или рядом активности) металлов (см. таблицу ниже).
Распространенность металлов в природе.
В первую тройку наиболее распространенных в земной коре (это поверхностный слой нашей планеты толщиной примерно 16 км) металлов входят алюминий, железо и кальций. Менее распространены натрий, калий, магний. В таблице ниже приведены массовые доли некоторых металлов в земной коре.
железо и кальций. Менее распространены натрий, калий, магний. В таблице ниже приведены массовые доли некоторых металлов в земной коре.
Распространенность металлов в земной коре
| Al | 8,8 | Cr | 8,3 ∙ 10-3 |
| Fe | 4,65 | Zn | 8,3 ∙ 10-3 |
| Ca | 3,38 | Ni | 8 ∙ 10-3 |
| Na | 2,65 | Cu | 4,7 ∙ 10-3 |
| K | 2,41 | Pb | 1,6 ∙ 10-3 |
| Mg | 2,35 | Ag | 7 ∙ 10-6 |
| Ti | 0,57 | Hg | 1,35 ∙ 10-6 |
| Mn | 0,10 | Au | 5 ∙ 10-8 |
Элементы, массовая доля которых в земной коре составляет менее 0,01 %, называются редкими. К числу редких металлов относятся, например, все лантаниды.
Если элемент не способен концентрироваться в земной коре, т. е. не образует собственных руд, а встречается в качестве примеси с другими элементами, то его относят к рассеянным элементам.
Рассеянными, например, являются следующие металлы: Sc, Ga, In, Tl, Hf.
В 40-х годах XX в. немецкие ученые Вальтер и Ида Нолла к высказали мысль о том. что в каждом булыжнике на мостовой присутствуют все химические элементы периодической системы. Вначале эти слова были встречены их коллегами далеко не с единодушным одобрением. Однако по мере появления все более точных методов анализа ученые все больше убеждаются в справедливости этих слов.
Поскольку все живые организмы находятся в тесном контакте с окружающей средой, то и в каждом из них должны содержаться если не все, то большая часть химических элементов периодической системы.
Например, в организме взрослого человека массовая доля неорганических веществ составляет 6 %. Из металлов в этих соединениях присутствуют Mg, Са, Na, К.
В составе многих ферментов и иных биологически активных органических соединений в нашем организме содержатся V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Сг и некоторые другие металлы.
В организме взрослого человека содержится в среднем около 140 г ионов калия и около 100 г ионов натрия. С пищей мы ежедневно потребляем от 1,5 г до 7 г ионов калия и от 2 г до 15 г ионов натрия. Потребность в ионах натрия настолько велика, что их необходимо специально добавлять в пищу.
Значительная потеря ионов натрия (в виде NaCl с мочой и потом) неблагоприятно сказывается на здоровье человека. Поэтому в жаркую погоду врачи рекомендуют пить минеральную воду.
Однако и избыточное содержание соли в пище негативно сказывается на работе наших внутренних органов (в первую очередь, сердца и почек).
Таблица молярных масс химических элементов
Молярная масса – это характеристика вещества, отношение массы вещества к его количеству.
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol). Исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярная масса численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро (NA = 6,022 140 76⋅1023 моль−1).
Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой (абсолютной молекулярной массой), выраженной в а. е. м., и относительной молекулярной массой.
В свою очередь, молекулярная масса – масса молекулы. Различают абсолютную молекулярную массу (обычно выражается в атомных единицах массы, а. е. м.) и относительную молекулярную массу – безразмерную величину, равную отношению массы молекулы к 1/12 массы атома углерода 12C.
Молярную массу обозначают M.
Необходимо иметь в виду, что молярные массы химических элементов и простых веществ, которые они образуют – не одно и то же.
Таблица молярных масс химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Молярная масса |
| 1 | Водород | H | 1,00784-1,00811 а.е.м. (г/моль) |
| 2 | Гелий | He | 4,002602(2) а.е.м. (г/моль) |
| 3 | Литий | Li | 6,938-6,997 а.е.м. (г/моль) |
| 4 | Бериллий | Be | 9,012182(3) а.е.м. (г/моль) |
| 5 | Бор | B | 10,806-10,821 а.е.м. (г/моль) |
| 6 | Углерод | C | 12,0096-12,0116 а.е.м. (г/моль) |
| 7 | Азот | N | 14,00643-14,00728 а.е.м. (г/моль) |
| 8 | Кислород | O | 15,99903-15,99977 а.е.м. (г/моль) |
| 9 | Фтор | F | 18,998403163(6) а.е.м. (г/моль) |
| 10 | Неон | Ne | 20,1797(6) а.е.м. (г/моль) |
| 11 | Натрий | Na | 22,98976928(2) а.е.м. (г/моль) |
| 12 | Магний | Mg | 24,304-24,307 а.е.м. (г/моль) |
| 13 | Алюминий | Al | 26,9815386(8) а.е.м. (г/моль) |
| 14 | Кремний | Si | 28,084-28,086 а.е.м. (г/моль) |
| 15 | Фосфор | P | 30,973762(2) а.е.м. (г/моль) |
| 16 | Сера | S | 32,059-32,076 а.е.м. (г/моль) |
| 17 | Хлор | Cl | 35,446-35,457 а.е.м. (г/моль) |
| 18 | Аргон | Ar | 39,948(1) а.е.м. (г/моль) |
| 19 | Калий | K | 39,0983(1) а.е.м. (г/моль) |
| 20 | Кальций | Ca | 40,078(4) а.е.м. (г/моль) |
| 21 | Скандий | Sc | 44,955912(6) а.е.м. (г/моль) |
| 22 | Титан | Ti | 47,867(1) а.е.м. (г/моль) |
| 23 | Ванадий | V | 50,9415(1) а.е.м. (г/моль) |
| 24 | Хром | Cr | 51,9961(6) а.е.м. (г/моль) |
| 25 | Марганец | Mn | 54,938045(5) а.е.м. (г/моль) |
| 26 | Железо | Fe | 55,845(2) а.е.м. (г/моль) |
| 27 | Кобальт | Co | 58,933194(4) а.е.м. (г/моль) |
| 28 | Никель | Ni | 58,6934(4) а.е.м. (г/моль) |
| 29 | Медь | Cu | 63,546(3) а.е.м. (г/моль) |
| 30 | Цинк | Zn | 65,38(2) а.е.м. (г/моль) |
Таблица молярных масс химических элементов (2 часть):
| 31 | Галлий | Ga | 69,723(1) а.е.м. (г/моль) |
| 32 | Германий | Ge | 72,630(8) а.е.м. (г/моль) |
| 33 | Мышьяк | As | 74,92160(2) а.е.м. (г/моль) |
| 34 | Селен | Se | 78,96(3) а.е.м. (г/моль) |
| 35 | Бром | Br | 79,901-79,907 а.е.м. (г/моль) |
| 36 | Криптон | Kr | 83,798(2) а.е.м. (г/моль) |
| 37 | Рубидий | Rb | 85,4678(3) а.е.м. (г/моль) |
| 38 | Стронций | Sr | 87,62(1) а.е.м. (г/моль) |
| 39 | Иттрий | Y | 88,90585(2) а.е.м. (г/моль) |
| 40 | Цирконий | Zr | 91,224(2) а.е.м. (г/моль) |
| 41 | Ниобий | Nb | 92,90638(2) а.е.м. (г/моль) |
| 42 | Молибден | Mo | 95,96(2) а.е.м. (г/моль) |
| 43 | Технеций | Tc | 97,9072 а.е.м. (г/моль) |
| 44 | Рутений | Ru | 101,07(2) а.е.м. (г/моль) |
| 45 | Родий | Rh | 102,90550(2) а.е.м. (г/моль) |
| 46 | Палладий | Pd | 106,42(1) а.е.м. (г/моль) |
| 47 | Серебро | Ag | 107,8682(2) а.е.м. (г/моль) |
| 48 | Кадмий | Cd | 112,411(8) а.е.м. (г/моль) |
| 49 | Индий | In | 114,818(1) а.е.м. (г/моль) |
| 50 | Олово | Sn | 118,710(7) а.е.м. (г/моль) |
| 51 | Сурьма | Sb | 121,760(1) а.е.м. (г/моль) |
| 52 | Теллур | Te | 127,60(3) а.е.м. (г/моль) |
| 53 | Йод | I | 126,90447(3) а.е.м. (г/моль) |
| 54 | Ксенон | Xe | 131,293(6) а.е.м. (г/моль) |
| 55 | Цезий | Cs | 132,9054519(2) а.е.м. (г/моль) |
| 56 | Барий | Ba | 137,327(7) а.е.м. (г/моль) |
| 57 | Лантан | La | 138,90547(7) а.е.м. (г/моль) |
| 58 | Церий | Ce | 140,116(1) а.е.м. (г/моль) |
| 59 | Празеодим | Pr | 140,90765(2) а.е.м. (г/моль) |
| 60 | Неодим | Nd | 144,242(3) а.е.м. (г/моль) |
Таблица молярных масс химических элементов (3 часть):
| 61 | Прометий | Pm | 144,9127 а.е.м. (г/моль) |
| 62 | Самарий | Sm | 150,36(2) а.е.м. (г/моль) |
| 63 | Европий | Eu | 151,964(1) а.е.м. (г/моль) |
| 64 | Гадолиний | Gd | 157,25(3) а.е.м. (г/моль) |
| 65 | Тербий | Tb | 158,92535(2) а.е.м. (г/моль) |
| 66 | Диспрозий | Dy | 162,500(1) а.е.м. (г/моль) |
| 67 | Гольмий | Ho | 164,93032(2) а.е.м. (г/моль) |
| 68 | Эрбий | Er | 167,259(3) а.е.м. (г/моль) |
| 69 | Тулий | Tm | 168,93421(2) а.е.м. (г/моль) |
| 70 | Иттербий | Yb | 173,045(10) а.е.м. (г/моль) |
| 71 | Лютеций | Lu | 174,9668(1) а.е.м. (г/моль) |
| 72 | Гафний | Hf | 178,49(2) а.е.м. (г/моль) |
| 73 | Тантал | Ta | 180,94788(2) а.е.м. (г/моль) |
| 74 | Вольфрам | W | 183,84(1) а.е.м. (г/моль) |
| 75 | Рений | Re | 186,207(1) а.е.м. (г/моль) |
| 76 | Осмий | Os | 190,23(3) а.е.м. (г/моль) |
| 77 | Иридий | Ir | 192,217(3) а.е.м. (г/моль) |
| 78 | Платина | Pt | 195,084(9) а.е.м. (г/моль) |
| 79 | Золото | Au | 196,966569(4) а.е.м. (г/моль) |
| 80 | Ртуть | Hg | 200,592(3) а.е.м. (г/моль) |
| 81 | Таллий | Tl | 204,382-204,385 а.е.м. (г/моль) |
| 82 | Свинец | Pb | 207,2(1) а.е.м. (г/моль) |
| 83 | Висмут | Bi | 208,98040(1) а.е.м. (г/моль) |
| 84 | Полоний | Po | 208,9824 а.е.м. (г/моль) |
| 85 | Астат | At | 209,9871 а.е.м. (г/моль) |
| 86 | Радон | Rn | 222,0176 а.е.м. (г/моль) |
| 87 | Франций | Fr | 223,0197 а.е.м. (г/моль) |
| 88 | Радий | Ra | 226,0254 а.е.м. (г/моль) |
| 89 | Актиний | Ac | 227,0278 а.е.м. (г/моль) |
| 90 | Торий | Th | 232,03806(2) а.е.м. (г/моль) |
| 91 | Протактиний | Pa | 231,03588(2) а.е.м. (г/моль) |
| 92 | Уран | U | 238,02891(3) а.е.м. (г/моль) |
| 93 | Нептуний | Np | 237,0482 а.е.м. (г/моль) |
| 94 | Плутоний | Pu | 244,0642 а.е.м. (г/моль) |
| 95 | Америций | Am | 243,061375 а.е.м. (г/моль) |
| 96 | Кюрий | Cm | 247,0703 а.е.м. (г/моль) |
| 97 | Берклий | Bk | 247,0703 а.е.м. (г/моль) |
| 98 | Калифорний | Cf | 251,0796 а.е.м. (г/моль) |
| 99 | Эйнштейний | Es | 252,083 а.е.м. (г/моль) |
| 100 | Фермий | Fm | 257,0951 а.е.м. (г/моль) |
| 101 | Менделевий | Md | 258,1 а.е.м. (г/моль) |
| 102 | Нобелий | No | 259,1009 а.е.м. (г/моль) |
| 103 | Лоуренсий | Lr | 266 а.е.м. (г/моль) |
| 104 | Резерфордий (Курчатовий) | Rf | 267 а.е.м. (г/моль) |
| 105 | Дубний (Нильсборий) | Db | 268 а.е.м. (г/моль) |
| 106 | Сиборгий | Sg | 269 а.е.м. (г/моль) |
| 107 | Борий | Bh | 270 а.е.м. (г/моль) |
| 108 | Хассий | Hs | 269 а. е. м. (г/моль) |
| 109 | Мейтнерий | Mt | 278 а. е. м. (г/моль) |
| 110 | Дармштадтий | Ds | 281 а. е. м. (г/моль) |






