Металлы
и сплавы имеют ряд ценных свойств и имеют широкое применение, но с течением
времени их свойства могут изменяться из-за отрицательного воздействия
окружающей среды.
Коррозия
(от. лат. corrosio – разъедание) – это
самопроизвольно протекающий процесс разрушения металлов в результате
взаимодействия их с окружающей средой.

- Коррозия
– это необратимый процесс, она наносит огромный ущерб экономике, потому что
в результате коррозии металлы становятся менее прочными и менее пластичными,
нарушается герметичность труб и аппаратов, что может привести к утечке нефти,
бензина, газа или к порче продуктов питания. - Все
металлы – восстановители, явление коррозии – это проявление
восстаногвительных свойств металлов.
Различают
два вида коррозии: химическую и электрохимическую. Химичекую
коррозию вызываю вещества-неэлекторлиты, она протекает в сухих газах при
повышенной температуре и не сопрровождается возникновением электрического тока.
Такой газовой коррозии подвергаются металлы при термической обработке. Например,
нагретые до высокой температуры детали из железа и его сплавов (вращающиеся
валы, шестерни и т.д.) могут реагировать с газообразными компон6ентами
атмосферы (O2, O3,
H2S, SO2, NO2).
При
этом возможны самые различные процессы химической коррозии железа:
- 2Fe + O2 = 2FeO
- 4Fe + 3O2 = 2Fe2O3
- 8Fe + 6NO2 = 4Fe2O3 + 3N2
- 2Fe + 2H2S
+ O2 = 2FeS + 2H2O - В
составе природного газа возможна примесь – сероводород, который вступает в
реакцию с металлической трубой, по которой транспортируют газ, сопла ракетных
двигателей взаимодействуют с окислителем топлива, детали нефтедобывающих
конструкций взаимодействуют с нефтью и продуктами её пераработки. - Наличие
в воздухе газообразных галогенов или галогенововдородов (например, на
химических производствах) ускоряет процесс химической коррозии железа и его
сплавов. - 2Fe + 3Cl2 = 2FeCl3
- Fe + 2HBr = FeBr2 + H2↑
- В
результате химической коррозии образуются, как правило, оксидные плёнки,
в тех местах, где было соприкосновение металла с агрессивной средой.

Например,
на поверхности щелочных и щелочноземельных металлов в процессе окисления
кислородо воздуха образуются толстые рыхлые оксидные плёнки, через которые
проникает кислород, поэтому они не защищают металл от коррозии. А на
поверхности таких металлов, как алюминий, цинк, хром, никель и других металлов,
образуются сплошные тонкие оксидные плёнки, которые защищают металл от
окружающей среды.
Поэтому
имеено такие металлы используют как легирующие добавки к сталям и для нанесения
защитных покрытий на изделия, работающие в условиях газовой коррозии.
Химичекая
коррозия протекает также в таких неэлектролитах, как бензин, керосин,
сероуглерод и других. Поэтому также наблюдается коррозия бензобаков,
нефтепроводов, нефтехимического оборудования.

Электрохимическая
коррозия протекает в растворах электролитов: кислоты, основания, соли,
морская и речная вода, влажная почва, и сопровождается возникновением
электрического тока.
Приведём
несколько примеров. Известно, что химически чистые металлы устойчивы к
воздействию внешней среды. Так, если враствор соляной кислоты поместить
химически чистый цинк, то сначала реакция протекает быстро, а потом
замедляется.
Это происходит из-за того, что ионы цинка переходят в раствор и
скапливаются на поверхности металла, препятствуя проникновению катионов
водорода к поверхности металла.
Кроме этого, в кристаллической решётке цинка
накапливаются электроны, которые затрудняют переод ионов цинка в раствор.
- Если
цинк будет находится в контакте с медью, то растворение цинка ускорится, так
как медь менее активный металл, чем цинк и с соляной кислотой не взаимодействует,
поэтому в кристаллической решётке меди электроны не накапливаются, при этом
свободные электроны цинка переходят на поверхность меди и восстанавливают ионы
водорода. - 2Н+
+ 2ē = Н2↑ - Поэтому
данная корозия и называется электрохимической, потому что наряду
с химическими процессами протекакют и электрические (перенос электронов от
одного металла к другому).
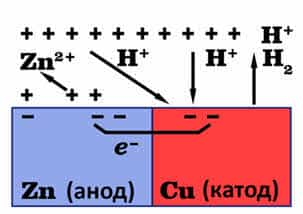
- В
результате концентрации избыточных электронов на поверхность меди цинк снова
окисляется и его ионы переходят в раствор. - Zn — 2ē = Zn2+
- Таким
образом, усиление коррозии цинка в контакте с медью объясняется возникновением гальваническго
элемента, в котором роль анода принадлежит цинку, а роль катода – меди. - Как
правило, роль анода выполняет более активный металл, на аноде происходит
окисление металла: - Me – nē = Men+
На
катоде, наоборот, частицы окислителя принимают электроны, которые поступают с
катода. Роль катода выполняют менее активные металлы или примесные включения.
- Например,
если частицы оксителя это ионы водорода, то на катоде идёт следующий процесс: - 2Н+
+ 2ē = Н2↑ - В
нейтральной среде в качестве окислителя выступает растворённый кислород: - О2
+ 4ē + 2Н2О = 4ОН- - Таким
образом, в кислой среде преобладает процесс восстановления водорода,
а если среда щелочная или нейтральная, то окислитель кислород.
Процесс
коррозии железа и его сплавов называется ржавлением. Чаще всего мы
встречаемся с атмосферной коррозией, вызванной присутствием кислорода и паров
воды. Продукт процесса коррозии железа – ржавчина – не имеет определённого состава.
- Под
действием окружающей среды разрушается не только железо и его сплавы, но и
другие металлы, как серебро и медь. - Всем
известно, что сос временем серебро темнеет, из-за образования чёрного сульфида
серебра (I), который образуется за счёт присутствия в
атмосфере даже следов сероводорода. - 2Ag + H2S = Ag2S↓ + H2↑
- 4Ag + 2H2S + O2 = 2Ag2S↓ + 2H2O
- Если
в атмосфере присутствуют следы озона, то серебрянные изделия также чернеют
из-за образования оксида серебра (I).

Все
типичные металлы в главных подгруппах I и II групп ПСХЭ Д.И. Менделеева
имеют малую коррозионную стойкость. Металлы побочной подгруппы I группы – стойкие. Это Cu, Ag, Au.
Металлы
побочной подгруппы II группы
более устойчивы, так как на их поверхности под действием кислорода внешней
среды образуются прочные оксидные плёнки, металлы III группы, главной подгруппы, как Al, защищён
оксидной плёнкой, которая обладает высокими защитными свойствами, однако может
разрушаться в кислотах и щелочах.
- Металлы
IV группы, главной подгруппы Sn и Pb
стойки к коррозии, покрыты прочной оксидной плёнкой. - Металлы
V, VI, VII,
VIII групп побочных подгрупп
способны к пассивации, обладают большой коррозионной стойкостью, но наибольшей
устойчивостью обладают металлы VIII группы,
побочной подгруппы Os, Ir, Pt. - То
есть, такие металлы, как золото и платина, являются малоактивными,
поэтому в меньшей мере подвержены коррозии, их так и называют – благородные
металлы, они не теряют свой блеск даже в агрессивной атмосфере.
Из
неблагородных металлов высокой коррозионной стойкостью обладает
титан и сплавы на его основе. Например, титановые изделия сохраняли свои
свойства в течении 10 лет пребывания в морской воде.
Материальные
потери, которые приносит коррозия очень велики. Ежегодно четверть выплавляемого
во всём мире железа уничтожается коррозией. Поэтому необходимы определённые
способы защиты от неё.
Существуют
различные способы защиты от коррозии. Один из распространённых способов – это легирование
металлов, то есть получение сплавов, устойчивых к коррозии, как
нержавеющая сталь.
Для
защиты от коррозии используются защитные покрытия.
Это могут быть
неметаллические покрытия (лаки, краски, эмали, плёнки из масел и нефтепродуктов),
химические (фосфатные, оксидные, нитридные), а также металлические
(оцинковывание, никелирование, хромирование, меднение, золочение, лужение –
покрытие оловом), проводят обработку среды (нагревание воды для уменьшения
растворимости газов, пропускание воды через железную стружку для удаления
кислорода или используя сульфит натрия), осуществляют химическое покрытие
(оксидирование, азотирование, науглероживание поверхности, добавление
ингибиторов коррозии: соли органических кислот, фосфаты, силикаты, карбонаты и
др.)
Например,
металл цинкуют в водной среде, в случае работы с серной кислотой металл
покрывают свинцом, белая жесть применяется для консервирования.
Различают
такие металлические покрытия, как катодные и анодные.
Если
защищаемый металл покрыт менее активным металлом, то это катодное
покрытие. Для железа катодным покрытием служит оловянное. При нарушении
целостности катодного покрытия железо разрушается, а олово остаётся защищённым.
- На
аноде происходит окисление атомов железа, а на катоде в кислой
среде происходит восстановление ионов водорода. - Fe — 2ē = Fe2+
- 2H+ + 2ē = H2↑
В
нейтральной среде (влажный воздух, вода) на аноде окисляются атомы железа,
а на катоде восстанавливается кислород. В растворе при этом образуется
гидроксид железа (II), который окисляется затем
кислородом до гидроксида железа (III).
- Fe — 2ē = Fe2+
- O2 + 4ē +2H2O = 4OH-
- Fe2+ + 2OH- = Fe(OH)2↓
- 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
При
высыхании продуктов коррозии образуется ржавчина – Fe2O3 · nH2O. Часто для разрушения окалины-ржавчины на оружейном металле
применяют «травильные супы» — раствор серной кислоты с добавлением пивных
дрожжей, крахмала, муки.
Анодное
покрытие – это покрытие защищаемого металла более активным металлом.
Для железа – это цинковое прокрытие. При нарушении этого анодного
покрытия анод – цинк разрушается, а катод – железо – остаётся защищённым. В
качестве активного металла используют магний, алюминий, цинк.
Протекторная
защита заключается в том, что к защищаемой металлической конструкции
присоединяют протекторы из более активного металла.
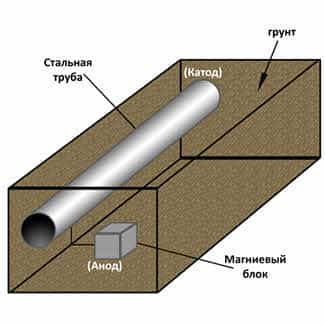
В
этом гальваническом элементе протектор выполняет рол анода, а защищаемый металл
– роль катода. Протектор разрушается и защищает тем самым металл. В качестве
протектора выступают цинк, магниевые сплавы. Протекторым способом защищают
трубопроводы и ёмкости, которые находятся по землёй, коруса морских судов и
карабельные винты.
Ещё
один способ защиты от коррозиии – это создание шлифованных поверхностей, чтобы
не задерживалась влага и лучше образовывалась оксидная плёнка, так как
поверхностный слой становится однородным. А такж используют такой метод, как
пассивация металлов, то есть изготовление сплавов с добавлением металлов: Ni, Al, Mn, Mo, W, V,
имеющих защитные оксидные плёнки.

Таким
образом, процесс взаимодействия металлов и сплавов с компонентами окружающей
среды, в результате которого происходит разрушение металлов, назвается
коррозией.
Различают
химическую и электрохимическую коррозию. В случае
электрохимической коррозии всегда образуется электрический ток, наблюдается
разрушение более активного металла, который выступает в роли анода, а менее
активный металл – в роли катода.
Скорость
коррозии зависит от от восстановительной способности контактирующих металлов.
Чем сильнее он6и отличаются по восстановительной способности, тем больше
скорость реакции. Существуют различные методы защиты от коррозии: использование
различных покрытий, а также использование металлов более активных, чем
защищаемый металл.
Коррозия металла


Средняя оценка: 4.6
Всего получено оценок: 409.
Средняя оценка: 4.6
Всего получено оценок: 409.
Процесс самопроизвольного разрушения металлов и их сплавов называется коррозией металлов. Коррозия возникает при контакте с веществами окружающей среды. Латинское слово corrosio означает «разъедать».
Коррозия – результат взаимодействия металла с веществами-окислителями, к которым относятся кислород, водород, кислоты, щёлочи. Основной характеристикой коррозии является окислительно-восстановительная реакция. Металл при коррозии окисляется, восстанавливая окислительный компонент среды.
Рис. 1. Коррозия.
Условиями для образования коррозии являются:
- наличие металла – простого или сложного вещества (сплава);
- наличие коррозионной среды – активных веществ, находящихся вокруг металла и воздействующих на его поверхность;
- продолжительный период времени.
Ржавчина – оксид или гидроксид железа (III) – образуется на железосодержащих изделиях и имеет рыжий цвет. Предметы из меди при коррозии приобретают зеленоватый оттенок. Это многослойная патина, верхний слой которой состоит из карбоната меди (II).
 Рис. 2. Патина.
Рис. 2. Патина.
Коррозия классифицируется по нескольким признакам. Классификация приведена в таблице.
| Признак | Вид | Описание |
| Участки поражения | Равномерная | Захватывает всю металлическую поверхность |
| Язвенная (местная) | Охватывает часть поверхности | |
| Точечная (питтинг) | Глубоко поражает отдельные участки | |
| Механизм протекания | Химическая | Протекает под действием химических веществ в отсутствии электролитов. Может происходить на воздухе (газовая коррозия) и в водной среде (жидкостная коррозия). Под действием коррозионной среды металл окисляется, на поверхности образуются сульфидные, оксидные и другие плёнки, а коррозионные вещества восстанавливаются. Выделяют кислородную химическую коррозию и водородную деполяризацию |
| Электрохимическая | Протекает в присутствии электролита – проводящего ток вещества в растворах или в расплавах. Может происходить в грунте, море, атмосфере. Состоит из анодного и катодного процессов, взаимосвязанных между собой и протекающих одновременно. При анодном процессе металл окисляется, при катодном происходит восстановление окислителя, находящегося в растворе (расплаве) | |
| Тип агрессивной среды | Атмосферная | Происходит во влажной атмосфере |
| Газовая | Протекает в отсутствии влаги | |
| Грунтовая | Происходит в кислых и щелочных почвах | |
| Жидкостная | Протекает в жидкой среде | |
| Радиационная | Воздействие радиоактивных веществ | |
| Контактная | Соприкосновение двух металлов во влажной среде | |
| Биокоррозия | Влияние живых организмов. Продукты жизнедеятельности бактерий окисляют и разрушают металл |
Если в металле находятся примеси (соли, неметаллы, модификации углерода), то наблюдается ускоренная коррозия. Проверить это можно дома, опустив в соляной раствор (NaCl + H2O) металлическую деталь. Уже через сутки появится ржавчина.
При постоянном взаимодействии с химическими элементами окружающей среды металл со временем истончается, становится хрупким, шершавым. Такой металл нельзя использовать в производстве. Поэтому были разработаны способы защиты металла от коррозии.
Сохранить металлические свойства и продлить срок службы металлическим изделиям можно с помощью:
- металлического покрытия – нанесения тонким слоем других металлов;
- неметаллического покрытия – изоляции металла от окружающей среды органическими или неорганическими веществами – лаками, эмалью, пластмассой, резиной, красками;
- электрохимической защиты – наложения постоянного электрического поля;
- ингибиторной защитой – нанесения ингибиторов для защиты металла в кислой среде.
Металлическое покрытие бывает двух видов:
- катодное – покрытие пассивными металлами (Ni, Sn, Ag, Au);
- анодное – покрытие активными металлами (Zn, Cr).
 Рис. 3. Оцинкованное железо.
Рис. 3. Оцинкованное железо.
Морские суда защищают пластинами, сделанными из более активных металлов (алюминия, магния, цинка), чем корпус корабля.
Металл также защищают «изнутри», добавляя в состав коррозиестойкие химические элементы. Например, нержавеющая сталь содержит хром, углерод, кремний, серу, фосфор, марганец.
Из урока химии 9 класса узнали о коррозии, её видах и способах защиты. Коррозия – саморазрушение металла под воздействием факторов окружающей среды, к которым относится воздействие кислорода, водорода, кислот, щелочей.
Под действием внешних элементов поверхность металла окисляется, становится тонкой и хрупкой. Тема коррозии важна для производства сплавов и металлических изделий.
Чтобы продлить срок службы, в металл добавляют устойчивые к коррозии элементы или покрывают поверхность другими металлами, органическими или неорганическими веществами, ингибиторами.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.6
Всего получено оценок: 409.
А какая ваша оценка?
Гость завершил
Тест «Маленький принц»с результатом 13/14
Гость завершил
Тест 2 том «Войны и мира»с результатом 9/12
Гость завершил
Тест «Алые паруса»с результатом 8/12
Гость завершил
Тест «Тарас Бульба»с результатом 12/16
Гость завершил
Тест «Левша»с результатом 11/12
Гость завершил
Тест «История болезни»с результатом 7/10
Гость завершил
Тест «Вишнёвый сад»с результатом 16/16
Гость завершил
Тест «Биография Шевцовой»с результатом 9/10
Гость завершил
Тест «Шинель»с результатом 8/12
Гость завершил
Тест «Жалобная книга»с результатом 8/10
Не подошло? Напиши в х, чего не хватает!
Конспект на тему Коррозия металлов
1.
Коррозия
металлов — самопроизвольное разрушение металлов вследствие химического или
электрохимического взаимодействия их с внешней средой. Коррозионный процесс —
гетерогенный (неоднородный), протекает на границе раздела металл — агрессивная
среда, имеет сложный механизм. При этом атомы металла
окисляются, т.е.
J теряют валентные электроны, атомы переходят через границу
раздела во внешнюю среду, взаимодействуют с ее компонентами и образуют
продукты коррозии. В большинстве случаев коррозия металлов пройм ходит
неравномерно по поверхности, имеются участки, на которых возникают
локальные поражения.
Некоторые продукты коррозии, образуя
поверхностные пленки, сообщают металлу коррозионную стойкость. Иногда могут
появляться рыхлые продукты коррозии, имеющие слабое сцепление с металлом.
Разрушение таких пленок вызывает интенсивную коррозию обнажающегося металла.
Коррозия металла снижает механическую прочность и меняет другие свойства его.
Коррозионные процессы классифицируют по видам коррозионных разрушений,
характеру взаимодействия металла со средой, условиям протекания.
Коррозия бывает сплошная, общая и
местная. Сплошная коррозия протекает по всей поверхности металла.
При местной коррозии поражения локализуются на отдельных участках поверхности.
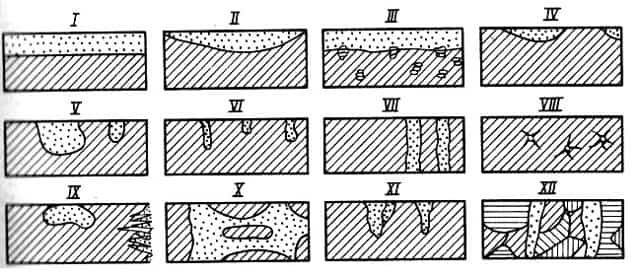
- Рис. 1Характер коррозионных
разрушений: - I – равномерное; II —
неравномерное; III — избирательное; IV — пятна; V — язвы;VI — точками или питтингами; VII — сквозное; VIII — нитевидное; IX — поверхностное; X — межкристаллитное;
XI — ножевое; XII — растрескивание
Общая коррозия подразделяется на
равномерную, неравномерную и избирательную (рис. 1).
Равномерная коррозия протекает с
одинаковой скоростью по всей поверхности металла; неравномерная — на различных
участках поверхности металла с неодинаковой скоростью. При избирательной коррозии
разрушаются отдельные компоненты сплава.
При коррозии пятнами диаметр
коррозионных поражений большой глубины. Для язвенной коррозии характерно
глубокое поражение участка поверхности ограниченной площади. Как правило, язва
находятся над слоем продуктов коррозии.
При точечной (питтинговой) коррозии
наблюдаются отдельные точечные поражения поверхности металла, которые имеют
малые поперечные размеры при значительной глубине. Сквозная — это местная
коррозия, вызывающая разрушение металлического изделия насквозь, в виде свищей.
Нитевидная коррозия проявляется под неметаллическими покрытиями и виде нитей.
Подповерхностная коррозия начинается с поверхности, пи преимущественно
распространяется под поверхностью металла, вызывая его вспучивание и
расслоение.
При межкристаллитной коррозии
разрушение сосредоточено по границам зерен металла или сплава. Этот вид
коррозии опасен тем, что происходит потеря прочности и пластичности металла.
Ножевая коррозия имеет вид надреза ножом вдоль сварного соединения в сильно
агрессивных средах.
Коррозионное растрескивание протекает при одновременном
воздействии коррозионной среды и растягивающих остаточных или приложенных
механических напряжениях.
Металлические изделия в
определенных условиях подвергаются коррозионно-усталостному разрушению,
протекающему при одновременном воздействии
на металл коррозионной среды и
переменных I механических напряжений.
По характеру взаимодействия
металла со средой различают химическую и электрохимическую коррозии.
Химическая коррозия — разрушение металла при химическом взаимодействии с
агрессивной средой, которой служат неэлектролиты — жидкости и сухие газы.
Электрохимическая коррозия — разрушение металла под воздействием электролита
при протекании двух самостоятельных, но взаимосвязанных процессов — анодного и
катодного.
Анодный процесс — окислительный, проходит с растворением металла;
катодный процесс — восстановительный, обусловлен
электрохимическим восстановлением компонентов среды.
Современная теория коррозии металлов не исключает совместного протекания
химической и электрохимической коррозии, так как в электролитах при
определенных условиях возможен перенос массы металла по химическому механизму.
- По условиям протекания
коррозионного процесса наиболее часто встречаются следующие виды коррозии: - 1) газовая
коррозия, протекает при повышенных температурах и полном отсутствии
влаги на поверхности; продукт газовой коррозии — окалина обладает при
определенных условиях защитными свойствами; - 2) атмосферная
коррозия, протекает в воздухе; различают три вида атмосферной коррозии: во
влажной атмосфере — при относительной влажности воздуха выше 40 %; в мокрой
атмосфере — при относительной влажности воздуха, равной 100 %; в сухой
атмосфере — при относительной влажности воздуха менее 40 %; атмосферная коррозия
— один из наиболее распространенных видов вследствие того, что основная часть
металлического оборудования эксплуатируется в атмосферных условиях; - 3) жидкостная
коррозия — коррозия металлов в жидкой среде; различают коррозию в электролитах
(кислоты, щелочи, солевые растворы, морская вода) и в неэлектролитах (нефть,
нефтепродукты, органические соединения); - 4) подземная коррозия —
коррозия металлов, вызываемая в основном действием растворов солей,
содержащихся в почвах и грунтах; коррозионная агрессивность почвы и грунтов
обусловлена структурой и влажностью почвы, содержанием кислорода и других химических
соединений, рН, электропроводностью, наличием микроорганизмов; - 5) биокоррозия — коррозия
металлов в результате воздействия микроорганизмов или продуктов их
жизнедеятельности, в биокоррозии участвуют аэробные и анаэробные бактерии,
приводящие к локализации коррозионных поражений; - 6)
электрокоррозия, возникает под действием внешнего
источника тока или блуждающего тока; - 7) щелевая коррозия — коррозия
металла в узких щелях, зазорах, м резьбовых и фланцевых
соединениях металлического оборудования,аксплуатирующегося в электролитах, в
местах неплотного контакта металла с изоляционным материалом;  контактная
контактная
коррозия, возникает при контакте разнородных металлов в электролите;- 9) коррозия под напряжением,
протекает при совместном воздействии на металл агрессивной среды и механических
напряжений — постоянных растягивающих (коррозионное растрескивание) и переменных
или циклических (коррозионная усталость); - 10) коррозионная кавитация —
разрушение металла в результате одновременно коррозионного и ударного
воздействий. При этом защитные пленки на поверхности металла разрушаются,
когда лопаются газовые пузырьки на поверхности раздела жидкости с твердым
телом; - 11) коррозионная эрозия —
разрушение металла вследствие одновременного воздействия агрессивной среды и
механического износа; - 12) фреттинг-коррозия — локальное
коррозионное разрушение металлов при воздействии агрессивной среды в условиях
колебательного перемещения двух
трущихся поверхностей относительно друг друга; - 13) структурная коррозия,
обусловлена структурной неоднородностью сплава; при этом происходит ускоренный
процесс коррозионного разрушения вследствие повышенной активности какого-либо
компонента сплава; - 14) термоконтактная коррозия,
возникает за счет температурного градиента, обусловленного неравномерным
нагреванием поверхности металла.
Урок 9. коррозия металлов и её предупреждение — Химия — 11 класс — Российская электронная школа
- Химия, 11 класс
- Урок № 9. Коррозия металлов и её предупреждение
- Перечень вопросов, рассматриваемых в теме: урок посвящён изучению видов коррозии, особенностям химической и электрохимической коррозии, методам защиты металлических изделий от коррозионного разрушения.
- Глоссарий
- Анодное покрытие – способ защиты металлического изделия от коррозии, когда защищаемый металл покрывается металлическим покрытием из более активного металла.
- Газовая коррозия – разрушение металла в среде агрессивных газов (кислорода, оксида серы, хлороводорода) обычно при высоких температурах.
- Гальванокоррозия – вид электрохимической коррозии, при которой два контактирующих металла в среде электролита образуют коррозионный гальванический элемент с возникновением электрического тока между металлами.
- Жидкостная коррозия – разрушение металла в жидкостях, не проводящих электрический ток (органические растворители, нефтепродукты).
- Ингибиторы – вещества, вводимые в коррозионную среду, в результате чего снижается её окисляющая способность.
- Катодная защита – способ защиты металла от коррозии, когда защищаемое металлическое изделие подсоединяется к отрицательному полюсу внешнего источника электрического тока.
- Катодное покрытие – способ защиты металла от коррозии, когда металлическое изделие покрывается тонким слоем из менее активного металла.
- Коррозия – разрушение металла в результате окислительно-восстановительных реакций между металлом и окружающей средой
- Осушение – удаление из окружающей среды влаги для предотвращения возникновения коррозии.
- Протекторная защита – способ защиты металла от коррозии, когда к защищаемому металлическому изделию присоединяют кусок другого, более активного металла.
- Химическая коррозия – разрушение металла в среде, не проводящей электрический ток.
- Электрокоррозия – вид электрохимической коррозии, возникающей в среде электролита под действием внешнего электрического поля.
- Электрохимическая коррозия – разрушение металла в среде электролита при контакте двух металлов с образованием коррозионного элемента и возникновением электрического тока.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Коррозия и её виды
Коррозия металлов – процесс разрушения металлического изделия в результате окислительно-восстановительной реакции металла с окружающей средой. В зависимости от механизма различают два вида коррозии: химическую и электрохимическую. Химическая коррозия происходит в среде, не проводящей электрический ток.
К этому виду коррозии относится газовая коррозия, в результате которой металл разрушается под действием агрессивных газов: кислорода, оксида серы, хлороводорода. Газовая коррозия обычно происходит при высоких температурах.
Другой вид химической коррозии – жидкостная коррозия, которая возникает в агрессивных жидкостях, не проводящих электрический ток, например, в органических растворителях или нефтепродуктах.
Электрохимическая коррозия происходит в среде электролитов, которые хорошо проводят электрический ток. Различают два вида электрохимической коррозии: гальванокоррозия и электрокоррозия.
Гальванокоррозия возникает в месте контакта двух металлов, наличия в металле примесей, разной температуры на соседних участках металлов, разной концентрации электролитов в среде, контактирующей с металлом и в случае разной концентрации кислорода на соседних участках металла.
Например, в чугуне примеси углерода и карбида железа играют роль катода, на котором происходит восстановление молекулярного кислорода в присутствии паров воды: 2Н2О + О2 + 4е → 4ОН-, а железо становится анодом и окисляется.
Fe0 – 2e → Fe2+. В результате среда становится щелочной, образуется сначала «белая» ржавчина Fe(ОН)2: Fe2+ + 2OH- → Fe(ОН)2↓, которая окисляется кислородом воздуха во влажной среде до трёхвалентного гидроксида железа.
4Fe(ОН)2↓ + 2Н2О + О2 → 4Fe(ОН)3↓, Fe(OH)3 + nH2O → Fe2O3·xH2O (ржавчина).
Если в атмосфере присутствует большое количество кислых газов (СО2, SO2, NO2), то при растворении их в воде образуются кислоты. В кислой среде коррозия идет ещё интенсивнее. В присутствии кислорода на катоде образуется вода, а в бескислородной среде выделяется водород.
- На аноде: Fe0 – 2е → Fe2+;
- На катоде: О2 + 4Н+ + 4е → 2Н2О
- или в бескислородной среде: 2Н+ + 2е → Н20↑.
Ионы железа образуют соли с кислотными остатками образовавшихся при растворении газов кислот. В дальнейшем под действием кислорода воздуха, соли двухвалентного железа окисляются до солей трёхвалентного железа.
Электрокоррозия возникает под действием на металл электрического тока от внешнего источника постоянного тока.
Часто она происходит под действием блуждающих токов от рельсов электротранспорта, от плохо изолированных опор линий электропередач.
Участок, на который попадает ток от внешнего источника, заряжается отрицательно и становится катодом. На нём происходит восстановление элементов среды. А соседний участок становится анодом, на нём металл окисляется.
Факторы, увеличивающие скорость коррозии
Возникновение коррозионного гальванического элемента увеличивает скорость коррозии. При контакте двух металлов более активный металл отдает электроны менее активному. Возникает электрический ток. Активный металл растворяется и в результате реакции со средой, и за счет передачи электронов менее активному металлу.
Принятые электроны менее активный металл отдает в окружающую среду, таким образом, окисление активного металла и восстановление компонентов окружающей среды происходит быстрее. Скорость коррозии зависит от количества кислорода, который контактирует с металлом.
Железный гвоздь, погруженный в воду на половину своей длины, разрушается быстрее всего, так как доступу кислорода ничего не препятствует. Гвоздь, полностью погруженный в воду, разрушается медленнее, так как количество кислорода, участвующего в реакции, ограничивается скоростью растворения кислорода в воде.
В пробирке, где сверху воды налили масло, коррозия идет медленнее всего, так как масло препятствует поступлению кислорода в воду.
Методы защиты металлов от коррозии
Одним из распространённых методов защиты металлов от коррозии является нанесение защитных покрытий. Покрытия бывают металлическими и неметаллическими. Если металлическое изделие покрыто слоем более активного металла, покрытие называют анодным. Если покрытие изготовлено из менее активного металла, оно называется катодным.
Неметаллические покрытия – это различные эмали, лаки, краски, резиновые, битумные и полимерные покрытия. По отношению к железу анодными покрытиями будут цинковые, хромовые, алюминиевые покрытия. Эти покрытия защищают металл даже в случае появления царапин или трещин.
Так как покрытие изготовлено из более активного металла, оно является анодом по отношению к защищаемому металлу и будет разрушаться. Защищаемое металлическое изделие разрушаться не будет. Катодные покрытия обычно делают из малоактивных металлов. Это никель, олово, свинец, медь, серебро, золото.
Из-за низкой активности такие металлы слабо подвергаются воздействию коррозии, но в случае нарушения покрытия, возникнет коррозионный элемент, в котором анодом станет защищаемое металлическое изделие. Оно начнет разрушаться.
Защитные оксидные покрытия на поверхности металла можно создать путем химической обработки концентрированной азотной кислотой (пассивация алюминия, хрома), концентрированным раствором щелочи и горячего масла (воронение), фосфорной кислотой и её кислыми солями (фосфатирование).
Эффективным, но дорогим методом защиты металлов от коррозии является введение в сплав антикоррозионных легирующих добавок: хрома, никеля, молибдена, титана. Для повышения стойкости к коррозии в кислой среде в сплав добавляют кремний.
К методам электрохимической защиты относятся протекторная и катодная защита. Протекторная защита предусматривает закрепление на защищаемом изделии пластин из активного металла: цинка, алюминия, магния.
Попадая в агрессивную среду, протектор становится анодом, начинает разрушаться, а металлическое изделие, являясь катодом, не разрушается до полного разрушения протектора. Катодная защита производится путём подсоединения защищаемого металлического изделия к отрицательному полюсу внешнего источника постоянного электрического тока.
В результате защищаемый металл приобретает отрицательный заряд и становится катодом. В качестве анода используют вспомогательный кусок металла (железный лом, старый рельс), который заземляют.
Важным направлением предотвращения коррозии металлов является снижение агрессивности окружающей среды. Для этого проводят осушение почвы, воздуха. В жидкие среды добавляют ингибиторы – вещества, реагирующие с окислительными компонентами среды и снижающие скорость коррозии. Для борьбы с блуждающими токами проводят надёжную изоляцию токопроводящих конструкций, организацию бесстыкового пути.
- Предотвращение потерь металла от коррозии позволит не только сберечь тонны металла, но и предотвратить аварии на производстве и транспорте, сберечь человеческие жизни.
- ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
- 1. Расчёт массы металла, предохраняемого от разрушения за счёт нанесения защитных покрытий
Условие задачи: В результате атмосферной коррозии толщина стального изделия уменьшается на 0,12 мм/год. Потерю какой массы стального изделия плотностью 7750 кг/м3 и площадью 10 м2 можно предотвратить путем нанесения лакокрасочного покрытия, которое сохраняет свои защитные свойства в течение 4 лет? Ответ запишите в виде целого числа в килограммах.
- Шаг первый: необходимо перевести скорость коррозии из мм/год в м/год.
- Для этого скорость коррозии умножим на 10-3:
- 0,12·10-3 = 1,2·10-4 (м/год).
- Шаг второй: Найдём объём слоя металла, который может быть разрушен коррозией за 1 год. Для этого толщину слоя разрушенного в течение года металла умножим на площадь стального изделия:
- 1,2·10-4·10 = 1,2·10-3 (м3/год).
- Шаг третий: Найдём массу вычисленного объёма металла.
- Для этого объём металла умножим на его плотность:
- 1,2·10-3·7750 = 9,3 (кг/год).
- Шаг четвёртый: Найдём массу металла, которая могла бы разрушиться за 4 года. Для этого массу сохранённого за год металла умножим за 4 года:
9,3·4 = 37,2 (кг). Округляем до целого числа, получаем 37 (кг).
Ответ: 37
2. Расчёт массы металла, разрушенного в результате коррозии
Условие задачи: Через железную решётку, предохраняющую от попадания в канализацию крупного мусора, проходит 20 м3 воды в сутки. Содержание кислорода в воде 1 % от объёма воды. Какая масса железа окислится за 6 месяцев использования решётки, если на окисление металла расходуется 60% содержащегося в воде кислорода? Ответ записать в килограммах в виде целого числа.
- Шаг первый: найдём объём кислорода, который содержится в 20 м3 воды.
- Для этого разделим 20 м3 на 100:
- 20 : 100 = 0,2 (м3/сутки) = 200 (л/сутки)
- Шаг второй: Найдём объём кислорода, который проходит в воде через решётку в течение 6 месяцев.
- Для этого объём кислорода, проходящий через решетку в сутки, умножим на 30 дней и на 6 месяцев:
- 200·30·6 = 36000 (л).
- Шаг третий: Найдём объём кислорода, который расходуется на окисление железа. Для этого умножим найденный объём кислорода на 60 и разделим на 100:
- (36000·60) : 100 = 21600 (л).
- Шаг четвёртый: Запишем уравнение реакции взаимодействия железа с кислородом в нейтральной среде:
- 2Fe + O2 + 2H2O → 2Fe(OH)2.
- Шаг пятый: Найдём массу железа, окисленного 21600 л кислорода.
- Для этого составим пропорцию с учётом того, что масса 1 моль железа равна 56 г/моль, а 1 моль газа в нормальных условиях занимает 22,4 л.
- 2·56 г железа реагирует с 22,4 л кислорода;
- х г железа реагирует с 21600 л кислорода.
- х = (2·56·21600) : 22,4 = 108000 (г) = 108 кг.
- Ответ: 108.






