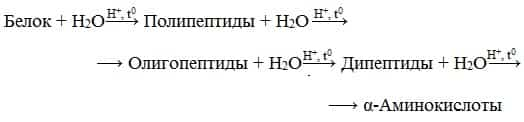- 1. Амфотерные свойства белков
- 2. Денатурация белка (необратимое осаждение, свертывание)
- 3. Гидролиз белков
- 4. Цветные (качественные) реакции на белки
- Цветные и именные качественные реакции на белки
- 3.8.2. Белки
- Химические свойства белков
- Гидролиз
- Денатурация
- Качественные реакции на белки
- Биуретовая реакция
- Ксантопротеиновая реакция
- Биологические функции белков
- Опыты по химии. Аминокислоты. Белки
- Реакция №3 «Осаждение солями тяжелых металлов»
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
- Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
- Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
- При действии же кислот он выступает в форме катиона:
- Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
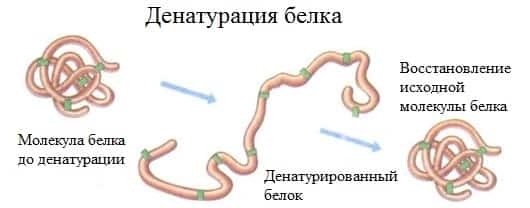
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
- Денатурация бывает обратимой и необратимой.
- Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
- Необратимаяденатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
- Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
- Видеоопыт «Свертывание белков при нагревании»
- Видеоопыт «Осаждение белков солями тяжелых металлов»
- Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
- Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
- Анализируя продукты гидролиза, можно установить количественный состав белков.
- Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
- В лабораторных условиях и в промышленности проводится кислотный гидролиз.
- В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
- Для белков известно несколько качественных реакций.
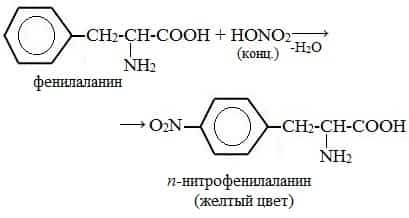
- а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
- Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
- Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
- Видеоопыт«Ксантопротеиновая реакция на белки»
- б) Биуретовая реакция (на пептидные связи)
- Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
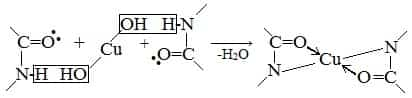
- Причина появления окраски – образование комплексных соединений с координационным узлом:
- Видеоопыт «Биуретовая реакция белков»
- Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
- в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
- Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
- Видеоопыт «Качественное определение азота в органических соединениях»
- Белки
Цветные и именные качественные реакции на белки
- РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Описание опыта. 2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
- РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911))
- a-Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
- Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a-аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Описание опыта. В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a-нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a-нафтола.
Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают.
Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
При взаимодействии a-аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a-аминокислот методом формального титрования (метод Сёренсена).
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
- ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ
a-Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a-аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения a-аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a-аминокислот дают соли, окрашенные в оранжевый цвет.
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
- ОСАЖДЕНИЕ БЕЛКА СОЛЯМИ ТЯЖеЛЫХ МЕТАЛЛОВ
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца. Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
- Открытие аминного азота в белках
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины.
Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают.
Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
Описание опыта. В пробирку наливают около ~0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца.
В другую пробирку наливают ~2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин.
Появление темного окрашивания указывает на образование сульфида свинца.
- РЕАКЦИЯ НА ПРИСУТСТВИЕ СЕРОСОДЕРЖАЩИХ a-АМИНОКИСЛОТ В БЕЛКЕ
Качественной реакцией на серосодержащие a-аминокислоты является реакция Фоля. Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь. Наблюдается появление серо-черного осадка.
- Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
- По аналогичной схеме протекает и реакция триптофана с формальдегидом.
- * * *
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с. Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с. Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с. Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев, секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
3.8.2. Белки
- Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
- В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
- Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | локальное упорядочивание фрагмента полипептидной цепи в спирали | |
| третичная | пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 кДж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |
Опыты по химии. Аминокислоты. Белки
Чтобы поделиться, нажимайте
Биуретовая реакция белков
Наличие белков в растворе можно обнаружить цветными реакциями. Наиболее универсальной качественной реакцией на белки является биуретовая реакция.
Эта реакция характерна для групп атомов, образующих пептидную связь. К раствору белка приливаем немного раствора щелочи и несколько капель слабого раствора сульфата меди.
Жидкость окрашивается в фиолетовый цвет, что указывает на присутствие белка в растворе.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Ксантопротеиновая реакция на белки
Ксантопротеиновая реакция проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с концентрированными кислотами, аммиаком и нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Образование медной соли аминоуксусной кислоты
Хотя раствор аминоуксусной кислоты имеет нейтральную реакцию, он способен взаимодействовать с оксидами металлов. К раствору аминоуксусной кислоты прибавим немного оксида меди (II). Нагреем полученную смесь. Раствор приобретает голубую окраску.
Альфа-аминокислоты дают с медью окрашенные, очень устойчивые комплексные соли. Эти комплексные соединения очень прочны и не разрушаются под действием раствора щелочи. Прильем к полученному раствору гидроксид натрия.
Осадка гидроксида меди (II) не образуется.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Осаждение белков солями тяжелых металлов
В две пробирки приливаем раствор белка. В первую пробирку добавляют раствор сульфата меди (II) , во вторую – раствор нитрата серебра. В обеих пробирках выпадают осадки. Соли тяжелых металлов осаждают белки из растворов, образуя с ними нерастворимые в воде солеобразные соединения.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Остерегаться попадания растворов солей на кожу.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Осаждение белков спиртом
К раствору белка прибавляем немного этилового спирта. Раствор мутнеет. При действии спирта происходит денатурация белка – разрушение его структуры.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Опыт безопасен.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Свертывание белков при нагревании
В пробирку нальем немного раствора белка. Нагреем раствор до кипения. Раствор мутнеет, белок выпадает в виде хлопьев. Свертывание белков при кипении — процесс необратимого осаждения, белковые молекулы меняют свою структуру.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Свойства аминоуксусной кислоты
Аминокислоты – твердые вещества, хорошо растворимые в воде. К раствору аминоуксусной кислоты прильем немного лакмуса. Окраска раствора не изменилась. Раствор аминоуксусной кислоты имеет нейтральную реакцию.
Аминокислоты обладают как кислотными, так и основными свойствами: кислотная — карбоксильная группа, основная — аминогруппа. Они взаимно нейтрализуют друг друга, образуя биполярные ионы.
Поэтому аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Опыт безопасен.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Реакция №3 «Осаждение солями тяжелых металлов»
- ХИМИЯ БЕЛКОВ
- Для обнаружения и изучения химического состава белков существует две группы реакций: цветные и реакции осаждения.
- Цветные реакции
Цветные реакции применяются для установления белковой природы вещества, идентификации белков и определения их аминокислотного состава в различных биологических жидкостях.
В клинической лабораторной практике эти методы используются для определения количества белка в плазме крови, аминокислот в моче и крови, для выявления наследственных или приобретенных нарушений обмена веществ у новорожденных.
Реакция №1 «Биуретовая реакция на пептидную связь»
Принцип: в основе биуретовой реакции лежит способность пептидных связей (-СО-NH-) образовывать с сульфатом меди в щелочной среде окрашенные комплексные соединения, интенсивность окраски которых зависит от длины полипептидной цепи. Раствор белка дает сине-фиолетовое окрашивание.
Реактивы: 1) яичный белок, 1% раствор (белок куриного яйца фильтруют через марлю и разводят дистиллированной водой 1:10); 2) гидроокись натрия, 10% раствор; 3) сульфат меди, 1% раствор.
Ход определения: в пробирку вносят 5 капель раствора яичного белка, 3 капли гидроокиси натрия и 1 каплю сульфата меди, перемешивают. Содержимое пробирки приобретает сине-фиолетовое окрашивание.
Реакция №2 «Нингидриновая реакция»
Принцип: сущность реакции состоит в образовании соединения, окрашенного в сине-фиолетовый цвет, состоящего из нингидрина и продуктов гидролиза аминокислот. Эта реакция характерна для аминогрупп в α-положении, которые присутствуют в природных аминокислотах и белках.
Реактивы: 1) яичный белок, 1% раствор; 2) нингидрин, 0,5% водный раствор.
Ход определения: в пробирку вносят 5 капель раствора яичного белка, добавляют 5 капель раствора нингидрина и нагревают до кипения. Развивается розово-фиолетовое окрашивание, переходящее с течением времени в сине-фиолетовое.
Реакция №3 «Ксантопротеиновая реакция»
Принцип: при добавлении к раствору белка концентрированной азотной кислоты и нагревании появляется желтое окрашивание, которое в присутствии щелочи переходит в оранжевое.
Сущность реакции заключается в нитровании бензольного кольца циклических аминокислот азотной кислотой с образованием нитросоединений, выпадающих в осадок.
Реакция выявляет наличие в белке циклических аминокислот (фенилаланин, тирозин, триптофан).
Реактивы: 1) яичный белок, 1% раствор; 2) концентрированная азотная кислота; 3) гидроокись натрия, 10% раствор.
Ход определения: к 5 каплям раствора яичного белка добавляют 3 капли азотной кислоты и (осторожно!) нагревают. Появляется осадок желтого цвета. После охлаждения добавляют (желательно на осадок) 10 капель раствора гидроокиси натрия, появляется оранжевое окрашивание.
- Реакция №4 «Реакция Адамкевича»
- Принцип: аминокислота триптофан в кислой среде, взаимодействуя с альдегидами кислот, образует продукты конденсации красно-фиолетового цвета.
- Реактивы: 1) неразбавленный яичный белок; 2) концентрированная (ледяная) уксусная кислота; 3) концентрированная серная кислота.
Ход определения: к одной капле белка прибавляют 10 капель уксусной кислоты. Наклонив пробирку, осторожно по стенке добавляют каплями около 0,5 мл серной кислоты так, чтобы жидкости не смешивались. При стоянии пробирки на границе жидкостей появляется красно-фиолетовое кольцо.
Реакция №5 «Реакция Фоля»
Принцип: аминокислоты, содержащие сульфгидрильные группы – SH, подвергаются щелочному гидролизу с образованием сульфида натрия Na2S. Последний, взаимодействуя с плюмбитом натрия (образуется в ходе реакции между ацетатом свинца и гидроокисью натрия), образует осадок сульфида свинца PbS черного или бурого цвета.
Na2S + Na2PbO2 + 2H2O PbS + 4 NaOH
Реактивы: 1) яичный белок, 1% раствор; 2) реактив Фоля (к 5% раствору ацетата свинца прибавляют равный объем 30% раствора гидроокиси натрия до растворения образовавшегося осадка).
Ход определения: к 5 каплям раствора яичного белка прибавляют 5 капли реактива Фоля и кипятят 2-3 минуты. После отстаивания 1-2 минут появляется черный или бурый осадок.
Реакции осаждения
Белки в растворе и соответственно в организме сохраняются в нативном (природном) состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная (водная) оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул и выпадению их в осадок.
Осаждение белков может быть обратимым и необратимым в зависимости от состава реактивов и условий реакций.
В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций (групп) белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения безбелкового раствора.
Обратимое осаждение
Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание.
- Реакция №1 «Высаливание»
- Принцип: насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором сульфата аммония – глобулиновая фракция.
- Сущность реакции заключается в дегидратации (обезвоживании) молекул белка.
- Реактивы:1) неразбавленный яичный белок; 2) насыщенный раствор сульфата аммония; 3) гидроокись натрия, 10% раствор; 4) сульфат меди, 1% раствор; 5) сульфат аммония в порошке; 6) дистиллированная вода.
Ход определения: в пробирку наливают 30 капель неразведенного яичного белка и добавляют равное количество насыщенного раствора сульфата аммония. Содержимое пробирки перемешивают. Получают полунасыщенный раствор сульфата аммония, при этом глобулиновая фракция белка осаждается, а альбуминовая остается в растворе.
Через 5 минут осадок отфильтровывают, на фильтре остается глобулиновая фракция, а в фильтрате – альбуминовая. Осадок с фильтрата снимают стеклянной палочкой и переносят в пробирку, куда добавляют несколько капель воды, пока не растворится осадок.
Наличие в растворе белка можно доказать с помощью биуретовой реакции, которая будет положительной.
В пробирку с фильтратом добавляют порошок сульфата аммония до полного насыщения раствора, т.е. до тех пор, пока не прекратится растворение соли. При этом выпадает осадок – альбумины. Его отфильтровывают, осадок с фильтра снимают стеклянной палочкой, растворяют водой и проводят биуретовую реакцию.
Необратимое осаждение
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими своих нативных свойств, т.е. денатурацией. Такие изменения белков можно вызывать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов и т.д.
Реакция №2 «Осаждение при кипячении»
Принцип: белки являются термолабильными соединениями и при нагревании свыше 50-600С денатурируются.
Сущность тепловой денатурации заключается в разрушении гидратной оболочки, разрыве стабилизирующих белковую молекулу связей и развертывании белковой молекулы.
Наиболее полное и быстрое осаждение происходит в изоэлектрической точке (когда заряд молекулы равен нулю), поскольку при этом частицы белка наименее устойчивы.
Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами – в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, т.к. его частицы перезаряжаются и несут в первом случае положительный, а во втором – отрицательный заряд, что повышает их устойчивость в растворе.
Реактивы: 1) яичный белок, 1% раствор; 2) уксусная кислота, 1% и 10% растворы; 3) гидроокись натрия, 10% раствор.
Ход определения: в 4 пронумерованные пробирки приливают по 10 капель раствора яичного белка. Затем 1-ю пробирку нагревают до кипения, при этом раствор белка мутнеет, но так как частицы денатурированного белка несут заряд, они в осадок не выпадают.
Это связано с тем, что яичный белок имеет кислые свойства (изоэлектрическая точка его рН 4,8) и в нейтральной среде заряжен отрицательно. Во 2-ю пробирку добавляют 1 каплю 1% раствора уксусной кислоты и нагревают до кипения.
Белок выпадает в осадок, так как его раствор приближается к изоэлектрической точке и белок теряет заряд (один из факторов устойчивости белка в растворе). В 3-ю пробирку добавляют 1 каплю 10% уксусной кислоты и нагревают до кипения.
Осадка не образуется, так как в сильнокислой среде частицы белка приобретают положительный заряд (сохраняется один из факторов устойчивости белка в растворе). В 4-ю пробирку добавляют 1 каплю раствора гидроокиси натрия и нагревают до кипения. Осадок не образуется, поскольку в щелочной среде отрицательный заряд частиц белка увеличивается.
Реакция №3 «Осаждение солями тяжелых металлов»
Принцип: белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
Реактивы: 1) яичный белок, 1% раствор; 2) сульфат меди, 10% раствор; 3) ацетат свинца, 5% раствор, 4) нитрат серебра, 5% раствор.
Ход определения: в 3 пронумерованные пробирки вносят по 5 капель раствора яичного белка. В 1-ю пробирку добавляют 1 каплю сульфата меди. Во 2-ю пробирку добавляют 1 каплю ацетата свинца. В 3-ю пробирку добавляют 1 каплю нитрата серебра.
Во всех пробирках выпадает осадок. Затем в первую пробирку добавляют 10 капель сульфата меди и во вторую пробирку добавляют 10 капель ацетата свинца и наблюдают растворение осадка. В третью пробирку вносят 10 капель нитрата серебра – растворение осадка нет.