- 2.3.1. Химические свойства водорода и галогенов
- Взаимодействие водорода с простыми веществами
- с металлами
- с неметаллами
- Взаимодействие водорода со сложными веществами
- с оксидами металлов
- c оксидами неметаллов
- c кислотами
- c солями
- Химические свойства галогенов
- Взаимодействие галогенов с простыми веществами
- Взаимодействие галогенов с неметаллами
- водородом
- фосфором
- серой
- Взаимодействие галогенов с металлами
- Реакции галогенов со сложными веществами
- Реакции замещения с галогенами
- Взаимодействие галогенов с водой
- Взаимодействие галогенов с растворами щелочей
- Фтор
- Фтор
- Свойства фтора
- Химические свойства фтора
- Содержание и образование фтора
- Применение фтора
- Фтор | это… Что такое Фтор?
- Электронное строение
- Строение молекулы
- Кристаллическая решётка
- Получение
- Лабораторный метод
- Промышленный метод
- Физические свойства
- Химические свойства
- Хранение
- Применение
- Применение в химии
- Ракетная техника
- Применение в медицине
- Биологическая и физиологическая роль
- См. также
- Литература
- Примечания


 А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
ФТОР (от греч. phthoros — разрушение; лат. Fluorum) F, хим. элементVП гр. периодич. системы, относится к галогенам; ат. н. 9, ат. м. 18,998403. Прир. фтор состоит из одного стабильного нуклида 19F. Поперечное сечение захвата тепловых нейтронов 1 ·10-31 м2. Конфигурация внеш. электронной оболочки атома 2s22p5 степень окисления -1; энергии ионизации при последоват. переходе от F0 к P7+ соотв. равны 1681, 3375, 6046, 8409, 11024, 15164 и 17868 кДж/моль; сродство к электрону 327,8 кДж/моль. Фтор- самый электроотрицат. элемент, его электроотрицательность по Полингу 3,98. Ионный радиус F (в скобках даны координац. числа): 0,115 нм (2), 0,116 нм (3), 0,117 нм (4) и 0,119 нм (6). Ядро атома 19F имеет спин 1/2 и близкое к свойственному для протия гиромагн. отношение, что позволяет получать спектры ЯМР с высоким разрешением.
Молекула своб. фтора двухатомна, межатомное расстояние 0,14165 нм. F2 имеет аномально низкую (по сравнению с ожидаемой) в ряду галогенов энергию диссоциации (158 кДж/моль).
Содержание фтора в земной коре 0,065% по массе. Встречается только в связанном состоянии. Осн. минерал, имеющий пром. значение,- флюорит (плавиковый шпат) CaF2, месторождения к-рого встречаются на всех континентах, а наиб.
запасы сосредоточены в США, Мексике, Великобритании, Италии, ЮАР, Таиланде, Монголии, КНР. Общее содержание фтора в пром. рудах CaF2 122, в перспективных — 236 млн. т (1984, без СССР).
В СНГ залежи флюорита имеются в Узбекистане, Таджикистане, Казахстане, в Забайкалье, Приморском крае и др.
К редким фторсодержащим минералам относятся криолит Na3AlF6, хиолит 5NaF·3AlF3, селлаит MgF2, иттрофлюорит Ca1-xYxF2-x. Изоморфно замещая ионы ОН-, О2- и др., фтор входит также в состав мн. минералов, напр. топаза Al2SiO4(OH, F)2, амблигонита LiAlPO4(OH, F), бастнезита (Ce, La)CO3F, апатита Ca5(PO4)3(OH, F), слюд и гидросиликатов. Наиб. пром.
значение помимо флюоритовых руд имеют апатит и фосфориты, из к-рых фтор получают в виде хим. соед.; они содержат не более 3,5-4,2% фтора по массе, но добываются в больших кол-вах для произ-ва соед. фосфора. Запасы фтора в фосфатных рудах СНГ в 5 раз превышают его запасы во флюоритовых рудах (1988). Соед. фтора содержатся во мн. подземных водах.
В небольших кол-вах фтор входит в состав живых организмов (в организме человека 2,6 г фтора, из них 2,5 г — в костях), участвует в процессах образования зубов и костей, в обмене в-в и в активации нек-рых ферментов. Нормальное поступление фтора в организм человека 2,5-3,5 мг в сут. Пониженные и повышенные кол-ва фтора вызывают разл. заболевания.
Свойства. Фтор- бесцв. газ с сильным запахом, напоминающим запах хлора; т. кип. -188,20 0C, т. пл. -219,70 0C; плотн. газа 1,693 кг/м3 (О 0C, 0,1 МПа), жидкости 1516 кг/м3 (-188 0C); .tкрит -128,84 0C, pкрит 5,215 МПа, dкрит 0,574 г/см3; давление в тройной точке 252 Па; 0,5104 кДж/моль, 6,544 кДж/моль; C0p 31,34 Дж/(моль·К); 202,68 Дж/(моль· К); теплопроводность газообразного фтора с точностью до 10% совпадает с теплопроводностью N2; коэф. самодиффузии при 0 0C и атм. давлении 0,170 см2/с.
В твердом состоянии при обычном давлении фтор образует две кристаллич. модификации: ниже -227,60 0C форму с моноклинной решеткой (плотн. 1,97 г/см3 при -250 С), выше — -форму с кубич. решеткой (а = 0,667 нм, плотн. 1,70 г/см3).
Плотн. жидкого фтора описывается ур-нием d= 1,907-2,20- 10-3T-2,948·10-5T2 г/см3 (67T 103 К); вязкость — ур-нием = 2,43 · 10-7ехр( 196/T)Па ·с; ур-ние температурной зависимости давления пара над жидким фтором 1n(р/ртрПа) = 7,89592346Х+3,38765063Х2 — 1,34590196X3 + + 2,71138936X(1-X)1,4327, где X = (1 — Ттр/T)/(1 — Ттр/Ткрит; Tтр и pтр — соотв. т-ра и давление в тройной точке; Ткрит -критич. т-ра; g жидкого фтора 0,0179 Н/м (69,2 К) и 0,0146 Н/м (81,0 К); 1,4577 (70,0 К) и 1,2073 (143,0 К).
Фтор раств. в нек-рых фторидах, хлор- и фторуглеродах. Жидкий фтор неограниченно смешивается с жидкими O2 и O3. С водой энергично реагирует: 2F2 + 2H2O 4HF + O2. Не образует кислородных к-т, с H2 бурно реагирует, давая фтористый водород. Для орг. соед. известны фторноватистой кислоты эфиры.
Фтор- один из сильнейших окислителей и фторирующих реагентов.
Благодаря высокой энергии связи элемент — фтор во фторидах и низкой энергии диссоциации F2 многие р-ции фторирования простых в-в, оксидов, галогенидов и др. соед.
необратимы, сопровождаются выделением большого кол-ва тепла и образованием фторидов элементов в высш. степенях окисления. Все хим. элементы, за исключением Не, Ne и Ar, образуют устойчивые фториды.
В то же время по кинетике взаимод. с фтором поведение в-в может сильно отличаться. Многие р-ции имеют цепной характер, самопроизвольно инициируются при комнатной или более низкой т-ре и протекают со вспышкой или со взрывом, а в потоке — с возникновением пламени. К таким р-циям относится фторирование H2 и водородсодержащих в-в (углеводородов, H2O, NH3, N2H4, HCl, HBr, HCN и др.
), S и ее производных (SO2, SOCl2, S4N4, SBr2 и др.), Si, P и др. Теоретич. т-ра горения стехиометрич. смеси с H2 4430 К. При комнатной т-ре с фтором способны реагировать щелочные металлы, нек-рые галогениды, гидраты солей. В то же время р-ции F2 с большей частью простых в-в и неорг. соед. протекают лишь при их активации, достигаемой обычно повышением т-ры или давления.
На величину т-ры начала фгорирования влияют природа в-в, дисперсность твердых в-в, св-ва продуктов р-ции (нелетучие фториды могут экранировать пов-сть, замедлять и даже прекращать фторирование), условия процесса (парциальное давление F2, интенсивность теплоотвода и др.).
Р-ция F2 с Ag, V, Re, Os начинается при 100-250 0C, с Au, Cd, Ti, Zr, Nb, Та, Cr, W, Mn, Со — при 300-350 0C, а с Al, Fe, Cu, Zn, Y, Ni (на пов-сти к-рых образуется пленка нелетучих фторидов) — лишь ок. 400-500 0C. Температурный интервал «спокойного», регулируемого фгорирования, однако, невелик, и при избытке F2 многие р-ции переходят при превышении нек-рой т-ры в горение.
Особое место занимает фгорирование графита, сопровождающееся образованием при т-рах ниже 400 0C фторидов графита CFx (см. Графита соединения).
Оксиды металлов и многие соли неск. более устойчивы к действию F2, чем сами металлы. Взаимод. оксидов может сопровождаться образованием на промежут. стадиях окси-фторидов.
Наиб. устойчивы к действию F2 благородные газы, N2, O2, алмаз, нек-рые виды стеклоуглерода, СО, CO2, сапфир и алунд.
Одним из путей снижения т-ры фгорирования является применение катализаторов. Активация F2 м. б. проведена также его атомизацией и ионизацией в газовых разрядах, электронном пучке, под действием УФ облучения и термока-талитически (на нагретой пов-сти катализатора). Атомный F при комнатной т-ре и в криогенных условиях взаимод. с Xe,
Kr, СО, NOF, NO2, O2, ClF3 и мн. др. в-вами. См. также Фторирование.
Наиб. важным соед. фтора посвящены отдельные статьи: Азота фториды, Бора трифторид, Галогенфториды, Кислорода фториды, Кремния фториды, Фтористоводородная кислота, Фтористый водород, Фторобораты, Фторорганические соединения, Фторосиликаты и др.
Получение. Общая схема произ-ва своб.
фтора включает добычу и обогащение флюоритовых руд, серно-кислотное разложение флюоритовых концентратов, выделение и очистку безводного HF, его электролитич. разложение.
Ведущие производители флюоритовых концентратов — Мексика (20-25% мирового произ-ва), ЮАР, Монголия, КНР, Таиланд, Франция, Испания. Общий мировой объем их произ-ва 4-5 млн. т в год.
Электролитич. разложение HF м. б. осуществлено 3 способами: низкотемпературным (15-50 0C, в смеси HF с KF), среднетемпературным (70-120 0C, расплав KH2F3) и высокотемпературным (245-310 0C, расплав KHF2). В пром-сти используют среднетемпературный способ.
Стандартный потенциал разложения HF в расплаве KH2F3 равен 2,9 В. Пром. электролизеры работают обычно при 80-105 0C, напряжении 8,5-12,0 В и анодной плотности тока 70-180 мА/см2.
Их мощность по току достигает 11 кА, опытных образцов -15 кА, что соответствует производительности 7-10 кг Р2/ч.
Электролизеры представляют собой стальные или монеле-вые ванны с размещенными на крышке угольными анодами и расположенными между анодами стальными катодами. В нек-рых конструкциях между катодами и анодами имеются перфорированные диафрагмы, предотвращающие смешивание и взаимод. выделяющихся F2 и H2. Совр.
электролизеры снабжены системами непрерывной подачи в них HF, поддержания постоянной т-ры, отвода H2 и F2. Отбор F2 проводят с помощью спец. коробчатых сборников, «колоколов», расположенных на крышке и погруженных в расплав так, что они окружают верх. часть анодов.
При электролизе на пов-сти угольных анодов образуется пассивирующий слой фторидов графита CFx, что вызывает «анодный эффект» — резкое повышение напряжения и его скачки. Этот эффект подавляют введением в электролит добавок, использованием анодов особой конструкции и пульсирующего тока.
Свежезагружаемый электролит тщательно обезвоживают, проводя электролиз примеси влаги при низком напряжении. Для снижения т-ры процесса разрабатывают электролиз смеси KH2F3 — NH4HF2 — HF.
Очищают фтор методами селективной сорбции примесей (HF на гранулированном пористом NaF), вымораживания примесей, сжижения фтора, хим. и фотохим. связывания примесей. Глубокую очистку фтора проводят с помощью низкотемпературной ректификации или его обратимой хемосорбцией (напр., путем образования и термич. разложения K2NiF4).
Для получения своб. фтора в лабораториях или в портативных установках могут использоваться его твердые источники. Так, MnF4 при нагр. до 200 0C выделяет ок. 15% F2 от своей начальной массы. Взаимод. K2MnF6 и SbF5 протекает с выделением KSbF6, MnF3 и F2. Разработаны пиротехн. источники F2, содержащие соли тетрафтораммония.
Определение. Осн. метод определения фтора в р-рах — потен-циометрия с использованием спец. селективных электродов. Чувствит. элемент таких электродов (мембрану) чаще всего изготовляют из монокристаллич. LaF3, легированного дифто-ридами др. металлов. Кроме того, применяют гравиметрич. или объемный методы, основанные на осаждении труднорастворимых PbClF, CaF2, ThF4 и др.
Наиб, универсальный метод разложения мн. твердых неорг. фторидов — пирогидролиз. Образующийся HF поглощают водными р-рами и анализируют объемным или потенциометрич. методами. Применяют также отгонку с парами H2O и улавливание в виде H2SiF6, разл. физ. методы.
Свободный фтор в газах определяют потенциометрически, поглощением его твердым NaCl и последующим определением выделившегося Cl2 иодометрически, поглощением его ртутью и волюмометрич. определением. Фторорг. в-ва предварительно разлагают натрием. Качественно фтор обнаруживают по вьщелению HF, а также методами количеств, анализа.
Применение. Своб. фтор — фторирующий реагент в произ-ве UF6 (см. Урана фториды), галогенфторидов, SF4, SF6, BF3, фторидов азота, фторидов графита, высш. фторидов металлов (WF6, MoF6, ReF6), фторидов благородных газов, фторорг. производных и др. Атомный фтор используют в хим. лазерах на HF и DF, для синтеза KrF2, кислорода фторидов и др.
Фтор сильно токсичен. Раздражает кожу, слизистые оболочки носа и глаз; непереносимая концентрация 77 мг/м3. Вызывает дерматиты, конъюнктивиты, отек легких. Контакт с чистым фтором приводит к ожогу. Хронич. отравление соед. фтора вызывает флюороз. ПДК 0,03 мг/м3 — в воздухе производств. помещений, 0,7 мг/л — в воде (для фторид-иона).
Сжиженный фтор перевозят в охлаждаемых цистернах и хранят в танках.
Мощности по произ-ву своб. фтора в развитых странах достигают 15-20 тыс. т в год.
Фтор открыт К. Шееле в 1771, в свободном виде получен А. Муассаном в 1886.
Лит.: Раков Э.Г., Химия и технологах неорганических фторидов, M., 1990; Gmelins handbook of inorganic chemistry, system. № 5. F. Fluorine. Suppl. v. 2. The element, B., 1980. Э.Г. Раков.
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
Еще по теме:
- Фтор — справочник по веществам
- Фтор — Неорганическая химия, Б.В.Некрасов
2.3.1. Химические свойства водорода и галогенов
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов.
Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов.
Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
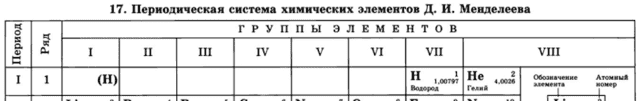
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
- Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
- Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
- При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
- В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген.
Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике.
Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ.
Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены.
К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
- При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
- Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
- Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
- Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5).
При этом происходит образование пентафторида фосфора:
- При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
- При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
- Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
- Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
- Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
- Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
- Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
- Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
- а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Фтор
ФТОР, F, химический элемент подгруппы галоидов седьмой группы периодической системы (аналог хлора, брома и йода). Порядковый номер 9; атомный вес 19,00 (фтор является «чистым элементом», изотопы его неизвестны). Элементарный фтор представляет собой газ бледного желто-зеленого цвета с неприятным резким запахом, напоминающим запах хлора и озона. Вес 1 литра фтора при 0°С и давлении 1 atm 1,71 г, плотность по отношению к воздуху 1,31. При сильном охлаждении фтор превращается в сильно преломляющую свет желтую жидкость удельным весом около 1,1, кипящую при температуре —187°С. При еще более низкой температуре он застывает в бледно-жёлтую кристаллическую массу, плавящуюся при —223°С, а при —252°С становящуюся бесцветной. Газообразный фтор состоит из двухатомных молекул. Как и остальные галоиды, фтор является типичным металлоидом, обнаруживающим большую склонность к образованию отрицательно заряженных ионов, причем в отличие от остальных галоидов фтор всегда одновалентен и никогда не образует электроположительной составной части соединений. Нормальный потенциал фтора (по отношению к водородному электроду) равен +2,8.
В связи с этим в отношении реакционной способности фтора среди химических элементов стоит на первом месте. С водородом он соединяется даже в темноте, причем реакция сопровождается воспламенением или взрывом.
Кроме того, фтор соединяется уже на холоде с бромом, йодом, фосфором, серой, мышьяком, сурьмой, бором, кремнием, аморфным углеродом и большинством металлов, причем соответствующие реакции сопровождаются часто явлениями воспламенения или взрыва. При температуре красного каления фтор соединяется далее с графитом, золотом и платиной.
Кремнезем и силикаты под действием фтора разрушаются, причем освобождается фтористый кремний SiF4 и выделяется свободный кислород. От сероводорода, галоидоводородов, аммиака и воды фтор отнимает водород, с которым при этом соединяется.
Получение чистого фтора весьма затруднительно. Впервые он был получен Муассаном в 1886 г. путем электролиза раствора кислого фтористого калия HF·KF в безводном фтористом водороде HF в аппарате из платины. Позднее выяснилось, что для этой цели можно, пользоваться также аппаратурой из меди, т. к.
последняя, как и некоторые другие металлы, покрывается плотной защитной пленкой фтористых соединений, препятствующей дальнейшему воздействию фтора. Получение элементарного фтора иным путем практически невозможно. Распространение фтора в земной коре определяется (по Вашингтону) цифрой 0,078% (хлор — 0,055%).
Важнейшими минералами фтора являются плавиковый шпат, криолит, апатит и фосфориты. Из последних в процессе переработки их на суперфосфат фтор выделяется в виде SiF4 и утилизируется обычно в виде кремнефтористого натрия. Кроме упомянутых известно еще большое количество содержащих фтор минералов, фторокарбонатов, фторосиликатов и т. д.
, не имеющих, однако, практического значения для получения соединений фтора. Небольшие количества фтора входят в состав живых организмов, растительных и животных, причем фтор обычно связан бывает с фосфором. Свободный фтор встречается в природе в некоторых разновидностях плавикового шпата и изумруда в виде включений.
Вследствие затруднительности его получения и хранения фтор практического применения не имеет.
Источник: Мартенс. Техническая энциклопедия. Том 25 — 1934 г.
Фтор
ФТОР, F (от греч. phthoros — гибель, разрушение, лат. Fluorum * а. fluorine; н. Fluor; ф. fluor; и. fluor), — химический элемент VII группы периодической системы Менделеева, относится к галогенам, атомный номер 9, атомная масса 18,998403. В природе 1 стабильный изотоп 19F. Искусственно получены радиоактивные изотопы с массовыми числами 16, 17, 18, 20, 21, 22.
Свойства фтора
Фтор получен французским химиком А. Муассаном в 1886. Фтор — бледно-жёлтый газ со специфическим запахом, ниже — 227,6°С образует кристаллы с моноклинной решёткой (а — F2), при более высоких температурах — с кубической решёткой (b — F2); плотность твёрдого фтора 1700 кг/м3, жидкого 1512 кг/м3; t плавления — 218,699°С, t кипения — 188,2°С; молярная теплоёмкость 31,3 Дж/(моль•К).
Химические свойства фтора
Фтор имеет степень окисления — 1. Самый электроотрицательный химический элемент, обладает исключительно высокой химической активностью и образует соединения со всеми элементами, кроме гелия, неона и аргона.
Взаимодействие фтора со многими элементами, оксидами и солями протекает очень энергично, а с водородом и углеводородами — часто со взрывом. В присутствии фтора большинство металлов, С, Si, R, S и др. воспламеняются при 200-300°С и сгорают с образованием фторидов. Фтор очень ядовит.
ПДК фтора 0,15 мг/м3, при экспозиции не более 1 ч — 1,5•10-3 мг/м3.
Среднее содержание фтора в земной коре 625•10-4% (по массе), в ультраосновных породах 100•10-4%, в основных — 400•10-4%, в высококальциевых гранитоидах 520•10-4%, гранитах 850•10-4 %, сиенитах 1400•10-4 %, агпаитовых нефелиновых сиенитах 2000•10-4 %. Фтор выносится из верхней мантии преимущественно с щелочными базальтовыми и ультрабазитовыми магмами, при кристаллизационной дифференциации которых он сильно концентрируется в остаточных расплавах.
Содержание и образование фтора
Фтор в силикатных расплавах связан с катионами повышенной основности, существенно влияя на структуру расплавов, способствует возникновению ликвации. Фтор характерен для гидротермальных систем. Важнейшие минералы, обогащенные фтором (% по массе): флюорит 47,81-48,8, фтор-апатит до 3,8, слюды 0,1-3,5, амфиболы 0,1-3,5, виллиомит 45,24, топаз 13,01-20,45, сфен 0,1-1,35, криолит 54,4.
Получают фтор электролизом HF в среде расплавленного KH2F3 или KHF. Фтор образуется также при термическом распаде некоторых высших фторидов (например, SbF3). Получающийся фтор содержит до 5% HF, который удаляется вымораживанием с последующим поглощением фторидом натрия.
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в металлических аппаратах.
Применение фтора
Применение в технике находят фторорганические соединения, характеризующиеся высокой термической и химической стойкостью.
Фторорганические соединения используют также в качестве смазок и рабочих тел в холодильных установках, а также для получения фторидов металлов. Плавиковую кислоту применяют при обработке некоторых неорганических силикатных материалов.
F2 — фторирующий агент в производстве фторорганических соединений и неорганических фторидов. Многие фториды металлов — промежуточные соединения при получении чистых металлов.
Фтор | это… Что такое Фтор?
β+-распад в править] Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Применение метода МО для молекулы F2
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллическая решётка
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Фтор образует две кристаллические модификации, стабильные при атмосферном давлении:
- α-фтор — существует при температуре меньше 45,6 K, кристаллическая решетка моноклинная, пространственная группа C 2/c, параметры a = 0,550 нм, b = 0,328 нм, c = 0,728 нм, β = 102,17°, Z = 4[5][6].
- β-фтор — существует в интервале температур 45,6 ÷ 53,53 K, кристаллическая решетка кубическая, параметры a = 0,667 нм, Z = 8.
Получение
Лабораторный метод получения фтора
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C[7]:
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен, кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта (III) до 300 °С, разложение фторидов серебра (слишком дорого) и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[8].
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом.
К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C).
В атмосфере фтора горят даже вода и платина:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора[9].
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются непреодолимой для фтора пленкой фторидов[10]).
Применение
Применение в химии
Газообразный фтор используется для получения:
Ракетная техника
Основная статья: Соединения фтора в ракетной технике
Соединения фтора и сам фтор применяются в ракетной технике как окислители ракетного топлива.
Применение в медицине
Основная статья: Соединения фтора в медицине
Фторированные углеводороды (напр. перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил и др.).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно[11].
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50% [12].
Предельно допустимая концентрация связанного фтора[13] в воздухе промышленных помещениях равна 0,0005 мг/литр воздуха.
См. также
Литература
- Рысс И. Г. Химия фтора и его неорганических соединений. М. Госхимиздат, 1966 г. — 718 с.
- Некрасов Б. В. Основы общей химии. (издание третье, том 1) М. Химия, 1973 г. — 656 с.
- L. Pauling, I. Keaveny, and A.B. Robinson, J. Solid State Chem., 1970, 2, p. 225. англ. — Подробней о кристаллической структуре фтора
Примечания
- ↑ http://www.xumuk.ru/nekrasov/vii-01.html
- ↑ Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 198.
- ↑ Таблица Менделеева на сайте ИЮПАК
- ↑ Главным образом в эмали зубов
- ↑ Journal of Solid State Chemistry, Vol. 2, Issue 2, 1970, P. 225—227.
- ↑ J. Chem. Phys. 49, 1902 (1968)
- ↑ Гринвуд Н., Эрншо А. «Химия элементов» т.2, М.: БИНОМ. Лаборатория знаний, 2008 стр. 147—148, 169 — химический синтез фтора
- ↑ Ахметов Н. С. «Общая и неорганическая химия».
- ↑ Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.
- ↑ Фтор в Популярной библиотеке химических элементов
- ↑ По данным National Toxicology Program
- ↑ Справочник потребителя. Журнал без рекламы
- ↑ в виде фторидов и фторорганических соединений






