- Как искали неизвестный алюминий
- Свойства крылатого металла
- Неправда, но хорошо придумано
- Алюминиевые сплавы, плюсы и минусы
- Дюраль
- Сплав 7075
- Сплавов разных много
- Старость в радость
- Минералы, месторождения…а самородный алюминий?
- Как производят крылатый металл
- Бывает технический и сверхчистый
- Металл для крыльев
- Где применяется
- Купить металл
- Алюминий, свойства атома, химические и физические свойства
- Атом и молекула алюминия. Формула алюминия. Строение алюминия:
- Изотопы и модификации алюминия:
- Свойства алюминия (таблица): температура, плотность, давление и пр.:
- Физические свойства алюминия:
- Химические свойства алюминия. Взаимодействие алюминия. Реакции с алюминием:
- Получение алюминия:
- Применение алюминия:
- Алюминий
- СТРУКТУРА
- СВОЙСТВА
- Запасы и добыча
- ПРОИСХОЖДЕНИЕ
- ПРИМЕНЕНИЕ
- КЛАССИФИКАЦИЯ
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
- Строение атома алюминия
Главная › Металлы
23.05.2020
Металл алюминий — мечта многих производств. Коррозия ему не страшна, он прекрасно проводит электрический ток, цветной металл легче железа почти в три раза, отличается прочностью. Не магнитится, легко образует сплавы с металлами.
Второе имя алюминия — крылатый металл. Появление чистого алюминия открыло человеку дорогу в небо.

Как искали неизвестный алюминий
История открытия алюминия вяло тянулась с античности. Плиний пишет о квасцах (Alumen). Но под квасцами понимались разные вещества. Это антимоний, тартар, щелочь, гипс.
Лавуазье высказал здравую мысль: алюмина является окислом неизвестного металла. Тут химики оживились и стали пытаться «выцепить» незнакомца. Попыток было много, но только в 1825 году датчанин Эрстед извлек-таки неизвестный металл, напоминающий олово. Назвали его алюминием.
Свойства крылатого металла
Алюминий (Aluminium) имеет несчастливый 13 номер в периодической таблице Менделеева. Однако на счастливую судьбу металла это не повлияло.

Этот легкий серебристый металл послушно поддается механической обработке и литью, имеет большую тягучесть.
Редкая способность — быстро образовывать окисные пленки на поверхности чистого металла. Но эти пленки не слишком хорошо защищают от коррозии. Надежнее химическое и электрохимическое оксидирование. Формула оксидной пленки А12Оз.
Химические и физические характеристики алюминия:
- плотность 2,7 г/см3;
- температура плавления 660°С;
- кипит цветной металл при температуре 2518°С;
- строение кристаллической решетки гранецентрированное, кубическое;
- степени окисления 0; +3.
С помощью металлического алюминия (его взаимодействия с оксидами металлов) получают трудновосстанавливаемые металлы. Этот метод называется алюминотермия.
Алюминий имеет один стабильный изотоп, 27Al.
 Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %, размер видимого сектора около 55×37 мм
Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %, размер видимого сектора около 55×37 мм
Неправда, но хорошо придумано
В печатных изданиях, а сейчас и в интернете гуляет история о крестьянине, который вел «крамольные беседы о полете на Луну».
Крестьянина (или мещанина), по одним сведениям Петрова, по другим Никифорова, сослали в киргизский поселок Байконур» Якобы известие о факте напечатано был в Московских губернских новостях», в 1848 году.
Сейчас, когда с космодрома Байконура ушли в космос не один десяток спутников и станций, этот факт выглядит пророческим и мистическим.
Алюминиевые сплавы, плюсы и минусы
Кодовый символ, указывающий, что алюминий может быть вторично переработан
Чистый алюминий в строительных конструкциях применять нецелесообразно. Прочностные характеристики у него «так себе». А вот алюминиевые сплавы — другое дело. Сейчас известны и используются около 60 сплавов. Можно выбрать для любых нужд, на любой вкус.
Классификация сплавов проводится по составу, свойствам, по способности к термической обработке.
Добавки меди, магния и марганца, цинка существенно улучшают характеристики сплава в сравнении с чистым металлом. Этими металлами чаще всего легируют алюминий. Титан, литий, ванадий, церий, скандий, некоторые редкоземельные элементы для легирования применяются реже, но свойства этих сплавов также востребованы в промышленности.
Дюраль
Дюралюмины — сплавы алюминия с медью (4%), магнием (0,5%) и небольшого количества железа, марганца, кремния. Недостаток дюралей — подверженность коррозии; с ней справляются, применяя анодирование, плакировку, авиационную грунтовку, окрашивание.
Востребованные свойства сплава: хорошая статическая и усталостная прочность, высокая вязкость разрушения.
Широко применяется в деталях и конструкциях, где большую роль играет масса изделия. Главные потребители сплава — авиация, судостроение, космонавтика.
Сплав 7075
Разрабатывался компанией Sumitomo Metal Corporation (Япония) в строжайшей тайне.
Представляет соединение алюминия с цинком (до 6%), магния (2-2,5%), меди (до 1,5%). В тот же сплав добавлены титан, кремний, марганец, хром, железо. Добавки эти составляют не более 0,5%, но свой вклад в свойства сплава вносят.
Модификации сплава:
- 7075-0;
- 7075-06;
- 7075-Т651;
- 7075-Т7;
- 7075-АСР.
Сплавы устойчивы к коррозии, хорошо полируются.

Применяются в производстве винтовок для армии и граждан. Промышленности автомобильная, авиационная, морская активно используют сплав. Его минус — достаточно высокая цена.
Сплавов разных много
В России довольно много сплавов с разными свойствами:
- D1, D16, 1161, 1163 — алюминий, магний, медь;
- АМГ1 — АМГ6, сплав алюминия и магния;
- AD31, AD33, AD35, AB — алюминий, кремний, магний. Список легко продолжить.
Старость в радость
Не всегда старость — это плохо. Металл — как человек или вино; с возрастом свойства алюминия меняются; он становится лучше, крепче, сильнее.
Естественное старение металла происходит при нормальных условиях; можно сказать, что металл «дозревает».
Искусственное старение проходит при термообработке и пластическом деформировании.
Термическая обработка бывает разных видов. Выбор зависит от назначения будущего сплава.
| Вид термообработки | Что дает термообработка |
| Закалка с полным искусственным старением | Высокая прочность сплава, но некоторое снижение пластичности |
| Закалка со стабилизирующим старением | Хорошая прочность, довольно высокая стабильность структуры |
| Закалка с последующим смягчающим отпуском | Хорошая пластичность, но снижение прочности сплава |
| Искусственное старение | Повышает прочность сплава, улучшает возможность обработки резанием |
| Отжиг | Повышение пластичности, уменьшение остаточных напряжений металла |
| Закалка | Улучшает прочностные характеристики |
| Закалка и неполное искусственное старение | Повышает прочность при сохранении пластичности |
Минералы, месторождения…а самородный алюминий?
Запасы алюминия в природе огромны. Среди металлов он держит первое место по распространенности. Но «общительность», активность элемента привела к тому, что в чистом виде металл практически отсутствует.
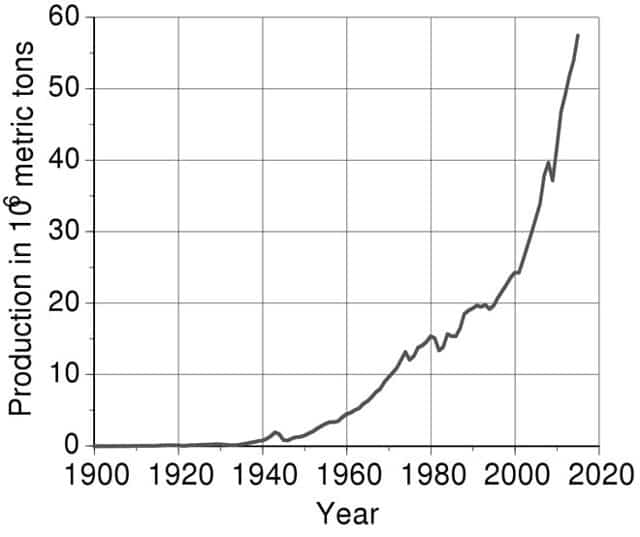 Производство алюминия в миллионах тонн
Производство алюминия в миллионах тонн
Минералов, содержащих алюминий, много:
- бокситы;
- глиноземы;
- полевые шпаты;
- нефелины;
- корунды.
Так что добыча алюминиевого сырья не составляет большого труда.
Если все запасы на Земле истощатся (что сомнительно), то алюминий можно добывать из морской воды. Там его содержание составляет 0,01 мг/л.
Кто захочет увидеть самородный алюминий, тому придется опускаться в жерла вулканов.
Происхождением такой металл из самых глубин нашей планеты.
Как производят крылатый металл
Производство металла можно разделить на две стадии.
- Первая — добыча бокситов, их дробление и отделение кремния при помощи пара.
- Вторая стадия: глинозем смешивают с расплавленным криолитом и воздействуют на смесь электротоком. В процессе реакции жидкий алюминий оседает на дне ванны.
Образовавшийся металл отливают в слитки; далее он отправляется потребителям или на производство сплавов и высокочистого алюминия.
Метод энергозатратный, «кушает» много электричества.
Бывает технический и сверхчистый
Полученный алюминий называется техническим или нелегированным. В нем содержание чистого металла не менее 99%. Его потребляет электронная промышленность, он необходим в производстве теплообменных и нагревательных устройств, осветительного оборудования.
Часть этого металла отправляется на дополнительную очистку, «рафинирование». В результате имеем металл высокой чистоты, с содержанием алюминия не менее 99,995%.
Его употребляют в электронике, в производстве полупроводников. Кабельное производство, химическое машиностроение сейчас не обойдется без сверхчистого алюминия.
Металл для крыльев
Без такого металла, как алюминий, невозможно покорение неба. Крыльев людям не дано, а летать хочется человеку с давних времен. Не напрасно миф об Икаре живет с античных времен. Попытки взлететь предпринимались неоднократно.
Но прорыв случился в 1903 году, когда романтики неба и замечательные механики братья Райт подняли в воздух самолетик. Этот самолет открыл путь в небо.
Где применяется
Применение легкого и прочного металла необходимо не только в авиации.

В пуленепробиваемых и бронированные стеклах, экранчиках смартфонов присутствует сапфир. У таких стекол высокая прочность на сжатие.
Из алюминия делают фольгу, которую используют в электрических конденсаторов. Домохозяйки с удовольствием запекают в фольге вкусняшки для домашних. Кастрюли, сковородки, другие изделия для домашнего хозяйства производят из «крылатого металла».

Тонко молотый порошок металла используют для производства прочной краски.
Вы удивитесь, но алюминиевая кастрюлька в кухне, самолет и перстень с сапфиром — родня. В каждом есть наш герой.
Оксид алюминия — это корунд. А к ним относятся сапфиры, рубины, изумруды — все эти короли драгоценных камней содержат алюминий. Сам корунд используют как наждак.
Купить металл
Стоимость металла на бирже 148 USD за тонну (на 05.05.2020).
Рекомендуем: ПЛАТИНА — «гнилое серебро» или благородный металл Алюминий — дороги, которые он выбирает Ссылка на основную публикацию 
Алюминий, свойства атома, химические и физические свойства
Al 13 Алюминий
26,9815386(8) 1s2 2s2 2p6 3s2 3p1
Алюминий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 13. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), третьем периоде периодической системы.
Атом и молекула алюминия. Формула алюминия. Строение алюминия
- Цена на алюминий
- Изотопы и модификации алюминия
- Свойства алюминия (таблица): температура, плотность, давление и пр.
- Физические свойства алюминия
Химические свойства алюминия. Взаимодействие алюминия. Реакции с алюминием
Получение алюминия
Применение алюминия
Таблица химических элементов Д.И. Менделеева
Атом и молекула алюминия. Формула алюминия. Строение алюминия:
Алюминий (лат. Aluminium, от лат. alumen – «квасцы») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Al и атомным номером 13. Расположен в 13-й группе (по старой классификации – главной подгруппе третьей группы), третьем периоде периодической системы.
Алюминий – амфотерный металл. Относится к группе лёгких, цветных металлов.
- Алюминий обозначается символом Al.
- Как простое вещество алюминий при нормальных условиях представляет собой лёгкий металл серебристо-белого цвета.
- Молекула алюминия одноатомна.
- Химическая формула алюминия Al.
Электронная конфигурация атома алюминия 1s2 2s2 2p6 3s2 3p1. Потенциал ионизации (первый электрон) атома алюминия равен 577,54 кДж/моль (5,985769(3) эВ). прием алюминия
Строение атома алюминия. Атом алюминия состоит из положительно заряженного ядра (+13), вокруг которого по трем оболочкам движутся 13 электронов. При этом 10 электронов находятся на внутреннем уровне, а 3 электрона – на внешнем. Поскольку алюминий расположен в третьем периоде, оболочек всего три.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома алюминия находятся два спаренных – на s-орбитали и один неспаренный – на p-орбитали электроны.
В свою очередь ядро атома алюминия состоит из 13 протонов и 14 нейтронов.
Радиус атома алюминия (вычисленный) составляет 118 пм.
Атомная масса атома алюминия составляет 26,9815386(8) а. е. м.
Алюминий – наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Концентрация алюминия в земной коре составляет 8,1 %.
Алюминий, свойства атома, химические и физические свойства
Изотопы и модификации алюминия:
Свойства алюминия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Алюминий |
| 102 | Прежнее название | |
| 103 | Латинское название | Aluminium |
| 104 | Английское название | Aluminium, Aluminum (в США и Канаде) |
| 105 | Символ | Al |
| 106 | Атомный номер (номер в таблице) | 13 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, лёгкий, цветной металл |
| 109 | Открыт | Ханс Кристиан Эрстед, Дания, 1825 г. |
| 110 | Год открытия | 1825 г. |
| 111 | Внешний вид и пр. | Мягкий, лёгкий и пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 8,1 % |
| 120 | Содержание в морях и океанах (по массе) | 5,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,005 % |
| 122 | Содержание в Солнце (по массе) | 0,006 % |
| 123 | Содержание в метеоритах (по массе) | 0,91 % |
| 124 | Содержание в организме человека (по массе) | 0,00009 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 26,9815386(8) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p1 |
| 203 | Электронная оболочка | K2 L8 M3 N0 O0 P0 Q0 R0  |
| 204 | Радиус атома (вычисленный) | 118 пм |
| 205 | Эмпирический радиус атома* | 125 пм |
| 206 | Ковалентный радиус* | 121 пм |
| 207 | Радиус иона (кристаллический) | Al3+
|
| 208 | Радиус Ван-дер-Ваальса | 184 пм |
| 209 | Электроны, Протоны, Нейтроны | 13 электронов, 13 протонов, 14 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 13-ая группа (по старой классификации – главная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1, +2, +3 |
| 302 | Валентность | III |
| 303 | Электроотрицательность | 1,61 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 577,54 кДж/моль (5,985769(3) эВ) |
| 305 | Электродный потенциал | Al3+ + 3e– → Al, Eo = -1,663 В |
| 306 | Энергия сродства атома к электрону | 41,762(5) кДж/моль (0,43283(5) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 2,70 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 2,375 г/см3 (при температуре плавления 660,32 °C и иных стандартных условиях, состояние вещества – жидкость), 2,289 г/см3 (при 1000 °C и иных стандартных условиях, состояние вещества –жидкость) |
| 402 | Температура плавления* | 660,32 °C (933,47 K, 1220,58 °F) |
| 403 | Температура кипения* | 2470 °C (2743 K, 4478 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 10,71 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 284 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,903 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 24,20 Дж/(K·моль) |
| 411 | Молярный объём | 9,993 см³/моль |
| 412 | Теплопроводность | 237 Вт/(м·К) (при стандартных условиях), 237 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная  |
| 513 | Параметры решётки | 4,050 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 394 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7429-90-5 |
- Примечание:
- 205* Эмпирический радиус атома алюминия согласно [1] и [3] составляет 143 пм.
- 206* Ковалентный радиус алюминия согласно [1] и [3] составляет 121±4 пм.
- 401* Плотность алюминия согласно [3] и [4] составляет 2,6989 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 2,699 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело).
- 402* Температура плавления алюминия согласно [3] составляет 660 °C (933,15 K, 1220 °F).
- 403* Температура кипения алюминия согласно [3] составляет 2518,82 °C ( 2792 K, 4565,88 °F).
- 407 * Удельная теплота плавления (энтальпия плавления ΔHпл) алюминия согласно [3] и [4] составляет 10,75 кДж/моль и 10,8 кДж/моль соответственно.
- 408* Удельная теплота испарения (энтальпия кипения ΔHкип) алюминия согласно [3] и [4] составляет 284,1 кДж/моль и 293 кДж/моль соответственно.
- 410* Молярная теплоёмкость алюминия согласно [3] составляет 24,20 Дж/(K·моль) и 24,35 Дж/(K·моль).
Физические свойства алюминия:
Химические свойства алюминия. Взаимодействие алюминия. Реакции с алюминием:
Получение алюминия:
Применение алюминия:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Источники:
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
алюминий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле алюминия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
- Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
- Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
- Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
- Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Алюминий

Кусок чистого алюминия
Алюминий — очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения.
Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм.
Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
СТРУКТУРА
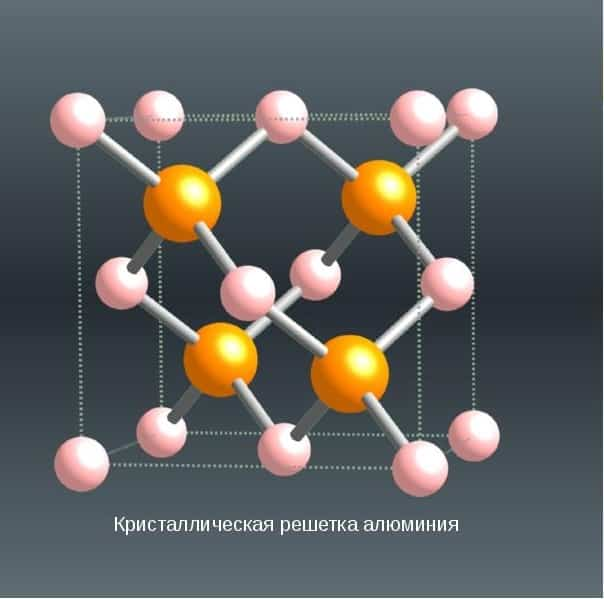
Кубическая гранецентрированная структура. 4 оранжевых атома
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно.
Элементарная ячейка состоит из четырех атомов размером 4,049596×10-10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10-10 м, а атомный объем 9,999×10-6 м3/г-атом.
Примеси в алюминии незначительно влияют на величину параметра решетки.
Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В.
В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10-5 см), но прочной пленкой оксида алюминия А1203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
СВОЙСТВА
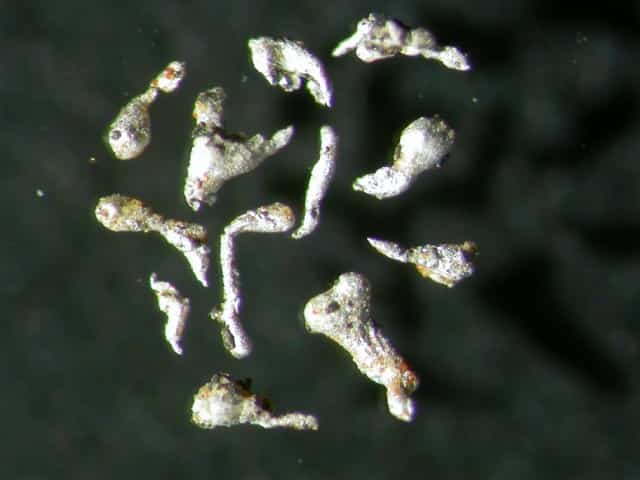
Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см3), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость.
Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой – оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления.
Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется.
При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты – соли, содержащие алюминий в составе аниона.
Запасы и добыча

Кусочки алюминия
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов.
Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ

Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико.
Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов.
Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ

Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость.
Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу.
Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем.
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г.
были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий (англ. Aluminium) – Al
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.21
Физические свойства
Оптические свойства
Плеохроизмне плеохроирует
Кристаллографические свойства
Строение атома алюминия


Средняя оценка: 4.6
Всего получено оценок: 425.
Средняя оценка: 4.6
Всего получено оценок: 425.
Алюминий (Al) – лёгкий металл, занимающий третье место по распространённости в земной коре среди химических элементов. Строение атома алюминия позволяет легко обрабатывать металл: он поддаётся литью, формовке, механическому воздействию.
Электронное строение атома элемента алюминия связано с его положением в периодической таблице Менделеева. Алюминий имеет 13 порядковый номер и находится в третьем периоде, в IIIa группе. Относительная атомная масса алюминия – 27. Электронная конфигурация атома алюминия – 1s22s22p63s23p1, модель распределения электронов – +13Al)2)8)3.
Рис. 1. Алюминий в периодической таблице.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трёх электронных оболочек с 13 электронами. На внешнем энергетическом уровне находится всего три электрона. В возбуждённом состоянии атом способен отдавать все три электрона, проявляя степень окисления +3, или образовывать три ковалентные связи. Поэтому алюминий имеет третью валентность.
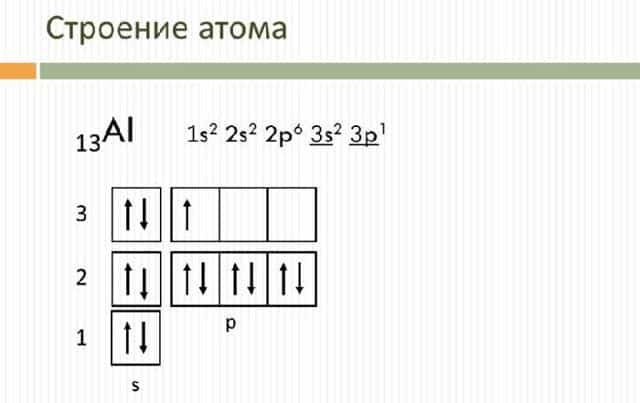 Рис. 2. Строение атома алюминия.
Рис. 2. Строение атома алюминия.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Алюминий – серебристый металл, обладающий высокой электропроводностью и пластичностью. Элемент при комнатной температуре легко соединяется с кислородом, образуя на поверхности оксидную плёнку, защищающую металл от коррозии. Образование плёнки препятствует реакции с водой, концентрированными азотной и серной кислотами, поэтому алюминиевая тара подходит для перевозки этих кислот.
 Рис. 3. Оксид алюминия.
Рис. 3. Оксид алюминия.
Для снятия оксидной плёнки используют соли аммония, горячие щёлочи, сплавы ртути. После разрушения оксидной плёнки алюминий вступает в реакцию со многими неметаллами и соединениями. Основные химические свойства элемента описаны в таблице.
| Взаимодействие | Ход реакции | Пример |
| С водой | Только в условиях отсутствия оксидной плёнки. Образуется гидроксид алюминия | 2Al + 6H2O → 2Al(OH)3 + 3H2 |
| С кислородом | Образуется оксид алюминия | 4Al + 3O2 → 2Al2O3 + Q |
| С галогенами | При комнатной температуре. С йодом – в присутствии катализатора | 2Al + 3Cl2 → 2AlCl3 |
| С серой | При температуре выше 200°С, образуется сульфид алюминия | 2Al + 3S → Al2S3 |
| С фосфором | При температуре 500°С, образуется фосфид алюминия | Al + P → AlP |
| С азотом | При температуре 800°С, образуется нитрид алюминия | 2Al + N2 → 2AlN |
| С углеродом | При температуре 2000°С, образуется карбид алюминия | 4Al + 3C → Al4C3 |
| С кислотами | При комнатной температуре реагирует с разбавленными кислотами, при нагревании – с концентрированными. Образуются соли |
|
| Со щелочами | Реагируют растворы и сплавы |
– 2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3H2 |
| С оксидами | Вытесняет металлы | 2Al + Cr2O3 = 2Cr + Al2O3 |
Алюминий не взаимодействует с водородом.
Атом алюминия включает 13 электронов. Схема строения алюминия – 1s22s22p63s23p1. На внешнем уровне находится три электрона, определяющие третью валентность элемента.
Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами.
При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.6
Всего получено оценок: 425.
А какая ваша оценка?
Гость завершил
Тест «Капитанская дочка»с результатом 17/17
Гость завершил
Тест «После бала»с результатом 10/10
Гость завершил
Тест «Недоросль»с результатом 14/18
Гость завершил
Тест «Мертвые души»с результатом 19/19
Гость завершил
Тест по произведению «12»с результатом 10/10
Гость завершил
Тест «Мастер и Маргарита»с результатом 13/16
Гость завершил
Тест «После бала»с результатом 8/10
Не подошло? Напиши в х, чего не хватает!