- Устаревшая и новая нумерация группы
- Строение атомов щелочных металлов
- Последовательность открытия щелочных металлов
- Физические свойства щелочных металлов
- Кристаллическое состояние
- Химические свойства щелочных металлов
- Получение и применение щелочных металлов
- Соли щелочных металлов
- Оксиды щелочных металлов
- Гидроксиды щелочных металлов (щелочи)
- Получение и применение щелочей
- Соли щелочных металлов
- Гидроксиды
- Неорганическая химия
- Соединения щелочных металлов
- Соли щелочных и щелочноземельных
- — 2 — Препараты натрия
- 2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- Взаимодействие средних солей с гидроксидами металлов
- Реакции средних солей с кислотами
- Реакции средних солей с другими средними солями
- Реакции термического разложения солей
- Разложение карбонатов
- Разложение нитратов
- Разложение солей аммония
- Разложение хлората калия
- Химические свойства кислых солей
- Отношение кислых солей к щелочам и кислотам
- Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
- Термическое разложение кислых солей
- Химические свойства основных солей
- Химические свойства комплексных солей (на примере соединений алюминия и цинка)
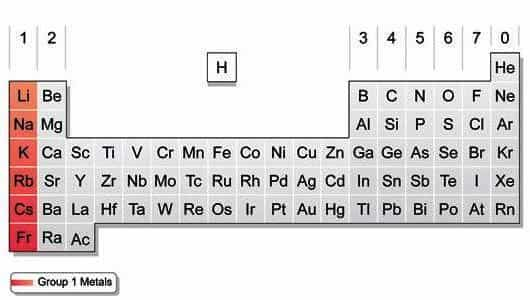
Щелочные металлы — общее название элементов 1-й группы периодической системы химических элементов.
Ее состав: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr), и гипотетический элемент — унуненний (Uue).
Наименование группы произошло от названия растворимых гидроксидов натрия и калия, обладающих реакцией и вкусом щелочи. Рассмотрим общие черты строения атомов элементов, свойства, получение и применение простых веществ.
Устаревшая и новая нумерация группы
По устаревшей системе нумерации щелочные металлы, занимающие крайний слева вертикальный столбец таблицы Менделеева, относятся к I-А группе. В 1989 году в качестве основного Международный химический союз (IUPAC) предложил иной вариант (длиннопериодный).
Щелочные металлы в соответствии с новой классификацией и сплошной нумерацией относятся к 1-й группе. Открывает эту совокупность представитель 2-го периода — литий, завершает ее радиоактивный элемент 7-го периода — франций.
У всех металлов 1-й группы во внешней оболочке атомов содержится один s-электрон, который они легко отдают (восстанавливаются).
Строение атомов щелочных металлов
Для элементов 1-й группы характерно наличие второго энергетического уровня, повторяющего строение предшествующего инертного газа. У лития на предпоследнем слое — 2, у остальных — по 8 электронов. В химических реакциях атомы легко отдают внешний s-электрон, приобретая энергетически выгодную конфигурацию благородного газа.
Элементы 1-й группы обладают малыми величинами энергии ионизации и электроотрицательности (ЭО). Они легко образуют однозарядные положительные ионы. При переходе от лития к францию возрастает количество протонов и электронов, радиус атома. Рубидий, цезий и франций легче отдают внешний электрон, чем предшествующие им в группе элементы.
Следовательно, в группе сверху вниз увеличивается восстановительная способность.
Легкая окисляемость щелочных металлов приводит к тому, что элементы 1-й группы существуют в природе в виде соединений своих однозарядных катионов. Содержание в земной коре натрия — 2,0%, калия — 1,1%. Другие элементы в ней находятся в малых количествах, например, запасы франция — 340 г. Хлорид натрия растворен в морской воде, рапе соленых озер и лиманов, образует залежи каменной или поваренной соли. Вместе с галитом встречаются сильвинит NaCl • KCl и сильвин KCl. Полевой шпат образован алюмосиликатом калия K2[Al2Si6O16]. В воде ряда озер растворен карбонат натрия, а запасы сульфата элемента сосредоточены в акватории Каспийского моря (Кара-Богаз-Гол). Встречаются залежи нитрата натрия в Чили (чилийская селитра). Существует ограниченное число природных соединений лития. В качестве примесей к соединениям элементов 1-й группы встречаются рубидий и цезий, а франций находят в составе урановых руд.
Последовательность открытия щелочных металлов
Британский химик и физик Г. Дэви в 1807 году провел электролиз расплавов щелочей, впервые получив натрий и калий в свободном виде. В 1817 году шведский ученый Иоганн Арфведсон открыл элемент литий в минералах, а в 1825-м Г. Дэви выделил чистый металл.
Рубидий был впервые обнаружен в 1861 году Р. Бунзеном и Г. Кирхгофом. Немецкие исследователи анализировали состав алюмосиликатов и получили в спектре красную линию, соответствующую новому элементу.
В 1939 году сотрудница Парижского института радиоактивности Маргарита Пере установила существование изотопа франция. Она же дала название элементу в честь своей родины. Унуненний (эка-франций) — предварительное название нового вида атомов с порядковым номером 119.
Временно используется химический символ Uue. Исследователи с 1985 года предпринимают попытки синтеза нового элемента, который станет первым в 8-м периоде, седьмым в 1-й группе.
Физические свойства щелочных металлов
Почти все щелочные металлы обладают серебристо-белым цветом и металлическим блеском на свежем срезе (цезий имеет золотисто-желтую окраску). На воздухе блеск тускнеет, появляется серая пленка, на литии — зеленовато-черная. Этот металл обладает наибольшей твердостью среди соседей по группе, но уступает тальку — самому мягкому минералу, открывающему шкалу Мооса. Натрий и калий легко сгибаются, их можно разрезать. Рубидий, цезий и франций в чистом виде представляют тестообразную массу. Плавление щелочных металлов происходит при относительно низкой температуре. Для лития она достигает 180,54 °С. Натрий плавится при температуре 97,86 °С, калий — при 63,51 °С, рубидий — при 39,32 °С, цезий — при 28,44 °С. Плотность щелочных металлов меньше, чем родственных им веществ. Литий плавает в керосине, поднимается на поверхность воды, калий и натрий также всплывают в нем.
Кристаллическое состояние
Кристаллизация щелочных металлов происходит в кубической сингонии (объемно-центрированной). Атомы в ее составе обладают зоной проводимости, на свободные уровни которой могут переходить электроны.
Именно эти активные частицы осуществляет особую химическую связь — металлическую. Общность строения энергетических уровней и природа кристаллических решеток объясняют сходство элементов 1-й группы.
При переходе от лития к цезию возрастают массы атомов элементов, что приводит к закономерному увеличению плотности, а также к изменению других свойств.
Химические свойства щелочных металлов
Единственный внешний электрон в атомах щелочных металлов слабо притягивается к ядру, поэтому им свойственна низкая энергия ионизации, отрицательное или близкое к нулю сродство к электрону. Элементы 1-й группы, обладая восстановительной активностью, практически не способны окислять. В группе сверху вниз возрастает активность в химических реакциях:
- Натрий, калий и литий при небольшом нагревании загораются на воздухе. Для первых двух металлов характерно образование в этой реакции пероксидов и надпероксидов, а для лития — оксида Li2O. Рубидий и цезий на воздухе самовоспламеняются.
- Щелочные металлы способны восстанавливать даже водород. При нагревании взаимодействуют с атомами самого легкого элемента и восстанавливают его до отрицательно заряженного иона H-. В реакции получаются гидриды, например, NaH, KH.
- Простые вещества, соответствующие элементам 1-й группы, взаимодействуют с водой и образуют щелочи, например, LiOH, NaOH, KOH. Процесс сопровождается выделением газообразного водорода, который самовоспламеняется или взрывается. 2Na + 2H2O = 2NaOH + H2↑. Рубидий и цезий вступают в реакцию даже со льдом. Хранение щелочных металлов допускается под слоем минерального масла, в керосине, в запаянных стеклянных сосудах.
- Активно взаимодействуют металлы 1-й группы с галогенами, особенно энергично происходит реакция с фтором и хлором, при нагревании — с серой и фосфором. Большинство получившихся солей обладает хорошей растворимостью.
- Качественная реакция — разложение солей щелочных металлов в огне газовой горелки. Пары окрашивают пламя в определенный цвет.
- При взаимодействии щелочных металлов со спиртами получаются алкоголяты, с карбоновыми кислотами они дают соответствующие соли, например, формиат натрия.
Получение и применение щелочных металлов
Металлы, относящиеся к 1-й группе, в промышленности получают электролизом расплавов их галогенидов и других природных соединений. При разложении под действием электрического тока положительные ионы на катоде присоединяют электроны и восстанавливаются до свободного металла. На противоположном электроде происходит окисление аниона.
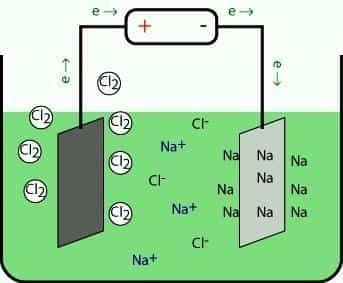
При электролизе расплавов гидроксидов на аноде окисляются частицы OH-, выделяется кислород и получается вода. Еще один метод заключается в термическом восстановлении щелочных металлов из расплавов их солей кальцием.
Простые вещества и соединения элементов 1-й группы имеют практическое значение. Литий служит сырьем в атомной энергетике, используется в ракетной технике. В металлургии применяется для удаления остатков водорода, азота, кислорода, серы.
Гидроксидом дополняют электролит в щелочных аккумуляторах.

Натрий необходим для атомной энергетики, металлургии, органического синтеза. Цезий и рубидий используются при изготовлении фотоэлементов. Широкое применение находят гидроксиды и соли, особенно хлориды, нитраты, сульфаты, карбонаты щелочных металлов. Катионы обладают биологической активностью, особенно важны для организма человека ионы натрия и калия.
Соли щелочных металлов
Из-за высокой химической активности щелочные металлы встречаются на Земле исключительно в виде соединений, главным образом солей. Литий является редким элементом. Он входит в состав некоторых алюмосиликатов (в частности, сподумена
Li2O•Аl2О3•4SiO2), а также в форме хлорида LiСl присутствует в морской воде, подземных водах, водах соляных озёр. Рубидий и цезий встречаются в виде примесей к алюмосиликатам, содержащим калий.
Натрий и калий, напротив, входят в десятку элементов, наиболее распространённых в земной коре (в ней содержится 2,3% натрия и 2,1% калия). Многие из их минералов, например Редкими называют элементы, содержание которых в земной коре не превышает 0,01 %. К ним относят Li, Rb, Cs, Be, Sc, Y, La, лантаниды, Ga, In, Tl, Zr, Hf, Ge, V, Nb, Та, Mo, W, Re и платиновые металлы.
галит (поваренная соль) NaCl, сильвин КСl, сильвинит КС1•NaCl, знакомы людям с глубокой древности. Из морской воды кристаллизуется также мирабилит (или глауберова соль) Na2SO4•10Н2О. Впервые это вещество было получено в 1648 г. немецким химиком Иоганном Рудольфом Глаубером (1604—1670).
Большинство солей щелочных металлов хорошо растворимы в воде; исключение составляют лишь соединения лития, а также соли некоторых кислот, например хлорной КСlО4.
Интересно, что многие соли лития выделяются из растворов в виде кристаллогидратов, тогда как для солей тяжёлых щелочных металлов (например, цезия или даже калия) кристаллогидраты оказываются неустойчивыми. Это связано с последовательным увеличением ионного радиуса катиона при движении вниз по подгруппе.
Чем больше радиус иона, тем ниже плотность заряда на его поверхности и тем сложнее иону удерживать молекулы воды. Вот почему соли калия менее гигроскопичны, чем аналогичные соли натрия. По этой причине в
пиротехнике и при производстве пороха предпочитают использовать калийную селитру, а не натриевую: она меньше отсыревает.
Среди соединений натрия важная роль принадлежит карбонату, или соде. Безводный средний карбонат натрия Na2CO3 называют кальцинированной содой, десятиводный кристаллогидрат Na2CO3•10H2O — стиральной содой, а гидрокарбонат NaHCO3— питьевой (или пищевой) содой.
Растворы среднего карбоната Na2CO3 имеют сильнощелочную реакцию среды, их используют при стирке белья и при обработке шерсти.
Кроме того, кальцинированная сода находит широкое применение в производстве стекла, мыла, сульфита натрия, органических красителей.
Растворы гидрокарбоната имеют слабощелочную реакцию среды, поэтому питьевую соду используют в медицине (например, для полоскания горла), а также при приготовлении пищи.
Чаша из галита.
В организме человека содержится в среднем около 140 г калия и около 100 г натрия. С пищей мы ежедневно потребляем от 1,5 до 7 г ионов калия и от 2 до 15 г ионов натрия. Потребность в ионах Na+ настолько велика, что их необходимо специально добавлять в пищу (в виде поваренной соли).
Значительная потеря ионов натрия (они выводятся из организма с мочой и потом) неблагоприятно сказывается на здоровье человека. Поэтому в жаркую погоду врачи рекомендуют людям есть больше солёного.
Однако и избыточное содержание их в пище вызывает негативную реакцию организма, например повышение артериального давления.
Источник: Мир Энциклопедий Аванта+
Авторы: Андрей Дроздов, Илья Леенсон, Дмитрий Трифонов, Денис Жилин, Александр Серов, Андрей Бреев, Андрей Шевельков, Вадим Ерёмин, Юлия Яковлева, Оксана Рыжова, Виктория Предеина, Наталья Морозова, Алексей Галин, Сергей Каргов, Сергей Бердоносов, Александр Сигеев, Оксана Помаз, Григорий Середа, Владимир Тюрин, Антон Максимов, Вячеслав Загорский, Леонид Каневский, Александр Скундин, Борис Сумм, Игнат Шилов, Екатерина Менделеева, Валерий Лунин, Абрам Блох, Пётр Зоркий, Александр Кури, Екатерина Иванова, Дмитрий Чаркин, Сергей Вацадзе, Григорий Серела, Анастасия Ростоцкая, Александр Серое, Анастасия Сигеева
Оксиды щелочных металлов
Оксиды щелочных металлов являются типичными основными оксидами, обладая всеми их свойствами. Им соответствуют сильные основания (щелочи).
Оксиды щелочных металлов высокореакционны, их основные свойства усиливаются от лития к цезию.
- реагируют с водой с образованием хорошо растворимых гидроксидов: Na2O+H2O = 2NaOH
- реагируют с кислотными оксидами с образованием солей: K2O+CO2 = K2CO3
- реагируют с кислотами с образованием соли и воды: K2O+H2SO4 = K2SO4+H2O
Получение оксидов щелочных металлов:
- оксид лития получают прямой реакцией с кислородом:4Li+O2 = 2Li2O
- оксиды остальных щелочных металлов, кроме лития, получают косвенными реакциями:Na2O2+2Na = 2Na2O
Гидроксиды щелочных металлов (щелочи)
- LiOH — гидроксид лития
- NaOH — г-д натрия (едкий натр или каустическая сода)
- KOH — г-д калия (едкое кали)
- RbOH — г-д рубидия
- CaOH — г-д кальция
Растворимость в воде и сила оснований возрастает в ряду от LiOH к CaOH, что обусловлено увеличением размера атома металла, а, значит, и поляризуемости связи Me-OH.
Физические свойства щелочей:
- не имеют цвета;
- гигроскопичны;
- хорошо растворимы в воде;
- проявляются сильные оснОвные свойства.
Химические свойства щелочей:
- В водных растворах щелочи практически полностью диссоциируют: CaOH ↔ Ca++OH-
- Легко взаимодействуют с минеральными кислотами (реакция нейтрализации), образуя соль и воду: NaOH+HCl = NaCl+H2O
- Хорошо поглощают влагу и углекислый газ из воздуха, что нашло применение в осушении газов: 2NaOH+CO2 = Na2CO3+H2O
- Реагируют с солями (если один из продуктов реакции выпадает в осадок, то реакция идет не до конца): 2NaOH+CaCl2 = 2NaCl+Ca(OH)2↓
- Взаимодействуют с амфотерными гидроксидами: NaOH+Al(OH)3 = Na[Al(OH)4]
- Водные растворы щелочей взаимодействуют с хлором и бромом: 2NaOH+Cl2 = NaCl+NaClO+H2O
Получение и применение щелочей
- В промышленности гидроксид лития, натрия, калия получают из водных растворов хлоридов методом электролиза: 2NaCl → 2NaOH+Cl2↑+H2↑
- Карбонатный метод получения щелочей: Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓
- Взаимодействием металлов или их оксидов с водой: K+H2O = 2KOH+H2↑ Li2O+H2O = 2LiOH
Применение щелочей:
- производство красок, мыла, искусственных волокон, бумаги;
- очистка нефтепродуктов;
- в реакциях химического синтеза;
- для осушки газов и органических жидкостей;
- в текстильной и кожевенной промышленности;
- в качестве электролитов в аккумуляторах.
Соли щелочных металлов
Реагируя с кислотами, щелочные металлы образуют хорошо растворимые в воде соли (за исключением солей лития). Наибольшее практическое применение нашли соли калия и натрия.
Применение солей щелочных металлов:
- NaCl (хлорид натрия, поваренная или каменная соль) есть в каждом доме на столе, о важности этой пищевой приправы говорит хотя бы тот факт, что в войну в первую очередь запасались спичками и солью; применяется в производстве хлора, соляной кислоты, соды, хлорной извести, едкого натра и проч.;
- Na2CO3 (сода, углекислая сода) — карбонат натрия применяется в производстве алюминия, стекла, моющих средств, искусственных волокон, для очистки нефтепродуктов;
- NaHCO3 (питьевая или пищевая сода) гидрокарбонат натрия является настоящим спасением для людей, страдающих изжогой, незаменимый компонент при выпечке хлеба и производстве кондитерских изделий, компонент огнетушителей, широко применяется в производстве безалкогольных напитков и минеральных вод;
- NaSO4 сульфат натрия применяют в производстве стекла, при окраске х/б тканей, для получения серной кислоты, соды, в медицине глауберова соль применяется, как слабительное средство.
- KCl хлорид калия широко применяется в качестве минерального удобрения в сельском хозяйстве.
Гидроксиды
Гидроксиды щелочных металлов — бесцветные гигроскопичные вещества, легко расплывающиеся на воздухе и постепенно превращающиеся в карбонаты.
Растворение гидроксидов в воде сопровождается выделением большого количества тепла из-за высокой энергии гидратации. Все щелочи образуют гидраты, некоторые из которых выделены в твердом виде.
В промышленности гидроксид натрия (едкий натр, каустическая сода) получают электролизом водного раствора хлорида натрия:
Гидроксиды натрия, калия, цезия и рубидия плавятся без разложения, гидроксид лития при температуре выше 600°С выделяет воду:
Основные химические свойства щелочей изложены в параграфе 10.3.
Практически все соли щелочных металлов хорошо растворимы в воде. Растворимость солей малых анионов (например, F ) и гидроксидов возрастает, а больших анионов (например, SO|”) уменьшается при переходе от Li к Cs.
Мало растворимы LiF, NaF, Csl, Li2C03, КСЮ/,, а также некоторые другие соли. Свойства солей будут подробно рассмотрены в главах, посвященных соответствующим кислотам.
Здесь остановимся лишь на термической устойчивости солей и получении карбоната и гидрокарбоната натрия, имеющих большое значение.
Галогениды щелочных металлов термически устойчивы. Их температуры плавления уменьшаются закономерно от соединений натрия к соединениям цезия и от фторидов к иодидам.
Нитраты щелочных металлов (кроме нитрата лития) разлагаются при нагревании до нитрита и кислорода:
Нитрат лития разлагается по схеме
Карбонаты (кроме карбоната лития) термически устойчивы. Карбонат натрия получают в процессе Сольве:
Полученный гидрокарбонат затем прокаливают при 100°С:
При кристаллизации из раствора образуется кристаллогидрат Na2C03- 10Н2О, который выветривается до моногидрата Na2C03 — Н20, а при нагревании до 100°С образует безводную соль. Карбонат лития разлагается на оксид и воду:
Сульфат натрия кристаллизуется в виде кристаллогидрата Na2SO410H2O.
Катионы щелочных металлов могут выступать как комплексообразова- тели. В разбавленных водных растворах ионы существуют в форме аквакомплексов, в которых лигандами являются молекулы воды. Наиболее устойчивы аквакомплексы лития и натрия: [Li(H20)4][Na(H20)6]+. В отличие от остальных щелочных металлов литий в связи с малым радиусом проявляет координационное число 4.
- Известны аммиачные комплексы — [Li(NH3)4]+, [Na(NH3)/J — устойчивость которых понижается при переходе от лития к натрию.
- С полидентатными лигандами, такими как (Р207)4 и анион этилендиа- минтетрауксусной кислоты (~OOC)2NCH2CH2N(COCr)2, устойчивость комплексов уменьшается от лития к цезию.
- В настоящее время известно большое число комплексных соединений щелочных металлов с краун-эфирами — циклическими полиэфирами, например:
В этих комплексах ион металла координирован шестью атомами кислорода. Комплексы имеют достаточно большие размеры и являются гидрофобными, поэтому образуемые ими соли хорошо растворимы в органических растворителях.
Еще один тип лигандов, на котором следует остановиться, — ионофоры. Ионофоры — небольшие гидрофобные молекулы (многочисленные антибиотики, например валиномицин, криптанды и другие вещества).
Они имеют хорошую растворимость в липидных бислоях мембран и обладают уникальной ионной избирательностью.
Существует два класса ионофоров: 1) ионофоры — подвижные переносчики ионов; 2) каиалообразующие ионофоры.
В основе действия ионофоров лежит способность образовывать комплексы с переносимыми ионами. Ионофор формирует полость, в которой катион удерживается координационными связями с участием атомов кислорода полярных групп, выстилающих полость.
При этом резко ослабляется связь иона с растворителем и противоионами. Например, валиномицин является подвижным переносчиком ионов калия.
Захватив ион калия с наружной стороны мембраны, валиномицин образует комплекс, внедряющийся в мембрану и перемещающийся к другой ее стороне, после чего комплекс диссоциирует, и ион калия высвобождается.
Неорганическая химия
Общая характеристика
К щелочным металлам относятся s-элементы I-ой группы Периодической системы — литий, натрий, калий, рубидий,цезий и франций. .
Литий имеет два стабильных изотопа -6Li (мольная доля в естественном элементе 0,073) и 7Li (0,927), натрий — один изотоп 23Na, калий — 39К (0,931) и 41К (0,069).
Изотоп калия с массовым числом 40 (40К, мольная доля 0,0002) — радиоактивный, -распад. У рубидия два стабильных изотопа — 85Rb (0,7215) и 87Rb (0,2785), у цезия — один 133Cs.
Франций стабильных изотопов не имеет, массовое число наиболее долгоживущего — 223.
Все щелочные металлы — электронные аналоги, внешний уровень имеет строение ns1. По сравнению с элементами других подгрупп соответствующего периода щелочные металлы имеют наиболее низкие энергии ионизации и наибольшие радиусы атомов и ионов.
В группе энергия ионизации уменьшается от лития к цезию, а радиус атома наоборот, возрастает. В соединениях проявляют степень окисления +1 и в свободном виде на Земле не встречаются.
Мольная доля лития в земной коре 0,0002, натрия — 0,024 (один из наиболее распространенных элементов), калия 0,014, рубидия — 0,00007. Содержание цезия около 10-10, франций получен только искусственно.
Важнейшие минералы щелочных металлов — NaCl -каменная соль, или галит, Na2SO4*10H2O — глауберова соль или мирабилит, Na2B2O7*10H2O — бура, Na3AlF6 -криолит, KCl — сильвин, NaCl*KCl — сильвинит, KCl*MgCl2*6H2O — карналлит, KCl*MgSO4*3H20 — каинит.
Простые вещества.
Все щелочные металлы не имеют аллотропных и полиморфных модификаций и образуют по одному простому веществу.
Физические свойства.
В виде простых веществ — мягкие, серебристо белые металлы, цезий имеет золотисто-желтый цвет. Плотности лития, натрия и калия меньше плотности воды ( 1 г/см3), температура плавления плавно уменьшается от лития (180оС) к цезию (28оС). Так же изменятся и температура кипения — от 1337оС у лития до 668оС у цезия. Твердость щелочных металлов мала — они легко режутся ножом.
В видимой области спектра в парах щелочные металлы имеют интенсивные линии излучения: натрий — желтую, литий — карминово-красную, калий — фиолетовую, рубидий — красную, цезий — голубую. Это позволяет распозновать эти металлы с помощью пламенной фотометрии.
Щелочные металлы исключительно реакционноспособны и проявляют сильные восстановительные свойства. Уже при комнатной температуре они реагируют со многими неметаллами. С кислородом литий образует оксид:
4Li + O2 = 2Li2O
Остальные щелочные металлы образуют пероксиды и надпероксиды (супероксиды), например:
2Na + O2 = Na2O2 2K + 2O2 = K2O4
В атмосфере фтора и хлора щелочные металлы самовоспламеняются, образуя галогениды:
Na + Cl2 = 2NaCl
С жидким бромом литий и натрий реагируют замедленно, остальные — о взрывом. С иодом взаимодействие протекает спокойно.
С водородом щелочные металлы реагируют при нагревании (200-400oC), при этом образуютсяионные гидриды:
2Na + Н2 = 2NaН
разлагающиеся водой с выделением водорода:
2NaН + 2Н2О = 2NaОН + Н2
С азотом щелочные металлы реагируют при нагревании, образуя нитриды состава Ме3N. Литий реагирует с азотом воздуха уже при комнатной температуре, покрываясь слоем красноватого нитрида:
6Li + N2 = 2Li3N
Щелочные металлы реагируют с водой:
2Ме + 2Н2О = 2МеОН + Н2
литий — спокойно, натрий — энергично, калий и остальные — со взрывом — воспламеняется выделяющийся водород. Рубидий и цезий реагируют не только с жидкой водой, но и со льдом.
С кислотами щелочные металлы образуют соли, часто эти реакции сопровождаются взрывами.
Со спиртами щелочные металлы реагируют спокойно, часто для завершения реакции необходимо нагревание:
2Ме + С2Н5ОН = 2С2Н5ОМе + Н2
При взаимодействии лития и натрия с алюминие, оловом, ртутью образуются интерметаллические соединения. Широко распространена амальгама натрия NanHgm. Между собой щелочные металлы образуют сплавы, широкое применение имеет сплав натрия и калия, обладающий высокой теплоемкостью.
Получение щелочных металлов
Основным способом получения щелочных металлов является электролиз расплавов их соединений. Для получения лития электролизу подвергают расплав эвтектическуй смеси хлоридов лития и калия.
Натрий получают электролизом расплава хлорида или гидроксида, калий — электролизом расплава смеси хлоридов натрия и калия. Смеси солей используют для понижения температуры электролиза.
Реакции электролиза хлоридов и гидроксидов в общем виде выглядят так:
2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О + О2
Кромe электролиза щелочные металлы можно получить и восстановлением оксидов и гидроксидов, например оксид лития восстанавливают кремнием при нагревании:
2Li2O + Si = Li + SiO2
Расплавленный гидроксид калия восстанавливают жидким натрием:
KOH + Na = NаOH + K
Гидроксиды рубидия и цезия восстанавливают металлическим кальцием в вакууме при нагревании:
RbOH + Ca = Rb + CaO CsOH + Ca = Cs + CaO
Хранят щелочные металлы в атмосфере инертного газа, под слоем сухого керосина или обезвоженного масла. Большие количества щелочных металлов хранят в герметичной железной таре (бочке).
Применение
Щелочные металлы используют в качестве восстановителей, в качестве жидких теплоносителей, например, в ядерных реакторах, в органическом синтезе. Литий применяется производстве сплавов в качестве легирующей добавки. Пары натрия используют для наполнения газоразрядных ламп уличного освещения, которые дают свет с оранжевым оттенком.
Соединения щелочных металлов
Гидриды
Гидриды щелочных металлов — соединения с ионным типом связи, сильные восстановители. Водой разлагаются с выделением водорода
2МеН + 2Н2О = 2МеОН + Н2
При нагревании в вакууме разлагаются:
2МеН = 2Ме + Н2
пр этом устойчивость гидридов уменьшается от лития к цезию. Рaсплавы гидридов проводят электрический ток.
Гидриды лития и натрия испльзуют для получения алюмогидридов, гидрид алюминия вводится в реакцию в виде эфирного раствора:
NaН + AlН3 = Na[AlH4]
Алюмогидриды лития и натрия используются в качестве восстановителей, напримеp, в органическом синтезе.
Карбиды
Карбиды щелочных металлов имеют состав Ме2С2 . Бесцветные кристаллические вещества. Обладают высокой химической активностью. При непосредственном взаимодействии простых веществ образуется толькр карбид лития, остальные — при взаимодействии металла и ацетилена.Водой разлагаются с выделением ацетилена:
Ме2С2 + 2Н2О = 2МеОН + С2Н2 Нитриды
Из нитридов щелочных металлов наиболее устойчив гидрид лития, который медленно образуется при взаимодействии с азотом уже при комнтной температуре и быстро — при 250oC. Водой нитрид лития разлагается с выделением аммиака:
Li3N + 3Н2О = 3LiОН + NН3
Нитриды остальных щелочных металлов получают при взаимодействии паров металла с азотом в тлеющем электрическом разряде.
При взаимодействии расплавленных щелочных металлов с аммиаком образуются амиды, например:
2Na + 2NН3 = 2NaNН2 + Н2
В жидком аммиаке щелочные металлы растворяются, образуя темно-синие, хорошо проводящие электрический ток растворы.
Оксиды, пероксиды, озониды
При сгорании при атмосферном давлении литий дает только оксид Li2O , натрий — пероксид Na2O2 , остальные — надпероксиды Ме2O4 или МеO2 . Оксид натрия можно получить только косвенным путем, например:
Na2O2 + 2Na = 2Na2O 2NaОН(твердый) + 2Na = 2Na2O + Н2 5NaN3 + 2NaNО3 = 3Na2O + 8N2
Оксиды щелочных металлов обладают высокой реакионной способностью, проявляют сильно выраженные основные свойства, энергично взаимодействуют с водой, образуя гидроксиды.
Пероксиды и надпероксиды — твердые вещеста, сильные окислители. При контакте с водой разлагаются:
Na2O2 + 2Н2О = 2NaOН + Н2O2 2NaO2 + 2Н2О = 2NaOН + Н2O2 + O2
Озониды натрия, калия, рубидия и цезия получают действием озона на твердые гидроксиды:
4МеOН + 4О3 = 4МеО3 + 2Н2О + O2
Озониды еще более сильные окислители, чем пероксиды и надпероксиды. Бурно реагируют с водой и разбавленной серной кислотой:
4МеO3 + 2Н2О = 4МеOН + 5O2 4КO3 + 2Н2SО4 = 2R2SО4 + 2Н2О + 5O2 Гидроксиды
Твердые, бесцветные, гигроскопические, хорошо растворимые в воде вещества. Растворение в воде сопровождаетсявыделением большого количества теплоты. В водном растворе почти полностью диссоциированы, сильные основания. Часто гидроксиды щелочных металлов называют едкими щелочами. Термически устойчивы до температур более 1000oC
Едкие щелочи жадно поглощают из воздуха водяные пары и углекислый газ, превращаясь в сиропообразную массу.Расплавы едких щелочей разрушают стекло и платину, поэтому щелочи плавят в железных тиглях.
Получают щелочи электролизом водных растворов хлоридов:
2NaСl + 2Н2О = 2NaOН + Н2 + Cl2
или обменными реациями карбоната металла и гидроксида кальция:
Rb2CO3 + Ca(OН)2 = 2RbOН + CaCO3
Наиболее широкое применение находит гидроксид натрия — для осушения газов, в органическом синтезе, в производстве искусственного волокна.
Соли щелочных и щелочноземельных
металлов. Препараты мышьяка, селена, фосфора
План.
-
Общая характеристика солей щелочных и щелочноземельных металлов.
-
Препараты натрия.
-
Препараты кальция.
-
Препараты калия.
-
Препараты магния.
-
Препараты мышьяка.
-
Препараты фосфора.
-
Препараты селена.
- — 1 —
-
Общая характеристика
солей щелочных и щелочноземельных - металлов
В жизнедеятельности
организмов, помимо органических
соединений, имеют большое значение
неорганические, в т. ч. соли щелочных и
щелочноземельных металлов.
Соли — это
соединения, получаемые при замещении
ионов водорода в кислотах на ионы
металлов или при замещении гидроксильных
ионов гидроокисных металлов на ионы
кислот.
Различают соли средние
(нейтральные) NaCl, кислые NaHCO3
и основные BiNO(OH)2.
В растворах они
диссоциируют на ионы и таким образом
проявляют разностороннее биологическое
действие, но строго специфичное для
каждой соли.
Соли изменяют
состояние протоплазмы клеток, их
проницаемость для воды и составных
частей протоплазмы, понижают или повышают
напряжение тканей, сохраняют
кислотно-основное равновесие и активность
биологических жидкостей организма.
В
зависимости от содержания ионов в
клетках и тканях изменяется характер
течения процессов обмена и возбуждения
в организме. Присутствие солей натрия,
калия, кальция и магния является
обязательным для живых клеток.
Они
способствуют сохранению здоровья,
обеспечивают прочность костей, имеют
большое значение в обмене веществ,
выполняют важные функции в химических,
а также и в ферментативных реакциях
организма.
Соли в недиссоциированном
состоянии влияют главным образом на
осмотическое напряжение тканей. Местно
это действие бывает разным в зависимости
от концентрации соли в растворе.
Изотонические растворы в связи с
одинаковым осмотическим напряжением
с тканями не влияют на последние.
Гипертонические растворы солей повышают
осмотическое давление в крови и
межтканевых жидкостях, в связи с чем
увеличивают проницаемость веществ в
окружающие ткани, последние теряют воду
и воспринимают соли, уменьшаются в
объеме, в них увеличивается концентрация
веществ и усиливается физиологическая
активность.
После в/в введения такие
растворы увеличивают лимфообразование,
усиливают функцию пищеварительных
желез, повышают кровяное давление,
сердечную деятельность, усиливают
дыхание.
-
С учетом главного
действия и применения соли щелочных и
щелочноземельных металлов можно
подразделить на три группы: -
1.Соли, имеющие
большое физиологическое значение; -
2.Слабительные
соли натрия и магния;
3. Мочегонные соли
натрия и калия.
— 2 — Препараты натрия
Метаболизм натрия
тесно связан с водным обменом и
кислотно-щелочным равновесием в
организме.
Ионы натрия
поддерживают водный баланс и распределение
воды в организме, они восстанавливают
нервно-мышечную возбудимость, обеспечивают
осмотическое давление, регулируют
кислотно-щелочное равновесие, участвуют
в поддержании коллоидного состояния
белков и их фракций, в образовании
ацетилхолина, в активации многих
ферментов и т. д.
- Натрия хлорид Natrii chloridum.
-
Получают из воды
морей, озер, а также из залежей каменной
соли. -
Бесцветные
кубические кристаллы или белый
кристаллический порошок соленого вкуса,
хорошо растворимый в воде. -
Местно натрия
хлорид действует раздражающе, и тем
сильнее, чем концентрированнее раствор. -
В пищеварительном
тракте в малых дозах действует как
слабый раздражитель, рефлекторно
усиливая секрецию слюнных, желудочных
и кишечных желез, способствует образованию
пепсина и выработке соляной кислоты,
незначительно усиливает перистальтику
и повышает всасывание питательных
веществ в кишечнике. -
Гипертонические
растворы натрия хлорида влияют
антисептически и противобродильно,
задерживают гниение. -
Резорбировавшийся
натрия хлорид участвует в минеральном
обмене веществ, поддерживает осмотическое
равновесие и активизирует обмен веществ. -
Гипертонический
раствор, введенный в/в, повышает
осмотическое давление крови, усиливает
лимфообразование, а также увеличивает
количество мочи, улучшает состояние
сердечно-сосудистой системы.
Применяют как
вкусовое средство и улучшающее
пищеварение. Как противовоспалительное
средство при хронических катарах
желудка; внутривенно 10 и 20 % растворы —
при атониях рубца у жвачных, при коликах
у лошадей.
-
В больших дозах —
как мочегонное (с большим количеством
воды) и как противоядие при отравлении
нитратом серебра, в виде изотонического
раствора п/к и в/в при интоксикациях. -
Натрия сульфат
(глауберова соль) Natrii sulfas. -
Плохо всасывается,
его действие основано только на изменении
осмотического напряжения и на раздражении
рецепторов чувствительных нервов.
Является активным
и малотоксичным слабительным средством.
Поступив в кишечник в форме раствора,
он удерживает воду в пищеварительном
канале. Общее количество массы в кишечнике
достигает больших размеров. Эта масса
давит на стенку тонкого отдела и тем
самым рефлекторно вызывает усиление
перистальтики.
-
В толстом отделе
эта масса ведет себя также, но здесь
давление на кишечную стенку рефлекторно
вызывает дефекацию, повторяющуюся до
тех пор, пока солевой раствор не будет
выведен с каловыми массами полностью. -
Слабительное
действие наступает уже при 4 % концентрации,
при увеличении ее до 6 % оно усиливается,
а при концентрации более 8 % развивается
резкая гиперемия, и значительно
увеличивается количество слизи. -
В концентрированном
виде гипертонические растворы оттягивают
жидкость из тканей, что способствует
очищению ран и скорейшему их заживлению.
В малых дозах
применяют для улучшения пищеварения;
как слабительное средство при спазмах
кишечника, при перекармливании, для
удаления из кишечника токсинов, ядов;
для обезвоживания организма и т. д.
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок.
Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида.
Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
- Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
- Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
- В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
- Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
- Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
- Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
- а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
- Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
- Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
- Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
- В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
- Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
- Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
- Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
- Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
- так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
- Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
- Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
- Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
- Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
- В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
- Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
- Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
- Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
- При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
- Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
- В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
- В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
- При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:






