- Химические свойства щелочных металлов
- 2. Реакция щелочных металлов с кислородом:
- 3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 4. Реакция щелочных металлов с кислотами
- 5. Взаимодействие щелочных металлов с аммиаком
- 6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
- 7. Качественная реакция на катионы щелочных металлов – окрашивание пламени в следующие цвета:
- Характерные химические свойства щелочных металлов
- 2. Реакция щелочных металлов с кислородом:
- 3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 4. Реакция щелочных металлов с кислотами
- 5. Взаимодействие щелочных металлов с аммиаком
- 6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
- 7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
- Получение щелочных металлов
- Особенности химических свойств s-элементов I группы и их физиологическое действие
- Щелочные металлы: общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 9 класс
- 2.2.1. Характерные химические свойства щелочных металлов
- Взаимодействие щелочных металлов с неметаллами
- с кислородом
- с галогенами
- с азотом
- с фосфором
- с водородом
- с серой
- с водой
- с галогенпроизводными углеводородов (реакция Вюрца):
- со спиртами и фенолами
- Щелочные металлы — семейство химических элементов
- Однозарядные катионы
- атомные и физические свойства щелочных металлов
- Взаимодействие с водой
- Взаимодействие с кислородом
- Таблица формула
- Взаимодействие с другими веществами
- Окраска пламени щелочными металлами и их соединениями
- Получение щелочных металлов
- Электролиз расплавов галогенидов
- Соединения щелочных металлов
- Гидроксиды
- Прежде щёлочь получали реакцией обмена:
- Соли
- Безопасность
Чтобы поделиться, нажимайте
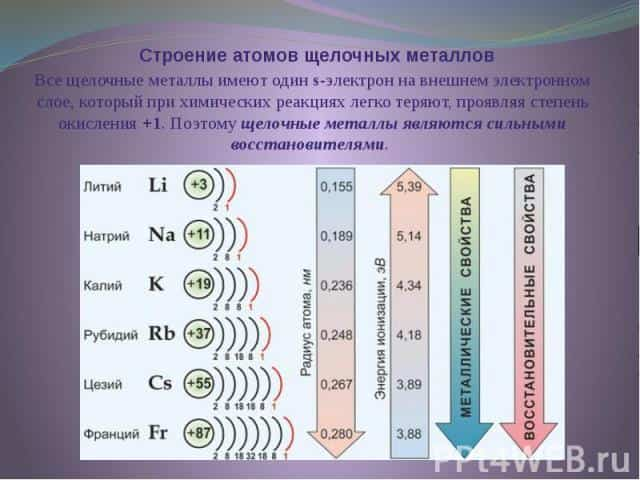
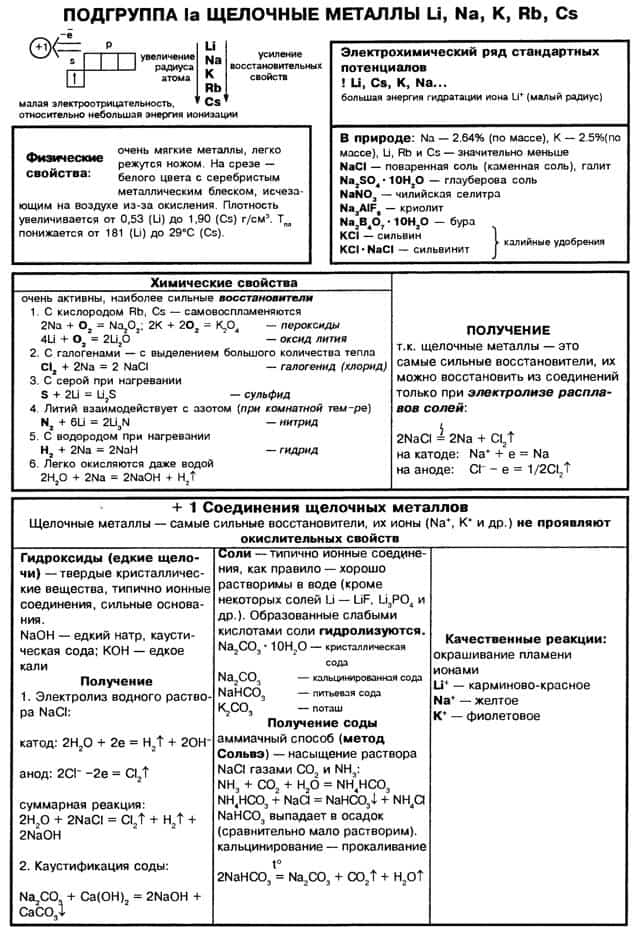
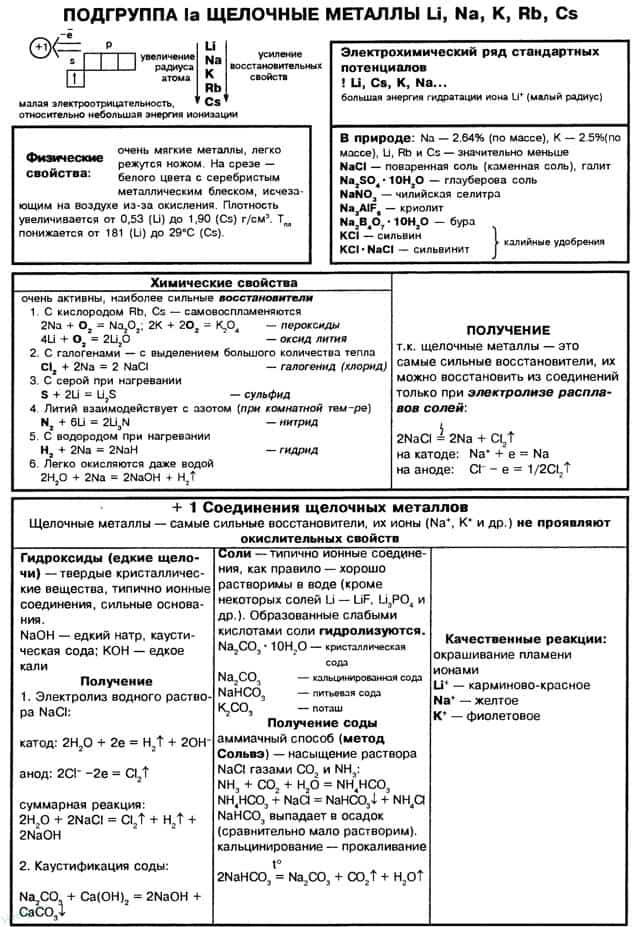
К щелочным металлам относятся литий, натрий, калий, рубидий, цезий и франций. В периодической системе они расположены в главной подгруппе I группы. Все щелочные металлы имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1.
Поэтому щелочные металлы являются сильными восстановителями. Радиусы их атомов возрастают от лития к францию. Электрон внешнего слоя с возрастанием радиуса атома находится все дальше от ядра, силы притяжения ослабевают и, следовательно, увеличивается способность к отдаче этого электрона, т. е. химическая активность.
В электрохимическом ряду напряжений металлов все щелочные металлы стоят левее водорода.
Это типичные металлы, в твердом состоянии хорошо проводят электрический ток. Они легкоплавки, быстро окисляются на воздухе, поэтому их хранят без доступа воздуха и влаги, чаще всего под керосином. Щелочные металлы образуют соединения с преимущественно ионной связью.
Оксиды щелочных металлов – твердые гигроскопичные вещества, легко взаимодействующие с водой. При этом образуются гидроксиды – твердые вещества, хорошо растворимые в воде. Соли щелочных металлов, как правило, тоже хорошо растворяются в воде.
Химические свойства щелочных металлов
2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH + H2
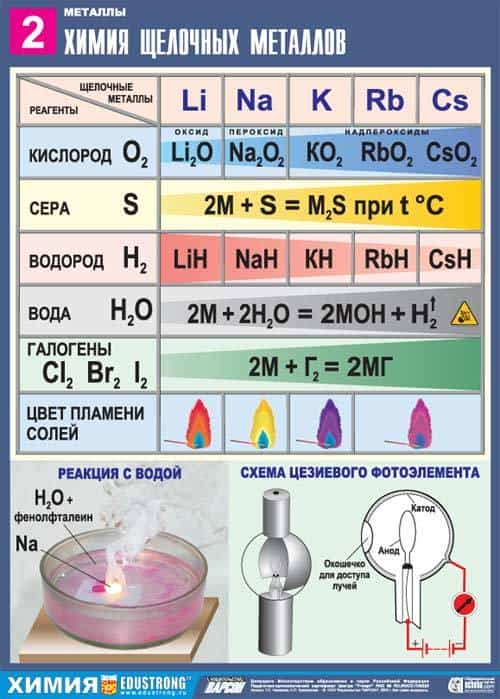
2. Реакция щелочных металлов с кислородом:
- 4Li + O2 → 2Li2O (оксид лития)
- 2Na + O2 → Na2O2 ( пероксид натрия)
- K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 2Li + Cl2 → 2LiCl (галогениды)
- 2Na + S → Na2S (сульфиды)
- 2Na + H2 → 2NaH (гидриды)
- 6Li + N2 → 2Li3N (нитриды)
- 2Li + 2C → Li2C2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
7. Качественная реакция на катионы щелочных металлов – окрашивание пламени в следующие цвета:
- Li+ – карминово-красный
- Na+ – желтый
- K+, Rb+ и Cs+ – фиолетовый
Характерные химические свойства щелочных металлов
- •Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
- •Все соединения щелочных металлов имеют ионный характер.
- •Практически все соли растворимы в воде.
- •Низкие температуры плавления,
- •Малые значения плотностей,
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги.
Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
-

- 2Na + 2H 2 O → 2NaOH + H 2
- 2Li + 2H 2 O → 2LiOH + H 2
2. Реакция щелочных металлов с кислородом:
- 4Li + O 2 → 2Li 2 O (оксид лития)
- 2Na + O 2 → Na 2 O 2 ( пероксид натрия)
- K + O 2 → KO 2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 2Li + Cl 2 → 2LiCl (галогениды)
- 2Na + S → Na 2 S (сульфиды)
- 2Na + H 2 → 2NaH (гидриды)
- 6Li + N 2 → 2Li 3 N (нитриды)
- 2Li + 2C → Li 2 C 2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H 2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH 3 = 2LiNH 2 + H 2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2 ;
2K + 2C 6 H 5 OH = 2C 6 H 5 OK + H 2 ;
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
- Li + – карминово-красный

- Na + – желтый
- K + , Rb + и Cs + – фиолетовый
Получение щелочных металлов
- Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl 2 В небольших масштабах используется также вакуум-термическое получение натрия и калия:
- 2NaCl+CaC 2 =2Na+CaCl 2 +2C; 4KCl+4CaO+Si=4K+2CaCl 2 +Ca 2 SiO 4 .
- Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).
-
Особенности химических свойств s-элементов I группы и их физиологическое действие
Электронная конфигурация атома лития 1s 2 2s 1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li + со стабильной конфигурацией инертного газа (гелия).
Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл.
От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li + сильно сольватирован; его окружают несколько десятков молекул воды.
Литий по величине энергии сольватации — присоединения молекул растворителя, стоит ближе к протону, чем к катионам щелочных металлов.
Малый размер иона Li + , высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е — , занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s 2 2s 2 2p 6 3s 1 . Единственная степень окисления натрия +1.
Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na + значительно больше, чем Li + , и сольватация его не так велика.
Однако в растворе в свободном виде он не существует.
Физиологическое значение ионов К + и Na + связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами.
Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К + , вследствие чего внутриклеточная концентрация К + значительно выше, чем ионов Na + . В то же время в плазме крови концентрация Na + превышает содержание в ней калия. С этим обстоятельством связывают возникновение мембранного потенциала клеток.
Ионы К + и Na + ‑ одни из основных компонентов жидкой фазы организма. Их соотношение с ионами Са 2+ строго определенно, а его нарушение приводит к патологии. Введение ионов Na+ в организм не оказывает заметного вредного влияния.
Повышение же содержания ионов К + вредно, но в обычных условиях рост его концентрации никогда не достигает опасных величин. Влияние ионов Rb + , Cs + , Li + еще недостаточно изучено.
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв.
Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте.
При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов.
В соединениях калия связь более ионная, а в виде иона К + он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39 К, 40 К, 41 К. Один из них 40 К ‑ радиоактивен и определенная доля радиоактивности минералов и почвы связана с присутствием этого изотопа.
Его период полураспада велик ‑ 1,32 млрд. лет. Определить присутствие калия в образце довольно легко: пары металла и его соединения окрашивают пламя в фиолетово-красный цвет. Спектр элемента довольно прост и доказывает наличие 1е — на 4s-орбитали.
Изучение его послужило одним из оснований для нахождения общих закономерностей в строении спектров.
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р.
Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей.
Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации.
Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (39 0 C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах.
Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно.
Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах.
В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li 3 N (до 75%) и Li 2 O. Остальные щелочные металлы образуют пероксиды (Na 2 O 2 ) и надпероксиды (K 2 O 4 или KO 2 ).
- Перечисленные вещества реагируют с водой:
- Li 3 N + 3 H 2 O = 3 LiOH + NH 3 ;
- Na 2 O 2 + 2 H 2 O = 2 NaOH + H 2 O 2 ;
- K 2 O 4 + 2 H 2 O = 2 KOH + H 2 O 2 + O 2 .
- Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
- Na 2 O 2 +CO 2 =Na 2 CO 3 +0,5O 2 ;
- K 2 O 4 + CO 2 = K 2 CO 3 + 1,5 O 2 .
- В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных. Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
- 2Li+H 2 =2LiH.
- Гидрид лития используется как сильный восстановитель.
- Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
- SiO 2 +2NaOH=Na 2 SiO 3 +H 2 O.
- Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 1300 0 С). Некоторые соединения натрия называют содами :
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na 2 CO 3 ; б) кристаллическая сода – кристаллогидрат карбоната натрия Na 2 CO 3 . 10H 2 O; в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO 3 ; г) гидроксид натрия NaOH называют каустической содой или каустиком.
Щелочные металлы: общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 9 класс
Щелочными металлами называются химические элементы-металлы (IA) группы Периодической системы Д. И. Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы (IA) характерна степень окисления (+1).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия (NaCl)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 (·) 10H2O,
- сильвин — хлорид калия (KCl),
- сильвинит — двойной хлорид калия-натрия (KCl) (·)(NaCl) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами (IA) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.

Рис. (1). Литий

Рис. (2). Натрий
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2H2O=2NaOH+H2↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности.
Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах.
Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
- В расплаве хлорида натрия присутствуют ионы:
- NaCl⇄Na++Cl−.
- При электролизе
- на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
- катод ((–)): 2Na++2e_=2Na,
- анод ((+)): 2Cl−−2e_=Cl2↑.
- Суммарное уравнение реакции при электролизе расплава хлорида натрия:
- 2NaCl→2Na+Cl2↑.
Источники:
Рис. 1. Литий © ЯКласс
Рис. 2. Натрий © ЯКласс
2.2.1. Характерные химические свойства щелочных металлов
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
- Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
- Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
- 4Li + O2 = 2Li2O
- Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
- 2Na + O2 = Na2O2,
- а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
- K + O2 = KO2
- Rb + O2 = RbO2
с галогенами
- Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
- 2Li + Br2 = 2LiBr бромид лития
- 2Na + I2 = 2NaI иодид натрия
- 2K + Cl2 = 2KCl хлорид калия
с азотом
- Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
- 6Li + N2 = 2Li3N нитрид лития
- 6K + N2 = 2K3N нитрид калия
с фосфором
- Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
- 3Na + P = Na3Р фосфид натрия
- 3K + P = K3Р фосфид калия
с водородом
- Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
- Н2 + 2K = 2KН-1 гидрид калия
- Н2 + 2Rb = 2RbН гидрид рубидия
с серой
- Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
- S + 2K = K2S сульфид калия
- S + 2Na = Na2S сульфид натрия
- Взаимодействие щелочных металлов со сложными веществами
с водой
- Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
- 2HOH + 2Na = 2NaOH + H2↑
- 2K + 2HOH = 2KOH + H2↑
- Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
- ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
- 2CH3OH + 2К = 2CH3OК + H2↑
- метилат калия
- 2C6H5OH + 2Na = 2C6H5ONa + H2
- фенолят натрия
Щелочные металлы — семейство химических элементов
Щелочные металлы — семейство химических элементов, элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы): литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr, унуненний Uue. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами.
- У щелочных металлов электронная конфигурация внешнего энергетического уровня : ns1, на внешнем энергетическом уровне находится 1 s-электрон.
- Типичная степень окисления щелочных металлов в соединениях +1.
- Располагаются сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1.
- Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
- Поэтому для всех щелочных металлов характерны восстановительные свойства.
- Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — самый низкий) и электроотрицательности (ЭО).
Однозарядные катионы
В большинстве соединений щелочные металлы присутствуют в виде однозарядных катионов.
Однако существуют и соединения, где щелочные металлы представлены анионами (см. Алкалиды).
атомные и физические свойства щелочных металлов
| 3 | Литий Li | 2 | 6,941(2) | 520,2 | 59,8 | 0,98 | 106,5 | 0,152 | 0,076 | 180,6 | 1342 | 0,534 | 2,93 | 148 | 162 |
| 11 | Натрий Na | 1 | 22,989768(6) | 495,8 | 52,9 | 0,99 | 73,6 | 0,186 | 0,102 | 97,8 | 883 | 0,968 | 2,64 | 99 | 108 |
| 19 | Калий К | 2+1 а | 39,0983(1) | 418,8 | 46,36 | 0,82 | 57,3 | 0,227 | 0,138 | 63,07 | 759 | 0,856 | 2,39 | 79 | 89,6 |
| 37 | Рубидий Rb | 1+1 а | 85,4687(3) | 403,0 | 46,88 | 0,82 | 45,6 | 0,248 | 0,152 | 39,5 | 688 | 1,532 | 2,20 | 76 | 82 |
| 55 | Цезий Cs | 1 | 132,90543(5) | 375,7 | 45,5 | 0,79 | 44,77 | 0,265 | 0,167 | 28,4 | 671 | 1,90 | 2,09 | 67 | 78,2 |
| 87 | Франций Fr | 2а | (223) | 380 | (44,0) | 0,7 | — | — | 0,180 | 20 | 690 | 1,87 | 2 | 65 | — |
| 119 | Унуненний Uue |
Радиоактивные изотопы: 40K, T1/2 = 1,277·109 лет; 87Rb, T1/2 = 4,75·1010 лет; 223Fr, T1/2 = 21,8 мин; 224Fr, T1/2 = 3,33 мин.
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Многие минералы содержат в своём составе щелочные металлы. Например, ортоклаз, или полевой шпат, состоит из алюмосиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl·KCl, карналлит KCl·MgCl2·6H2O, полигалит K2SO4·MgSO4·CaSO4·2H2O.
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li) их хранят под слоем керосина.
Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
Взаимодействие с водой
Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
{mathsf {2 Li+2 H_{2}Olongrightarrow 2 LiOH+ H_{2}uparrow ))
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
Взаимодействие с кислородом
- Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
- Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
{mathsf {4 Li+ O_{2}longrightarrow 2 Li_{2}O))
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
{mathsf {2 Na+ O_{2}longrightarrow Na_{2}O_{2))}
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
{mathsf {K+ O_{2}longrightarrow KO_{2))} - Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
- {mathsf {2 Na+2 NaOHlongrightarrow 2 Na_{2}O+ H_{2}uparrow ))
{mathsf {2 Na+ Na_{2}O_{2}longrightarrow 2 Na_{2}O))
{mathsf {3 K+ KO_{2}longrightarrow 2 K_{2}O))
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О2−
2 и надпероксид-ион O− - 2.
- Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой увеличивается в ряду от Li до Cs:
Таблица формула
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
- Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
- {mathsf {Li_{2}O+ H_{2}Olongrightarrow 2 LiOH))
{mathsf {K_{2}O+ SO_{3}longrightarrow K_{2}SO_{4))}
{mathsf {Na_{2}O+2 HNO_{3}longrightarrow 2 NaNO_{3}+ H_{2}O)) - Пероксиды и надпероксиды проявляют свойства сильных окислителей:
- {mathsf {Na_{2}O_{2}+2 NaI+2 H_{2}SO_{4}longrightarrow I_{2}+2 Na_{2}SO_{4}+2 H_{2}O))
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды: - {mathsf {Na_{2}O_{2}+2 H_{2}Olongrightarrow 2 NaOH+ H_{2}O_{2))}
{mathsf {2 KO_{2}+2 H_{2}Olongrightarrow 2 KOH+ H_{2}O_{2}+ O_{2}uparrow ))
Взаимодействие с другими веществами
Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
{mathsf {2 Na+ H_{2}longrightarrow 2 NaH))
{mathsf {2 Na+ Cl_{2}longrightarrow 2 NaCl))
{mathsf {2 K+ Slongrightarrow K_{2}S))
{mathsf {6 Li+ N_{2}longrightarrow 2 Li_{3}N))
{mathsf {2 Li+2 Clongrightarrow Li_{2}C_{2))}
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) щелочные металлы реагируют с кислотами.
- Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
- {mathsf {2 Na+2 NH_{3}longrightarrow 2 NaNH_{2}+ H_{2}uparrow ))
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака: - {mathsf {KNH_{2}+ H_{2}Olongrightarrow KOH+ NH_{3}uparrow ))
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей): - {mathsf {2 Na+2 CH_{3}CH_{2}OHlongrightarrow 2 CH_{3}CH_{2}ONa+ H_{2}uparrow ))
{mathsf {2 Na+2 CH_{3}COOHlongrightarrow 2 CH_{3}COONa+ H_{2}uparrow ))
Качественное определение щелочных металлов - Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
Окраска пламени щелочными металлами и их соединениями
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Буро-красный |
| Cs | Фиолетово-красный |
Получение щелочных металлов
Электролиз расплавов галогенидов
- Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
- {mathsf {2 LiCllongrightarrow 2 Li+ Cl_{2}uparrow ))
катод: {displaystyle {mathsf {Li^{+))}+elongrightarrow {mathsf {Li))}
анод: {displaystyle {mathsf {2Cl^{-))}-2elongrightarrow {mathsf {Cl_{2))}uparrow }
Электролиз расплавов гидроксидов - Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
- {mathsf {4 NaOHlongrightarrow 4 Na+2 H_{2}O+ O_{2}uparrow ))
катод: {displaystyle {mathsf {Na^{+))}+elongrightarrow {mathsf {Na))}
анод: {displaystyle {mathsf {4OH^{-))}-4elongrightarrow {mathsf {2H_{2}O+O_{2))}uparrow }
Восстановление из галогенидов - Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600—900 °C:
{mathsf {2 MCl+ Calongrightarrow 2 Muparrow + CaCl_{2))}
Чтобы реакция пошла в нужную сторону, образующийся свободный щелочной металл (M) должен удаляться путём отгонки. Аналогично возможно восстановление цирконием из хромата. Известен способ получения натрия восстановлением из карбоната углём при 1000 °C в присутствии известняка.
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из водных растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов
Гидроксиды
- Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
- {mathsf {2 NaCl+2 H_{2}Olongrightarrow H_{2}uparrow + Cl_{2}uparrow +2 NaOH))
катод: {displaystyle 2 {mathsf {H^{+))}+2 elongrightarrow {mathsf {H_{2))}uparrow } - анод: {displaystyle 2 {mathsf {Cl^{-))}-2 elongrightarrow {mathsf {Cl_{2))}uparrow }
Прежде щёлочь получали реакцией обмена:
- {mathsf {Na_{2}CO_{3}+ Ca(OH)_{2}longrightarrow CaCO_{3}downarrow +2 NaOH))
Получаемая таким способом щёлочь была сильно загрязнена содой Na2CO3. - Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями.
Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
- {mathsf {2 LiOH+ H_{2}SO_{4}longrightarrow Li_{2}SO_{4}+2 H_{2}O))
{mathsf {2 KOH+ CO_{2}longrightarrow K_{2}CO_{3}+ H_{2}O)) - {mathsf {KOH+ Al(OH)_{3}longrightarrow K[Al(OH)_{4}]))
- Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду:
- {mathsf {2 LiOHlongrightarrow Li_{2}O+ H_{2}O))
Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола.
Соли
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века.
Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26—30 °C.
При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:
- {mathsf {NaCl+ NH_{3}+ CO_{2}+ H_{2}Olongrightarrow NaHCO_{3}downarrow + NH_{4}Cl))
Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO3−, необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону: - {mathsf {2 NH_{4}Cl+ Ca(OH)_{2}longrightarrow 2 NH_{3}uparrow + CaCl_{2}+2 H_{2}O))
Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение. - При прокаливании гидрокарбоната натрия получается кальцинированная, или стиральная, сода Na2CO3 и диоксид углерода, используемый в процессе получения гидрокарбоната натрия:
- {mathsf {2 NaHCO_{3}longrightarrow Na_{2}CO_{3}+ CO_{2}uparrow + H_{2}O))
Основной потребитель соды — стекольная промышленность. - В отличие от малорастворимой кислой соли NaHCO3, гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ, K2CO3 получают действием углекислого газа на раствор гидроксида калия:
- {mathsf {2 KOH+ CO_{2}longrightarrow K_{2}CO_{3}+ H_{2}O))
Поташ используют в производстве стекла и жидкого мыла.
Литий — единственный щелочной металл, для которого не получен гидрокарбонат. Причина этого явления в очень маленьком радиусе иона лития, который не позволяет ему удерживать довольно крупный ион HCO−
3.
Безопасность
Все щелочные металлы проявляют высокую активность при взаимодействии с водой, кислородом, галогенами и другими соединениями.
Особенно опасны взаимодействия с водой, так как продуктами реакций являются едкие щёлочи, а также происходит огромное выделение энергии, сопровождаемое огненной вспышкой (в случае с калием) или взрывом (в случае с рубидием или цезием).
Поэтому необходимо соблюдать правила безопасности при работе с ними. Работа должна проводиться исключительно в перчатках из латекса, также необходимо надевать защитные очки.
В экспериментах используют только небольшие количества, манипуляции с которыми производят при помощи щипцов; в случае непрореагировавших остатков щелочных металлов (например, натрия или калия), применяют утилизацию в обезвоженном спирте. Рубидий и цезий ввиду чрезвычайно высокой химической активности (взрывоопасные) практически не применяют в опытах.
|
||
|
||
|
||
|
||
|
Не копируй — поделись ссылкой:






