- Кремниевая (силиконовая) долина
- Основное и возбужденное состояние кремния
- Природные соединения
- Получение
- Химические свойства
- Оксид кремния IV — SiO2
- Кремниевая кислота
- Кремниевая кислота — формула, физические и химические свойства
- Особенности силикатов
- Физические и химические свойства
- Способы получения
- Применение в различных отраслях
- Особенности получения и применения кремниевой кислоты
- Химические и физические свойства
- Влияние на организм человека: польза и вред
- Кремний и его соединения
- Способы получения кремния
- Физические свойства кремния. Аллотропные модификации кремния
- Химические свойства кремния
- Силан (моносилан) SiH4
- Оксид кремния (IV) (кремнезем) SiO2
- Физические свойства
- Химические свойства
- Кремниевые кислоты
- Способы по-лучения
- Химические свойства
- Силикаты — соли кремниевых кислот
- Стекло
- Цемент
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.

Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь ?

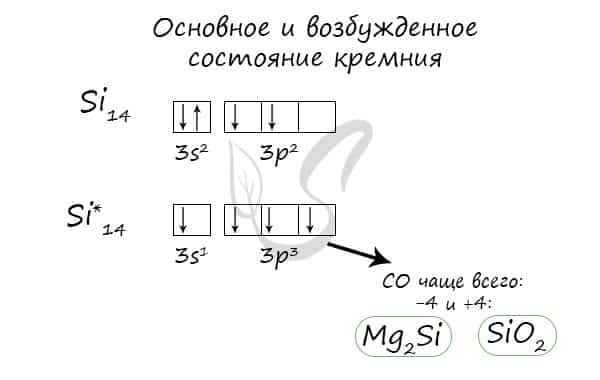
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe3+ — цитрин
- SiO2 с примесью Fe2+ и Fe3+ — аметист

Получение
- В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
- SiO2 + C → (t) Si + CO2↑
- SiO2 + Al → (t) Si+ Al2O3
- В лабораторных условиях мелкий белый песок прокаливают с магнием:
- SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
- Si + Cl2 → (t) SiCl4
- Si + C → (t) SiC
- Si + O2 → (t) SiO2
- Si + O2 → (t = 1200 °C) SiO
- Реакции с металлами
- Реакция с щелочами
При обычных условиях без нагревания кремний реагирует только со фтором. Si + F2 → SiF4 При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.

В подобных реакциях кремния проявляет свои окислительные способности. Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи. KOH + Si → K2SiO3 + H2↑
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
- Получение
- В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
- Si + O2 → SiO2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
Na2SiO3 + CH3COOH → CH3COONa + H2SiO3↓
H2SiO3 → SiO2 + H2O

Химические свойства
- Реакции с кислотами
- Реакции с основными оксидами и щелочами
- С карбонатами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью). SiO2 + HF → SiF4 + H2O
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты. MgO + SiO2 → MgSiO3 NaOH + SiO2 → Na2SiO3 + H2O 
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами. K2CO3 + SiO2 → K2SiO3 + CO2↑
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
- LiOH + SiO2 → Li2SiO3 + H2O
- Li2SiO3 + HCl → LiCl + H2SiO3↓
- Химические свойства
- Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
- H2SiO3 → H2O + SiO2

Кремниевая кислота — формула, физические и химические свойства

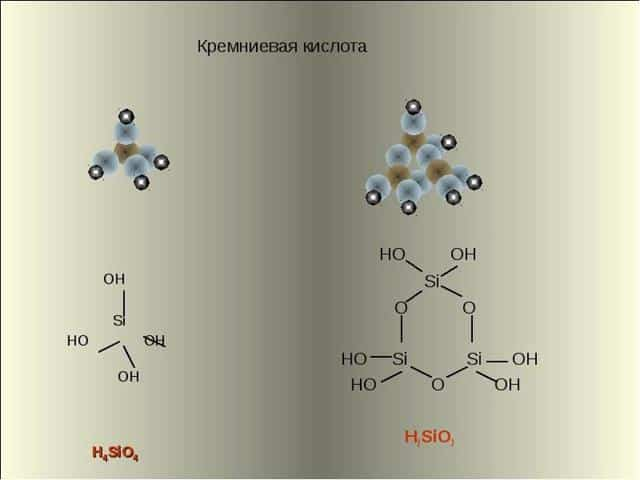
Основная формула кремниевой кислоты — H2SiO3 (так как кислота не имеет постоянного состава, её обозначение иногда принимает вид nSiO2 • mH2O, что соответствует поликремниевым видам). Номенклатура кислоты включает в себя и её подвиды. Условное обозначение их химического состава выглядит следующим образом:
- Ортокремниевая — H4SiO4. Наряду с метакремниевой кислотой, чья формула считается основной, ортокремниевая является наиболее распространённым химическим соединением кислот этого вида.
- Дикремниевая — H2Si2O5, H6Si2O7 и H10Si2O9 (показатель растворимости в воде при t = 20 градусов по цельсию составляет 2,9310 в минус 4 степени моль/л).
- Пирокремниевая — H6Si2O7.
Соли кремниевых кислот обозначаются как силикаты. Поликремниевые кислоты состоят из структурных звеньев, соединяющихся в сложные линейные и разветвлённые цепи. Несмотря на различие в формулах и отдельных характеристиках кремниевой кислоты, все виды этих химических соединений имеют тетраэдрическое строение.
Особенности силикатов
В природе широко распространены (в частности, к ним относятся полевые шпаты, асбест, тальк, слюда и различные виды глины). Соли кремниевой кислоты в большинстве своём плохо растворимы в воде (исключения составляют силикаты калия и натрия).
Получение солей происходит при сплавлении едких щёлочей или карбонатами натрия и калия с диоксидом кремния. В остатке выходит диоксид углерода с высокой массовой долей вещества или вода.
Примерами таких уравнений могут послужить следующие реакции:
- SiO2 + K2CO3 = K2SiO3 + CO2 (образование углекислого газа).
- SiO2 + 2NaOH = Na2SiO3 + H2O.
- SiO2 + Na2CO3 = Na2SiO3 + CO2.
К свойствам солей относится высокая температура плавления: в среднем — от 1000 до 1300 градусов по Цельсию (такая разновидность силикатов, как каолинит, плавится при t = 1800 и выше). Твёрдость этих веществ по шкале Мооса составляет 6−8 баллов, что является высоким показателем.
Несмотря на то что силикаты не реагируют на отдельные соединения и в целом относятся к классу химически пассивных веществ, они способны взаимодействовать со слабыми кислотами и растворимыми солями. Формула гидролиза представляет собой уравнение: Na2SiO3 + H2O = NaHSiO3 + NaOH. Расплавленные силикаты имеют высокие электролитические свойства.
Ещё одной особенностью солей кремниевых соединений является их возможность замещать атомы кремния на атомы алюминия, образуя при этом алюмосиликаты. Они также нерастворимы в воде и обладают абсорбционными, ионообменными, диэлектрическими и термостойкими свойствами.
Физические и химические свойства

Неорганическая кислота образуется при действии сильных кислот на растворимые силикаты. Вещество представляет собой белый аморфный и стекловидный полимер, имеющий цепочечную структуру. Не вступает в реакцию с другими кислотами и не гидратом аммиака. Так как все поликремниевые соединения относятся к малорастворимым веществам, они образуют коллоидные растворы при реакции с водой. Молярная масса вещества равна 78 а. е. м. (H2SiO3 — 2 атома водорода = 1 • 2, 1 атом кремния = 28 и 3 атома кислорода = 16 • 3).
Кислотные свойства выражены очень слабо (у молекулы вещества степень окисления кремния равна +4), вещество не имеет кислого вкуса или запаха, а также не изменяет окраску индикатора.
Согласно таблице сильных и слабых кислот, кремниевая занимает последнюю строчку).
Константа диссоциации для метакремниевых соединений составляет K1 = 1,3•10 -10, K2 = 1,6•10 -12, а для ортокремниевой K1 = 2•10 -10, K2 = K3 = K4 = 2•10 -12 .
Вследствие своей неустойчивости химическое вещество при нагревании либо длительном хранении разлагается на оксид кремния и воду (реакция термического разложения H2SiO3 = H2O + SiO2).
Каждый атом кремния в кристаллах (SiO2) окружён 4 атомами кислорода, которые, будучи связаны друг с другом, образуют кристаллическую трёхмерную решётку, что обусловливает твёрдость вещества.
Некоторые другие химические свойства кремниевых кислот можно проиллюстрировать следующими уравнениями:

- H2SiO3 + 4KOH = K2SiO3 + 4H2O (растворение студенистого кислотного остатка и образование средней соли метасиликата калия и воды).
- 2H4SiO4 = (HO)3SiOSi (OH)3 + H2O (эта реакция называется поликонденсацией).
- Пример взаимодействия с плавиковой кислотой и образованием газообразного фторида кремния: H2SiO3 + 6HF = H2SiF6 + 3H2O = SiF4 (образование газа) + 2HF (фтороводород) + 3H2O.
- CaCl2 + Na2SiO3 = 2NaCl + CaSiO3 (химическая реакция двух солей с выпадением осадка).
В присутствии щёлочных катализаторов — к примеру, NaOH — ортокремниевая кислота может образовывать эфиры-ортосиликаты. В большинстве своём они имеют вид R1R2R3R4SiO3, где R1−4 являются органическими радикалами. Примером такого эфира является распространённый тетраэтилортосиликат с формулой Si (C2H5O)4.
Способы получения
Основной способ получения кремниевой кислоты — косвенным путём, воздействуя сильной кислотой на силикат калия или натрия (Na2SiO3 + 2HCl = H2SiO3 + 2NaCl). При этом невозможно получить кислоту в чистом виде — в водном растворе образуется золь, который через малый промежуток времени превращается в гель.
Кремниевые соединения также можно получить посредством гидролиза хлорсиланов (SiH2Cl2 + 3H2O = H2SiO3 +2HCl + 2H2); конечным продуктом гидролитического расщепления является H2SiO3.
Наконец, для промышленных масштабов, а также для лабораторных экспериментов и отдельных опытов по химии могут использоваться методы электродиализа и ионного обмена.
Большое внимание уделяется и получению силикагеля — другое название вещества, образовывающегося от перенасыщенных растворов кремниевых кислот. Технология производства включает в себя несколько стадий:

- Возникновение золя и его застудневание в однородную массу (гидрогель).
- Созревание (последующее гелеобразование и разжижение вещества).
- Очищение и промывка геля от солей.
- Высушивание и превращение вещества в ксерогель.
Опытным путём доказано, что наиболее чистый силикагель получается при гидролизе соединений кремния (SiCl4), а также ортокремниевых соединений. Химическая формула получения геля выглядит так: Na2SiO3 + H2SO4 = nSiO2 • mH2O + Na2SO4, где nSiO2 • mH2O — гидратированный аморфный кремнезём.
Применение в различных отраслях

Благодаря пористой структуре силикагеля его часто применяют в качестве абсорбента для поглощения вредных газов и смесей. Для общественности известны медицинские высокопористые гели, эффективные при различного рода отравлениях и недомоганиях. Помимо этого, вещество используется и для создания технических фильтрационных систем.
Кремниевые соединения являются важным строительным элементом для кожи, волос и ногтей, поэтому эти вещества широко используются для производства косметики и лекарственных препаратов. Препараты на основе кремния обеспечивают гибкость соединительных тканей внутренних органов (в частности, кишечника и желудка) и улучшают усвоение кальция, что способствует восстановлению костной ткани.
В нефтяной промышленности гели на основе кремнийсодержащих веществ используются для очистки углеводородов от смол, а в ядерной отрасли при помощи силикагеля производится не только очистка сточных вод, но и разделение изотопов радиоактивных веществ.

Любопытно, что вещества на основе кремниевых соединений находят массу применений в повседневной жизни.
К примеру, процесс сушки обуви займёт куда меньше времени, если в промокшие ботинки положить пакетик с соответствующим абсорбентом. Силикагель позволит избавиться от неприятных запахов в помещении или в сумке с вещами.
Столовое серебро можно спасти от почернения, положив в шкаф с ценными приборам гелевые шарики на основе силикагеля.
Если необходимо продлить срок службы бритвенных лезвий, то для спасения от ржавчины нужно положить к ним несколько гранул с силикагелем.
Это же относится и к хранению старых фотографий, а также других вещей, которые со временем могут потускнеть или изменить свой внешний вид под воздействием окружающей среды.
Автолюбителям могут уменьшить запотевание ветрового стекла, всего лишь положив на приборную панель цветы или пакетик с силикагелем.
Особенности получения и применения кремниевой кислоты
Конечный продукт получения кремниевой кислоты представляет собой студенистую массу, которая содержит воду, или коллоидный раствор (золь). Кислота в процессе нагревания достаточно легко распадается на оксид кремния (IV) и воду, как и угольная. Данный процесс протекает очень быстро.
H2SiO3 SiO2 + H2O
Источник: chemiday.com
Источник: chemege.ru
Формула 1
При анализе данной формулы можно заключить, что молекула кремниевой кислоты состоит из:
- двух атомов водорода (Ar = 1 а.е.м.);
- одного атома кремния (Ar = 28 а.е.м);
- трех атомов кислорода (Ar = 16 а.е.м.).
Исходя из химической формулы соединения, рассчитывают характеристику молекулярной массы кремниевой кислоты:
- Mr(H2SiO3)=2×Ar(H)+Ar(Si)+3×Ar(O);
- Mr(H2SiO3)=2×1+28+3×16=2+28+48=78.
Молярная масса кремниевой кислоты составляет 78 г/моль.
Формула 2Формула 3
Из-за склонности к полимеризации известен целый ряд кремниевых кислот. Состав веществ можно описать общей формулой nSiO2•mH2O. Все кремниевые кислоты являются очень слабыми. Соединения малорастворимы в воде, образуют коллоидные растворы.
Кремниевая кислота включает в состав тетраэдрические структурные звенья (в каждом таком звене атом кремния расположен в центральной точке тетраэдра, а в вершинах находятся атомы кислорода). При объединении в цепочки структурные звенья формируют поликремниевые кислоты с более высокой степенью устойчивости:
Источник: ru.solverbook.com
Классификация кремниевых кислот:
- метакремниевая H2SiO3;
- ортокремниевая H4SiO4;
- дикремниевые H2Si2O5 и H10Si2O3;
- пирокремниевая H6Si2O7;
- поликремниевые nSiO2•mH2O.
Примечание
Химические и физические свойства
Свойства 1Реакция 1
Конечным результатом являются сложные линейные, разветвленные и смешанные структуры.
Свойства 2Свойства 3Свойства 4Свойства 5Свойства 6Реакция 2Реакция 3
Гидрозоли кремниевых кислот используют в качестве наполнителей и связующих веществ в производстве изделий из керамики и разнообразных покрытий. Данные материалы играют роль носителей катализаторов и светочувствительных слоев в фотоматериалах. Их используют, как сырье в производстве следующих видов продукции:
- кварцевое стекло;
- разные адсорбенты;
- поглотители паров воды и газов;
- фильтры очистки воды и масел.
Влияние на организм человека: польза и вред
Кремниевая кислота является неорганическим соединением, которое имеет большое значение в осуществлении метаболических процессов организма:
- участие в усвоении витаминов и минералов;
- нейтрализация тяжелых металлов и токсинов;
- поддержание нормального функционирования сердца;
- влияние на синтез коллагена, то есть белка, являющегося основой для соединительной ткани.
Кремниевая кислота играет важную роль в метаболизме. Организм человека во взрослом возрасте содержит до 1-2 грамм кремния. Самой высокой концентрацией элемента обладают:
- соединительная ткань;
- кровь;
- кости;
- кожа;
- мышцы.
По мере старения организма содержание кремния может снижаться на фоне атеросклероза и опухолевых заболеваний. Данный процесс оказывает негативное влияние на состояние всех внутренних органов и систем.
Польза кремниевой кислоты для организма человека заключается в следующем:
- Соединение взаимодействует с более чем 70 минеральными солями и витаминами, улучшает процесс усвоения кальция, увеличивает скорость минерализации костей и зубов, оказывает укрепляющее действие на соединительную ткань суставов, связок и сухожилий.
- Кремневая кислота обеспечивает работоспособность сердечно-сосудистой системы. Соединение укрепляет внутреннюю оболочку ткани, из которой состоят артерии, снижает уровень вредного холестерина в крови, уменьшает вероятность закупорки сосудов и предотвращает атеросклеротические поражения в сосудах.
- Стимулирует ряд процессов, протекающих в пищеварительной системе. Кремнийорганические вещества восстанавливают и поддерживают слизистые оболочки органов желудочно-кишечного тракта, обладают оздоровительным эффектом, позволяет исключить распространенные расстройства желудка и пищеварительной системы.
- Кремниевая кислота способна восстанавливать строение слабых истонченных волос, устранять ломкость и расслаивание ногтевых пластин, поддерживать нормальный уровень влаги в кожных покровах. Соединение стимулирует выработку коллагена, укрепляет и разглаживает кожу, ускоряет регенерацию тканей.
- Кремниевая кислота необходима для выведения из организма алюминия, излишки которого являются одной из причин развития болезни Альцгеймера. Соединение удаляет токсины, соли тяжелых металлов и вредные продукты метаболизма.
- Кремниевая кислота улучшает когнитивные функции и физическую работоспособность. Согласно одной из гипотетических теорий, данный процесс обеспечивает способность соединения уменьшать содержание алюминия в организме.
Кремниевую кислоту содержат многие растительные продукты. Самой высокой концентрацией вещества обладают культурные растения с повышенным содержанием клетчатки:
- овес;
- рис;
- ячневая крупа;
- пшеница;
- гречка;
- фасоль;
- кукуруза;
- фисташки;
- бананы;
- топинамбур;
- изюм.
Рацион питания, в котором присутствуют богатые кремнием продукты, восполняет баланс кремниевой кислоты частично. С пищей человек потребляет примерно 1 мг вещества. Норма потребления вещества составляет 5-10 мг ежедневно.
Кремниевая кислота является безопасной биологической добавкой. В том случае, когда человек рационально употребляет ее в пищу, наблюдается положительный эффект. При длительном приеме вещества в больших дозах развиваются следующие осложнения:
- образование камней в почках;
- развитие ревматоидного артрита;
- возникновение аутоиммунных заболеваний.
Медицинские препараты, содержащие кремний, не рекомендованы к употреблению людям, которые страдают диабетом. Причиной такого ограничения являются риски падения уровня сахара в крови.
Кремниевая кислота способна усиливать реакции определенных лекарственных средств, в том числе, диуретиков, БАДов хрома.
В связи с этим, перед приемом добавок необходимо проконсультироваться с лечащим специалистом.
Кремний и его соединения
Кремний 14Si является аналогом углерода, находится в главной подгруппе IV группы, в 3-м периоде. Как и углерод, кремний является неметаллом и проявляет в своих соединениях и положительные и отрицательные степени окисления, наиболее характерными из которых являются +4 и -4.
14Si 1s22s22p63s23p2
Аr = 28,0855
Изотопы: 28Si (92.27 %); 29Si (4.68 %); 30Si (3,05 %)
ЭО = 1,8
Кремний — второй после кислорода по распространенности в земной коре элемент (27,6 % по массе). В свободном состоянии в природе не встречается, находится преимущественно в виде SiO2 или силикатов.
Соединения Si токсичны; вдыхание мельчайших частиц SiO2 и др. соединений кремния (например, асбеста) вызывает опасную болезнь — силикоз
В основном состоянии атом кремния имеет валентность = II, а в возбужденом состоянии = IV.
Наиболее устойчивой степенью окисления Si является +4. В соединениях с металлами (силицидах) С.О. -4.
Способы получения кремния
Самым распространенным природным соединением кремния является кремнезем (диоксид кремния) SiО2. Он является основным сырьем для получения кремния.
- 1) Восстановление SiO2 углеродом в дуговых печах при 1800'С: SiO2 + 2С = Si + 2СО
- 2) Высокочистый Si из технического продукта получают согласно схеме:
- a) Si → SiCl2 → Si
- б) Si → Mg2Si → SiH4 → Si
Физические свойства кремния. Аллотропные модификации кремния
1) Кристаллический кремний — вещество серебристо — серого цвета с металлическим блеском, кристаллическая решетка типа алмаза; т. пл. 1415'С, т. кип. 3249'С, плотность 2,33 г/см3; является полупроводником.
2) Аморфный кремний — порошок бурого цвета.
Химические свойства кремния
- При низких температурах кремний химически инертен, при нагревании его реакционная способность резко возрастает.
- 1. С кислородом взаимодействует при Т выше 400°С:
- Si + О2 = SiO2 оксид кремния
- 2.
С фтором реагирует уже при комнатной температуре:
- Si + 2F2 = SiF4 тетрафторид кремня
- 3. С остальными галогенами реакции идут при температуре = 300 — 500°С
- Si + 2Hal2 = SiHal4
- 4.
С парами серы при 600°С образует дисульфид:
- Si + 2S = SiS2
- 5. Реакция с азотом происходит выше 1000°С:
- 3Si + 2N2 = Si3N4 нитрид кремния
- 6.
При температуре = 1150°С реагирует с углеродом:
- SiO2 + 3С = SiС + 2СО
- По твердости карборунд близок к алмазу.
7. С водородом кремний непосредственно не реагирует.
8. Кремний стоек к действию кислот. Взаимодействует только со смесью азотной и фтороводородной (плавиковой) кислот:
- 3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O
- 9. реагирует с растворами щелочей с образованием силикатов и выделением водорода:
- Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
- 10. Восстановительные свойства кремния используют для выделения металлов из их оксидов:
- 2MgO = Si = 2Mg + SiO2
- Кремний образует силициды с s-металлами и большинством d-металлов.
Состав силицидов данного металла может быть различен. (Например, FeSi и FeSi2; Ni2Si и NiSi2.) Один из наиболее известных силицидов — силицид магния, который можно получать прямым взаимодействием простых веществ:
2Mg + Si = Mg2Si
Силан (моносилан) SiH4
Силаны (кремневодороды) SinH2n + 2, (ср. с алканами), где п = 1-8. Силаны — аналоги алканов, отличаются от них неустойчивостью цепей -Si-Si-.
- Моносилан SiH4 — бесцветный газ с неприятным запахом; растворяется в этаноле, бензине.
- Способы получения:
- 1. Разложение силицида магния соляной кислотой: Mg2Si + 4HCI = 2MgCI2 + SiH4
- 2. Восстановление галогенидов Si алюмогидридом лития:
SiCl4 + LiAlH4 = SiH4↑ + LiCl + AlCl3 - Химические свойства.
- Силан — сильный восстановитель.
- 1.SiH4 окисляется кислородом даже при очень низких температурах:
- SiH4 + 2O2 = SiO2 + 2Н2О
- 2. SiH4 легко гидролизуется, особенно в щелочной среде:
- SiH4 + 2Н2О = SiO2 + 4Н2
- SiH4 + 2NaOH + Н2О = Na2SiO3 + 4Н2
Оксид кремния (IV) (кремнезем) SiO2
Кремнезем существует в виде различных форм: кристаллической, аморфной и стеклообразной. Наиболее распространенной кристаллической формой является кварц. При разрушении кварцевых горных пород образуются кварцевые пески. Монокристаллы кварца — прозрачны, бесцветны (горный хрусталь) или окрашены примесями в различные цвета (аметист, агат, яшма и др.).
Аморфный SiO2 встречается в виде минерала опала: искусственно получают силикагель, состоящий из коллоидных частиц SiO2 и являющийся очень хорошим адсорбентом. Стеклообразный SiO2 известен как кварцевое стекло.
Физические свойства
В воде SiO2 растворяется очень незначительно, в органических растворителях также практически не растворяется. Кремнезем является диэлектриком.
Химические свойства
- 1. SiO2 — кислотный оксид, поэтому аморфный кремнезем медленно растворяется в водных растворах щелочей:
- SiO2 + 2NaOH = Na2SiO3 + Н2О
- 2. SiO2 взаимодействует также при нагревании с основными оксидами:
- SiO2 + К2О = K2SiO3;
- SiO2 + СаО = CaSiO3
- 3. Будучи нелетучим оксидом, SiO2 вытесняет углекислый газ из Na2CO3 (при сплавлении):
- SiO2 + Na2CO3 = Na2SiO3 + CO2↑
- 4. Кремнезем реагирует с фтороводородной кислотой, образуя кремнефтористоводородную кислоту H2SiF6:
- SiO2 + 6HF = H2SiF6 + 2Н2О
- 5. При 250 — 400°С SiO2 взаимодействует с газообразным HF и F2, образуя тетрафторсилан (тетрафторид кремния):
- SiO2 + 4HF (газ.) = SiF4 + 2Н2О
- SiO2 + 2F2 = SiF4 + O2
Кремниевые кислоты
- Известны:
- — ортокремниевая кислота H4SiО4;
- — метакремниевая (кремниевая) кислота H2SiO3;
- — ди- и поликремниевые кислоты.
- Все кремниевые кислоты малорастворимы в воде, легко образуют коллоидные растворы.
Способы по-лучения
- 1. Осаждение кислотами из растворов силикатов щелочных металлов:
- Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
- 2. Гидролиз хлорсиланов: SiCl4 + 4Н2О = H4SiO4 + 4HCl
Химические свойства
- Кремниевые кислоты — очень слабые кислоты (слабее угольной кислоты).
- При нагревании они дегидратируются с образованием в качестве конечного продукта кремнезема
- H4SiО4 → H2SiO3 → SiO2
Силикаты — соли кремниевых кислот
- Поскольку кремниевые кислоты чрезвычайно слабые, их соли в водных растворах сильно гидро лизованы:
- Na2SiO3 + Н2О = NaHSiO3 + NaOH
- SiO32- + Н2О = HSiO3- + ОН- (щелочная среда)
- По этой же причине при пропускании углекислого газа через растворы силикатов происходит вытеснение из них кремниевой кислоты:
- K2SiO3 + СO2 + Н2О = H2SiO3↓ + K2СO3
- SiO3 + СO2 + Н2О = H2SiO3↓ + СO3
- Данную реакцию можно рассматривать как качественную реакцию на силикат-ионы.
- Среди силикатов хорошо растворимыми являются только Na2SiO3 и K2SiO3, которые называются растворимым стеклом, а их водные растворы — жидким стеклом.
Стекло
Обычное оконное стекло имеет состав Na2O • СаО • 6SiO2, т. е. является смесью силикатов натрия и кальция. Его получают сплавлением соды Na2CO3, известняка СаСO3 и песка SiO2;
Na2CO3 + CaCO3 + 6SiO2 = Na2O • СаО • 6SiO2 + 2СO2↑
Цемент
Порошкообразный вяжущий материал, образующий при взаимодействии с водой пластичную массу, превращающуюся со временем в твердое камневидное тело; основной строительный материал.
Химический состав наиболее распространенного портланд-цемента (в % по массе) — 20 — 23% SiO2; 62 — 76 % СаО; 4 — 7 % Al2O3; 2-5% Fe2O3; 1- 5% МgО.






