- Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов
- Структура Периодической системы элементов
- Свойства Периодической системы элементов
- Элементы Периодической таблицы Менделеева
- Щелочные металлы
- Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс
- Щелочноземельные металлы
- Лантаноиды и актиноиды
- Переходные металлы
- Неметаллы
- Подгруппа углерода
- Подгруппа азота
- Подгруппа кислорода
- Галогены
- Инертные газы
- Общая характеристика металлов
- 2. Характерные физические свойства металлов
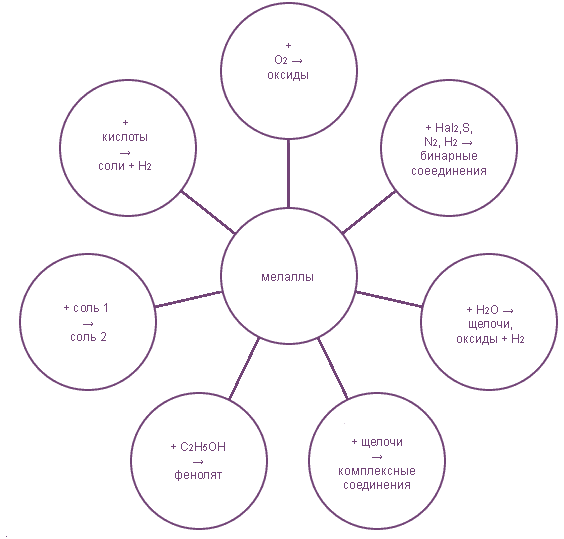
- 3. Общие химические свойства
- Видеоурок «Положение металлов в периодической системе химических элементов Д.И. Менделеева и особенности строения их атомов»
- Металлы, их положение в периодической системе химических элементов Д.И. Менделеева, строение атома, химические свойства, применение
- Таблица групп металлов и неметаллов в периодической системе Менделеева: что это такое и как определить самый мягкий элемент
- Периодическая система Менделеева
- Что такое период
- Что такое группа
- Общие физические свойства
- Вывод
- Общая характеристика металлов IА–IIIА групп | CHEMEGE.RU
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде.
Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов.
Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему.
Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
- Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
- Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
 Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий.
Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку.
Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил.
Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
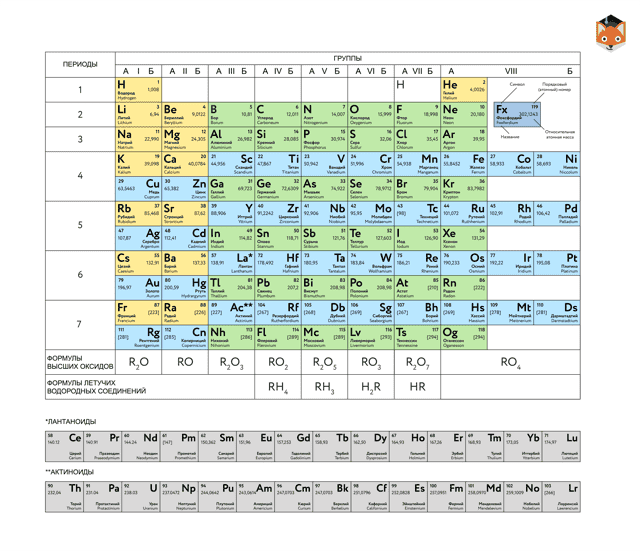 Периодическая таблица химических элементов
Периодическая таблица химических элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов.
В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп.
Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.

Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу.
Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов).
Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
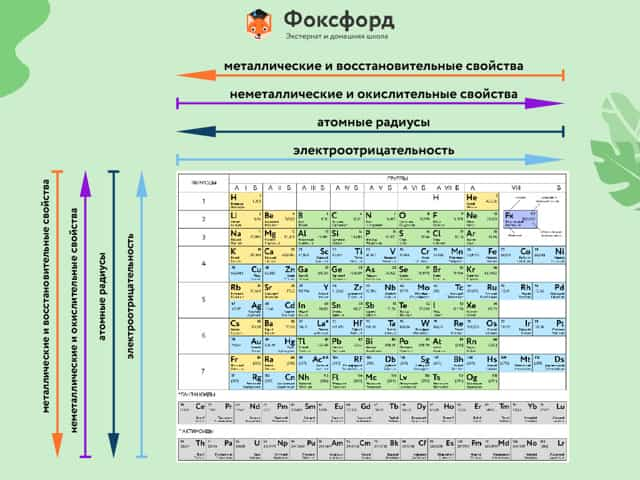
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы

Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс
Щелочноземельные металлы
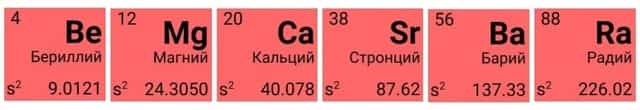
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.

Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы

Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот).
Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
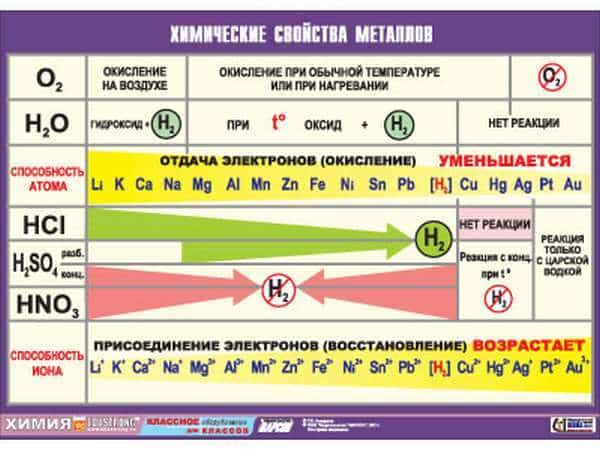
Общая характеристика металлов
1. Положение в периодической таблице, строение атомов металлов.
2. Характерные физические свойства металлов.
3. Общие химические свойства.
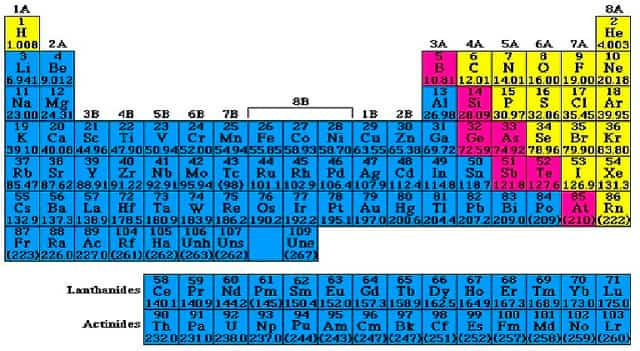
Металлы в периодической системе химических элементов Д.И.Менделеева находятся в левом нижнем углу по диагонали B-At, а далее в побочных подгруппах. Исключение: Н, Ве, В.
У металлов на последнем электронном слое от 1 до 3 электронов, следовательно, степень окисления от +1 до +3 . Могут иметь степень окисления: +4, +5, +6, +7 металлы главных ( IV — VI ) и побочных подгрупп.
Металлы-восстановители.

Восстановительные свойства в периоде ослабевают, радиус атома уменьшается , т.к. количество электронов на внешнем слое увеличивается. Увеличивается заряд ядра.
Восстановительные свойства в группе усиливаются . Число электронов на внешнем электронном уровне не изменяется. Радиус атома увеличивается, следовательно металлические свойства усиливаются.
— s — элементы -металлы I и II группы А (кроме Н и Ве).
— p — элементы — Al, Ga, In, Tl (внизу главной подгруппы).
— d — элементы -металлы побочных подгрупп.
— f — элементы лантаноиды и актиноиды.
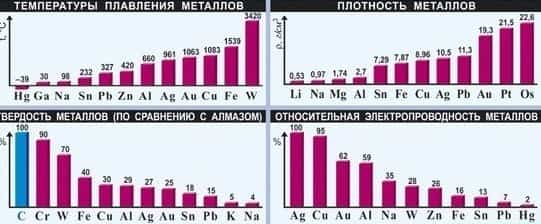
2. Характерные физические свойства металлов
- — Металлический блеск (характерен не только для металлов: его имеют и неметаллы йод и углерод в виде графита);
- — Хорошая электропроводность;
- — Возможность лёгкой механической обработки — пластичность; однако, некоторые металлы, например германий и висмут, непластичны;
- — Высокая плотность (обычно металлы тяжелее неметаллов);
- — Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы);
- — Большая теплопроводность;
- — В реакциях всегда являются восстановителями.
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако они обладают различной твёрдостью. Так, щелочные металлы легко режутся кухонным ножом, а такие металлы, как ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
3. Общие химические свойства
Видеоурок «Положение металлов в периодической системе химических элементов Д.И. Менделеева и особенности строения их атомов»
Содержание:
§ 1 Положение металлов в периодической системе химических элементов Д.И. Менделеева
В современной периодической системе Д.И. Менделеева размещено 118 химических элементов. Большая часть из них относится к металлам.
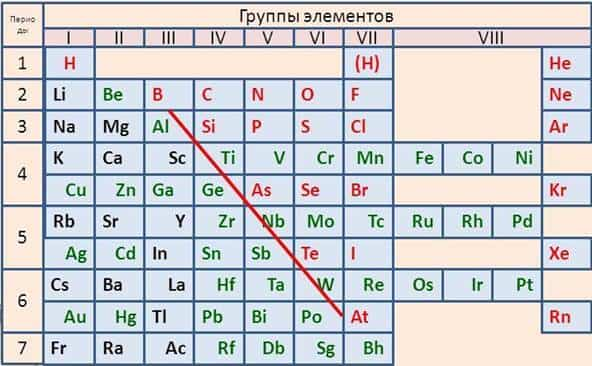
Металлы содержатся во всех группах этой системы, например, в первой группе все элементы, кроме водорода, относятся к металлам. Во второй группе — все металлы, в третьей группе все элементы являются металлами, кроме бора.
В IV, V, VI группах металлы располагаются в побочных подгруппах и внизу главных подгрупп (в IV группе — это германий, олово, свинец, в V группе – сурьма, висмут, в VI группе – полоний).
В VII – VIII группах металлы располагаются только в побочных подгруппах.
Таким образом, условная граница между элементами-металлами и элементами-неметаллами в главных подгруппах проходит по диагонали B (бор) — Si (кремний) – As (мышьяк) — Te (теллур) – At (астат). Все элементы побочных подгрупп относятся к металлам.
§ 2 Названия групп металлов в периодической системе химических элементов Д.И. Менделеева
Металлы I группы главной подгруппы — литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr) — называются щелочными. Их так назвали, потому что их гидроксиды являются растворимыми в воде основаниями – щелочами.
Металлы II группы главной подгруппы – магний (Mg), кальций (Ca), стронций (Sr),
барий (Ba), радий(Ra) — называются щелочноземельными. Их гидроксиды обладают щелочными свойствами, а оксиды сходны по тугоплавкости с оксидами алюминия и железа, которые ранее называли «земли».
- В периодической системе выделяют группу благородных металлов: золото (Au),
- серебро (Ag), платина (Pt) и металлы платиновой группы рутений (Ru), родий (Rh),
- палладий (Pd), осмий (Os), иридий (Ir), их так назвали из-за блеска в изделиях и их способности не окисляться на воздухе.
§ 3 Строение атомов в металлах 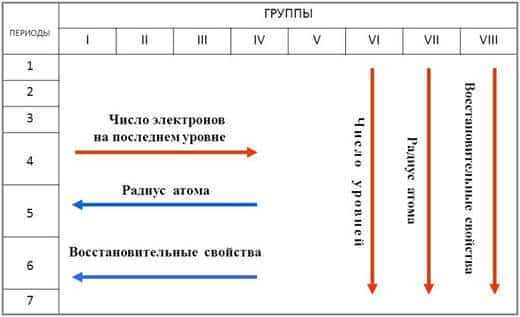
- Из положения металлов в периодической системе химических элементов можно определить и особенности их строения.
- Первой особенностью является небольшое число электронов на внешнем уровне
- (от 1 до 3 электронов) у большинства металлов.
- Ко второй особенности можно отнести сравнительно большой радиус атома.
Атомы металлов в отличие от атомов неметаллов легко отдают наружные электроны и превращаются в положительно заряженные ионы. Свободные электроны перемещаются между ионами металлов.
Положительные ионы металлов удерживаются все вместе за счет притяжения ко всем свободно движущимся в металлах электронам.
Между этими частицами (свободными электронами и ионами металлов) возникает связь, которую называют металлической.
Схематично такую связь можно изобразить так:
; где М-символ элемента металла.
Электроны находятся в постоянном движении, при их столкновении с положительно заряженными ионами металлов ионы превращаются в нейтральные атомы, а затем снова в ионы, и такой процесс происходит непрерывно. Поэтому ввели понятие – ион-атом металла.
Металлическая связь имеется в металлах, находящихся в жидком и твердом состоянии. Твердые металлы – вещества кристаллические. Их кристаллические решетки называются металлическими. В узлах их решеток находятся ион-атомы металлов, а между ними передвигаются относительно свободные электроны. Металлическая связь является очень прочной.
§ 4 Краткие итоги по теме урока
В периодической системе Д.И. Менделеева из 118 химических элементов большая часть относится к металлам. Металлы содержатся во всех группах периодической системы.
Они в основном расположены в левой нижней части системы, условная граница между элементами-металлами и элементами-неметаллами в главных подгруппах проходит по диагонали B (бор) — Si (кремний) – As (мышьяк) — Te (теллур) – At (астат). Все элементы побочных подгрупп относятся к металлам.
Для металлов характерна металлическая химическая связь и металлическая кристаллическая решетка. Металлическая связь очень прочная.
Список использованной литературы:
- Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений/ — М.: Дрофа, 2010.
- Химия. 9 класс: Настольная книга учителя/О.С. Габриелян, И.Г. Остроумов. – М.: Дрофа, 2003.
- Рудзитис Г.Е., Фельдман Ф.Г. Химия: Неорган. химия. Орган. химия: Учеб. для 9 кл. общеобразоват. учреждений. -М.: Просвещение, 1999.
- https://ru.wikipedia.org/wiki/
Использованные изображения:
Металлы, их положение в периодической системе химических элементов Д.И. Менделеева, строение атома, химические свойства, применение
В периодической системе элементов Д.И.Менделеева металлы расположены в левом нижнем углу от диагонали B–At.
Класс металлов образован элементами s-семейства (кроме Н и Не), p-элементы главных подгрупп III (кроме В), IV (Ge, Sn, Pb), V (Sb, Bi) и VI (Po), все d— и f-элементы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge), обладают двойственным характером. Металлов в периодической системе элементов – большинство (Из 109 элементов только 22 неметаллы).
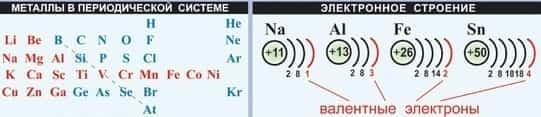
- На наружном электронном уровне находятся 1,2 или 3 электрона, слабо связанных с ядром.
- 11Na +11 ) ) ) 20Ca +20 ) ) ) ) 13Al +13 ) ) )
- 2 8 1 2 8 8 2 2 8 3
- 1s22s22p63s1 1s22s22p63s2 3p64s2 1s22s22p63s3
- В металлах связь металлическая и металлическая кристаллическая решётка чем объясняются физические свойства металлов.
Для главных подгрупп: чем левее и ниже металл, тем большую химическую активность он проявляет. В периодах металлические свойства убывают, а в группах усиливаются (с увеличением порядкового номера), так как изменяется радиус атома.
- Для металлов характерны общие физические свойства:
- 1) твёрдость; 2) электро и теплопровдность; 3) непрозрачность; 4) металлический блеск;
- 5) ковкость или пластичность (объяснение – металлическая кристаллическая решётка).
- Химические свойства: , n=1,2,3. (металлы всегда восстановители)
- I. С простыми веществами:
- 1) с кислородом:
- а) 2Ca + O2 → 2CaO б) 2Mg + O2 2MgO в) Au + O2 ↛
- в-ль ок-ль многие металлы покрыты тонкой плёнкой, которая препятствует дальнейшему окислению.
- 2) с галогенами:
- а) 2Na + Cl2 → 2NaCl б) 2Fe + 3Cl2 FeCl3
- 3) с серой: Fe + S → FeS
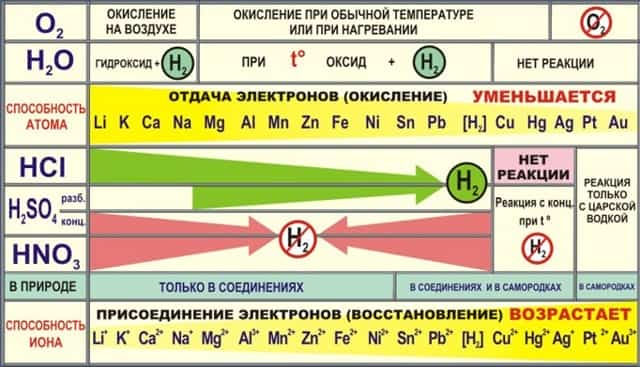
- II. Со сложными веществами (ряд активности металлов):
- 1) с водой:
- а) (для щелочных и щелочноземельных металлов) 2Na + 2H2O → 2NaOH + H2↑
- б) металлы средней активности Mg + H2O MgO +H2↑
- в) правее водорода Au + H2O ↛
- 2) с растворами кислот, кроме HNO3
- а) Zn + 2HCl → ZnCl2 + H2 б) Cu + HCl ↛
- 3) с солями: Fe + CuSO4 → FeSO4 + Cu
- Применение:
- 1) в быту – посуда, бытовые приборы; 2) в технике, в промышленности;
3) в самолёто- и ракетостроении; 4) в медицине и т.д.
- Билет №9 (2)
- Фенол, его строение, свойства, получение и применение.
- Фенол – это производное бензола, в котором один атом водорода замещён на группу ОН.
- Взаимное влияние бензольного кольца и ОН-групп:
- 1) Радикал С6Н5 обладает свойством оттягивать на себя электроны атома кислорода ОН—группы, делая связь О–Н более полярной и атом водорода более подвижным.
- 2) ОН—группа придаёт большую подвижность атомам водорода в положениях 2,4,6 – бензольного кольца.
- Этим взаимовлиянием и определяются свойства фенола.
- Фенол – бесцветное, кристаллическое вещество с характерным запахом больницы.
- Температура плавления 40,9℃ , хорошо растворим в горячей воде (карболовая кислота).
- Фенол – ядовит!
- Химические свойства:
- 1) В воде диссоциирует на ионы:
- 2) Проявляет слабые кислотные свойства, реагирует с металлами:
- 2C6H5OH + 2Na → 2C6H5ONa + H2↑
- фенолят натрия
- 3) Реагирует со щёлочью:
- C6H5OH + NaOH → C6H5ONa + H2O (отличие от спиртов)
- 4) Реакции замещения:
- В промышленности фенол получают по схеме:
- 1) 2)
- Фенол применяют для производства:
- 1) полимеров и пластмасс на их основе, красителей;
- 2) медикаментов;
3) взрывчатых веществ. Водородный раствор фенола используется как дезинфицирующее средство.
Билет №10 (1)
Таблица групп металлов и неметаллов в периодической системе Менделеева: что это такое и как определить самый мягкий элемент
Свойства химических элементов позволяют объединять их в соответствующие группы. На этом принципе была создана периодическая система, изменившая представление о существующих веществах и позволившая предположить существование новых, ранее неизвестных элементов….
Периодическая система Менделеева
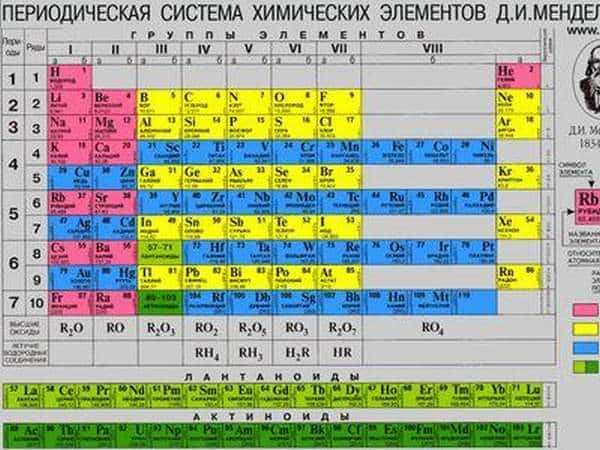
Периодическая система Менделеева в химии свела в единую систему все существующие элементы, прежде считавшиеся просто отдельными веществами.
На основании ее изучения были предсказаны, а впоследствии — синтезированы новые химические вещества. Значение этого открытия для науки невозможно переоценить, оно значительно опередило свое время и дало толчок к развитию химии на многие десятилетия.
Существует три наиболее распространенных варианта таблицы, которые условно именуются «короткая», «длинная» и «сверхдлинная». Основной считается длинная таблица, она утверждена официально. Отличием между ними является компоновка элементов и длина периодов.
Что такое период
Система содержит 7 периодов. Они представлены графически в виде горизонтальных строк. При этом, период может иметь одну или две строки, называемые рядами. Каждый последующий элемент отличается от предыдущего возрастанием заряда ядра (количества электронов) на единицу.
Если не усложнять, период — это горизонтальная строка периодической таблицы. Каждый из них начинается металлом и заканчивается инертным газом.
Собственно, это и создает периодичность — свойства элементов изменяются внутри одного периода, вновь повторяясь в следующем.
Первый, второй и третий периоды — неполные, они называются малыми и содержат соответственно 2, 8 и 8 элементов. Остальные — полные, они имеют по 18 элементов.
Что такое группа
Группа — это вертикальный столбец, содержащий элементы с одинаковым электронным строением или, говоря проще, с одинаковой высшей валентностью. Официально утвержденная длинная таблица содержит 18 групп, которые начинаются со щелочных металлов и заканчиваются инертными газами.
Каждая группа имеет свое название, облегчающее поиск или классификацию элементов. Усиливаются металлические свойства в независимости от элемента по направлению сверху-вниз. Это связано с увеличением количества атомных орбит чем их больше, тем слабее электронные связи, что делает более ярко выраженной кристаллическую решетку.
 Металлы в таблице Менделеева имеют преобладающее количество, список их достаточно обширен. Они характеризуются общими признаками, по свойствам они неоднородны и делятся на группы. Некоторые из них имеют мало общего с металлами в физическом смысле, а иные могут существовать только доли секунды и в природе абсолютно не встречаются (по крайней мере, на планете Земля), поскольку созданы, точнее, вычислены и подтверждены в лабораторных условиях, искусственно. Каждая группа имеет собственные признаки, название и довольно заметно отличается от других. Особенно это различие выражено у первой группы.
Металлы в таблице Менделеева имеют преобладающее количество, список их достаточно обширен. Они характеризуются общими признаками, по свойствам они неоднородны и делятся на группы. Некоторые из них имеют мало общего с металлами в физическом смысле, а иные могут существовать только доли секунды и в природе абсолютно не встречаются (по крайней мере, на планете Земля), поскольку созданы, точнее, вычислены и подтверждены в лабораторных условиях, искусственно. Каждая группа имеет собственные признаки, название и довольно заметно отличается от других. Особенно это различие выражено у первой группы.
Какого положение металлов в периодической системе? Элементы расположены по увеличению атомной массы или количества электронов и протонов. Их свойства изменяются периодически, поэтому аккуратного размещения по принципу «один к одному» в таблице нет.
Как определить металлы, и возможно ли это сделать по таблице Менделеева? Для того, чтобы упростить вопрос, придуман специальный прием: условно по местам соединения элементов проводится диагональная линия от Бора до Полония (или до Астата). Те, что оказываются слева — металлы, справа — неметаллы.
Это было бы очень просто и здорово, но есть исключения — Германий и Сурьма.
Важно! Это работает только в длинной системе, на коротком варианте таблицы Менделеева многие металлы оказываются справа.
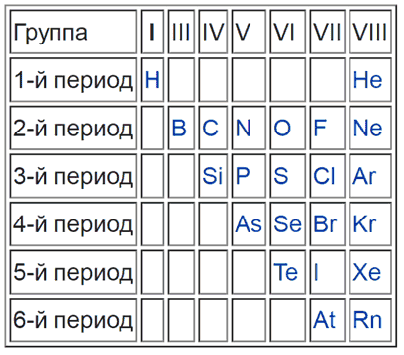 Такая «методика» — своего рода шпаргалка, она придумана лишь для упрощения процесса запоминания. Для более точного представления следует запомнить, что список неметаллов составляет всего 22 элемента, поэтому отвечая на вопрос, сколько всего металлов всего содержится в таблице Менделеева
Такая «методика» — своего рода шпаргалка, она придумана лишь для упрощения процесса запоминания. Для более точного представления следует запомнить, что список неметаллов составляет всего 22 элемента, поэтому отвечая на вопрос, сколько всего металлов всего содержится в таблице Менделеева
На рисунке можно наглядно увидеть, какие элементы являются неметаллами и как они располагаются в таблице по группам и периодам.
Это интересно! Каково содержание кислорода в воздухе: процентный состав и норма
Общие физические свойства
Существуют общие физические свойства металлов. К ним относятся:
- Пластичность.
- Характерный блеск.
- Электропроводность.
- Высокая теплопроводность.
- Все, кроме ртути, находятся в твердом состоянии.
Следует понимать, что свойства металлов очень различаются относительно их химической или физической сути. Некоторые из них мало похожи на металлы в обыденном понимании этого термина. Например, ртуть занимает особенное положение.
Она при обычных условиях находится в жидком состоянии, не имеет кристаллической решетки, наличию которой обязаны своими свойствами другие металлы.
Свойства последних в этом случае условны, с ними ртуть роднят в большей степени химические характеристики.
Интересно! Элементы первой группы, щелочные металлы, в чистом виде не встречаются, находясь в составе различных соединений.
Самый мягкий металл, существующий в природе — цезий — относится к этой группе. Он, как и другие щелочные подобные вещества, мало общего имеет с более типичными металлами.
Некоторые источники утверждают, что на самом деле, самый мягкий металл калий, что сложно оспорить или подтвердить, поскольку ни тот, ни другой элемент не существует сам по себе будучи выделенным в результате химической реакци они быстро окисляются или вступают в реакцию.
Вторая группа металлов — щелочноземельные — намного ближе к основным группам. Название «щелочноземельные» происходит из древних времен, когда окислы назывались «землями», поскольку они имеют рыхлую рассыпчатую структуру.
Более-менее привычными (в обиходном смысле) свойствами обладают металлы начиная с 3 группы. С увеличением номера группы количество металлов убывает, замещаясь неметаллическими элементами.
Последняя группа состоит из инертных (или благородных) газов.
Определение металлов и неметаллов в таблице Менделеева. Простые и сложные вещества.
- Простые вещества (металлы и неметаллы)
Вывод
Соотношение металлов и неметаллов в таблице Менделеева явно перевешивает в пользу первых. Такое положение свидетельствует о том, что группа металлов объединена слишком широко и требует более подробной классификации, что признается научным сообществом.
Это интересно! Основной закон Гесса и следствия из него
Общая характеристика металлов IА–IIIА групп | CHEMEGE.RU
Кодификатор ЕГЭ. Раздел 1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность, г/см3 |
| Литий | 6,941 | +3 | 0,98 | 0,152 | 520,2 | 180,6 | 0,534 |
| Натрий | 22,99 | +11 | 0,99 | 0,186 | 495,8 | 97,8 | 0,968 |
| Калий | 39,098 | +19 | 0,82 | 0,227 | 418,8 | 63,07 | 0,856 |
| Рубидий | 85,469 | +37 | 0,82 | 0,248 | 403,0 | 39,5 | 1,532 |
| Цезий | 132,905 | +55 | 0,79 | 0,265 | 375,7 | 28,4 | 1,90 |
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами.
С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О.
Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Э2О + Н2О = 2ЭОН
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность, г/см3 |
| Бериллий | 9,012 | +4 | 1,57 | 0,169 | 898,8 | 1278 | 1,848 |
| Магний | 24,305 | +12 | 1,31 | 0,245 | 737,3 | 650 | 1,737 |
| Кальций | 40,078 | +20 | 1,00 | 0,279 | 589,4 | 839 | 1,55 |
| Стронций | 87,62 | +38 | 0,95 | 0,304 | 549,0 | 769 | 2,54 |
| Барий | 137,327 | +56 | 0,89 | 0,251 | 502,5 | 729 | 3,5 |
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
- Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
- Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
- … ns2nр1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Характеристики элементов IIA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Радиус атома, нм | Энергия ионизации, Э → Э3+, эВ |
Степень окисления в соединениях | Валентные электроны |
| Бор | 10,811 | +5 | 2,01 | 0,091 | 71,35 | +3, -3 | 2s22p1 |
| Алюминий | 26,982 | +13 | 1,47 | 0,143 | 53,20 | +3 | 3s23p1 |
| Галлий | 69,723 | +31 | 1,82 | 0,139 | 57,20 | +3 | 4s24p1 |
| Индий | 114,818 | +49 | 1,49 | 0,116 | 52,69 | +3 | 5s25p1 |
| Таллий | 204,383 | +81 | 1,44 | 0,171 | 56,31 | +1, +3 | 6s26p1 |
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы.
Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам.
Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
В общем металлы IА–IIIА подгрупп характеризуются:
- небольшим количеством электронов на внешнем энергетическом уровне:
- сравнительно сильными восстановительными свойствами;
- низкими значениями электроотрицательности;
- сравнительно большими атомными радиусами (относительно радиусов других атомов в периодах, в которых расположены соответствующие металлы);
- металлической кристаллической решеткой;
- высокой электро- и теплопроводностью;
- твердым фазовым состоянием при нормальных условиях.






