- 3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ
- 4. Практически осуществите следующие превращения:
- Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe(NO3)3
- Вариант 2. Распознавание карбоната кальция CaCO3, нитрата стронция Sr(NO3)2, сульфата натрия NaSO4, сульфида натрия Na2S. 1. В четырех пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ
- 2. Докажите, что кристаллы сульфата железа (III) частично окислились и содержат примеси ионов Fe3+
- 3. В двух склянках дана вода. В одной из них вода содержит сульфат магния, а в другой — гидрокарбонат кальция. Проделайте опыты, при помощи которых можно устранить постоянную и временную жёсткость воды
- 4. Практически осуществите следующие превращения:
- Аl→Al2(SO4)3→Аl(ОН)3→Na[Al(OH)4]
- 5. Отчёт о работе оформите в произвольной форме
- Практическая работа 3. "Экспериментальные задачи по распознаванию и получению веществ"
- Экспериментальные задачи по распознаванию и получению веществ
- Гдз (ответы) химия 9 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, практическая работа №3 решение экспериментальных задач по теме «металлы»
- Экспериментальные задачи по распознаванию соединений металлов. 9-й класс
- Практическая работа 3. Экспериментальные задачи по распознаванию и получению веществ
- Внимание !!! Эксперимент на распознавание веществ и химических процессов, происходящих в пробирках. *** Опыт *** В пробирку 1 добавляем по каплям вещество. — презентация
- Урок 10: Вещества неорганические
- Основные понятия
- Индикаторы
- Распознавание катионов щелочных металлов
- Распознавание ионов щелочноземельных металлов
- Определение катионов бериллия
- Определение катионов магния
- Определение катионов кальция
- Определение ионов стронция
- Определение катионов бария
- Определение ионов меди
- Определение ионов двух- и трехвалентного железа
- Определение катионов аммония
- Качественные реакции на анионы
- Сульфат-ион и сульфит-ион
- Хлорид-, бромид-, йодид-ион
- Карбонат-ион

Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
| Что делали? | Что наблюдали? | Вывод |
| Твёрдые вещества растворили в воде, далее прилили соляную кислоту. |
|
В пробирке — карбонат натрия. |
| К другим растворам добавили несколько капель фенолфталеина. | Содержимое одной из пробирок окрасилось с малиновый цвет. | В пробирке — гидроксид натрия (образует щелочную среду). |
| К оставшимся растворам добавили нитрат серебра. | В одной пробирке выпадает белый осадок: | В одной пробирке находится хлорид магния, в пробирке с осадком — нитрат натрия. |
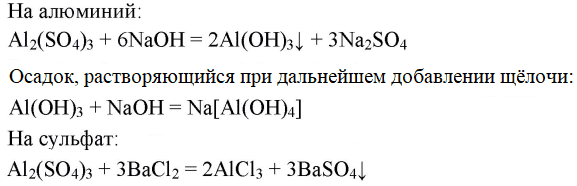
3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ
| Что делали? | Что наблюдали? | Вывод |
| К растворам добавили сульфат калия. | В одной пробирке выпадает белый осадок: | В пробирке — хлорид стронция. |
| К оставшимся растворам прилили раствор гидроксида натрия. | В пробирке — хлорид аллюминия. В пробирке с осадком — хлорид натрия. |
4. Практически осуществите следующие превращения:
Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe(NO3)3
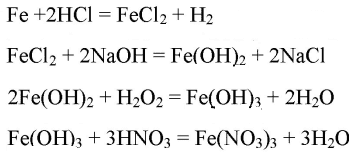
Вариант 2. Распознавание карбоната кальция CaCO3, нитрата стронция Sr(NO3)2, сульфата натрия NaSO4, сульфида натрия Na2S. 1. В четырех пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ
| Что делали? | Что наблюдали? | Вывод |
| Растворили твёрдые вещества и добавили к растворам соляную кислоту. | В пробирке вещество не растворилось в воде, после добавления соляной кислоты выделился газ без запаха и цвета: | В пробирке — карбонат кальция. |
| В другой пробирке выделяется газ с характерным запахом тухлых яиц: | В пробирке — сульфид натрия. | |
| К остальным растворам прилили раствор серной кислоты. | В одной из пробирок выпадает белый осадок: | В пробирке — нитрид стронция, в пробирке с осадком — сульфат натрия. |
2. Докажите, что кристаллы сульфата железа (III) частично окислились и содержат примеси ионов Fe3+
Качественным реагентом на присутствие трёхвалентного железа является роданид калия. Появляется красное окрашивание.
3. В двух склянках дана вода. В одной из них вода содержит сульфат магния, а в другой — гидрокарбонат кальция. Проделайте опыты, при помощи которых можно устранить постоянную и временную жёсткость воды
4. Практически осуществите следующие превращения:
Аl→Al2(SO4)3→Аl(ОН)3→Na[Al(OH)4]
5. Отчёт о работе оформите в произвольной форме
Отчёт представлен выше (1,2,3,4 пункты каждого варианта).
Вам также может понравиться
Практическая работа 3. "Экспериментальные задачи по распознаванию и получению веществ"
«Химия. 9 класс». О.С. Габриелян (гдз)
Экспериментальные задачи по распознаванию и получению веществ
Вариант 1. В выданных пробирках содержатся твердые белые вещества. Для начала растворим их в воде. Добавим к полученным растворам раствор Н2SO4: Вариант 2. В пробирках содержатся твердые белые вещества. Сначала их растворим в воде. а) В одной пробирке вещество не будет растворяться. Это СаСО3. Для окончательной проверки добавим к нему раствор HCl. Вариант 3. В пробирках — твердые белые вещества. Попытаемся их растворить в воде. Не растворившееся вещество в одной из пробирок — зто СаСО3. Для подтверждения можно добавить к нему раствор кислоты (смотри вариант 2(а)). Для определения Na2SO4 проведем аналогичный опыт, как и в варианте 2(б). В оставшейся пробирке находится Ва(NO3)2. Для подтверждения к нему можно прилить раствор серной кислоты, выпадет белый осадок:
Ва(NO3)2 + H2SO4 ↔ BaSO4↓ + 2HNO3
Ba2+ + 2NO3– + 2H+ + SO42– ↔ BaSO4↓ + 2H+ + 2NO3– Ba2+ + SO42– ↔ BaSO4↓ Вариант 4. В пробирках — три различных раствора. Добавим к каждой из трех пробирок немного раствора NaОН. а) В пробирке, где нет видимых изменений, содержится NaСI.
б) В пробирке с раствором АlСl3 выпал белый студенистый осадок, растворимый как в кислотах, так и в щелочах:
Задача 1. Для определения примеси сульфата железа (III) в железном купоросе воспользуемся качественной реакцией на ион Fe3+, т.е. проведем реакцию с желтой кровяной солью:
2Fe2(SO4)3 + 3K4[Fe(CN)6] ↔ Fe4[Fe(CN)6]3↓ + 6K2SO4.
Если примесь ионов Fe3+ содержится в купоросе, то выпадет темно-синий осадок турнбулевой соли (берлинская лазурь).
Задача 2. Для начала переведем FeCl3, в гидроксид, добавляя раствор NаОН. Идет реакция:
FeCl3 + 3NaOH ↔ Fe(OH)3↓ + 3NaCl.
Выпадает бурый осадок гидроксида. Теперь сольем с него раствор по возможности, а сам осадок перенесем в фарфоровый тигль и прокалим на огне. Оставшийся порошок цвета ржавчины и будет Fe2O3.
Задача 3. Для получения алюмината натрия необходимо к Аl добавить избыток раствора NаОН и подождать некоторое время. Алюминий на воздухе покрывается оксидной пленкой, которая медленно растворяется в щелочи. Сам же алюминий со щелочью реагирует довольно активно. Запишем все происходящие реакции: Задача 4. Для получения FeCl2 проведем реакцию между Fe и раствором НСl:
Fe + 2HCl ↔ FeCl2 + H2↑
Гдз (ответы) химия 9 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, практическая работа №3 решение экспериментальных задач по теме «металлы»
Гдз (ответы) химия 9 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, практическая работа №3 решение экспериментальных задач по теме «металлы»
Другие задания смотри здесь…
ОПЫТ 1
Осуществление цепочки превращений
Проведите химические реакции, с помощью которых можно осуществить превращения по схеме MgO ⟶ MgCl2 ⟶ Mg(OH)2 ⟶ MgSO4 ⟶ MgCO3.
Все опыты проводите в одной пробирке, добавляя по каплям следующий реагент до прекращения признаков протекания реакции. Напишите уравнения реакций в молекулярной и ионной формах.
MgO + 2HCl = MgCl2 + H2O MgO + 2H+ + 2Cl- = Mg2+ + 2Cl- + H2O MgO + 2H+ = Mg2+ + H2O
MgCl2 + 2NaOH = 2NaCl + Mg(OH)2↓
Mg2+ + 2Cl- + 2Na+ + 2OH- = 2Na+ + 2Cl- + Mg(OH)2↓Mg2+ + 2OH- = Mg(OH)2↓
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
Mg(OH)2 + 2H+ + SO42- = Mg2+ + SO42- + 2H2OMg(OH)2 + 2H+ = Mg2+ + 2H2O
MgSO4 + Na2CO3 = Na2SO4 + MgCO3↓
Mg2+ + SO42- + 2Na+ + CO32- = 2Na+ + SO42- + MgCO3↓ Mg2+ + CO32- = MgCO3↓
ОПЫТ 2
Получение соединений металлов и изучение их свойств
Используя предложенные вам реактивы, получите хлорид железа (II). Докажите наличие иона Fe2+ в полученном растворе.
При добавлении щелочи к хлориду железа (II) образуется осадок гидроксида железа (II) зеленоватой окраски: FeCl2 + 2NaOH = 2NaCl + Fe(OH)2↓ Fe2+ + 2Cl- + 2Na+ + 2OH- = 2Na+ + 2Cl- + Fe(OH)2↓ Fe2+ + 2OH- = Fe(OH)2↓Используя в качестве окислителя пероксид водорода, получите из хлорида железа (II) хлорид железа (III).
2FeCl2 + 2HCl + H2O2 = 2FeCl3 + 2H2O 2Fe2+ + 4Cl- + 2H+ + 2Cl- + H2O2 = 2Fe3+ + 6Cl- + 2H2O 2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O
Докажите наличие иона Fe3+ в полученном растворе. Переведите ион Fe3+ в осадок в виде гидроксида железа (III). При добавлении щелочи к хлориду железа (III) образуется осадок гидроксида железа (III) бурой окраски:FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓ Fe3+ + 3Cl- + 3Na+ + 3OH- = 3Na+ + 3Cl- + Fe(OH)3↓ Fe3+ + 3OH- = Fe(OH)3↓
ОПЫТ 3
Распознавание соединений металлов
В четырёх пронумерованных пробирках без этикеток находятся кристаллические соли: сульфат магния, сульфат цинка, сульфат натрия, карбонат кальция. С помощью предложенных вам реактивов распознайте каждую соль. Напишите уравнения проведённых реакций в молекулярной и ионной формах.
Доливаем в пробирки воды и разделяем вместимое всех пробирок на 3 порции.
В четыре пробирки 1 порции добавляем соляную кислоту, в пробирке с карбонатом кальция будет наблюдаться выделение углекислого газа: CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ CaCO3 + 2H+ + 2Cl- = Ca2+ + 2Cl- + H2O + CO2↑ CaCO3 + 2H+ = Ca2+ + H2O + CO2↑В три пробирки 2 порции добавляем раствор гидроксида натрия.
В пробирках с сульфатом магния и сульфатом цинка образуются осадки, однако при дальнейшем добавлении раствора гидроксида натрия, в одной из пробирок произойдет растворение осадка, следовательно, в этой пробирке содержится сульфат цинка, а в другой ― сульфат магния.
ZnSO4 + 2NaOH = Na2SO4 + Zn(OH)2↓ Zn2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Zn(OH)2↓ Zn2+ + 2OH- = Zn(OH)2↓ Zn(OH)2↓ + 2NaOH = Na2[Zn(OH)4] Zn(OH)2↓ + 2Na+ + 2OH- = 2Na+ + [Zn(OH)4]-Zn(OH)2↓ + 2OH- = [Zn(OH)4]-
MgSO4 + 2NaOH = Na2SO4 + Mg(OH)2↓ Mg2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Mg(OH)2↓ Mg2+ + 2OH- = Mg(OH)2↓ В оставшуюся пробирку 3 порции добавим хлорид бария, выпадет белый мелкодисперсный осадок:
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓ 2Na+ + SO42- + Ba2+ + 2Cl- = 2Na+ + 2Cl- + BaSO4↓ Ba2+ + SO42- = BaSO4↓
| реактив | пробирка 1 | пробирка 2 | пробирка 3 | пробирка 4 |
| порция 1:cоляная кислота HCl | без изменений | без изменений | без изменений | выделяется СО2↑ |
| порция 2:гидроксид натрия NaOH | образуется Mg(OH)2↓ | образуется Zn(OH)2↓с последующим его растворением | без изменений | ― |
| порция 3: хлорид бария BaCl2 | ― | ― | образуется BaSO4↓ | ― |
| Вывод | MgSO4 | ZnSO4 | Na2SO4 | CaCO3 |
Другие задания смотри здесь…
Экспериментальные задачи по распознаванию соединений металлов. 9-й класс
Класс: 9
В курсе химии 9-го класса при изучении темы «Многообразие веществ» значительная роль отводится химическому эксперименту: проведению практических и лабораторных работ по распознаванию исследуемых веществ с помощью качественных реакций.
Данная экспериментальная практическая работа является традиционной формой проведения таких занятий.
Поскольку наличие хорошей химической лаборатории позволяет использовать более эффективные возможности в формировании полноценной химической грамотности у учащихся.
Для учителя основная цель выполнения экспериментальных задач выражается в контроле знании и умений отдельных учащихся.
Обучение решать экспериментальные задачи является сложным делом, так как требует много времени и постоянного повторения основных приемов решения этого рода задач.
Поэтому на данном занятии я применила один из приемов общего алгоритма решения экспериментальных задач, из разработанного модуля практических работ в виде мультимедийных слайдов.
Это дало возможность эффективно использовать время урока, грамотно провести эксперимент и организовать самоконтроль методом сравнения с эталоном.
Такой тип урока лучше проводить при закреплении изученного материала, как обобщающий, в темах: соединения металлов и неметаллов. Урок может проходить в виде практической или лабораторной работы.
Использование данной методики дает возможность перед каждой работой быстро вспомнить основные этапы алгоритма решения экспериментальных задач и обсудить конкретные примеры. Такая форма инструкции позволяет систематизировать действия ученика, направлять его наблюдения и помогают правильно делать выводы.
- Использование этой технологии также способствует выполнению такого рода работ не фронтально, а по вариантам и экономит время урока.
- Цель урока: отработать умения и практические навыки распознавания солей щелочных металлов с помощью качественных реакций; научиться анализировать результаты наблюдений; делать выводы; продемонстрировать учащимся актуальность приобретённых знаний и умений, для правильного использования химического оборудования, и соблюдения правил техники безопасности
- Задачи урока:
- создать комфортные условия для успешного выполнения практической работы и развития творческих и практических способностей учащихся (при работе в малой группе);
- отработать навыки аналитических методов исследования солей щелочных металлов с помощью качественных реакций;
- выработать алгоритм действий при решении практической задачи по химии, опирающийся на полученные знания при изучении темы;
- совершенствовать знания о безопасности работы, продолжить формирование представлений о практическом применении химических знаний.
- Форма урока:урок проводиться в форме практической работы: фронтально проводится работа с мультимедийными слайдами по приемам работы со спиртовкой и растворами веществ, что позволяет активизировать деятельность учащихся.
- Этапы урока
- I. Постановка цели урока
- «Широко распростирает химия руки свои в дела человеческие»
М.В.Ломоносов
– Уважаемые ребята! Эпиграфом для нашей работы я выбрала высказывание одного из мудрейших ученых мира М.В.Ломоносова. Эти слова не потеряли актуальности и сегодня. Ведь сколько людей разных профессий пользуются химическими знаниями. Это и фармацевты и люди, профессионально занимающиеся сельским хозяйством, и просто любители садоводы, врачи, физики и астрономы.
Да что далеко ходить, вот я – учитель, преподаю Вам химию. И очень хочу, чтобы Вы полюбили эту интересную, увлекательную и очень полезную науку. В химии выделяют несколько химических наук, это общая химия, неорганическая, физическая, агрохимия. Но есть одна очень интересная область – это аналитическая химия.
Эта наука позволяет узнать какие частицы входят в состав исследуемого вещества.
https://www.youtube.com/watch?v=Hc_j9t2uh78u0026t=14s
И на этом занятии Вы можете себя почувствовать в роли химика – аналитика. Перед Вами стоит серьезная задача с помощью качественных реакций распознать соединения щелочных металлов.
- II. Правила техники безопасности
- – Основная идея этой части нашей работы может быть выражена такими стихами:
- Помни каждый ученик, Знай любая кроха: Безопасность – хорошо
- А халатность – плохо!
– Вы догадались, о чем пойдет речь, да о правилах техники безопасности и особое внимание хочу обратить на приемы работы со спиртовкой и растворами веществ.
(На боковой доске рисунки ребят по т/б). Работа с мультимедийными слайдами по правилам работы со спиртовкой:
Это должен каждый знать: Спирт в спиртовке поджигать (…) только можно И очень осторожно. Чтобы пламя погасить, Спиртовку следует закрыть. И для этого, дружок,
У нее есть (…)
Не спеши хватать пробирку, А инструкцию читай. Убедись, что ты все понял, Вот тогда и начинай. Если хочешь долго жить,
Надо медленно (…).
Чтобы опыт получился, Пользуйся посудой (…)
III. Выполнение практической работы
– Приступаем к выполнению опытов, на смарт доске задания, которые Вы должны выполнить по инструкции, и наблюдения занести в карту-отчет.
Задача 1. В пробирках под номерами 1,2,3 имеются растворы трех веществ: хлорида калия, хлорида натрия и хлорида лития. Определите каждое вещество опытным путем, по окраске пламени спиртовки. Оформите отчет о выполненной работе в виде таблицы. Инструкция по выполнению у каждого на столе.
Задача 2. В пробирках под номерами 4,5 имеются растворы хлорида калия и иодида калия. Распознайте растворы этих солей одним реактивом. Оформите отчет в виде таблицы. Проверяем выполненную вами работу с использованием слайдов-подсказок. Если вы правильно определили выданные вам растворы веществ в пронумерованных пробирках отметьте знаком «плюс» в графе самоконтроль.
IV. Подведение итогов и заключение
– Итак, мы знаем, какими аналитическими способами распознать катионы щелочных металлов от катионов других металлов, хлориды от иодидов. Кто справился с работой? Как вы думаете, где используется свойство катионов металлов окрашивать пламя в разные цвета?
Предполагаемый ответ ученика: Фейерверки. Демонстрация опыта по окраске пламени катионами солей бария и стронция.
- После подведения итогов практической работы, было предложено домашнее задание: используя средства массовой информации (газеты, журналы, радио, телевидение, интернет), написать, в каких случаях человеку может потребоваться знание аналитической химии.
- Инструкция по выполнению работы.
1. Прокалите в пламени спиртовки нихромовую спираль. 2. Осторожно опустите ее в первую пробирку с раствором соли и вновь внесите в пламя спиртовки. 3. Какую окраску приобрело пламя?
4. Проделайте то же самое с двумя другими растворами солей; каждый раз, тщательно прокаливая нихромовую петлю в пламени спиртовки перед погружением в очередной раствор. Наблюдения занесите в отчет в виде таблицы.
Карта-отчет
Дата ___________ Ф.И. ученика __________________
- Практическая работа «Экспериментальные задачи по распознаванию соединений металлов».
- Цель: распознать катионы щелочных металлов по окраске пламени спиртовки; определить растворы хлорида и иодида с помощью качественной реакции.
- Оборудование и реактивы: штатив с пробирками; спиртовка; нихромовая петля; растворы хлоридов калия; натрия; лития; раствор иодида калия; раствор нитрата серебра.
- При выполнении опытов соблюдайте правила техники безопасности.
- Таблица. Результаты исследования
| Испытуемая соль | Цвет пламени | Химическая формула | + / – |
| №1 | |||
| №2 | |||
| №3 |
- Для подготовки к уроку были использованы материалы:
- Приложение 1
13.06.2012
Практическая работа 3. Экспериментальные задачи по распознаванию и получению веществ
- «_____»___________20___г.
- Практическая работа №3.
- Экспериментальные задачи по распознаванию и получению веществ.
- Цель: закрепить на практике знания по теме «Металлы» о способах получения и распознавания веществ
- Оборудование: пробирка — шт, спиртовка, спички, держатель, фарфоровая чашка
- Вещества: хлорид железа (III) – FeCl3, раствор гидроксида натрия- NaOH, раствор HCl или H2SO4– соляной кислоты или серной кислоты , хлорид алюминия (III) – АlCl3, железо — Fe
- Провести следующие химические превращения:
- FeCl3→Fe(OH)3→Fe2O3
- АlCl3→Al(OH)3→Na{Al(OH)}
- Fe+ H2SO4или 2HCl→ FeSO4или FeCl2+H2↑
- I. Знакомство с Инструкцией по технике безопасности:
Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров. Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
Гасить спиртовку можно только одним способом – накрыть пламя фитиля колпачком. Колпачок должен находиться всегда под рукой.
Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
Наливать кислоту надо так, чтобы при наклоне склянки этикетка, во избежание её порчи, оказывалась сверху.
Соединения меди в виде пыли при попадании на кожу, особенно в местах микротравм, могут вызвать раздражения, привести к аллергии в лёгкой форме.
Работать с соединениями бария нужно так, чтобы не допустить попадания их в рот, так как они токсичны. Для получения тяжёлого отравления достаточно дозы массой менее 0,5г. После завершения работы тщательно помыть руки с мылом под проточной водой.
- Первая помощь при порезах:
- а) в первую очередь, необходимо остановить кровотечение (давящая повязка, пережатие сосуда);
- б) если рана загрязнена, грязь удаляют только вокруг неё, но ни в коем случае – из глубинных слоёв раны. Кожу вокруг раны обеззараживают йодной настойкой или раствором бриллиантовой зелени;
- в) после обработки рану закрывают стерильной салфеткой так, чтобы перекрыть края раны, и плотно прибинтовывают обычным бинтом;
- г) после получения первой помощи обратиться в медпункт.
Первая помощь при ожогах:
Ожог первой степени обрабатывают этиловым спиртом, затем, для снятия болевых ощущений, глицерином и накладывают сухую стерильную повязку. Во всех остальных случаях накладывают стерильную повязку после охлаждения места ожога и обращаются в медпункт.
- Первая помощь при попадании кислоты на кожу рук:
- Попавшие на кожу капли кислоты стряхните и тщательно смойте большим количеством воды, а затем обработайте поражённую поверхность 2% раствором питьевой соды.
- Работаете по инструкции, приведённой в учебнике.
- II. Ход работы Таблица
| Что делал | Что наблюдал | Выводы | |
|
|
|
|
Список учащихся 9 класса ознакомившихся с инструкцией по ТБ
| № | Ф.И.О | Дата | Роспись | Ф.И.О и роспись инструктора |
| 1 | ||||
| 2 | ||||
| 3 | ||||
| 4 | ||||
| 5 | ||||
| 6 | ||||
| 7 | ||||
| 8 | ||||
| 9 | ||||
| 10 | ||||
| 11 |
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/101843-prakticheskaja-rabota-3-jeksperimentalnye-zad
Внимание !!! Эксперимент на распознавание веществ и химических процессов, происходящих в пробирках. *** Опыт *** В пробирку 1 добавляем по каплям вещество. — презентация
1 Внимание !!! Эксперимент на распознавание веществ и химических процессов, происходящих в пробирках. *** Опыт *** В пробирку 1 добавляем по каплям вещество А. Что наблюдаем ? Раствор из пробирки 2 вливаем в пробирку 1 Произошла ли химическая реакция ? Задание : 1)Распознать вещества, содержащиеся в пробирках 2) Вещество А – это …. ???
2 Основания, их классификация и свойства в свете теории электролитической диссоциации ЭЛЕКТРОЛИТИЧ ЕСКОЙ ДИССОЦИАЦИИ
3 ЦЕЛИ УРОКА: 1)сформировать понятие об основаниях как электролитах; 2) рассмотреть классификацию оснований по различным признакам; 3) познакомить практически с химическими свойствами оснований в свете теории электролитической диссоциации; 4)совершенствовать умения и навыки в написании формул веществ и уравнений химических реакций; 5) развивать умения и навыки работы с химическими реактивами и химическим оборудованием; 6) учиться сравнивать, анализировать, делать выводы;
4 ЗАДАЧИ УРОКА: 1)учиться проводить химические реакции и записывать уравнения химических реакций в молекулярной, полной и сокращенной ионной формах; 2) различать свойства растворимых и нерастворимых оснований. ДЕВИЗ УРОКА: «Всё познаётся в сравнении».
5 : 1. Основания — это сложные вещества, в которых атом металла связан с одной или несколькими гидроксигруппами (ОН). 2.Основания- это электролиты, которые при диссоциации образуют катионы металла и гидроксид- анионы: NaOH = Na+ + OH- Ca(OH) 2 = Ca OH- 3.
Общая формула оснований: Ме (ОН) п Названия оснований состоят из двух слов: гидроксид + название металла в родительном падеже. Если металл образует соединения с разными степенями окисления, то степень окисления указывается после названия металла в скобках римской цифрой: Fe(OH) 2 ___ гидроксид железа (II).
Fe(OH) 3 – гидроксид железа (///)
- 6 Составить формулы оснований, образованных следующими металлами, и назвать их: 1) Cu (II) 2) Na 3) Fe (III) 4) Zn
- 7 NaOH Na + + OH – Ca(OH) 2 Ca 2+ +2OH – Ba(OH) 2 Ba 2+ +2OH – Диссоциация оснований
- 8 Основания
9 Классификация оснований По степени ЭД 1) сильные NaOH, KOH, Ca(OH)2 2 ) слабые Mg(OH)2, Al(OH)3 Fe(OH)2,Cu(OH)2 Fe(OH)3,CuOH. По кислотности Однокислотные ; NaOH, KOH, CuOH Двухкислотные : Ca(OH)2,Mg(OH)2, Fe(OH)2, Cu(OH)2 Трёхкислотные __?______________
10 Физические свойства оснований Все основания металлов – твёрдые вещества. Как и соли, они могут быть бесцветными и окрашенными. Основания делятся на растворимые и нерастворимые в воде.
Растворимые в воде основания образованы самыми активными металлами, которые реагируют с водой при обычной температуре. Эти металлы находятся в 1 А группе ( щелочные металлы ), 2 А группе ( щелочноземельные металлы ).
Их гидроксиды называются щелочами.
- 11 Гидроксид калия ( едкое кали )
- 12 Гидроксид кальция ( гашеная известь )
- 13
14 Химические свойства Щелочей Вступают в реакцию : * а ) кислотными оксидами : 2NaOH + CO 2 = Na 2 CO 3 +H 2 O Ca(OH) 2 +MgO = реакция не идёт? * б ) кислотами : NaOH + HCl NaCl + H 2 O * в ) растворами солей : FeCl 3 +3NaOH = Fe(OH) 3+3NaCl NaCl+KOH = реакция не идёт ?? Нерастворимых оснований * кислотами : Cu(OH) HCl = CuCl H 2 O 2Al(OH) 3 +3H 2 SO 4 = Al 2 (SO4) 3 + 6H 2 O Fe(OH) 2 + H 2 SiO 4 реакция не идёт?? * при нагревании разлагаются : Cu(OH) 2 = CuO + H 2 O Fe(OH) 2 = FeO + H 2 O 2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O KOH = основание не разложится ??
15 Свойства растворимых оснований Щёлочь + Кислота = Соль + Вода 1) Изменяют окраску индикаторов Изменяют окраску индикаторов 2) Взаимодействие с кислотными оксидами Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O 3)Взаимодействие с кислотами — реакция обмена (нейтрализация)нейтрализация Са(OH) 2 + 2HNO 3 = Ca(NO 3 ) 2 + 2H 2 O 4) С растворами солей, если в результате образуется осадок или газ Соль (раствор) + Щёлочь = Нерастворимое основание + Новая соль FeCI 3 + 3NaOH = Fe(OH) 3 + 3NaCl 2NH 4 Cl+Ca(OH) 2 =CaCl 2 +2NH 3 +2H 2 O 5)С амфотерными оксидами и гидроксидами 2NaOH+Al 2 O 3 =2NaAlO 2 +H 2 O 2КOH+Zn(OH) 2 =K 2 ZnO 2 +2H 2 O
16
17 ЗАПОМНИТЕ Основания сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп ОН –. Растворимые в воде основания щелочи.
При контакте со щелочами фенолфталеин окрашивается в малиновый цвет метилоранж в желтый, а универсальный индикатор и лакмус в синий. Щёлочи реагируют: а) с кислотами, б) с кислотными оксидами в) с некоторыми солями.
Нерастворимые в воде основания: а)растворяются в кислотах,б) при нагревании легко разлагаются.
18 Вариант I Вариант II 1. Даны вещества: CaO; Al(OH) 3 ; HCl; KOH; Na 2 SO 4 ; MgO; Ba(OH) 2 ; H 2 SO 4 ; N 2 O 5 ; NaOH; HNO 3 ; Cu(OH) 2 ; MgCO 3 ; Fe(OH) 3 Выбрать щелочи. Выбрать нерастворимые основания. 2.
Выбрать оксиды, с которыми реагирует NaOH KOH а) SO 2 ; CO 2, б) Al 2 O 3, MgO а) Na 2 O; CaO б) CO 2 ; N 2 O 5 в) N 2 O 5 ; P 2 O 5; г) CaO, Fe 2 O 3 в) FeO; K 2 O г) P 2 O 5 ; SO Выбрать вещества, с которыми реагирует Al(OH) 3 Fe(OH) 3 а) CO 2, б) NaCl, в) H 2 SO 4 а) H 3 PO 4 б) Na 2 O в) KOH. Желаю всем успехов!!! «5» «5»
19 Дом. Зад. Ответы к тесту : ВАРИАНТ 1 1. KOH, Ba(OH)2, NaOH 2. a) в) 3. в) ВАРИАНТ 2 * 1. Al(OH)3, Cu(OH)2, Fe(OH)3 * 2. б) г) 3. а) МОЛОДЦЫ! СПАСИБО ЗА УРОК!!! П. 39 Упр. 1,4, 6-9 стр 149 в П / Т ; подготовить сообщения о применении в промышленности : А ) едкого натра ; Б ) едкого кали ; В ) гашёной извести.
- 20
- 21 Образование средних и кислых солей 1) средних: H 2 SO 4 + 2NaOH = Na 2 SO 4 +2 H 2 O Na 2 SO 4 – сульфат натрия 2)кислых: H 2 SO 4 + NaOH = NaHSO4 + H 2 O NaHSO 4 – гидросульфат натрия
- 22 Образование средних и основных солей. 1)средних: Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O Ca(NO3)2 – нитрат кальция 2)основных: Ca(OH)2 + HNO3 = CaOHNO3 + H2O CaOHNO3 – гидроксонитрат кальция
- 23 Образование средних и кислых солей фосфорной кислоты. H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O H 3 PO 4 + NaOH = NaH 2 PO4 + H 2 O H 3 PO4 + 2NaOH = Na 2 HPO 4 + 2H 2 O Na 3 PO 4 — фосфат натрия NaH 2 PO 4 – дигидрофосфат натрия Na 2 HPO 4 – гидрофосфат натрия
- 24
Урок 10: Вещества неорганические
- План урока:
- Основные понятия
- Распознавание катионов щелочных металлов
- Распознавание ионов щелочноземельных металлов
- Качественные реакции на анионы
Основные понятия
Качественная реакция – это реакция, обладающая определенными признаками для того или иного соединения. К таким процессам предъявляется ряд требований: низкий порог чувствительности, специфичность, селективность.
Определять можно ионы. Это заряженные частицы. Если ион заряжен положительно – это катион, если отрицательно – анион. Ионы могут быть простыми и сложными, но у каждого есть специфическая качественная реакция.
Индикаторы
Индикаторы – вещества, которые дают специфический продукт реакции (осадок, газ, соль определенного цвета) с тем или иным ионом.
Определять можно не только конкретное соединение, но и класс, к которому оно относится. Одним из первых индикаторов являются индикаторы среды: фенолфталеин, метилоранж и лакмус. Молекулы этих веществ меняют свою конфигурацию в зависимости от кислотности раствора, на чем основана их индикаторная значимость.
В лабораториях и на производстве часто используют не сам раствор, а бумажку, пропитанную им – индикаторную бумагу. Существует несколько типов таких бумаг:
- Универсальная;
- Фенолфталеиновая;
- Лакмусовая;
- Свинцовая и т.д.
Для каждого вида индикаторных бумажек есть шкала цвета, по которому можно определить значение того или иного результата.
Распознавание катионов щелочных металлов
Для некоторых ионов есть несколько способов их идентификации. Например, ионы щелочных металлов определяются сухим способом – окрашиванием пламени и реакциями в растворах.
Каждый ион щелочного металла окрашивает пламя в определенный цвет:
- натрий – ярко-желтый,
- калий – розово-фиолетовый,
- литий – карминово-красный,
- рубидий – темно-фиолетовый.
Для определения наличия катиона щелочного металла можно провести качественную реакцию. Для каждого катиона используется определенный реактив.
Таблица. Характеристика качественных реакций на ионы щелочных металлов.
Распознавание ионов щелочноземельных металлов
Щелочно-земельные металлы расположены во второй группе таблицы Менделеева. Они, так же, активны, но меньше щелочных. Их распространенность в природе намного выше. К этим металлам относятся: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Раньше первые два металла не относили к группе щелочно-земельных. Последние научные исследования подтвердили их принадлежность к этому ряду.
Эти металлы можно определять окрашиванием пламени, но различить правильный оттенок у некоторых из них довольно трудно:
- Be – красный;
- Mg – ярко-белый (сильное выделение тепла);
- Ca – оранжево-красный;
- Sr – карминово-красный;
- Ba – желтовато-зеленый;
- Ra – темно-красный.
Определение катионов бериллия
Бериллий имеет специфическое строение атома. Его электронная конфигурация больше свойственная инертным газам. Обычных химических реакций для определения этого катиона нет.
Бериллий определяют электрометрическим титрованием. При этом, производится титрование (по каплям) бериллия фторидом аммония в кислой среде.
Бериллий образует аквафторокомплексы [BeF4]2-, удерживая до четырех молекул воды.
Еще одним инновационным способом определения бериллия является нефелометрический метод с применением гидроксида аммиака. При этом получают мутные спеси с дальнейшим определением оптической плотности.
Описанные методы основаны не на химической реакции, а на процессе образования комплексных соединений.
Определение катионов магния
Для определения магния используют сильные щелочи, карбонат аммония или гидрофосфат натрия в присутствии солей аммония.
В первых двух случаях выпадает белый аморфный осадок. Его кристаллы настолько малы, что практически не оседаю на дно, оставаясь взвешенными в водном растворе.
- Mg2+ + 2OH- → Mg(OH)2↓
- 2Mg2+ + 4NН4+ + 2CO32- + Н2O → Mg2+(OH)2CO3↓ + 4NН4+ + CO2
- Во втором случае образуется, так же, белый осадок, но крупнокристаллический:
- Mg2+ + NН4OH + НРО42- → MgNН4РО4↓ + Н2O
Определение катионов кальция
Для определения кальция чаще всего используют угольную или сернистую кислоту. Образующиеся соли белого цвета и не растворимы в вод. При этом, они хорошо растворимы в других кислотах:
CaCl2 + (NH4)2CO3 → CaCO3 ↓+ 2NH4Cl
Еще один способ – микрокристаллоскопическая реакция с серной кислотой. Образуются белые кристаллы игольчатой формы.
4Ca + 5H2SO4 → 4CaSO4↓ + 4H2O + H2S
Определение ионов стронция
- Стронций образует белые нерастворимые осадки с серной кислотой, карбонатом аммония:
- Sr + H2SO4 = SrSO4↓+ H2
- Sr(NO3)2 + (NH4)2CO3 = SrCO3↓ + NH4NO3
- Также, для индикации используют оксалат аммония. Образующийся белый осадок растворяется во всех кислотах:
- Sr+ + C2O4- = Sr(C2O4) ↓
- Одной из самых ярких реакций на ион стронция является реакция с родизонатом натрия. При этом образуется красно-бурый осадок:
Определение катионов бария
В растворе ионы бария определяют с помощью серной кислоты или ее растворимых солей.
Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2NaNO3
При реакции образуется белый нерастворимый в кислотах осадок. Это микрокристаллоскопическая реакция, можно рассмотреть форму кристаллов под микроскопом.
Определение ионов меди
- Для обнаружения ионов меди в растворе соли в него добавляют концентрат аммиачного раствора.
- Cu2+ + 4NН3 → [Cu(NH3)4]2+
- При этом, медь образует комплексную соль ярко-синего цвета.
еще один способ — реакция с гидроксидом натрия. В результате реакции образуется синий студенистый осадок.
- Cu2+ + 2OH- = Cu(OH)2 ↓
- При его нагревании происходит разложение с образованием черного оксида меди.
- Cu(OH)2 → CuO + H2O
Медь можно определить сухим способов в пламени горелки. Она приведет к окрашиванию пламени в зеленый цвет.
Определение ионов двух- и трехвалентного железа
Железо имеет два основных иона: Fe2+ и Fe3+.
Ионы Fe3+ можно идентифицировать с помощью трех реактивов. Первый из них – щелочь. При этом образуется красно-бурый нерастворимый осадок:
FeCl₃ + 3NaOH = Fe(OH)₃↓+ 3NaCl.
Другой вариант – желтая кровяная соль K₃[Fe(CN)₆], при взаимодействии с которой трехвалентное железо образует комплексное соединение синего цвета.
Третий вариант – роданид калия (ядовитое вещество). При реакции образуется красная густая соль. Это соединение часто использовали в кинематографе в качестве искусственной крови.
Для определения Fe2+используют красную кровяную соль K₄[Fe(CN)₆]. В результате образуется соединение синего цвета (берлинская лазурь).
Определение катионов аммония
Катион аммония необычен тем, что состоят из молекулы аммиака с присоединенным за счет донорно-акцепторной связи водородом. Так, ион имеет вид NH4+. Соли аммония применяются в сельском хозяйстве, медицине.
Определить наличие этого катиона можно с помощью индикаторной бумаги. Над раствором соли аммония она синеет.
Значения цветов индикаторной бумаги
Гидроксид аммония – слабое соединение, которое распадается на аммиак и воду. Аммиак обладает характерным запахом (нашатырный спирт), по которому, так же, определяют наличие катиона аммония.
- Качественная реакция на катион аммония: NH4Cl + NaOH → NaCl + NH3↑ + H2O
- Другой способ индикации – с помощью реактива Несслера– K2[HgI4]. При взаимодействии с солями аммония образуется бурый цвет:
- NH3 + 2[HgI4]2- + 3ОН- → [NH2Hg2O]I + 7I- + 2Н2О
Реакция очень чувствительная. При малом содержании катионов аммония, цвет будет желтый.
Качественные реакции на анионы
Сульфат-ион и сульфит-ион
- Ионы серной и сернистой кислот дают одинаковую реакцию с растворимыми солями бария – образуется белый осадок:
- BaCl2 + Na2SO3 = BaSO3↓ + 2NaCl
- BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Различить их можно добавлением к полученному раствору азотной кислоты. Осадок сульфита бария растворится с образованием газа, а сульфата – нет.
BaSO3+ 2HNO3 = Ba(NO3)2 +SO2 ↑ +H2O
Хлорид-, бромид-, йодид-ион
Для определения этих ионов используют один реактив – нитрат серебра. Во всех трех случаях выпадает творожистый осадок, но цвет у каждого – свой. Фторид-ион осадок с этим реактивом не дает.
- Для индикации фторида используют нитрат кальция. При этом образуется белый осадок:
- 2NaF + Ca(NO3)2 → 2NaNO3 + CaF2↓
Карбонат-ион
- Карбонат-ион определяется в две стадии. Первая – получение угольной кислоты:
- CaCO3 + 2HCl⟶CaCl2 + H2O + CO2↑
- Эта кислота слабая и быстро диссоциирует с образованием воды и углекислого газа.






