- Химические свойства металлов — Гипермаркет знаний
- Взаимодействие воды с металлами
- Как они взаимодействуют?
- Пример взаимодействие активных металлов с водой
- Электрохимический ряд напряжений металлов (ЭРН)
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с водой
- Взаимодействие металлов с водными растворами солей
- Процесс термического распада нитратов
- Какие металлы взаимодействуют с водой при обычной температуре
- Взаимодействие с простыми веществами
- с кислородом
- с галогенами
- с неметаллами IV–VI групп
- с водородом
- Взаимодействие со сложными веществами
- с водой
- c кислотами-неокислителями
- c кислотами-окислителями
- − разбавленной азотной кислотой
- − концентрированной азотной кислотой
- − концентрированной серной кислотой
- с щелочами
- с оксидами
- Химические свойства металлов
- ЩЕЛОЧАМ
- Теоретическая часть
- Важнейшими химическими свойствами металлов являются их отношение к воде, водным растворам кислот и щелочей.
По химической активности (см. табл. «Ряд напряжений») все металлы (Ме) можно разделить на 3 группы:
- — Ме высокой активности (Li…Al);
- — Ме средней активности (после Al и до Н2);
- — Ме неактивные (после Н2).
- 1. Отношение металлов к воде
- Во взаимодействии металлов с водой при комнатной температуре наблюдаются следующие случаи:
- 1) Металлы восстанавливают водород из воды, образуя растворимые гидроксиды (щелочи) или малорастворимые гидроксиды по следующей схеме:
где n – валентность Ме.
Эти реакции свойственны для всех металлов от Li доAl включительно (Al должен быть очищен от оксидной пленки или нагрет).
2) Металлы, расположенные в ряду напряжений между Al и Н2 (Ме средней активности) реагируют с водой при температурах 500…7000С, т.е. реагируют с перегретым водяным паром, образуя оксид и выделяя водород. Например,
- 3) Металлы, расположенные в ряду напряжений после Н2 (неактивные Ме) вытеснить водород из воды не могут ни при каких условиях.
- 2. Отношение металлов к разбавленным кислотам (кроме азотной)
- Основным фактором оценки отношения металлов к разбавленным кислотам (кроме азотной), является их положение в таблице “Ряд напряжений”.
Например:
2) Металлы, имеющие положительные значения стандартных электродных потенциалов , с разбавленными кислотами не взаимодействуют. К числу таких металлов относятся: Аu, Аg, Ru, Rh, Pd, Os, Ir, Pt, а также Cu, Hg, Вi.
- Например:
- ,
- .
- Однако, следует иметь в виду, что рядом напряжений следует пользоваться с учетом особенностей рассматриваемых реакций. Так, свинец практически не растворяется в разбавленной соляной и серной кислотах вследствие образования на его поверхности нерастворимых хлоридной и сульфатной пленок (происходит пассивирование):
- ;
- .
- Отношение металлов к разбавленной азотной кислоте
Азотная кислота обладает ярко выраженной окислительной активностью. Роль окислителя в ней выполняет не ион Н+, а ион , , поэтому водород из азотной кислоты не вытесняется.
- В зависимости от активности Ме, реагирующего с разбавленной
- НNO3, восстановление идет по следующей схеме:
- (NH3 + HNO3) =
- — Ме от Li до Al
- +8ē
- +5ē — Me от Al до Cd
- +4ē
- — Me от Cd до H2
- +3ē
- — Me после H2
- Не реагируют с HNO3(р) благородные металлы, кроме серебра и палладия. Например:
- ;
- ;
- ;
- ;
- 4. Отношение металлов к концентрированной азотной кислоте и “царской водке”
- В концентрированной азотной кислоте так же, как и в разбавленной, роль окислителя выполняет ион .
- Восстановление идет по следующей схеме:
- +3ē (Ме от Li до Al)
- +ē (остальные Ме)
- Например,
- ;
- ;
- .
- Концентрированная азотная кислота (С ³ 70 %) не реагирует:
- 1) с благородными металлами (кроме Аg и Рd);
2) с пассивирующимися металлами, на поверхности которых легко образуется пленка малорастворимых оксидов.
Наличием защитной оксидной пленки объясняется пассивность данных металлов по отношению к концентрированным растворам кислот-окислителей на холоду.
К числу пассивирующихся металлов относятся Ве, Аl, Тi, Zn, Нf, V, Мn, Сr, Мо, W, Fе, Со, Ni, Вi. В горячей концентрированной азотной кислоте пассивирующиеся Ме растворяются.
Смесь азотной и соляной кислот в соотношении 1:3 (“царская водка”) — более активный окислитель, чем азотная кислота. Название (царская водка) происходит от того, что эта смесь растворяет «царя металлов» золото и другие благородные Ме. Так Аu и Рt легко растворяются в ней с образованием соответствующих хлоридов:
- .
- 5. Отношение металлов к концентрированной серной кислоте
- При действии концентрированной серной кислоты на металлы роль окислителя играет не ион Н+, как в разбавленной Н2SО4, а ион поэтому водород не выделяется, а образуются соединения серы (SО2, S или Н2S).
- Восстановление идет по следующей схеме в зависимости от активности растворяющегося Ме:
- +8ē (Me от Li до Al)
- +6ē (Ме от Al до H2)
- +2ē (Ме после Н2)
- Например:
- ;
- ;
- .
- Не растворяются в концентрированной серной кислоте:
- 1) благородные Ме, кроме Ag и Pd;
- 2) если ≥ 90%, то на холоду не растворяются пассивирующиеся Ме; в горячей концентрированной серной кислоте пассивирующиеся Ме растворяются.
- Например:
- ,
- .
Необходимо отметить, что в реакциях концентрированной серной кислоты с металлами, стоящими в ряду напряжений до водорода, в зависимости от условий протекания реакции (концентрация кислоты и температура) может выделиться любое из соединений серы (SO2, S, или H2S). Чем меньше концентрация кислоты, тем более вероятно самое глубокое восстановление металлом (выделение сероводорода Н2S).
6. Отношение металлов к водным растворам щелочей
С водными растворами щелочей могут реагировать металлы (Ве, Аl, Zn, Sn, Рb), дающие амфотерные гидроксиды. В результате образуется комплексная соль данного металла и выделяется водород.
- Например:
- ,
- — тетрагидроксоалюминат натрия,
- ,
- — тетрагидроксоплюмбат натрия.
- Экспериментальная часть
- Цель работы: изучить отношение некоторых технически важных металлов к воде, водным растворам кислот и щелочей.
- Опыт № 1
- Отношение металлов к воде
В пять пробирок налейте по 2-3мл Н2О. В первую пробирку поместите кусочек Nа, во вторую — кусочек Са, в третью насыпьте немного порошка Мg, в четвертую — железные опилки, в пятую — медную стружку.
Третью, четвертую и пятую пробирки подогрейте. Что наблюдается? Во все пробирки добавьте по 2-3 капли фенолфталеина.
Во всех ли пробирках изменилась окраска? Почему? Какие металлы не вступают во взаимодействие с водой? Объясните причину. Составьте уравнения реакций.
Опыт № 2
Химические свойства металлов — Гипермаркет знаний
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Химические свойства металлов
В химических реакциях металлы проявляют только восстановительные свойства, т. е. их атомы отдают электроны, образуя в результате положительные ионы. Окислителями при этом могут выступать неметаллы (кислород, галогены, сера и др.), катионы водорода Н+ и катионы других металлов.С кислородом воздуха легко взаимодействуют щелочные и щелочноземельные металлы:
Железо, цинк, медь и другие менее активные металлы энергично окисляются кислородом только при нагревании:
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.Как вы уже знаете, металлы образуют с неметаллами бинарные соединения — оксиды, хлориды, сульфиды, фосфиды и т. д., например:
- Щелочные и щелочноземельные металлы легко реагируют с водой, восстанавливая катионы водорода до свободного водорода, и образуют при этом растворимые гидроксиды — щелочи:
- Менее активные металлы, например железо, взаимодействуют с водой только в раскаленном виде:
При этом, как и при горении железа, получается оксид состава Fе3O4, который представляет собой смесь двух оксидов FеО • Fе2O3. Его называют также железной окалиной.
По восстановительной способности, как вы уже знаете, металлы располагаются в ряд, который называют электрохимическим рядом напряжений:К, Са, Nа, Мg, Аl, Zn, Fе, Ni, Sn, РЬ, (Н2), Сu, Нg, Аg, АuВ этот ряд помещен и водород, который, как и металлы, способен отдавать электроны, образуя при этом положительно заряженные ионы Н+.
Как вы, очевидно, помните из курса химии 8 класса, из положения металлов в ряду напряжений вытекают два правила, характеризующие химические свойства металлов. Повторим их.
1. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот, а стоящие правее — не вытесняют водород из растворов кислот:
А вот медь не реагирует с хлороводородной кислотой.
Напомним, что это правило имеет ряд поправок:а) правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;б) концентрированная серная кислота и азотная кислота любой концентрации реагирует с металлами по-особому, при этом водород не образуется;в) на щелочные металлы правило не распространяется, так как они легко взаимодействуют с водой (а указанное правило относится к реакциям водных растворов кислот с металлами).2. Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее, например:
- Это правило также имеет поправки, аналогичные таковым к первому правилу, а именно — правило соблюдается при условии образования растворимой соли; правило не распространяется на щелочные металлы.
1. Восстановительные свойства металлов.
2. Взаимодействие металлов с кислородом и другими неметаллами.
3. Электрохимический ряд напряжений.
4. Правила применения электрохимического ряда напряжений при определении возможности взаимодействия металлов с растворами кислот и солей.
5. Поправки к правилам применения электрохимического ряда напряжений.
Определите число электронов, которое отдают три атома железа молекуле воды в реакции образования железной окалины.
Какой объем воздуха потребуется для сжигания 36 г магния? (Напоминаем, что объемная доля кислорода в воздухе равна 0,21.
)Какой объем водорода может быть получен при растворении в воде 120 мг кальция, если выход газа составляет 80% от теоретически возможного?Почему щелочные и щелочноземельные металлы хранят под керосином? Почему литий, в отличие от натрия и калия, хранят в вазелине?Определите коэффициенты в следующем уравнении реакции, используя метод электронного баланса:
Какой ион проявляет в этой реакции окислительные свойства?Можно ли получить водород при взаимодействии свинца с раствором серной кислоты?Определите коэффициенты в следующем уравнении методом электронного баланса:
- Zn+ H2SO4(конц) -> ZnSO4 + H2S + H2O
- Какое вещество проявляет в этой реакции восстановительные свойства?
- аудио для урока химии, анекжоты для урока химии в 9 классе, учебные пособия
Содержание урока
конспект урока
опорный каркас презентация урока
акселеративные методы интерактивные технологии Практика
задачи и упражнения самопроверка
практикумы, тренинги, кейсы, квесты
домашние задания
дискуссионные вопросы
риторические вопросы от учеников Иллюстрации
аудио-, видеоклипы и мультимедиа
фотографии, картинки графики, таблицы, схемы
юмор, анекдоты, приколы, комиксы
притчи, поговорки, кроссворды, цитаты Дополнения
рефераты
статьи фишки для любознательных шпаргалки учебники основные и дополнительные
словарь терминов прочие
Совершенствование учебников и уроков
исправление ошибок в учебнике
обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей
идеальные уроки
календарный план на год методические рекомендации программы
обсуждения Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Взаимодействие воды с металлами
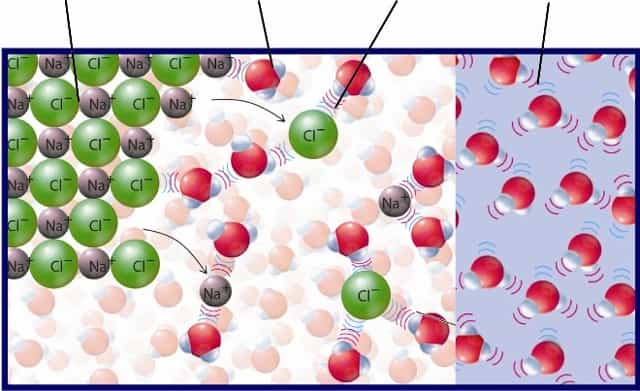
Вода обладает разнообразными свойствами. Она может замерзать. Превращаться в пар. С водой человек дружит с рождения. Помимо всего этого она так же может вступать во взаимодействие с металлом. Как? Читайте нашу статью, и Вы узнаете об этом! Вступая в контакт с жидкостью, металлы способны давать самые удивительные реакции! Например: чтобы насытить воду железом её настаивают несколько часов на железе, после чего употребляют во внутрь, а если бросить в стакан с водой щелочной металл то произойдет взрыв. Существует множество разнообразных металлов и каждый случай взаимодействия уникален! Проводите опыты, делайте собственные открытия, а посвятить Вас в основы взаимодействия воды с металлами поможет наша статья!
Как они взаимодействуют?
Взаимодействие металла с водой может происходить по разному, в зависимости от металла и воды. Каждый металл обладает своими неповторимыми особенностями.
Так же, может показаться, что формулы очень сложные, однако со временем Вы легко научитесь их читать. Если алюминий, железо вступает в активные реакции с водой, то это значит что в нем присутствуют образующиеся соли. Он окисляется ионами водорода.
Проследить это можно по формуле и записать в виде сокращенной формулировки Me + nH+ → Men+ + H2↑
Вступая в реакцию с водой, в исключительных ситуациях образуются гидроксиды. Очень активно в спокойных условиях вступают в реакцию с влагой щелочные металлы, например Литий (Li), натрий (Na) , Калий (К), Рубидий (Rb) , Цезий (Cs), Франций (FR).
- Щелочные металлы вступают в очень бурную реакцию с водой. Отследить процесс взаимодействия металлов с водой можно по формулам:
- NaH + H2O ® NaOH + H2
- NaH + HCl ® NaCl + H2
 Разные активные реакции металлы выдают так же при различных условиях. Например, в состоянии покоя и при комнатной температуре реакция может быть одна, а в других условиях взаимодействие проявляться по разному: Тихо, спокойно, бурно.
Разные активные реакции металлы выдают так же при различных условиях. Например, в состоянии покоя и при комнатной температуре реакция может быть одна, а в других условиях взаимодействие проявляться по разному: Тихо, спокойно, бурно.
Активные металлы способны вступать во взаимодействие с водой при обычных условиях согласно схеме: 2Me + 2nH2O → 2Me(OH)n + nH2 .Итогом окисления как правило становится гидроксид Me(OH)n (где n-степень окисления металла).
Приведем пример: Ca + 2H2O → Ca(OH)2 + H2↑
Металлы же со средней степенью активности вступают во взаимодействие с водой при нагревании по схеме: 2Me + nH2O Me2On + nH2 . Итогом такой реакции становится появление оксида металла. Его формула — Me2On (где n-степень окисления металла) .
Пример взаимодействие активных металлов с водой
Металлы так же используют при изготовлении кухонной утвари. К примеру алюминиевая сковородка, металлический корпус чайника, лопасти блендера. Тут важна стойкость металла. Самой известной реакцией металла на воду является окисление самой обыкновенной стали на воздухе и в воде.
Железо в таком случае разрушается, ржавеет. Происходящие при этом процессы являются весьма сложными и удивительным природным процессом. Если же окисление происходит в морской воде, то процесс ускоряется, этому способствует определенная концентрация соли находящаяся в составе воды.
Противостоять образованию ржавчины можно при использовании разнообразных лаков, призванных защитить от коррозии металла и перехитрить химические законы! Так же, вода вступая в реакцию с нагретым металлом способна образовывать накипь.
Это явление можно наблюдать на частях чайника сделанных из алюминия или стали, который давно не чистили. Такой чайник достаточно прокипятить с лимонной кислотой и он снова будет как новый!
Иногда образование накипи не связано с активными металлами, а имеет немного другую природу. В частности, накипь может появляться из-за солей жесткости в воде. В таком случае нужно купить качественный фильтр для жесткой воды.
Электрохимический ряд напряжений металлов (ЭРН)
| Li | K | Ba | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | Hg | Ag | Pt | Au |
Ряд напряжений металлов широко используется в неорганической химии. В частности, результаты многих реакций и даже возможность их осуществления зависят от положения некоторого металла в ЭРН. Обсудим этот вопрос подробнее.
Взаимодействие металлов с кислотами
Металлы, находящиеся в ряду напряжений левее водорода, реагируют с кислотами — неокислителями. Металлы, расположенные в ЭРН правее Н, взаимодействуют только с кислотами — окислителями (в частности, с HNO3 и концентрированной H2SO4).
- Пример 1. Цинк расположен в ЭРН левее водорода, следовательно, способен реагировать практически со всеми кислотами:
- Zn + 2HCl = ZnCl2 + H2
- Zn + H2SO4 = ZnSO4 + H2
- Пример 2. Медь находится в ЭРН правее Н; данный металл не реагирует с «обычными» кислотами (HCl, H3PO4, HBr, органические кислоты), однако вступает во взаимодействие с кислотами-окислителями (азотная, концентрированная серная):
- Сu + 2HCl ≠
- Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
- Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
Обращаю внимание на важный момент: при взаимодействии металлов с кислотами-окислителями выделяется не водород, а некоторые другие соединения. Подробнее об этом можно почитать здесь!
Взаимодействие металлов с водой
- Металлы, расположенные в ряду напряжений левее Mg, легко реагируют с водой уже при комнатной температуре с выделением водорода и образованием раствора щелочи.
- Пример 3.
Натрий, калий, кальций легко растворяются в воде с образованием раствора щелочи:
- 2Na + 2H2O = 2NaOH + H2
- 2K + 2H2O = 2KOH + H2
- Ca + 2H2O = Ca(OH)2 + H2
Металлы, расположенные в ряду напряжений от водорода до магния (включительно), в ряде случаев взаимодействуют с водой, но реакции требуют специфических условий. Например, алюминий и магний начинают взаимодействие с Н2О только после удаления оксидной пленки с поверхности металла. Железо не реагирует с водой при комнатной температуре, но взаимодействует с парами воды. Кобальт, никель, олово, свинец практически не взаимодействуют с H2O не только при комнатной температуре, но и при нагревании.
Металлы, расположенные в правой части ЭРН (серебро, золото, платина) не реагируют с водой ни при каких условиях.
Взаимодействие металлов с водными растворами солей
- Речь пойдет о реакциях следующего типа:
- металл (*) + соль металла (**) = металл (**) + соль металла (*)
- Хотелось бы подчеркнуть, что звездочки обозначают в данном случае не степень окисления, не валентность металла, а просто позволяют различить металл № 1 и металл № 2.
- Для осуществления подобной реакции необходимо одновременное выполнение трех условий:
- соли, участвующие в процессе, должны растворяться в воде (это легко проверить, пользуясь таблицей растворимости);
- металл (*) должен находиться в ряду напряжений левее металла (**);
- металл (*) не должен реагировать с водой (что тоже легко проверяется по ЭРН).
- Пример 4. Рассмотрим несколько реакций:
- Zn + CuSO4 = ZnSO4 + Cu
- Fe + CuS ≠
- Pb + FeSO4 ≠
- K + Ni(NO3)2 ≠
- Первая реакция легко осуществима, все перечисленные выше условия выполнены: сульфат меди растворим в воде, цинк находится в ЭРН левее меди, Zn не реагирует с водой.
Вторая реакция невозможна, т. к. не выполнено первое условие (сульфид меди (II) практически не растворяется в воде). Третья реакция неосуществима, поскольку свинец — менее активный металл, нежели железо (находится правее в ЭРН). Наконец, четвертый процесс НЕ приведет к осаждению никеля, поскольку калий реагирует с водой; образовавшийся гидроксид калия может вступить в реакцию с раствором соли, но это уже совершенно другой процесс.
Процесс термического распада нитратов
Напомню, что нитраты — это соли азотной кислоты. Все нитраты разлагаются при нагревании, но вот состав продуктов разложения может быть разным. Состав определяется положением металла в ряду напряжений.
- Нитраты металлов, расположенных в ЭРН левее магния, при нагревании образуют соответствующий нитрит и кислород:
- 2KNO3 = 2KNO2 + O2
- В ходе термического разложения нитратов металлов, расположенных в ряду напряжений от Mg до Cu включительно, образуются оксид металла, NO2 и кислород:
- 2Cu(NO3)2 = 2CuO + 4NO2 + O2
- Наконец, при разложении нитратов наименее активных металлов (расположенных в ЭРН правее меди) образуются металл, диоксид азота и кислород:
- Hg(NO3)2 = Hg + 2NO2 + O2
Какие металлы взаимодействуют с водой при обычной температуре
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы.
Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием.
В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме0 – 2e— → Ме+2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO.
Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
- Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
- 2Mg + O2 = 2MgO
- 2Ca + O2 = 2CaO
- 2Ba + O2 = 2BaO
- Ba + O2 = BaO2
- Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
- Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
- Мg + I2 = MgI2 – иодид магния
- Са + Br2 = СаBr2 – бромид кальция
- Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл.
Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена.
Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла.
С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
При воспалении какая базальная температура
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода.
Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO.
В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
- Ве + Н2SO4(разб.) = BeSO4 + H2↑
- Mg + 2HBr = MgBr2 + H2↑
- Ca + 2CH3COOH = (CH3COO)2Ca + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
- С разбавленной азотной кислотой реагируют все металлы IIA группы.
При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
- 4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + N2O↑ + 5H2O
- 4Mg + 10HNO3(сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
- Be + 2H2SO4 → BeSO4 + SO2↑+ 2H2O
- Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
- Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
- 4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S↑ + 4H2O
с щелочами
- Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении.
При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
- Be + 2KOH + 2H2O = H2↑ + K2[Be(OH)4] — тетрагидроксобериллат калия
- При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
- Be + 2KOH = H2↑+ K2BeO2 — бериллат калия
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Химические свойства металлов
Общие представления о химической устойчивости металлов. Металлы и их сплавы – важнейшие конструкционные материалы. Чтобы иметь представление о химической устойчивости этих материалов, необходимо знать свойства металлов, их поведение в различных средах. Химические свойства металлов объясняются следующими особенностями.
Все металлы – восстановители, что обусловлено строением их атомов.
Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо – атомы металлов характеризуются низкими энергиями ионизации и близким к нулю или отрицательным сродством к электрону.
Именно поэтому металлы легко отдают валентные электроны, выступая в качестве восстановителей и превращаясь в положительные ионы и, как правило, не способны присоединять электроны – проявлять окислительные свойства.
Все металлы по восстановительным свойствам разделены на три группы:
1) активные металлы (в «Ряду напряжений» находятся от Li до Al включительно);
2) металлы средней активности (в ряду напряжений находятся от Al до H2);
3) малоактивные металлы (в ряду напряжений стоят после водорода).
Будучи восстановителями, металлы могут взаимодействовать с окислителями. Важнейшим окислителем, входящим в состав воздуха, является кислород. С кислородом взаимодействуют почти все металлы, кроме Ag, Au, Hg и платиновых металлов, причём щелочные и щелочноземельные взаимодействуют очень активно, так что уже при обычной температуре рубидий и цезий самовозгораются:
4Cs + O2 = 2Cs2O.
Хотя процессы взаимодействия других металлов с кислородом протекают менее активно, их окисление всегда термодинамически выгодно, т.к. сопровождается уменьшением свободной энергии Гиббса. Образующиеся при этом оксиды во многих случаях придают химическую устойчивость изделиям из металла.
Термодинамическая возможность реакции металла с тем или иным окислителем определяется условием или ЭДС реакции (Е = jо — jв ) положительна. Сравнение ряда потенциалов окислителей:
| F2/2F | Cl2/2Cl | Br2/2Br | O2/OH | H2O, H/H2 |
| +2,87 | +1,356 | +1,087 | +1,23 (рН=0) | 0,0 (рН=0) |
| +0,82 (рН=7) | -0,41 (рН=7) |
с электродными потенциалами металлов позволяет сделать следующие выводы. Все металлы окисляются фтором и могут окисляться хлором. Большинство металлов (кроме платины и золота) могут окисляться бромом и кислородом в кислой среде. В нейтральной среде кислород не может окислять золото, платиновые металлы, ртуть, серебро.
Ионы водорода в кислой среде могут окислять многие металлы, кроме платиновых, ртути, золота, серебра, меди, рения, сурьмы и висмута. Реальная возможность окисления того или иного металла определяется не только термодинамикой, но и кинетикой процесса.
Взаимодействие многих металлов с окислителями тормозится пассивными пленками на поверхности металлов.
Взаимодействие металлов с водой. Окислителем в этом случае является катион водорода (ион гидроксония Н3О+), присутствующий в результате равновесной реакции Н2О D Н+ + ОН.
- Схема ОВР:
- Me + H2O ® H2 + Me(OH)n
- Me – n® Men+
- 2H2O + 2® H2 + 2OH.
Для того чтобы выяснить, какие металлы окисляются катионами водорода, концентрация которых обусловлена диссоциацией молекул воды, необходимо определить окислительно-востановительный потенциал водородного электрода в воде. При 25оС и рН = 7 , Е = .
ЭДС реакции будет положительна (Е > 0), если < - 0,41В. Значит, все металлы, имеющие стандартный электродный потенциал меньший, чем – 0,41В (в «Ряду напряжений» стоят до кадмия включительно), могут окисляться катионами водорода, т.е.
восстанавливать водород из воды.
Чтобы процесс мог протекать до конца, необходимо, чтобы образующиеся гидроксиды Me(OH)n были растворимы в воде. В противном случае, вследствие образования малорастворимых оснований, покрывающих металл, реакция практически прекращается.
- Примеры:
- 1. 2Na + 2H2O ® H2 + 2NaOH
- < - 0,41B
- 2 Na – eˉ = Na+
- 1 2H2O + 2е = H2# + 2OH-
- 2Na + 2H2O ® 2 Na+ + H2 + 2OH.
- 2. Zn +2 H2O ® H2 + Zn(OH)2¯
Процесс термодинамически возможен, т.к. < - 0,41B, но из-за образования малорастворимого Zn(OH)2, предохраняющего цинк от воздействия воды, практически не идёт.
3. Cu + H2O
Процесс термодинамически не возможен, т.к. > — 0,41B.
Приведённые выше расчёты указывают лишь на возможность осуществления процесса, а не на обязательное его протекание. В действительности существуют ограничения, которые препятствуют реализации такой возможности, а иногда полностью её исключают.
Например, пассивацию поверхности металла малорастворимым соединением, в частности основанием, мы уже рассмотрели. На возможность реального осуществления реакции влияет реальное состояние поверхности (наличие оксидных плёнок).
Так, в соответствии с электродными потенциалами металлы Be, Mg, Al, Ti и др. должны взаимодействовать с водой (восстанавливать катионы водорода из воды). Однако оксидные поверхностные слои, не растворимые в воде, исключают возможность такого взаимодействия.
Нерастворимость TiO2 ни в воде, ни в разбавленных растворах кислот и щелочей обусловливает высокую химическую пассивность титана.
- Взаимодействие металлов с растворами щелочей. Только амфотерные металлы Be, Al, Zn, Pb, Sn могут взаимодействовать с растворами щелочей по ионно-молекулярной схеме:
- Мe + H2O + OH H2 + [Мe(OH)n]m-,
- где n, m – степень окисления металла и заряд комплексного иона, соответственно.
- В качестве примера рассмотрим взаимодействие бериллия с раствором гидроксида натрия. Схема процесса:
- Be0 + H2O + NaOH H2+ Na2[Be(OH)4]
- или
- Be0 + H2O + OHH2+ [Be(OH)4]2-
- в-ль ок-ль продукт продукт
- в-ния ок-ия
- Схемы полуреакций и ионно-молекулярное уравнение:
- 1 Be + 4OH– 2eˉ = [Be(OH)4]2-
- 1 2H2O + 2eˉ = H2 + 2OH
- Be + 4OH+ 2H2O = [Be(OH)4]2- + H2 + 2OH
- Be + 2OH+ 2H2O = [Be(OH)4]2- + H2
- Молекулярное уравнение:
- Be0 + 2H2O + 2NaOH = H2 + Na2[Be(OH)4] .
Для определения металлов, восстанавливающих водород из щелочных растворов, т.е. для расчёта ЭДС реакции нельзя пользоваться потенциалами окислительно-восстановительных систем , т.к. металл, окисляясь, переходит в значительно более сложный ион – [Me(OH)n]m- . В подобных случаях надо рассматривать потенциал системы [Me(OH)n]m-/Ме.
Кроме того, концентрация [H+] в щелочном растворе зависит от концентрации щелочи. Например, для 1М раствора NaOH [OH] = 1 моль/л; при 25 0С [H+] = = 10-14 моль/л. Отсюда .
Взаимодействие металлов с растворами кислот.Минеральные кислоты HCl, H3PO4, H2SO4 разбавленная и др., за исключением HNO3 любой концентрации и H2SO4 концентрированной, являются окислителями металлов за счёт катионов водорода.
- Для перечисленных кислот взаимодействие с металлами идёт по схеме:
- Ме + 2Н+ ® Меn+ + H2
- Определим ЭДС данной ОВР в общем виде в стандартных условиях:
- Ео =
- Чтобы металл мог восстанавливать катионы Н+ до Н2 при взаимодействии с перечисленными минеральными кислотами, необходимо, чтобы его стандартный электродный потенциал был меньше нуля вольт и образующаяся соль была растворимой в воде (реакция будет идти до конца; в противном случае поверхность металла запассивируется).
- Примеры:
- 1. Zn + 2HCl ® H2 + ZnCl2
- , процесс термодинамически возможен.
- 1 Zn – 2eˉ = Zn2+
- 1 2H+ + 2eˉ = H2
- Zn + 2H+ = Zn2+ + H2
- 2. Pb + H2SO4 = PbSO4¯ + H2
- , процесс возможен, но образующаяся в начальный момент малорастворимая соль PbSO4 покрывает металл пассивирующей солевой плёнкой и реакция практически прекращается.
Особенности взаимодействия металлов с растворами азотной кислоты. В азотной кислоте сильным окислителем является нитрат- ион NO, поэтому при её взаимодействии с металлами водород Н2 не выделяется, а протекает восстановление NO. Каким будет продукт восстановления — зависит от концентрации кислоты и активности металла.
Чем активнее металл и чем меньше концентрация кислоты, тем в большей степени восстанавливается азот (понижается его степень окисления). Азотная кислота как сильный окислитель окисляет металлы до высоких степеней окисления, взаимодействует со всеми металлами, стоящими в «Ряду напряжений», по серебро включительно.
- В зависимости от концентрации кислоты и активности металла получаются следующие продукты:
- -3
- HNO3 + Me(акт) = NH4NO3 + Me(NO3)n + H2O






