- Общая характеристика
- Природные соединения
- Получение
- Химические свойства
- Оксиды щелочных металлов
- Получение
- Химические свойства
- Гидроксиды щелочных металлов
- Получение
- Химические свойства
- Литий — в космосе, на земле, под водой
- Из четырех процентов
- Свойства лития
- Месторождения
- Добыча
- Производство
- Применение
- Плюсы и минусы литиевых батарей ?
- Стоимость
- Литий металл или неметалл? Все свойства лития, применение и добыча
- Краткое описание
- Из четырех процентов
- Структура и характеристики
- История открытия и изучения
- Распространенность лития
- В природе
- Месторождения и добыча
- Где в России добывают литий и производят литиевую продукцию?
- Промышленное получение
- Свойства
- Основные параметры лития по таблице Менделеева
- Химические
- Электронная схема лития
- Степень окисления лития
- Гидроксид лития (LiOH) формула, свойства, риски и применение / химия
- Физико-химические свойства
- Реактивность и опасности
- приложений
- ссылки
- Гидроксид лития: получение, химические свойства
- Способы получения
- Качественная реакция
- Химические свойства
- § 35. Характеристика химического элемента по его положению в периодической системе
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
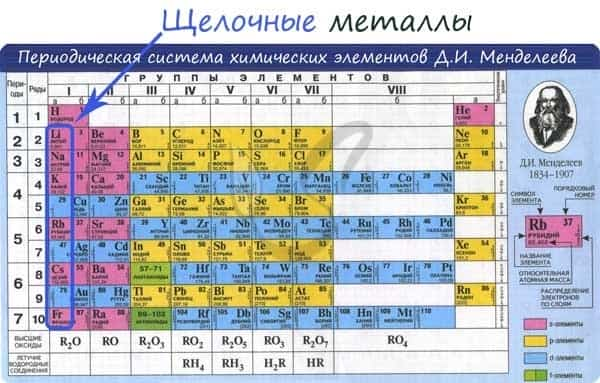
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвин
- NaCl*KCl — сильвинит

Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Li + O2 → Li2O (оксид лития)
- Na + O2 → Na2O2 (пероксид натрия)
- K + O2 → KO2 (супероксид калия)
- Реакции с неметаллами
- Li + H2 → LiH (в гидридах водород -1)
- Na + F2 → NaF (в фторидах фтор -1)
- Na + S → Na2S (в сульфидах сера -2)
- K + N2 → K3N (в нитридах азот -3)
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий — пероксид, калий, рубидий и цезий — супероксиды.
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет». Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный, цезий — синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
- Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
- Li + O2 → Li2O (оксид лития)
- В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
- Na2O2 + Na → Na2O
- KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание — реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание — мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.
Получение
- Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
- KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде — хлор)
- Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
- K + H2O → KOH + H2↑
- Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
- LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке — получается кислая соль)
- 2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке — получается средняя соль)
- KOH + SO2 → KHSO3 (соотношение 1:1 — получается кислая соль)
- 2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 — получается средняя соль)
- NaOH + MgBr2 → NaBr + Mg(OH)2↓
- С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов — смешанных оксидов (при высоких температурах — прокаливании).
- NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
- NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел — смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
- Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
- NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
- NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
- В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
- NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

- NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
- Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам — и азотной, и азотистой.
- LiOH + NO2 → LiNO2 + LiNO3 + H2O
Литий — в космосе, на земле, под водой
Главная › Металлы
10.10.2020
«По значимости в современной технике литий является одним из важнейших редких элементов».
Краткая химическая энциклопедия.
Из четырех процентов
История открытия лития началась с …математики. Химик Арфведсон анализировал минерал с рудника Уто.
Ученый определил, что это обычный алюмосиликат, и содержание в нем алюминия, кремния и кислорода составляет 96%. Настырный химик задумался — что с оставшимися 4%.
Отделив основные составляющие и растворив остаток, он получил раствор со щелочными свойствами. Логично было предположить, что открыт новый элемент.

Описанием минерала, из которого извлекли новый элемент, служат слова: «обычный булыжник». Потому и назвали новый металл литием (litos по латыни камень).
Свойства лития
Характеристики:
- относится к пластичным и мягким металлам (легко режется ножом);
- его легко отличить от других металлов — он самый легкий на Земле, не тонет даже в керосине (плотность почти в 2 раза меньше плотности воды);
- структура кристаллической решетки объемноцентрированная, кубическая;
- в ряду щелочных металлов у лития самые высокие температуры плавления и кипения.
Химические свойства:
- В условиях повышенной влажности реагирует с газами воздуха. Образуются соединения с литием — нитриды, карбонаты, гидроксиды.
- Постоянная валентность лития 1+.
- С водой реагирует по формуле 2Li + 2H₂O → 2LiOH + H₂↑.
- Охотно реагирует с галогенами (кроме йода), образует галогениды.
- При температуре от 100 до 300 градусов образует на поверхности оксидную пленку.
| Ли́тий / Lithium (Li), 3 |
| [6,938; 6,997][комм 1][1] а. е. м. (г/моль) |
| [He] 2s1, 1s22s1 |
| 145[2] пм |
| 134[2] пм |
| 76 (+1e)[3] пм |
| 0,98 (шкала Полинга) |
| -3,06 В |
| +1 |
| 519,9 (5,39) кДж/моль (эВ) |
| 0,534 г/см³ |
| 453,69 K (180,54 °C, 356,97 °F) |
| 1613 K (1339,85 °C, 2443,73 °F) |
| 2,89 кДж/моль |
| 148 кДж/моль |
| 24,86[4] Дж/(K·моль) |
| 13,1 см³/моль |
| кубическая объёмноцентрированная |
| 3,490 Å |
| 400 K |
| (300 K) 84,8 Вт/(м·К) |
| 7439-93-2 |
Рекомендуем: НАТРИЙ — соль жизни
Месторождения
В природе литий содержится в солевых растворах (подземных водах). Твердые источники часто расположены в пегматитовых рудах. Минералы: сподумен, лепидолит, эльбаит, ядарит.
В России 16 месторождений, но добыча не производится.
Мировые месторождения:
- Боливия;
- Аргентина;
- Чили;
- Китай.
Добыча
В добыче литиевого рассола есть пара проблем — география и надежность.
Рассол выкачивают в «бассейны» — специальные пруды, где естественным выпариванием концентрируется содержание элемента. Нужна постоянно высокая температура (география) и время — процесс занимает до года. Дальше концентрированная рапа (1-2% Li) отправляют на обработку на химзавод.

Твердые источники разрабатываются традиционными методами бурения и переработки.
В мире четыре производителя контролируют 85% добычи (основные — Аргентина и Чили).
Производство
Способы получения лития зависит от исходного материала.
Солевые растворы (рапа) выпаривают, затем осаждают литиевое соединение.
Твердые минералы вначале обогащают (с помощью магнитной сепарации, гравитационных методов, а при добыче крупных кристаллов сподумена просто вручную). Производство происходит в основном гидрометаллургическим способом.
Применение
Литий и его соединения используют:
- В производстве аккумуляторов и батарей.
- В качестве лигатуры в сплавах.
- В ядерной энергетике, радиоэлектронике.
- В медицине (соединения лития используют в лечении подагры, как психотропные, антидепрессанты).
- В пиротехнике (LiNO3 даст фейерверку красный цвет).
Рекомендуем: ВОЛЬФРАМ — самый тугоплавкий металл
Мировое применение легкого металла распределяется так:
- 56% производство батарей и аккумуляторов;
- 23% керамика и стекло;
- 6% консистентные смазки;
- 2% воздухоочистка;
- 13% прочие.
Плюсы и минусы литиевых батарей ?
Эти аккумуляторы и батареи просты в эксплуатации, они постоянно готовы к эксплуатации.

| Достоинства | Недостатки |
| Хороший ресурс эксплуатации (до 10 лет) | Взрывоопасны при нарушении герметичности корпуса |
| Запас циклов зарядки-разрядки более 1000 | Срок службы зависит от времени работы (не от количества циклов зарядка-разрядка) |
| Нет «эффекта памяти» (батареи можно регулярно подзаряжать) | Работает в ограниченном температурном диапазоне (от -20 до +50оС) |
| Легкий вес | Высокая цена |
Стоимость
Цена лития марки ЛЭ-1 (99,9%) за килограмм 15 000 рублей.
Литий — в космосе, на земле, под водой Ссылка на основную публикацию 
Литий металл или неметалл? Все свойства лития, применение и добыча
Его название связано с греческим словом «камень» и впервые звучало как «литион». Все из-за того, что обнаружен он был в камнях или же минералах. До XIX века не было известно, металл литий или неметалл. О существовании такого элемента никто и не догадывался, пока швед Иоганн Авфердсон в 1817 году не обнаружил неизвестную щелочь в минералах сподумене и петалите.
Из-за активности вещества ученому не удалось получить из щёлочи элемент. Зато годом позже это сделал англичанин Хэмфпри Дэви посредством электролиза. После этого его можно было изучать, и научный мир смог узнать, что такое литий. Оказалось, что это легкий и мягкий металл с довольно интересными свойствами.

Уже через четверть века его научились получать промышленным путём и сразу нашли ему применение. Литий использовали в медицине, назначая его от головной боли, подагры и ревматизма. Хотя реальная его польза при этих недугах доказана не была. В XX веке на основе карбоната лития появился напиток с лимоном и лаймом. Сейчас он известен как 7Up, но соединения металла в него уже не входят.
Краткое описание
Литий — щелочной металл, который имеет выраженные пластичные свойства, серебристый цвет, характерный металлический блеск. Его легко обрабатывать, он имеет низкую температуру плавления — 180°C. Если сравнивать его с другими щелочными металлами, он обладает самой низкой плотностью. Поскольку она ниже чем у воды, материал всплывает на поверхность.
Из четырех процентов
История открытия лития началась с …математики. Химик Арфведсон анализировал минерал с рудника Уто.
Ученый определил, что это обычный алюмосиликат, и содержание в нем алюминия, кремния и кислорода составляет 96%. Настырный химик задумался — что с оставшимися 4%.
Отделив основные составляющие и растворив остаток, он получил раствор со щелочными свойствами. Логично было предположить, что открыт новый элемент.

Описанием минерала, из которого извлекли новый элемент, служат слова: «обычный булыжник». Потому и назвали новый металл литием (litos по латыни камень).
Структура и характеристики
Структура кристаллической решетки металлического лития — кубическая, объемноцентрированная. Ее параметры — 3,490 Å. Данные характеристики соблюдаются только при комнатной температуре.
Атом лития имеет две оболочки — внешнюю и внутреннюю. На внешней расположены электроны. Они участвуют в образовании химических связей.
История открытия и изучения
Первый образец металлического лития был получен благодаря работе Гемфри Дэви. С помощью электрического тока он разложил расплав гидроксида этого щелочного металла. Через некоторое время Леопольд Гмелин проэкспериментировал с литиевосодержащими солями. Он смог выявить, что они окрашивают пламя в темный цвет.
Основная заслуга в открытии нового химического элемента и росте его популярности принадлежит Иоганну Августу. В 1817 году он нашел новое вещество в составе петалита, алюмосиликата. Через некоторое время литий нашли и в других минеральных образованиях. Такое название он получил из-за того, что впервые был найден в камнях. Название камня по гречески — «литос».
Распространенность лития
Вселенная состоит из лития на 6×10-7% Солнце состоит из лития на 6×10-9% Мировой океан состоит из лития на 0.000018% Человеческое тело состоит из лития на 3×10-6%
В природе
На нашей планете литий встречается только в соединениях. Он содержится в морской воде в количестве примерно 0,17 мг/л и в сильносолёных озёрах. Он также содержится в верхний слоях земной коры в количестве 21 г/т.
Литий в основном содержится в лепидолитах, сподуменах, петалитах, литиофилитах, амблигонитах и циннвальдитах. Встречается вместе с редкими элементами в пегматитах и онгонитах. Он может образовывать самостоятельные минералы, а может замещать в них калий.

Металл присутствует и в космосе, главным образом в звездах-гигантах. Огромное количество лития находится в объекте Торна-Житкова, который состоит из красного гиганта с нейтронной звездой внутри.
Месторождения и добыча
Литий содержится в разных минералах. Самые богатые по содержанию этого щелочного металла камни — слюда лепидолит, пироксен сподумен. Литий можно найти в разных породообразующих минералах. В них он замещает кальций.
Основные месторождения этого металла находятся в Боливии, Чили, Аргентине, США, Китае, Конго, Сербии, Бразилии, Австралии, России.
Где в России добывают литий и производят литиевую продукцию?
Собственная добыча лития в России была полностью утрачена после распада СССР. Первый литиевый рудник был введен в эксплуатацию еще в 1941 году в Восточном Забайкалье, на Завитинском месторождении сподумена.
Предприятие проработало 56 лет и было законсервировано в 1997 году в связи с изменением экономической ситуации.
С конца 1990-х годов из-за закрытия единственного рудника в Восточном Забайкалье литиевую продукцию импортировали в основном из Чили, Боливии, Аргентины, США и Китая.
В 2017 году в России была запущена экспериментальная установка, позволяющая добывать литий из бедных руд с небольшими затратами. Внедряемая технология поможет обеспечить потребность страны в литии полностью за счет собственных запасов и избавиться от импортного сырья.
Запасы лития в России, по оценке экспертов Аналитического кредитного рейтингового агентства (АКРА), составляют около 900 тыс. тонн. Более 50% запасов сосредоточено в редкометалльных месторождениях Мурманской области.
Производство литиевой продукции ведется на Сибирском химическом комбинате (Северск), а также на Химико-металлургическом заводе (Красноярск), Новосибирском заводе химических концентратов, также им занимается «ТД Халмек» (Москва).
Промышленное получение
Для получения лития промышленными способами сначала происходит подготовка расходного сырья — минералов или солевых растворов, которые добываются из соляных озер. Независимо от способа добычи расходного сырья, на выходе получается Li2CO3, который будет проходить промышленную обработку.
Способы получения расходного сырья:
- электролиз;
- восстановление;
- рафинирование.
Выбор промышленного способа получения щелочного металла зависит от наличия оборудования, требуемого результата, вида расходного сырья.
Свойства
Свойства элемента известны ученым давно. По сравнению с другими щелочными металлами он имеют ряд уникальных особенностей, по которым определяются основные сферы применения этого вещества.
Основные параметры лития по таблице Менделеева
Атомный номер Z 3 Атомная масса 6.941 Группа 1 Период 2 Принадлежность к группе щелочные металлы
Химические
Свойства:
- молярная масса — 6,941;
- валентность — 1;
- электроотрицательность — 1;
- атомный номер — 3;
- ковалентный радиус — 1,23 А;
- теплоемкость — 3,307 кДж/(кг·°С).
Литий проявляет стабильность находясь на воздухе. Из группы щелочных металлов он наименее активный. Про взаимодействии с сухим воздухом и кислородом практические не реагирует (при условии соблюдения комнатной температуры).
Взаимодействие лития с водой проходит относительно спокойно. При контакте с водой он начинает образовывать щелочь, выделять кислород. Металл плавает на поверхности жидкости, быстро растворяясь и издавая характерное шипение.
При влажном воздухе металл вступает в реакции с газами, которые содержатся в нем (особенно с азотом). Оксидная пленка покрывает поверхности лития при нагревании до 100–300°C. Пленка защищает металл от окислительных процессов.
При реакции с серой образуется сульфид (при условии нагревания до 130°C). С кремнием вступает в реакцию при нагревании до 700°C. Растворяется в жидком аммиаке, образуя раствор синего цвета.
Литий нельзя хранить в керосиновой жидкости. Из-за малой плотности материал всплывет на поверхность. Для хранения подойдет минеральное масло, газолин, парафин. Емкость лучше выбирать из жести. Она должна герметично закрываться.
Электронная схема лития
Li: 1s2 2s1 → Li-: 1s22s2
- Одинаковую электронную конфигурацию имеют ион лития -1 и Be, +1B, +2C, +3N
- Порядок заполнения оболочек атома лития (Li-) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
- На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
- Литий имеет 3 электрона, заполним электронные оболочки в описанном выше порядке:
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
Степень окисления лития
- Атомы лития в соединениях имеют степени окисления 1, -1.
- Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
- то степень окисления положительная.
Гидроксид лития (LiOH) формула, свойства, риски и применение / химия
гидроксид лития представляет собой химическое соединение формулы LiOH (EMBL-EBI, 2008). Гидроксид лития является основным неорганическим соединением. Это используется в значительной степени в органическом синтезе, чтобы продвинуть реакцию из-за ее сильной основности.
Гидроксид лития не встречается в природе свободно. Он очень реактивный, и если бы он был в природе, он мог бы легко реагировать с образованием других соединений. Однако некоторые минералы лития / алюминия, которые образуют различные смеси, могут быть найдены в различных минералах..
В 1950 году изотоп Li-6 использовался в качестве сырья для производства термоядерного оружия, такого как водородная бомба.
С этого момента индустрия атомной энергетики США начала использовать большое количество гидроксида лития, что привело к неожиданному развитию литиевой промышленности (Lithium hydroxide, 2016).
Большая часть гидроксида лития образуется в результате реакции между карбонатом лития и гидроксидом кальция (формула гидроксида лития, S.F.). Эта реакция дает гидроксид лития, а также карбонат кальция:
- Li2Колорадо3 + Ca (OH)2 → 2 LiOH + CaCO3
- Его также готовят из реакции оксида лития и воды:
- Li2O + H2O → 2LiOH
Гидроксид лития использовался в качестве абсорбента углекислого газа на подводной лодке и надувном источнике армейского воздушного шара в 1944 году..
индекс
- 1 Физико-химические свойства
- 2 Реактивность и опасности
- 3 использования
- 4 Ссылки
Физико-химические свойства
Гидроксид лития — это белые кристаллы без характерного аромата (Национальный центр биотехнологической информации, 2017). Его внешний вид показан на рисунке 2.
В водном растворе он образует кристаллическую жидкость с едким ароматом. Его молекулярная масса составляет 23,91 г / моль. Он существует в двух формах: безводный и моногидрат LiOH.H2O, который имеет молекулярную массу 41,96 г / мес. Соединение имеет плотность 1,46 г / мл для безводной формы и 1,51 г / мл для моногидратированной формы..
Его температуры плавления и кипения составляют 462 ° C и 924 ° C соответственно. Гидроксид лития является единственным щелочным гидроксидом, который не имеет полиморфизма, а его сеть имеет тетрагональную структуру. Это соединение очень хорошо растворяется в воде и слабо растворяется в этаноле (Royal Society of Chemistry, 2015).
Гидроксид лития и другие щелочные гидроксиды (NaOH, KOH, RbOH и CsOH) очень универсальны для использования в органическом синтезе, потому что они являются более сильными основаниями, которые легко реагируют.
Может реагировать с водой и углекислым газом при комнатной температуре. Он также может реагировать со многими металлами, такими как Ag, Au, Cu и Pt, поэтому он является важным исходным материалом в металлоорганическом синтезе..
Растворы гидроксида лития экзотермически нейтрализуют кислоты с образованием солей и воды. Они реагируют с определенными металлами (такими как алюминий и цинк) с образованием оксидов или гидроксидов металлов и образуют газообразный водород. Они могут инициировать реакции полимеризации в полимеризуемых органических соединениях, особенно эпоксидах..
Он может генерировать легковоспламеняющиеся и / или токсичные газы с солями аммония, нитридами, галогенированными органическими соединениями, различными металлами, пероксидами и гидропероксидами. Может служить катализатором.
Реагирует при нагревании выше примерно 84 ° C с водными растворами редуцирующих сахаров, кроме сахарозы, с образованием токсичных уровней окиси углерода (CAMEO, 2016).
Реактивность и опасности
Гидроксид лития является стабильным соединением, хотя он несовместим с сильными кислотами, углекислым газом и влагой. Вещество разлагается при разогреве (924 ° C) с образованием токсичных паров.
Раствор в воде является сильной основой, бурно реагирует с кислотой и вызывает коррозию алюминия и цинка. Реагирует с окислителями.
Это вещество вызывает коррозию глаз, кожи, дыхательных путей и проглатывания. Вдыхание вещества может вызвать отек легких.
Симптомы отека легких часто проявляются только через несколько часов и усиливаются при физической нагрузке. Воздействие может привести к смерти. Последствия могут быть отсрочены (Национальный институт безопасности и гигиены труда, 2015 г.).
Если соединение попало в глаза, контактные линзы должны быть проверены и удалены. Глаза следует немедленно промыть большим количеством воды в течение не менее 15 минут холодной водой.
При попадании на кожу пораженный участок следует немедленно промыть в течение не менее 15 минут большим количеством воды или слабой кислоты, например, уксуса, при снятии загрязненной одежды и обуви..
Покройте раздраженную кожу смягчающим средством. Стирайте одежду и обувь перед тем, как использовать их снова. Если контакт сильный, промойте дезинфицирующим мылом и покройте кожу, загрязненную антибактериальным кремом.
В случае вдыхания пострадавшего следует перенести в прохладное место. Если вы не дышите, вам дадут искусственное дыхание. Если дыхание затруднено, обеспечьте кислород.
При проглатывании соединения не следует вызывать рвоту. Ослабьте тесную одежду, такую как воротник рубашки, ремень или галстук.
Во всех случаях требуется немедленная медицинская помощь (паспорт безопасности материала Гидроксид лития, 21).
приложений
Гидроксид лития используется при производстве литиевых солей (мыл) стеариновой кислоты и других жирных кислот.
Эти мыла широко используются в качестве загустителей в консистентных смазках для улучшения термостойкости, водостойкости, стабильности и механических свойств. Жировые добавки можно использовать в подшипниках автомобиля, самолета, крана и т. Д..
Обожженный твердый гидроксид лития может использоваться в качестве поглотителя углекислого газа для членов экипажа космического корабля и подводной лодки..
Космический аппарат проектов НАСА «Меркурий», «Джеминни» и «Аполлон» использовал гидроксид лития в качестве абсорбентов. Он имеет надежную производительность и может легко поглощать углекислый газ из водяного пара. Химическая реакция:
2LiOH + CO2 → Ли2Колорадо3 + H2О.
1 г безводного гидроксида лития может абсорбировать диоксид углерода объемом 450 мл. Только 750 г безводного гидроксида лития может поглощать выдыхаемый углекислый газ одним человеком каждый день.
Гидроксид лития и другие соединения лития недавно использовались для разработки и исследования щелочных батарей (ENCYCLOPÆDIA BRITANNICA, 2013).
ссылки
- CAMEO. (2016). ГИДРОКСИД ЛИТИЯ, РЕШЕНИЕ. Извлечено от Cameochemicals.
- EMBL-EBI. (2008, 13 января). гидроксид лития. Выздоровел из ЧЕБИ.
- БРИТАНСКАЯ ЭНЦИКЛОПИЯ. (2013, 23 августа). Литий (Li). Выздоровел от британницы.
- Гидроксид лития. (2016). Восстановлено с chemicalbook.com.
- Формула гидроксида лития. (S.F.). Восстановлено от softschools.com.
- Паспорт безопасности материала Гидроксид лития. (21 мая 2013 г.) Восстановлено от sciencelab.com.
- Национальный центр биотехнологической информации. (2017, 30 апреля). База данных PubChem Compound; CID = 3939. Получено из ПабХима.
- Национальный институт охраны труда и здоровья. (2015, 22 июля). ГИДРОКСИД ЛИТИЯ. Восстановлено из cdc.gov.
- Королевское химическое общество. (2015). Гидроксид лития. Получено с chemspider: chemspider.com.
Гидроксид лития: получение, химические свойства
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы. Растворяется в воде.
Относительная молекулярная масса Mr = 23, 95; относительная плотность для тв. и ж. состояния d = 1, 46; tпл = 471◦ C;
Способы получения
- 1. Гидроксид лития получают электролизом раствора хлорида лития:
- 2LiCl + 2H2O → 2LiOH + H2 + Cl2
- 2. При взаимодействии лития, оксида лития, гидрида лития и пероксида лития с водой также образуется гидроксид лития:
- 2Li + 2H2O → 2LiOH + H2
- Li2O + H2O → 2LiOH
- 2LiH + 2H2O → 2LiOH + H2
- Li2O2 + H2O → 2LiOH + H2O2
- 3. Карбонат лития при взаимодействии с гидроксидом кальция образует гидроксид лития:
- Li2CO3 + Ca(OH)2 → CaCO3↓ + 2LiOH
Качественная реакция
Качественная реакция на гидроксид лития — окрашивание фенолфталеина в малиновый цвет.
Химические свойства
1. Гидроксид лития реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
- 3LiOH + H3PO4 → Li3PO4 + H2O
- 2LiOH + H3PO4 → Li2HPO4 + 2H2O
- LiOH + H3PO4 → LiH2PO4 + H2O
2. Гидроксид лития реагирует с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2LiOH(избыток) + CO2 → Li2CO3 + H2O
LiOH + CO2 (избыток) → LiHCO3
3. Гидроксид лития реагирует с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли:
- 2LiOH + Al2O3 → 2LiAlO2 + H2O
- в растворе образуется комплексная соль — тетрагидроксоалюминат:
- 2LiOH + Al2O3 + 3H2O → 2Li[Al(OH)4]
4. С кислыми солями гидроксид лития также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
LiOH + LiHCO3 → Li2CO3 + H2O
5. Гидроксид лития взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
- При этом кремний окисляется до силиката и водорода:
- 2LiOH + Si + H2O → Li2SiO3 + H2
- Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
- 4LiOH + 2F2 → 4LiF + O2 (OF2) + 2H2O
- Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида лития:
- 3LiOH + P4 + 3H2O = 3LiH2PO2 + PH3↑
- 2LiOH(холодный) + Cl2 = LiClO + LiCl + H2O
- 6LiOH(горячий) + 3Cl2 = LiClO3 + 5LiCl + 3H2O
- Сера взаимодействует с гидроксидом лития только при нагревании:
- 6LiOH + 3S = 2Li2S + Li2SO3 + 3H2O
6. Гидроксид лития взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
- 2LiOH + Zn → Li2ZnO2 + H2
- В растворе образуются комплексная соль и водород:
- 2LiOH + 2Al + 6Н2О = 2Li[Al(OH)4] + 3Н2
7. Гидроксид лития вступает в обменные реакции с растворимыми солями.
- Хлорид меди (II) реагирует с гидроксидом лития с образованием хлорида лития и осадка гидроксида меди (II):
- 2LiOH + CuCl2 = Cu(OH)2↓+ 2LiCl
- Также с гидроксидом лития взаимодействуют соли аммония.
- Например, при взаимодействии хлорида аммония и гидроксида лития образуются хлорид лития, аммиак и вода:
- NH4Cl + LiOH = NH3 + H2O + LiCl
- 8. Гидроксид лития разлагается при нагревании до температуры 600°С:
- 2LiOH → Li2O + H2O
9. Гидроксид лития проявляет свойства сильного основания. В воде практически полностью диссоциирует, образуя щелочную среду и меняя окраску индикаторов.
LiOH ↔ Li+ + OH—
10. Гидроксид лития в расплаве подвергается электролизу. При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4LiOH → 4Li + O2 + 2H2O
§ 35. Характеристика химического элемента по его положению в периодической системе
- а) Литий
- 1) Название химического элемента — литий, химический знак Li, относительная атомная масса 7.
- 2) Атомный (порядковый) номер в периодической системе 3, элемент 2-го периода (малого), IA-группы (главной).
3) Заряд ядра атома 3+ , оно содержит 3 прогона; в ядре нуклида 37Limathrm{^7_3Li}37Li 4 нейтрона. Так как заряд ядра лития равен 3+, то у него 3 электрона, которые размещаются на двух электронных слоях: 3Li  2e−, 1e−.mathrm{_3Li,, 2e^-,, 1e^-.}3Li2e−,1e−.
На внешнем (незавершенном) слое — один электрон.
4) Элемент относится к группе металлов. Его простое вещество при обычны условиях находится в твердом агрегатном состоянии. Формула простого вещества — Li.
5) Валентноеть лития в высшем оксиде равна 1, летучих водородных соединений не образует.
6) Формула высшего оксида — Li2Omathrm{Li_2O}Li2O. Taк как литий является типичным металлом, то этот оксид принадлежит к основным оксидам. Гидроксид, соответствующий ему, представляет собой основание (щелочь) — LiOHmathrm{LiOH}LiOH.
- 7) Летучего водородного соединения не образует.
- б) Азот
- 1) Название химического эле мента — азот, химический знак N, относительная масса 14,0.
- 2) Атомный (порядковый) номер в периодической системе 7, элемент 2-го периода (малого), VA-группы (главной).
3) Заряд ядра атома 7+, оно содержит 7 протонов; в ядре нуклида 714Nmathrm{^{14}_7N}714N 7 нейтронов. Так как заряд ядра азота равен 7+, то у него 7 электронов, которые размещаются на двух электронных слоях: 7N  2e−, 5e−.mathrm{_7N,, 2e^-,, 5e^-}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества N2mathrm{N_2}N2.
5) Валентность азота в высшем оксиде равна V, так как это элемент V группы. Валентность в летучем водородном соединении равна III.
6) Формула высшего оксида — N2O5mathrm{N_2O_5}N2O5. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, предел являет собой кислоту HNO3mathrm{HNO_3}HNO3.
- 7) Формула летучего водородного соединения — NH3mathrm{NH_3}NH3.
- в) Алюминий
- 1) Название химического элемента — алюминий, химический знак Al, относительная масса 27.
- 2) Атомный (порядковый) номер в периодической системе 13, элемент 3-го периода (малого), IIIA-группы (главной).
3) Заряд ядра атома 13+, оно содержит 13 протонов; в ядре нуклида 1327Al  14mathrm{_{13}^{27}Al,, 14}1327Al14 нейтронов.
Так как заряд ядра алюминия равен 13+, то у него 13 электронов, которые размещаются на трех электронных слоях: 13Al  2e−, 8e−, 3e−mathrm{_{13}Al,, 2e^-,, 8e^-,, 3e^-}13Al2e−,8e−,3e−. На внешнем (незавершенном) слое — три электрона.
4) Элемент относится к группе металлов. Его простое вещество при обычных условиях находится в твердом агрегатном состоянии. Формула простого вещества — Al.
5) Валентность алюминия в высшем оксиде равна III, летучих водородных соединений не образует.
6) Формула высшего оксида A12O3mathrm{A1_2O_3}A12O3, оксид принадлежит к амфотерным оксидам. Гидроксид, соответствующий ему, проявляет амфотерные свойства — Al(OH)3mathrm{Al(OH)_3}Al(OH)3 или HAlO2mathrm{HAlO_2}HAlO2.
- 7) Летучего водородного соединения не образует.
- г) Хлор
- 1) Название химического эле мента — хлор, химический знак Cl, относительная масса 35.
- 2) Атомный (порядковый) номер в периодической системе 17, элемент 3-го периода (малого), VIIA-группы (главной).
3) Заряд ядра атома 17+, оно содержит 17 протонов; в ядре нуклида 1735Clmathrm{^{35}_{17}Cl}1735Cl 18 нейтронов. Так как заряд ядра хлора равен 17+, то у него 17 электронов, которые размещаются на трех электронных слоях: 17Cl  2e−, 8e−, 7e−.mathrm{_{17}Cl,, 2e^-,, 8e^-,, 7e^-.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества — Cl2mathrm{Cl_2}Cl2.
5) Валентность хлора в высшем оксиде равна VII, так как это элемент VII-А группы. Валентность в летучем водородном соединении равна I.
6) Формула высшего оксида — Cl2O7mathrm{Cl_2O_7}Cl2O7. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, представляет собой кислоту — HClO4mathrm{HClO_4}HClO4.
7) Формула летучего водородного соединения — HClmathrm{HCl}HCl.






