- Оксиды
- Основания
- Кислоты
- Соли
- Амфотерные металлы: цинк и алюминий — Умскул Учебник
- Характеристика амфотерных металлов
- Характеристики элементов-металлов
- Физические свойства
- Способы получения
- Химические свойства
- Оксиды алюминия и цинка
- Гидроксиды алюминия и цинка
- Важнейшие химические свойства солей
- Фактчек
- Проверь себя
- Естественные семейства химических элементов и их свойства в химии — формулы и определения с примерами решения задач
- Естественные семейства химических элементов и их свойства
- Щелочные металлы
- Галогены и инертные газы
- Металлы и неметаллы
- Амфотерные металлы
- Что такое амфотерные металлы
- Свойства амфотерных металлов
- Как отличить металл от неметалла
- Основания амфотерных металлов
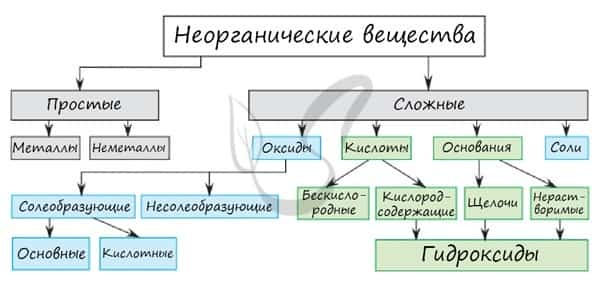
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
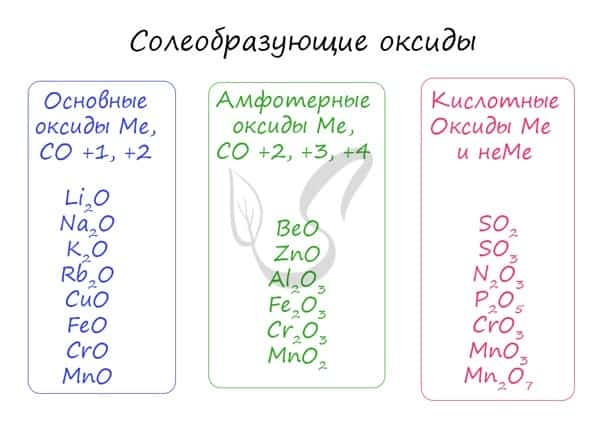
- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
- Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
- SO3 + H2O → H2SO4 (сохраняем СО серы +6)
- SO2 + H2O → H2SO3 (сохраняем СО серы +4)
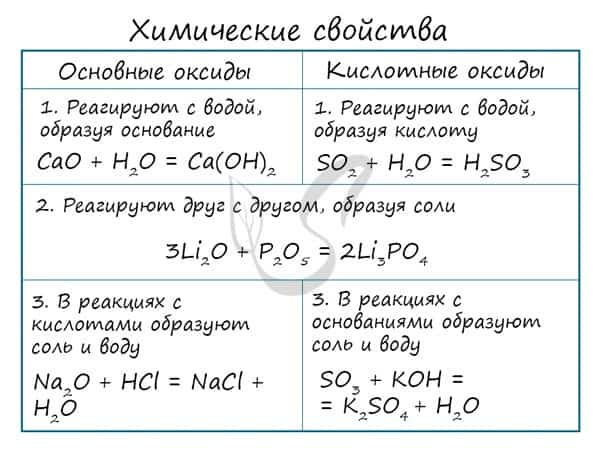
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO. Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют. Li2O + H2O → LiOH (основный оксид + вода → основание) Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль) Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода) Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3. С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами. Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль) ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль) ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции) Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции) 
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7. Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.
- Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
- Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
- FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.
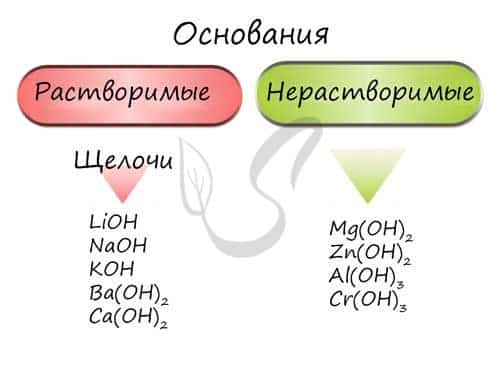
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
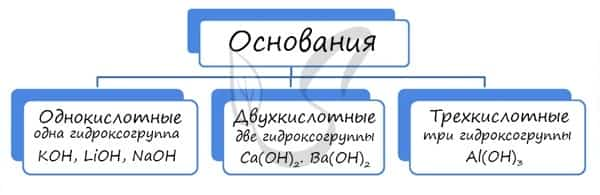
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
- Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
- LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
- KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
- В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли и воды, так и с основаниями — с образованием комплексных солей.
- Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
- Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
- При нагревании до высоких температур комплексные соли не образуются.
- Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.
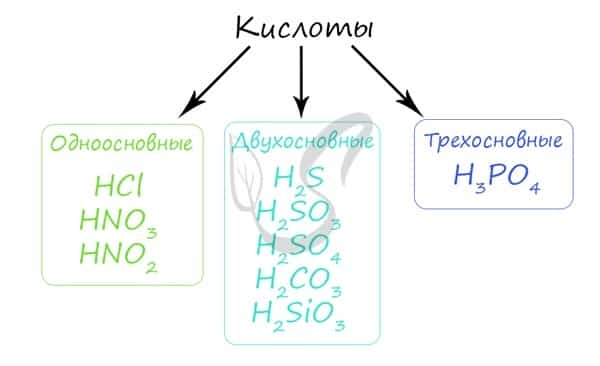
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
- H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
- Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
- Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
- Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде — виде газа и воды.
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
- Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь ?
- K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
- K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4] (тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)
Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода), то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
- Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
- MgCl2 + LiOH → Mg(OH)2↓ + LiCl
- K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
- Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
- KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)
Амфотерные металлы: цинк и алюминий — Умскул Учебник
- Особенности строения атомов амфотерных металлов;
- Физические и химические свойства;
- И нашим, и вашим: обсудим амфотерность цинка и алюминия.
Кто-то любит соленое, кто-то любит сладкое, а кто-то — и то, и другое. То же самое происходит и с амфотерными металлами.
Характеристика амфотерных металлов
Под амфотерностью понимают способность соединений проявлять одновременно и кислотные, и основные свойства в зависимости от условий и природы реагентов, участвующих в реакции.
Список амфотерных металлов включает в себя множество наименований. Из них мы рассмотрим цинк и алюминий.
Характеристики элементов-металлов
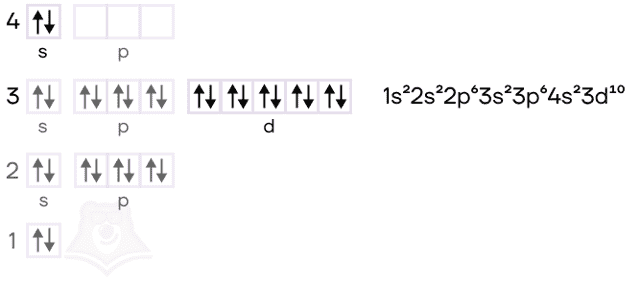
Алюминий — элемент IIIA группы третьего периода. Его электронная конфигурация [Ne]3s23p1.
В возбужденном состоянии электронная пара на 3s-орбитали распаривается. В результате образуются три неспаренных электрона, которые способны образовывать химические связи. Поэтому у алюминия постоянная степень окисления +3.
Цинк — расположен во IIВ группе в четвертом периоде. Цинк относится к d-элементам, при этом атом цинка имеет полностью заполненные 3d– и 4s– электронные подуровни.
Его электронная конфигурация в основном состоянии [Ar]3d104s2. В соединениях цинк проявляет постоянную степень окисления +2.
Физические свойства

Алюминий — лёгкий серебристо-белый металл, покрывающийся на воздухе оксидной плёнкой из-за взаимодействия с кислородом (на фото расположен слева). Из алюминия часто делают тысячи вещей, которые окружают нас в быту: от фольги на баночке йогурта до стильного корпуса смартфона.
Цинк — голубовато-белый металл (на фото расположен справа).
Способы получения

Химические свойства
По химическим свойствам они являются типичными восстановителями, а значит, способны реагировать с окислителями. Как и другие металлы, они будут взаимодействовать со своими противоположностями — неметаллами. Также они будут вступать в реакции вытеснения с водой, кислотами-неокислителями, щелочами и солями менее активных металлов.
Как типичные металлы, алюминий и цинк способны вступать в реакции с неметаллами и образовывать различные бинарные соединения.
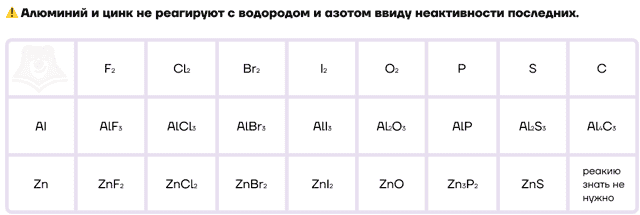
Ввиду низких значений электроотрицательности алюминий и цинк, как и другие металлы, являются отличными восстановителями. Настолько сильными, что они даже способны восстанавливать некоторые металлы и неметаллы из их оксидов. Этот процесс называется металлотермией.
| Активные металлы (стоящие до алюминия в ряду активности) не получают путём восстановления из оксидов. |
Алюминий является очень активным металлом, который, помимо этого, ещё и является одним из наиболее распространённых в земной коре.
Его очень часто используют в металлургии для получения других металлов из их оксидов. Этот процесс называется алюмотермией.
Так как алюминий и цинк — металлы, стоящие в ряду активности левее водорода, то они способны вытеснять водород из воды.

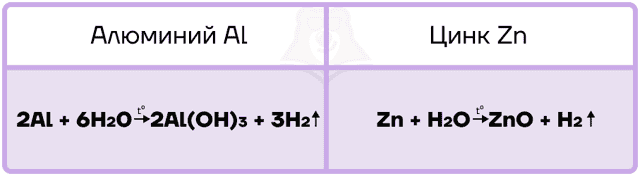
Алюминий, подобно другим активным металлам, при взаимодействии с водой образует гидроксид и водород.
Цинк является уже менее активным металлом, поэтому нуждается в создании более жёстких условий для реакции с водой. Он взаимодействует только с перегретым водяным паром и в таких жёстких условиях вытесняет из воды ОБА атома водорода, превращаясь в оксид.
Алюминий и цинк также способны вытеснять водород не только из воды, но и из кислот-неокислителей.
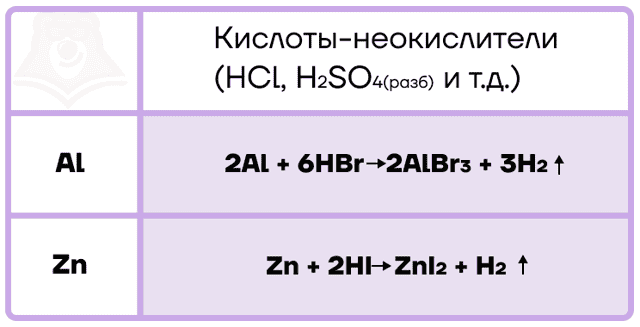
С кислотами-окислителями протекают более сложные ОВР, при этом помним, что в холодных концентрированных растворах кислот-окислителей алюминий пассивируется из-за наличия оксидной плёнки на его поверхности.
Амфотерные металлы реагируют со щелочами, причем продукты зависят от определенных условий:
Как и другие металлы, алюминий и цинк способны вытеснять менее активные металлы из их солей.
Оксиды алюминия и цинка
Оксиды алюминия и цинка по физическим свойствам представляют собой бесцветные порошки, нерастворимые в воде.
По химическим свойствам это типичные амфотерные оксиды, которые способны вступать в основно-кислотные взаимодействия как с основным, так и с кислотным. Как и другие оксиды, они могут вступать в ОВР с сильными восстановителями с восстановлением из них металла.
Оксидам алюминия и цинка соответствуют нерастворимые гидроксиды Al(OH)3 и Zn(OH)2, поэтому и сами оксиды с водой не взаимодействуют.
- Амфотерные свойства оксидов
Как типичные амфотерные оксиды, оксиды алюминия и цинка будут реагировать как с веществами, проявляющими основные свойства (основаниями, основными оксидами), так и с веществами, проявляющими кислотные свойства (кислотами, кислотными оксидами):
- ОВР с сильными восстановителями
Как и другие оксиды, оксид цинка может вступать в ОВР с сильными восстановителями (C, CO, H2, Al, Mg, Ca и т. д.) с восстановлением из них металла.
Гидроксиды алюминия и цинка
По физическим свойствам гидроксиды алюминия и цинка представляют собой белые порошкообразные вещества, нерастворимые в воде. Все их химические свойства обусловлены тем, что они являются амфотерными гидроксидами: они способны вступать в реакции как с основным, так и с кислотным.
Помимо этого, как и для других нерастворимых гидроксидов, для гидроксидов алюминия и цинка характерны реакции термического разложения.
- Гидроксиды алюминия и цинка как амфотерные гидроксиды
- Термическое разложение гидроксидов
Подобно другим нерастворимым гидроксидам, нерастворимые Al(OH)3 и Zn(OH)2 способны разлагаться при нагревании на соответствующий оксид и воду.
Важнейшие химические свойства солей
- Реакции с растворами щелочей
Соли алюминия и цинка реагируют с растворами щелочей.
- Разрушение комплексных солей и их аналогов кислотами
Если сильная кислота находится в недостатке, её хватает только для самого сильного металла (щелочного или щелочно-земельного). В результате образуется соль и амфотерный гидроксид, возможно также образование воды.
Если сильная кислота находится в избытке, её хватает на оба металла: образуются две соли и вода.
Со слабыми кислотами (угольной CO2(р-р), сернистой SO2(р-р), сероводородной H2S) ситуация немного сложнее:
- Если слабая кислота находится в недостатке, её также хватает только для самого сильного металла (щелочного или щелочно-земельного).
— Если слабая кислота находится в избытке, в продуктах образуется кислая соль (из-за избытка кислотного) и амфотерный гидроксид.Со слабой кислотой он не взаимодействует, так как сам слабый.
При нагревании комплексной соли будет происходить выпаривание из неё воды. В анионе там, где нет воды (например, в расплаве), образуются средние соли с амфотерными металлами.
Самые “страшные” реакции с участием комплексных солей — их реакции с солями. Чтобы их написать, можно для себя представить комплексную соль как совокупность щёлочи и амфотерного гидроксида.
Фактчек
- Алюминий и цинк относятся к амфотерным металлам, то есть таким, которые могут реагировать и с кислотами, и со щелочами в зависимости от природы реагирующих веществ.
- Алюминий относится к p-элементам, его постоянная степень окисления +3; цинк относится к d-элементам, его постоянная степень окисления +2.
- Алюминий и цинк реагируют с рядом веществ: неметаллами, водой, кислотами, щелочами, солями.
- Оксиды и гидроксиды алюминия и цинка также обладают амфотерными свойствами ,что определяет их химическое поведение в различных реакциях.
- Алюминий и цинк способны образовывать особый тип солей, называемый комплексными.
Проверь себя
Задание 1.Какими свойствами обладают алюминий, цинк и их оксиды и гидроксиды?
- Основными свойствами;
- Кислотными свойствами;
- Амфотерными свойствами;
- Нейтральными свойствами.
Задание 2.Цинк реагирует с водой с образованием:
- Оксида цинка и водорода;
- Гидроксид цинка и водорода;
- Цинката и водорода;
- Гидрида цинка и кислорода.
Задание 3.Что можно наблюдать при приливании раствора гидроксида натрия к раствору хлорида алюминия?
- Выделение газа;
- Выпадение осадка;
- Видимых изменений не наблюдается;
- Выпадение осадка, а затем его растворение.
Задание 4.Что образуется в реакции оксида цинка и сернистого газа?
- Сульфат цинка;
- Сульфит цинка;
- Сульфид цинка и кислород;
- Реакция не идет.
Задание 5.Какая соль образуется при взаимодействии тетрагидроксоалюмината натрия и избытка сероводорода?
- Средняя соль;
- Комплексная соль;
- Кислая соль;
- Основная соль.
ОТВЕТЫ: 1. — 3; 2. — 1; 3. — 4; 4. — 4; 5. — 3
Естественные семейства химических элементов и их свойства в химии — формулы и определения с примерами решения задач
Содержание:
После того как выяснилось, что классификация на металлы и неметаллы не является полной, ученые стали выделять из этих двух больших классов элементы, особенно близкие по свойствам их простых веществ. Такие группы элементов назвали естественными семействами.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Естественные семейства химических элементов и их свойства
Выделяют следующие естественные семейства: Щелочные металлы – Na, K, Cs, Rb, Li. Галогены – F, CI, Br, I.
Щелочные металлы
В любой отрасли науки по мере накопления фактов возникает необходимость в их систематизации и установлении внутренней причинно-следственной связи между ними.
Из курса биологии вы хорошо знакомы с систематизацией в растительном и животном мире. В химии накопление знаний об элементах и их соединениях привело к необходимости их группировки по сходным признакам.
Классификация элементов началась с деления их на металлы и неметаллы, что было предложено шведским химиком Й. Я. Берцелиусом.
Кроме металлов и неметаллов существуют химические элементы, которые проявляют двойственную природу, т. е. обладают свойствами и металлов, и неметаллов в зависимости от условий протекания химических реакций (Be, Zn, Аl и др.). Их оксиды и гидроксиды называют амфотерными веществами (от греческого аmphoteros – оба, тот и другой).
В природе существуют группы элементов со сходными химическими свойствами, их называют естественными семействами элементов. К типичным металлам относятся щелочные металлы. Кроме этих металлов мы будем рассматривать группу галогенов (VIIА) и инертных газов.
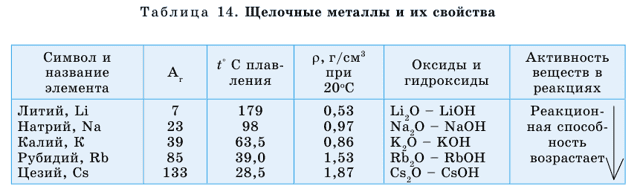
Щелочные металлы расположены в IА группе. Это литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr). Франций – радиоактивный элемент.
Они называются щелочными металлами, потому что при взаимодействии с водой образуют сильные растворимые основания – щелочи (рис. 39).
Общая электронная формула валентных электронов
Щелочные металлы обладают некоторыми общими свойствами: молекулы щелочных металлов состоят из одного атома, очень активные. Поэтому их нужно хранить под слоем керосина. Энергично реагируют с водой, в соединениях проявляют валентность, равную I.
Металлическая активность щелочных металлов усиливается сверху вниз по группе, что связано с возрастанием атомных радиусов в этом направлении.
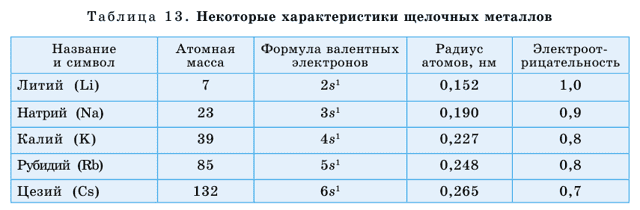
У щелочных металлов валентные электроны расположены на s-орбитали, поэтому их называют s-элементами. s-элементы в обычных условиях – это кристаллические вещества, которые по сравнению с остальными металлами обладают малыми значениями плотности (табл. 13).
Литий, калий и натрий легче воды поэтому они плавают на ее поверхности. У этих элементов температуры плавления и кипения также имеют низкие значения. Щелочные металлы и их соединения окрашивают пламя: натрий – в желтый, калий – в красно-фиолетовый, литий – в карминово-красный, рубидий – в розово-фиолетовый цвета (рис. 40).

Литий по своим свойствам несколько отличается от остальных металлов. С водой литий взаимодействует медленно, натрий – более энергично, калий – наиболее энергично реагирует с водой, вспыхивает фиолетовым пламенем, а рубидий – со взрывом.
Оксиды этих элементов являются основными, им соответствуют основания, хорошо растворимые в воде, – щелочи, основные свойства которых усиливаются сверху вниз по группе.
Литий был открыт в 1817 г. шведским ученым Арфедсоном, натрий и калий – в 1807 г. английским ученым Г. Дэви, рубидий и цезий – в 1861 г. Р. Бунзеном.
Литий используют для изготовления различных свинцовых и алюминиевых сплавов, которые применяются в самолетостроении. Добавка лития к сплавам увеличивает их твердость.
Рубидий и цезий используют для изготовления фотоэлементов.
Галогены и инертные газы
Какие галогены и инертные газы вы знаете? Где они применяются? Что вы знаете об инертных газах? Расскажите об их применении.
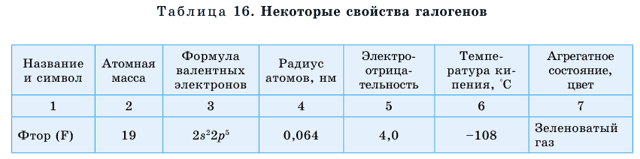
В природе существуют группы элементов с противоположными щелочным металлам свойствами, к примеру, галогены (табл. 15).

Галогены – типичные неметаллы, при взаимодействии с металлами образуют соли (галоген означает солерод). Молекулы галогенов двухатомные. Все галогены образуют летучие водородные соединения, растворы которых являются кислотами. В отличие от щелочных металлов, активность элементов по мере возрастания относительных атомных масс у галогенов ослабевает.
Галогены расположены в VIIА группе. Это фтор F, хлор Cl (рис. 41), бром Br, йод I, астат At. Астат – радиоактивный элемент.
Последний электрон у атомов галогенов поступает на р-орбиталь, поэтому они называются р-элементами.
По группе сверху вниз радиусы атомов увеличиваются, в том же направлении растут значения температур кипения и плотности.
Агрегатные состояния переходят из газообразного через жидкое в твердое а окраска сгущается (от желто-зеленой у хлора до черно-серого с фиолетовым блеском у йода).
Галогены – типичные неметаллы, на внешнем энергетическом уровне у них не хватает одного электрона для завершения слоя, поэтому они легко принимают один электрон, проявляя неметаллические свойства. При этом принимают электронное строение инертного газа, стоящего после них в периодической системе. Кроме фтора, все остальные галогены образуют кислотные оксиды.
В соединениях фтор проявляет валентность, равную I. Остальные галогены проявляют валентности I, III, V, VII.
Неметаллические свойства элементов в группе сверху вниз ослабевают, так как из-за увеличения атомных радиусов сила притяжения электронов к ядру уменьшается.
Еще одна природная группа элементов – инертные газы (табл. 17).
Каждый период в Периодической системе завершается инертным газом. Инертные газы характеризуются низкой химической активностью. Из-за чего такая пассивность? Для разрешения этого вопроса рассмотрим электронное строение этих элементов. У известных вам инертных газов внешний слой завершен (у гелия – два, у аргона и неона – по восемь электронов).
Это одноатомные газы без цвета и запаха. Среди них самым химически инертным является гелий, более активны криптон и ксенон. В направлении возрастания относительной атомной массы, от He до Xe, наблюдается возрастание температуры кипения и плавления. Усиливается также растворимость газов в воде и других растворителях.
Гелий обнаружен в атмосфере Солнца и других звезд. В земной атмосфере и коре гелий может накапливаться в результате распада радиоактивных элементов.
Он состоит из двух изотопов: неон и аргон из трех: и Криптон на Земле встречается в виде шести изотопов, ксенон – девяти, а радон не имеет устойчивых изотопов.
Аргон более распространен на Земле, его содержание в земной атмосфере составляет 0,9%.
Инертные газы (He, Ne, Ar) применяются в основном при сварке металлов, в лампах, в фонарях, а также как хладагенты при физических исследованиях (рис. 42).
Изучение свойств естественных семейств химических элементов и их соединений помогает нам систематизировать наши знания.
Йод был открыт при «помощи» кошки. Французский ученый Б. Кур-туа приготовил в двух склянках два различных раствора: в первой -концентрированную во второй — спиртовый раствор морских водорослей.
В это время на плече ученого сидела кошка, она прыгнула и опрокинула обе склянки. Эти вещества прореагировали с образованием сине-фиолетового газа. При охлаждении он превратился в фиолетовые кристаллы. Так в 1811 г.
был открыт йод.
Металлы и неметаллы
Вы знаете, что простые вещества в зависимости от электронного строения атомов подразделяются на металлы и неметаллы. Рассмотрим их структуру, свойства и применение в сравнительном аспекте. Обратите внимание на их различия и с чем они связаны.
В периодах в I, II, ІІІ группах находятся в основном металлы, а в IV–VIII главных подгруппах в основном расположены неметаллы.
Если провести диагональ от бора к астату, то справа вверх от диагонали расположены элементы – неметаллы (кроме элементов побочных подгрупп), а слева вниз – элементы металлы. На внешних энергетических уровнях металлов вращаются в основном 1–3 электрона, у неметаллов 4–8 электронов.
- Электронное строение металлов и неметаллов Радиусы атомов металлов большие, неметаллы характеризуются малыми значениями радиусов.
- В химических реакциях металлы отдают электроны
- неметаллы присоединяют и могут отдавать электроны, кроме фтора.
- Металлы, кроме ртути, твердые вещества, а неметаллы – твердые (S, P, C, Si, ), жидкие и газообразные
- Металлы и их соединения применяются в тяжелой индустрии, а соединения неметаллов применяются в пищевой, бумажной и текстильной промышленности.
- Металлы встречаются в литосфере, а соединения неметаллов чаще находятся в атмосфере.
По распространенности металлы подразделяются на благородные (Au, Ag, Pt), редкие, рассеянные, макро- и микроэлементы; неметаллы по содержанию в живых организмах – на макро-, микро- и ультраэлементы. В недрах земли они встречаются в виде минералов, в морских и водах океанов – в виде соединений.
Оксиды металлов I–II главных подгрупп – основные оксиды, им соответствуют гидроксиды: СаО → Оксиды неметаллов главных подгрупп VI–VII групп – кислотные оксиды, им соответствуют кислоты:
Металлы не образуют летучие водородные соединения. Неметаллы образуют летучие водородные соединения кислотного характера, например, HCl, HF, HBr, HI. А некоторые неметаллы образуют водородные соединения, проявляющие основные свойства в водных растворах, например, и
Металлы обладают характерной особенностью – металлическим блеском, легко куются, вытягиваются, гнутся и прокатываются.
Металлы хорошо проводят электричество и тепло, они хорошие провjдники. Из неметаллов хорошим проводником электрического тока является графит. Многие соединения неметаллов (кристаллический кремний) проявляют полупроводниковые свойства или являются диэлектриками.
Делаев выводы:
- Свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда атомных ядер.
- Группы элементов со сходными физическими и химическими свойствами называются естественными семействами.
- Формулы валентных электронов щелочных металлов ns1, галогенов — ns2np5, а инертных газов — пз2пръ (кроме гелия).
- Щелочные металлы — легко отдают один электрон с внешнего энергетического уровня, а галогены легко присоединяют недостающий до завершения внешнего слоя один электрон.
- В группе металлические свойства щелочных металлов усиливаются сверху вниз, а у галогенов неметаллические свойства в этом направлении ослабевают.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
- Лекции по химии:
- Лекции по неорганической химии:
- Лекции по органической химии:
Амфотерные металлы
Простые вещества сходные с металлическими элементами по структуре и ряду химических и физических параметров называют амфотерными, т.е. это те элементы, проявляющие химическую двойственность.
Надо отметить, что это не сами металли, а их соли или оксиды.
К, примеру, оксиды некоторых металлов могут обладать двумя свойствами, при одних условиях они могут проявлять свойства присущие кислотам, в других, они ведут себя как щелочи.
К основным амфотерным металлам относят алюминий, цинк, хром и некоторые другие.
Термин амфотерность был введен в оборот в начале XIX века. В то время химические вещества разделяли на основании их сходных свойств, проявляющиеся при химических реакциях.
Что такое амфотерные металлы
Список металлов, которые можно отнести амфотерным, достаточно велик. Причем некоторые из них можно назвать амфотерными, а некоторые – условно.
Перечислим порядковые номера веществ, под которыми они расположены в Таблице Менделеева. В список входят группы с 22 по 32, с 40 по 51 и еще много других. Например, хром, железо и ряд других можно с полным основанием называть основными, к последним можно отнести и стронций с бериллием.
Кстати, самым ярким представителем амфорных металлов считают алюминий.
Именно его сплавы в течение длительного времени используют практически во всех отраслях промышленности. Из него делают элементы фюзеляжей летательных аппаратов, кузовов автомобильного транспорта, и кухонную посуду.
Он стал незаменим в электротехнической промышленности и при производстве оборудования для тепловых сетей. В отличии от многих других металлов алюминий постоянно проявляет химическую активность. Оксидная пленка, которая покрывает поверхность металла, противостоит окислительным процессам.
В обычных условиях, и в некоторых типах химических реакций алюминий может выступать в качестве восстановительного элемента.
Этот металл способен взаимодействовать с кислородом, если его раздробить на множество мелких частиц. Для проведения операции такого рода необходимо использование высокой температуры. Реакция сопровождается выделением большого количества тепловой энергии.
При повышении температуры в 200 ºC, алюминий вступает в реакцию с серой. Все дело в том, что алюминий, не всегда, в нормальных условиях, может вступать в реакцию с водородом. Между тем, при его смешивании с другими металлами могут возникать разные сплавы.
Еще один ярко выраженный металл, относящийся к амфотерным – это железо. Этот элемент имеет номер 26 и расположен между кобальтом и марганцем. Железо, самый распространенный элемент, находящийся в земной коре.
Железо можно классифицировать как простой элемент, имеющий серебристо-белый цвет и отличается ковкостью, разумеется, при воздействии высоких температур. Может быстро начинать коррозировать под воздействием высоких температур.
Железо, если поместить его в чистый кислород полностью прогорает и может воспламениться на открытом воздухе.
Такой металл обладает способностью быстро переходить в стадию корродирования при воздействии высокой температуры. Помещенное в чистый кислород железо полностью перегорает. Находясь на воздухе металлическое вещество, быстро окисляется вследствие чрезмерной влажности, то есть, ржавеет. При горении в кислородной массе образуется своеобразная окалина, которая называется оксидом железа.
Свойства амфотерных металлов
Они определены самим понятием амфотерности. В типовом состоянии, то есть обычной температуре и влажности, большая часть металлов представляет собой твердые тела. Ни один металл не подлежит растворению в воде.
Щелочные основания проявляются только после определенных химических реакций. В процессе прохождения реакции соли металла вступают во взаимодействие.
Надо отметить что правила безопасности требуют особой осторожности при проведении этой реакции.
Соединение амфотерных веществ с оксидами или самими кислотами первые показывают реакцию, которая присуща основаниями. В тоже время если их соединять с основаниями, то будут проявляться кислотные свойства.
Нагрев амфотерных гидроксидов вынуждает их распадаться на воду и оксид. Другими словами свойства амфотерных веществ весьма широки и требуют тщательного изучения, которое можно выполнить во время химической реакции.
Свойства амфотерных элементов можно понять, сравнив их с параметрами традиционных материалов. Например, большинство металлов имеют малый потенциал ионизации и это позволяет им выступать в ходе химических процессов восстановителями.
Амфотерные — могут показать как восстановительные, так и окислительные характеристики. Однако, существуют соединения которые характеризуются отрицательным уровнем окисления.
Абсолютно все известные металлы имеют возможность образовывать гидроксиды и оксиды.
Всем металлам свойственна возможность образования основных гидроксидов и оксидов. Кстати, металлы могут вступать в реакцию окисления только с некоторыми кислотами. Например, реакция с азотной кислотой может протекать по-разному.
Амфотерные вещества, относящиеся к простым, обладают явными различиями по структуре и особенностям. Принадлежность к определенному классу можно у некоторых веществ определить на взгляд, так, сразу видно что медь – это металл, а бром нет.
Как отличить металл от неметалла
Главное различие заключается в том, что металлы отдают электроны, которые находятся во внешнем электронном облаке. Неметаллы, активно их притягивают.
Все металлы являются хорошими проводниками тепла и электричества, неметаллы, такой возможности лишены.
Основания амфотерных металлов
В нормальных условиях это вещества не растворяются в воде и их можно спокойно отнести к слабым электролитам. Такие вещества получают после проведения реакции солей металла и щелочи. Эти реакции довольно опасны для тех, кто их производит и поэтому, например, для получения гидроксида цинка в емкость с хлоридом цинка медленно и аккуратно, по капле надо вводить едкий натр.
Вместе тем, амфотерные — взаимодействуют с кислотами как основания. То есть при выполнении реакции между соляной кислотой и гидроксидом цинка, появится хлорид цинка. А при взаимодействии с основаниями, они ведут себя как кислоты.






