- Механизм образования химической ковалентной связи
- Основные типы химических связей
- Основные характеристики химической связи:
- Ковалентная связь
- Ионная связь
- Металлическая связь
- Образование металлической связи — урок. Химия, 8 класс
- Металлическая химическая связь — характеристика, способы образования и свойства
- Характерные кристаллические решетки
- Металлическая связь
- Гдз химия 8 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, §21 металлическая связь
- Металлическая связь — Химия
- Типы химического взаимодействия
- Металлическая химическая связь
- Отличия от других видов
- Схема связи и примеры
- Свойства металлов
- Металлическая химическая связь. Полные уроки — Гипермаркет знаний
- Цель урока
- Задачи урока
- Основные термины:
- Металлическая химическая связь
- Интересно знать что…
- Список литературы
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону.
Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку.
Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
- обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
- донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
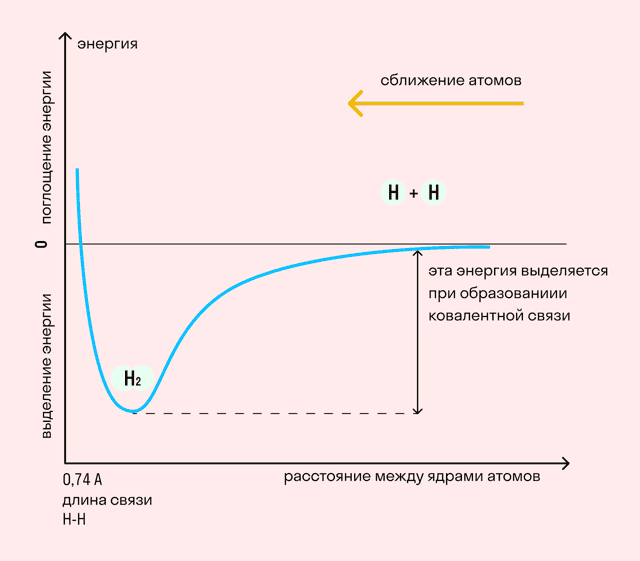
- Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
- Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь.
Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии.
Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
- насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
- полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
- направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
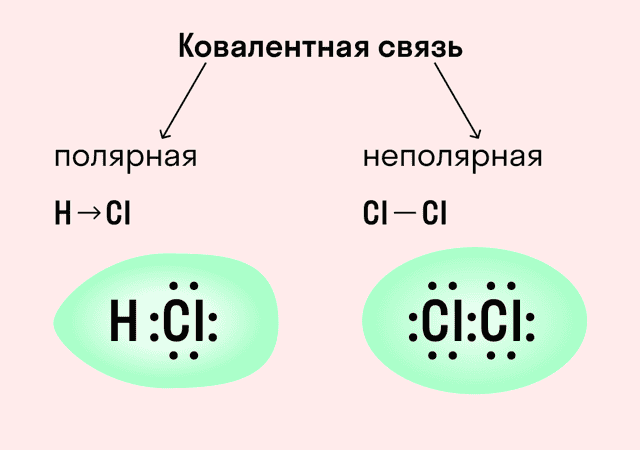
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
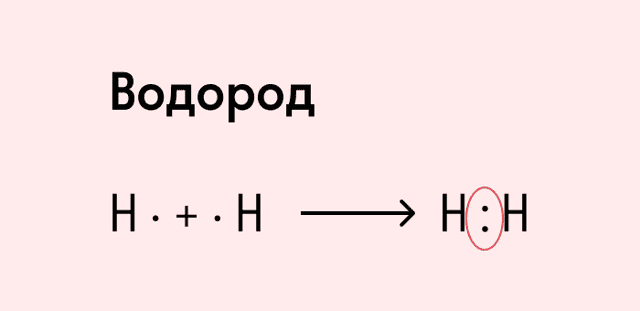
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
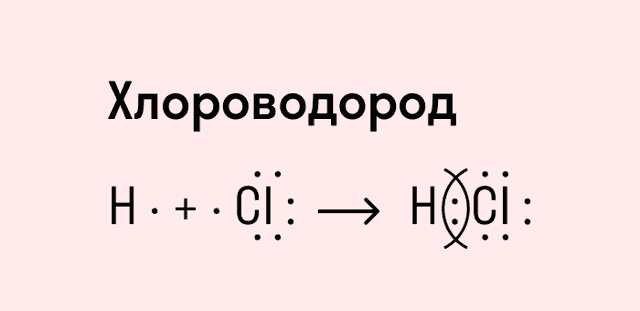
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
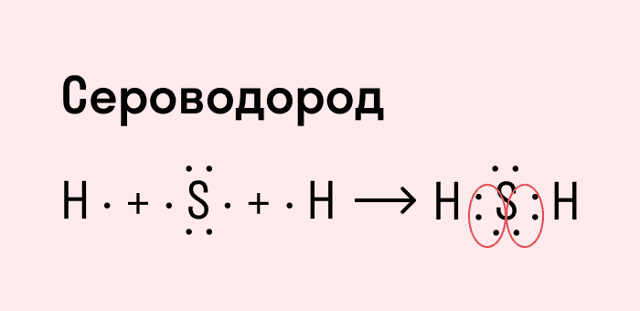
| Число связей, которые могут быть у атома в молекуле вещества, называется валентностью. |
Характеристики ковалентной связи:
- насыщена,
- направлена,
- имеет полярность.
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом.
Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд.
В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
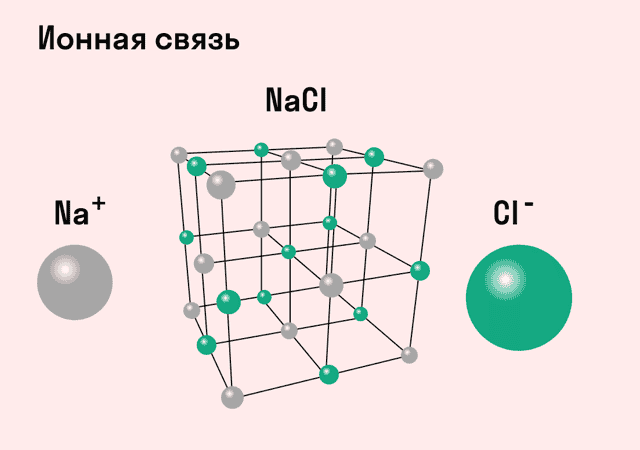
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
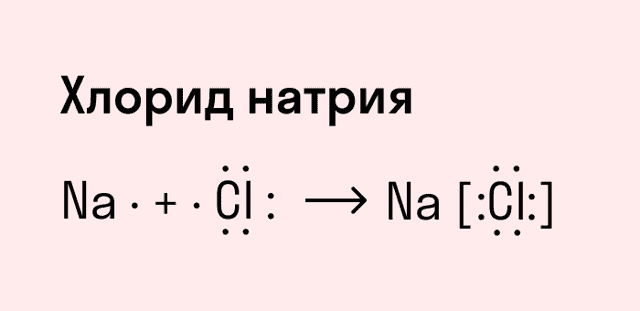 Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
- ненасыщенна,
- не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
| Характеризуется появлением электронных пар, принадлежащих обоим атомам. | Характеризуется появлением и взаимным притяжением ионов. |
| Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. | Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
| Имеет направленность и насыщенность. | Ненасыщенна и не имеет направленности. |
| Количество связей, образуемых атомом, называется валентностью. | Количество ближайших соседей атома называется координационным числом. |
| Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. | Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
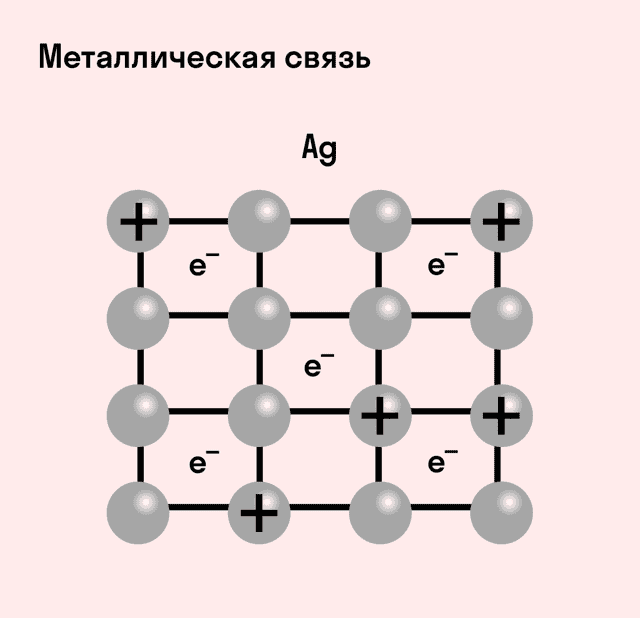
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
- ненаправленность,
- делокализованный характер,
- многоэлектронность.
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
- M — металл,
- n — число свободных внешних электронов.
- К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Образование металлической связи — урок. Химия, 8 класс
Все металлы имеют сходные свойства: у них характерный металлический блеск, высокая ковкость, хорошая электропроводность и теплопроводность.

Рис. (1). Цинк

Рис. (2). Золото
- Эти свойства металлов обусловлены наличием у них особого вида химической связи — металлической связи.
- Особенность атомов металлов — небольшое число электронов на внешнем уровне и сравнительно большие радиусы. Поэтому атомы металлов в отличие от атомов неметаллов легко отдают наружные электроны и превращаются в положительные ионы:
- Me−ne_→Men+.
- Оторвавшиеся от атомов электроны перемещаются от одного иона к другому. Соединяясь с ионами, электроны временно превращают их в атомы:
- Потом электроны снова отрываются и присоединяются к другим ионам и так далее.
Эти процессы происходят бесконечно, что можно выразить общей схемой:
Me−ne_⇄Men+.
Между электронами и положительными ионами возникает электростатическое взаимодействие. Отрицательные электроны и положительно заряженные ионы металла притягиваются.
Суть металлической связи заключается в притяжении положительных ионов металлов и обобществлённых электронов.
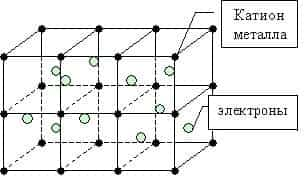
Кристаллическая структура металла — это катионы металла, вокруг которых свободно движется обобществлённое электронное облако, принадлежащее всему куску металла.
Рис. (3). Строение кристалла металла
Наличие свободных электронов в металлах обуславливает их общие физические свойства. Металлы хорошо проводят тепло и электрический ток, имеют характерный блеск и ковкость.
Число внешних электронов у атомов металлов различается. Оно равно номеру группы Периодической системы, в которой находится металл. Так, у щелочных металлов способен отрываться от атома один электрон, а у алюминия таких электронов три:
K−e_⇄K+;
Al−3e_⇄Al3+.
Металлическая связь характерна для чистых металлов и для смесей различных металлов — сплавов (бронза, сталь, чугун, латунь и т. д.), если они находятся в твёрдом или жидком состоянии.

Рис. (4). Сталь

Рис. (5). Изделия из латуни
В парообразном состоянии атомы металлов связаны между собой ковалентной связью. Например, парами натрия заполнены лампы жёлтого цвета для уличных фонарей. Натрий в газообразном состоянии образует двухатомные молекулы. Молекулы натрия неустойчивы, так как при их образовании атомы не получают
восьмиэлектронный внешний слой.
Источники:
Рис. 1. Цинк https://image.shutterstock.com/image-photo/close-zinc-metal-using-be-600w-1496747426.jpg
Рис. 2. Золото https://cdn.pixabay.com/photo/2014/11/01/22/33/gold-513062_960_720.jpg
Рис. 3. Строение кристалла металла © ЯКласс
Рис. 4. Сталь https://cdn.pixabay.com/photo/2020/08/30/04/58/steel-tube-5528518_960_720.jpg
Рис. 5. Изделия из латуни https://cdn.pixabay.com/photo/2016/11/15/18/46/sanitary-engineering-1827125_960_720.jpg
Металлическая химическая связь — характеристика, способы образования и свойства
Время на чтение: 11 минут
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов — металлическую, ионную и водородную, свойственную кристаллам льда.
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
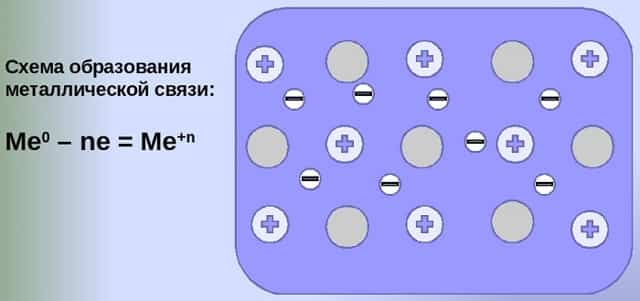
- Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
- Me — ne⁻ ⇆ Me,
- здесь n — число электронов, участвующих в образовании связи, как правило, от 1 до 3.
- В левой части уравнения — атом металла, отдающий электроны, в правой — образовавшийся в результате ион.
- Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
- Схемы формирования связи на примере атомов различной валентности:
- K — e⁻ ⇆ K;
- Cu — 2e⁻ ⇆ Cu;
- Al — 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
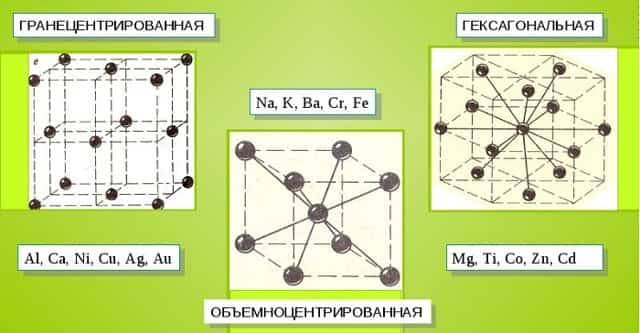
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni — в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
- хорошая электропроводность, благодаря наличию условно свободного электронного облака;
- высокая проводимость тепла;
- низкая реакционная способность или инертность;
- пластичность — большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
- При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
- Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
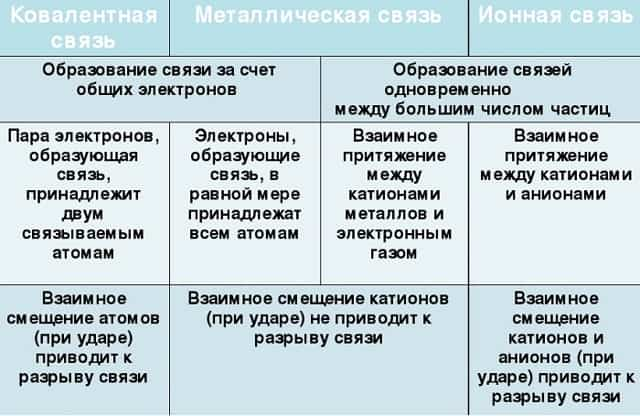
Их общие черты:
- участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
- металл высвобождает электроны и становится катионом;
- соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью — поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
 металлическая связь
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.
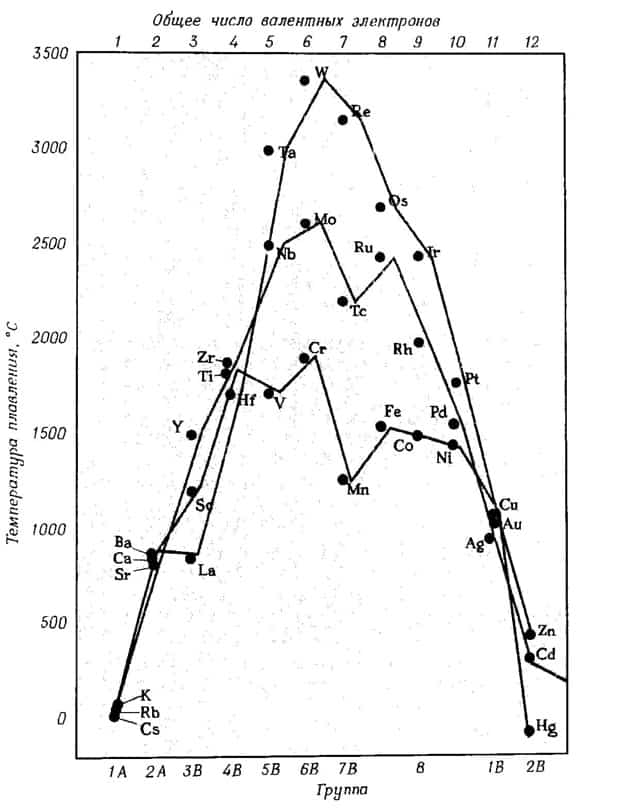 зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Гдз химия 8 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, §21 металлическая связь
Гдз химия 8 класc габриелян о.с. , остроумов и.г., сладков с.а., 2018, §21 металлическая связь
Другие задания смотри здесь…
| Красным цветом даются ответы, а фиолетовым ― объяснения. |
ПРОВЕРЬТЕ СВОИ ЗНАНИЯУпражнение 1. Что общего между ковалентной и металлической связями и чем они различаются?Общего: заключается в обобществлении валентных электронов.Различия: при образовании ковалентной связи обобществляются внешние неспаренные электроны между двумя соседними атомами, в рамках одной молекулы, в то время как, при образовании металлической связи обобществляются валентные электроны всех атомов.
Упражнение 2. Что общего между ионной и металлической связями и чем они отличаются?
Общего: происходит путем отдачи и принятия электронов.Различия: при ионной связи электроны переходят от одного атома только к соседнему, тогда как при металлической связи электроны способны переходить на любой атом, то есть все электроны обобществлены.
Упражнение 3. Определите тип химической связи в веществах, формулы которых:
а) Са; Металлическая, т.к. она образована атомами металла.б) СаСl2; Ионная, т.к. она образована атомами металла и неметалла.в) Cl2; Ковалентная неполярная, т. к. она образована атомами неметаллов с одинаковой электроотрицательностью.г) HCl. Ковалентная полярная, т.к.
она образована атомами неметаллов з различной электроотрицательностью.
Упражнение 4.
Как строение металлов связано с их физическими свойствами? Ионы металла упакованы в плотные кристаллические структуры — металлические кристаллические решётки, образуется гигантский металлический кристалл, связанный особым «клеем» — обобществлёнными электронами, которые и определяют наиболее характерные физические свойства металлов: все металлы твёрдые, за исключением ртути, проводят электрический ток и теплоту, куются, прокатываются, вытягиваются в проволоку, имеют металлический блеск.
Назовите области применения металлов, в которых используют их физические свойства.Для производства электроники благодаря электропроводности применяется серебро и золото, а для электропроводки и проводов ЛЭП — медь и алюминий.
Для производства радиаторов и теплообменников благодаря теплопроводности используют медь и алюминий.Для производства зеркал и декоративных покрытий благодаря металлическому блеску применяют хром и серебро, а для прожекторов и мощных отражателей — алюминий.
В ювелирном деле, для декоративных покрытий (сусальное золото) благодаря пластичности применяют золото, для изготовления листов, труб, проволок — железо, а для производства фольги, упаковочных материалов для пищевых продуктов — алюминий.
Для производства лёгких сплавов в авиационной и космической промышленности благодаря малой плотности (лёгкости) используется алюминий.
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1. Запишите формулы и укажите вид химической связи для следующих веществ: а) поваренная соль; NaCl, ионная связь, т.к. она образована атомами металла и неметалла.б) серебро; Ag, металлическая связь, т.к. она образована атомами металла.в) магний; Mg, металлическая связь, т.к. она образована атомами металла.г) углекислый газ; CO2, ковалентная полярная связь, т.к. она образована атомами неметаллов з различной электроотрицательностью.д) вода; H2O, ковалентная полярная связь, т.к. она образована атомами неметаллов з различной электроотрицательностью.е) азот. N2, ковалентная неполярная связь,
т.к. она образована атомами одного и того же неметалла.
Упражнение 2. Запишите по одной схеме образование ионной, ковалентной полярной и неполярной, металлической связей для веществ, перечисленных в предыдущем задании.
а) Na0 + Cl0 -> Na+Cl- -> NaClб) Ag0 – 1e -> Ag+д)е) Упражнение 3. Какое количество вещества соответствует 96 кг меди?Дано: m(Cu)=96 кгНайти: ʋ(Cu)-?Решение:Количество вещества заданной массы рассчитываем по формуле: ʋ=m/M, где M―молярная масса.M(Cu)=Mr(Cu)=Ar(Cu)=64 кг/кмольʋ(Cu)=m(Cu)/M(Cu)=96 кг : 64 кг/кмоль=1,5 кмольОтвет: 1,5 кмоль
ВЫРАЗИТЕ МНЕНИЕ
Упражнение 1. Согласны ли вы с утверждением, что все типы химической связи имеют единую физическую природу? Согласны. Аргументируйте свою позицию. В образовании химической связи участвуют кулоновские силы, носителями которых являются электроны и ядра атомов. О единстве связей говорит тот факт, что между ними нет резкой границы, например, ионную связь можно рассматривать как крайний случай ковалентной полярной связи.Другие задания смотри здесь…
Металлическая связь — Химия
В одноатомном состоянии при обычных условиях находятся только благородные газы. Остальные же элементы не существуют в виде индивидуальном, так как имеют возможность взаимодействовать между собой или с другими атомами. При этом образуются более сложные частицы.
- Типы химического взаимодействия
- Металлическая химическая связь
- Отличия от других видов
- Схема связи и примеры
- Свойства металлов
Совокупность атомов может образовать следующие частицы:
- молекулы;
- молекулярные ионы;
- свободные радикалы.
Типы химического взаимодействия
Взаимодействие между атомами называют химической связью. Основой являются электростатические силы (силы взаимодействия электрических зарядов), которые действуют между атомами, носителями этих сил являются ядро атома и электроны.
: полярная и неполярная ковалентная связь – что это?
Электронам, находящимся на внешнем энергетическом уровне, отведена основная роль в образовании химических связей между атомами. Они наиболее удалены от ядра, а, следовательно, связаны с ним наименее прочно. Их называют валентными электронами.
Частицы взаимодействуют между собой различными способами, что приводит к образованию молекул (и веществ) разного строения. Различают следующие типы химической связи:
- ионная;
- ковалентная;
- водородная;
- вандерваальсова;
- металлическая.
Говоря о различных типах химического взаимодействия между атомами, стоит помнить о том, что все типы одинаково основаны на электростатическом взаимодействии частиц.
: алканы – химические свойства предельных углеводородов.
Металлическая химическая связь
Как видно из положения металлов в таблице химических элементов, они, в большинстве своём, обладают небольшим числом валентных электронов. Электроны связаны со своими ядрами достаточно слабо и легко отрываются от них. В результате этого образуются положительно заряженные ионы металла и свободные электроны.
- Эти электроны, свободно перемещающиеся в кристаллической решётке, называют «электронным газом».
- На рисунке схематично изображено строение вещества металла.
- То есть в объёме металла атомы постоянно превращаются в ионы (их называют атом-ионами) и наоборот ионы постоянно принимают электроны из «электронного газа».
- : как расставлять коэффициенты в химических уравнениях?
- Механизм образования металлической связи можно записать в виде формулы:
- атом M0 — ne ↔ ион Mn+
Таким образом, металлы представляют собой положительные ионы, которые расположены в кристаллической решётке в определённых положениях, и электроны, которые могут достаточно свободно перемещаться между атом-ионами.
Кристаллическая решётка представляет «скелет», остов вещества, а электроны перемещаются между её узлами. Формы кристаллических решёток металлов могут быть различными, например:
- объёмно-центрическая кубическая решётка характерна для щелочных металлов;
- гранецентрическую кубическую решётку имеют, например, цинк, алюминий, медь, другие переходные элементы;
- гексагональная форма типична для щёлочноземельных элементов (исключением является барий);
- тетрагональная структура — у индия;
- ромбоэдрическая — у ртути.
Пример кристаллической решётки металла показан на картинке ниже.
Отличия от других видов
Отличается металлическая связь от ковалентной по прочности. Энергия металлических связей меньше, чем ковалентных в 3−4 раза и меньше энергии ионной связи.
В случае с металлической связью, нельзя говорить и о направленности, ковалентная связь строго направлена в пространстве.
Такая характеристика, как насыщаемость также не характерна для взаимодействия между атомами металлов. В то время как ковалентные связи являются насыщаемыми, то есть количество атомов, с которыми может произойти взаимодействие, строго ограничено количеством валентных электронов.
Схема связи и примеры
- Процесс, происходящий в металле можно записать с помощью формулы:
- К — е К +
- Al — 3e Al3+
- Na — e Na+
- Zn — 2e Zn2+
- Fe — 3e Fe3+
- Если описывать более подробно, металлическую связь, как образуется этот тип связи, необходимо рассматривать строение внешних энергетических уровней элемента.
В качестве примера можно рассмотреть натрий. Имеющийся на внешнем уровне единственный валентный 3s электрон может свободно перемещаться по свободным орбиталям третьего энергетического уровня. При сближении атомов натрия, происходит перекрывание орбиталей.
Теперь уже все электроны могут перемещаться между атом-ионами в пределах всех пререкрывшихся орбиталей.
У цинка на 2 валентных электрона приходится целых 15 свободных орбиталей на четвёртом энергетическом уровне. При взаимодействии атомов эти свободные орбитали будут перекрываться, как бы обобществляя электроны, которые по ним перемещаются.
У атомов хрома валентных электронов 6 и все они будут участвовать в образовании электронного газа и связывать атом-ионы.
Свойства металлов
Особый вид взаимодействия, который характерен для атомов металлов, определяет ряд объединяющих их свойств и отличающих металлы от других веществ. Примерами таких свойств являются высокие температуры плавления, высокие температуры кипения, ковкость, способность отражать свет, высокая электропроводность и теплопроводность.
Высокие температуры плавления и кипения объясняются тем, что катионы металла прочно связаны электронным газом.
При этом прослеживается закономерность, что прочность связи увеличивается с увеличением количества валентных электронов.
Например, рубидий и калий являются легкоплавкими веществами (температуры плавления 39 и 63 градуса Цельсия, соответственно), по сравнению с, например, хромом (1615 градусов Цельсия).
Равномерностью распределения валентных электронов по кристаллу объясняется, например, такое свойство металлов, как пластичность — смещение ионов и атомов в любых направлениях без разрушения взаимодействия между ними.
Свободное перемещение электронов по атомным орбиталям объясняет и электропроводность металлов. Электронный газ при наложении разности потенциалов переходит из хаотического движения к движению направленному.
В промышленности часто используют не чистые металлы, а их смеси, называемые сплавами. В сплаве свойства одного компонента обычно удачно дополняют свойства другого.
Металлический тип взаимодействия характерен как для чистых металлов, так и для их смесей — сплавов, находящихся в твёрдом и жидком состояниях. Однако, если металл перевести в газообразное состояние, то связь между его атомами будет ковалентная. Металл в виде пара состоит и отдельных молекул (одно- или двухатомных).
Металлическая химическая связь. Полные уроки — Гипермаркет знаний
Гипермаркет знаний>>Химия>>Химия 8 класс. Полные уроки>>Химия: Металлическая химическая связь. Полные уроки
Тема. Металлическая химическая связь
Цель урока
- Дать представление о металлической химической связи.
- Научится записывать схемы образования металлической связи.
- Ознакомится с физическими свойствами металлов.
- Научится четко разделять виды химических связей.
Задачи урока
- Узнать, как взаимодействуют между собой атомы металлов
- Определить, каким образом влияет металлическая связь на свойства образованных ею веществ
Основные термины:
- Электроотрицательность — химическое свойство атома, которое является количественной характеристикой способности атома в молекуле притягивать к себе общие электронные пары.
- Химическая связь —явление взаимодействия атомов, из-за перекрытия электронных облаков взаимодействующих атомов.
- Металическая связь — это связь в металлах между атомами и ионами, образованная за счет обобществления электронов.
- Ковалентная связь — химическая связь, образуется с помощью перекрытия пары валентных электроннов. Обеспечивающие связь электроны называются общей электронной парой. Бывает 2-х видов: полярная и не полярная.
- Ионная связь — химическая связь,которая образуется между атомами неметалов, при которой общая электронная пара переходит к атому с большей электроотрицательностью. В итоге атомы притягиваются, как разноименно заряженные тела.
- Водородная связь — химическая связь между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
ХОД УРОКА
Металлическая химическая связь
Определите элементы ставшие не в ту «очередь».Почему?Ca Fe P K Al Mg Na
Какие элементы из таблицы Менделеева называются металлами?
Сегодня мы узнаем какие свойства есть у металлов, и как они зависят от связи которая образуется между йонами металов.Для начала вспомним месторасполажения металлов в периодической системе?Металлы как мы все знаем обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Выясним, что собирает атомы металла в целостном объеме. Рис. 1.
Золото.На примере мы видим кусок золота. И кстати уникальным металлом является золото. С помощью ковки из чистого золота можно сделать фольгу толщиной 0,002 мм! такой нончайший лист фольги почти прозрачный и имеет зелёный оттенок просвете. В итоге из слитка золота размером со спичечный коробок можно получить тонкую фольгу, которая покроет площадь тенисного корта.
В химическом отношении все металы характеризуются легкостью отдачи валентных электронов, и как следствие образование положительно заряженных ионов и проявлять только положительную окисленность. Именно поэтому металы в свободном состоянии являются востановителями. Общей особенностью атомов металов являются большие размеры по отношению к неметалам.
Внешние эллектроны находятся на больших расстояниях от ядра и поэтому слабо с ним связаны, следовательно легко отрываются.Атомы большего колличества металлов на внешнем уровне имеют маленькое колличество электронов – 1,2,3. Эти электроны легко отрываются и атомы металлов становятся ионами. Ме0 – n ē ⇆ Men+ атомы метала – електроны внешн.
орбиты ⇆ ионы металаТаким образом оторвавшиеся электроны могут перемещатся от одного иона к другому тоесть становятся свободными, и как бы связывая их в единое целое.Поэтому получается, что все оторвавшиеся электроны евляются общими, так как нельзя понять какой эллектрон принадлежит какому из атомов металла.
Электроны могут обьединятся с катионами, тогда временно образуются атомы, от которых сопять потом отрываются электроны. Этот процесс происходит постоянно и без остановки. Получается, что в объеме металла атомы непрерывно превращаются в ионы и наоборот. При этом небольшое число общих электронов связывает большое число атомов и ионов металла.
Но важно, что число электронов в металле равно общему заряду положительных ионов, тоесть получается, что в целом металл остается электронейтральным. Такой процесс представляют как модель — ионы металла находятся в облаке из электронов. Такое электронное облако называют «электронным газом».
Вот например на данной картинке мы видим как электрончики двигаются среди неподвижныхйонов внутри кристалической решетки метала.Рис. 2. Движение электроннов
Для того чтоб лучше понять, что такое Электронный газ и как он ведет себя в химических реакциях разных металлов посмотрим интересное видео. (золото в этом видео упоминается исключительно как цвет!)
Теперь мы можем записать определение: металлическая связь — это связь в металлах между атомами и ионами, образованная за счет обобществления электронов.
Давайте сравним все виды связей которые мы знаем И закрепим, чтобы лучше различать их, для этого посмотрим видео.
Металлическая связь бывает не только в чистых металах но также характерна для смесей разных металов, сплавов в разных агрегатных состояниях. Металлическая связь имеет важное значение и обуславливает основные свойства металлов- электропроводность – беспорядочное движение електронов в объеме металла.
Но при небольшой разности потенциалов , чтобы электроны двигались упорядоченно. Металами с лучшей проводимостью являются Ag, Cu, Au, Al. — пластичность Связи между слоями металла не очень значительны, это позволяет перемещать слои под нагрузкой (деформировать металл не ломая его).
Наилучше деформирующиеся металы (мягкие)Au, Ag, Cu. — металлический блеск
Электронный газ отражает почти все световые лучи. Вот почему чистые металлы так сильно блестят и чаще всего имеют сенрый или белый цвет. Металы являющиеся наилучшими отражателями Ag, Cu, Al, Pd, Hg
- Упражнение 1
- Выбрать формулы веществ которые имеют а) ковалентную полярную связь: Cl2, KCl, NH3, O2, MgO, CCl4, SO2; б) с ионную связь: HCl, KBr, P4, H2S, Na2O, CO2, CaS.
- Упражнение 2
- Вычеркните лишнее: а) CuCl2, Al, MgS б) N2, HCl, O2 в) Ca, CO2, Fe
- г) MgCl2, NH3, H2
Интересно знать что…
Металлический натрий, металлический литий, и остальные щелочные металлы меняют цвет пламени. Металлический литий и его соли придают огню —красный цвет, металлический натрий и соли натрия — жёлтый, металлический калий и его соли — фиолетовый, а рубидия и цезия — тоже фиолетовый, но более светлый. Рис. 4. Кусок металического лития Рис. 5.
Окрашивание пламени металами
Литий (Li). Металлический литий, как и металлический натрий, относится к щелочным металлам. Оба растворяются в воде. Натрий, растворяясь в воде образует едкий натр –очень сильную кислоту. При растворении щелочных металов в воде выделяется много тепла и газа (водорода).
Такие металы желательно не трогать руками, так как можно обжечся.
Список литературы
1. Урок по теме «Металлическая химическая связь», учителя химии Тухта Валентины Анатольевны МОУ «Есеновичская СОШ»2. Ф. А. Деркач «Химия», — научно-методическое пособие. – Киев, 2008.3. Л. Б.
Цветкова «Неорганическая химия» – 2-е издание, исправленное и дополненное. – Львов, 2006.4. В. В. Малиновский, П. Г. Нагорный «Неорганическая химия» — Киев, 2009.
5. Глинка Н.Л. Общая химия. – 27 изд./ Под. ред. В.А. Рабиновича.
– Л.: Химия, 2008. – 704 с.ил.
Отредактировано и выслано Лисняк А.В.
Над уроком работали:
Тухта В.А.
Лисняк А.В.
- Поставить вопрос о современном образовании, выразить идею или решить назревшую проблему Вы можете на Образовательном форуме, где на международном уровне собирается образовательный совет свежей мысли и действия.
- Создав блог, Вы не только повысите свой статус, как компетентного преподавателя, а и сделаете весомый вклад в развитие школы будущего.
- Гильдия Лидеров Образования открывает двери для специалистов высшего ранга и приглашает к сотрудничеству в направлении создания лучших в мире школ.
- Предмети > Химия > Химия 8 класс






