- Бериллий – полезные свойства, уникальность и опасность металла
- Что представляет собой
- Проблемы классификации
- Как был открыт
- Формы нахождения в природе
- Месторождения
- Физико-химические характеристики
- Технология получения
- Где используется
- Другие отрасли
- Цены
- Опасность
- Бериллий, свойства атома, химические и физические свойства
- Общие сведения:
- Свойства атома бериллия:
- Химические свойства бериллия:
- Физические свойства бериллия:
- Кристаллическая решётка бериллия:
- Дополнительные сведения:
- Примечание:
- Источники:
- Бериллий
- Исторические факты
- Химические свойства бериллия
- Где применяется бериллий
- Интересные факты
Можно найти в изумрудах и орбитальных телескопах, но не стоит трогать руками.
В периодической таблице Менделеева больше сотни элементов, и если часть из них у всех на слуху, взять хотя бы кислород или золото, то множество других имеют известность лишь в кругах химиков и физиков. И ладно бы речь шла о тяжёлых элементах, которые рождаются только в недрах ускорителей и живут считанные доли секунды, как например ливерморий, но даже в самом верху таблицы существует химическая терра инкогнита. Сегодня мы будем искать на страницах журнала всё, что так или иначе касается одного такого таинственного элемента, занимающего положение в таблице между литием и бором, – бериллия.  Бериллий – четвёртый по счёту элемент в периодической системе Менделеева. fdecomite/Flickr.com
Бериллий – четвёртый по счёту элемент в периодической системе Менделеева. fdecomite/Flickr.com
Заочно с этим элементом знаком каждый, кто читал «Волшебника Изумрудного города». Нет, герои сказочной повести Александра Волкова, к счастью, не имели никаких дел с бериллием – на их голову и без этого хватало опасных приключений. Тем не менее, один из ключевых элементов рассказа, изумруд – это не что иное, как форма алюмосиликата бериллия.
Кстати говоря, если волшебнику Гудвину и удавалось водить за нос жителей изумрудного города, выдавая обычные стекляшки за драгоценные камни, то вот в реальности его аферу ждал бы мгновенный провал: можно с лёгкостью отличить фальшивый изумруд от настоящего с помощью рамановской и люминесцентной спектроскопии.
Можно пойти ещё дальше и установить, в каком регионе планеты был добыт конкретный изумруд, правда для этого придётся уже изучить изотопный состав кислорода в образцах драгоценного камня.
А информацию такой метод даёт очень интересную! Например, было установлено, что в ювелирных украшениях, изготовленных в Древнем Риме, использовались изумруды, добытые в Пакистане – совсем не ближний свет, даже по меркам нашего времени.
 Неогранённый изумруд с трещиной. Kurt Bauschardt/Flickr.com
Неогранённый изумруд с трещиной. Kurt Bauschardt/Flickr.com
Но не только изотопы кислорода могут рассказать о бериллии – изотопы самого бериллия тоже способны поведать много интересного, например, помочь с датировкой древних останков.
Дело в том, что для объектов, чей возраст превышает 50 000 лет, уже неприменим обычный радиоуглеродный метод датирования – это связано с довольно быстрым периодом полураспада изотопа углерода-14.
Поэтому возраст останков устанавливают по косвенным признакам, что в итоге выливается в большую погрешность, где плюс-минус миллион лет – не такой уж плохой результат. Однако существует метод датировки, основанный на измерении концентрации изотопа бериллия-10 в образцах горной породы, окружающей погребённые останки.
С помощью такого метода, разработанного профессором Дэррилом Грейнджером, удалось поставить точку в споре о том, какой из австралопитеков старше: Люси, чьи останки найдены в долине реки Аваш в Эфиопии, или Литлфут, кости которого были обнаружены в пещере Стеркфонтейн в ЮАР. Вердикт был однозначный: Литлфут оказался почти на полмиллиона лет старше Люси.
 Австралопитек Люси (реконструкция). Peter/Flickr.com Есть ещё один интересный и немного настораживающий момент, связанный с изотопом бериллия-10. В 1987 году в глубинных пластах гренландского льда были обнаружены два слоя с необычно высоким содержанием бериллия-10. Одно из возможных объяснений этому открытию – вспышки сверхновых в относительной, по космическим меркам, близости от Земли. Возросший поток космических лучей высокой энергии увеличивает количество образующегося в атмосфере и вблизи поверхности бериллия-10, в результате чего изотоп накапливается в горных породах или льдах. Вспышки сверхновых считаются одной из потенциальных космических угроз для жизни на нашей планете, способных в буквальном смысле стерилизовать Землю.
Австралопитек Люси (реконструкция). Peter/Flickr.com Есть ещё один интересный и немного настораживающий момент, связанный с изотопом бериллия-10. В 1987 году в глубинных пластах гренландского льда были обнаружены два слоя с необычно высоким содержанием бериллия-10. Одно из возможных объяснений этому открытию – вспышки сверхновых в относительной, по космическим меркам, близости от Земли. Возросший поток космических лучей высокой энергии увеличивает количество образующегося в атмосфере и вблизи поверхности бериллия-10, в результате чего изотоп накапливается в горных породах или льдах. Вспышки сверхновых считаются одной из потенциальных космических угроз для жизни на нашей планете, способных в буквальном смысле стерилизовать Землю.  SNR 0509-67.5 — остаток сверхновой, вспыхнувшей около 400 лет назад в галактике Большое Магелланово Облако. NASA, ESA, CXC, SAO, the Hubble Heritage Team (STScI/AURA), and J. Hughes (Rutgers University) / Flickr.com Сами же космические лучи – это потоки элементарных частиц и ядер атомов, которые обладают огромными скоростями и огромной энергией. Среди ядер атомов, проносящихся сквозь космическое пространство, встречаются и ядра бериллия. Изучать космические лучи не так и просто. Попадая в атмосферу, высокоэнергетическая частица вызывает каскад вторичных частиц, поток которых уже можно регистрировать с поверхности. А чтобы изучать первичные космические лучи, приходится запускать измерительную аппаратуру в космос. Один из таких орбитальных экспериментов, стартовавших в 2006 году и продлившийся без малого девять лет, называется «PAMELA». Магнитный спектрометр и несколько типов детекторов позволили изучить изотопный состав лучей и источники их возникновения. А самое замечательное открытие, которое сделала ПАМЕЛА, это подтверждение гипотезы о существовании слоя из антиматерии в магнитосфере Земли.
SNR 0509-67.5 — остаток сверхновой, вспыхнувшей около 400 лет назад в галактике Большое Магелланово Облако. NASA, ESA, CXC, SAO, the Hubble Heritage Team (STScI/AURA), and J. Hughes (Rutgers University) / Flickr.com Сами же космические лучи – это потоки элементарных частиц и ядер атомов, которые обладают огромными скоростями и огромной энергией. Среди ядер атомов, проносящихся сквозь космическое пространство, встречаются и ядра бериллия. Изучать космические лучи не так и просто. Попадая в атмосферу, высокоэнергетическая частица вызывает каскад вторичных частиц, поток которых уже можно регистрировать с поверхности. А чтобы изучать первичные космические лучи, приходится запускать измерительную аппаратуру в космос. Один из таких орбитальных экспериментов, стартовавших в 2006 году и продлившийся без малого девять лет, называется «PAMELA». Магнитный спектрометр и несколько типов детекторов позволили изучить изотопный состав лучей и источники их возникновения. А самое замечательное открытие, которое сделала ПАМЕЛА, это подтверждение гипотезы о существовании слоя из антиматерии в магнитосфере Земли.  Макет космического спутника «Ресурс-ДК1» с установленным детектором «PAMELA». Vlsergey/Wikimedia Commons
Макет космического спутника «Ресурс-ДК1» с установленным детектором «PAMELA». Vlsergey/Wikimedia Commons
Перед тем как спуститься с космических высот на Землю, вспомним об одном масштабном проекте, который, правда, так и не был реализован. В 1973 году было начато исследование теоретической возможности постройки космического корабля для межзвёздного полёта.
Спустя пять лет группа специалистов представила проект звездолёта, который по замыслу создателей был способен достичь звезды Барнарда за время чуть более 40 лет.
Чтобы защититься от межзвёздной пыли, головную секцию корабля предлагалось спрятать за плоским экраном из бериллия толщиной 7 миллиметров.
Алюминиево-бериллиевые сплавы, обладающие отличной прочностью, использовали в конструкции межпланетных станций «Венера», несколько из которых осуществили мягкую посадку на поверхность планеты. К сожалению, проект звездолёта так и остался проектом, да и к освоению космических просторов человечество заметно охладело.
 Цветная фотография поверхности Венеры, переданная аппаратом «Венера-13» в 1982 году. НПО имени С.А. Лавочкина/NASA.gov
Цветная фотография поверхности Венеры, переданная аппаратом «Венера-13» в 1982 году. НПО имени С.А. Лавочкина/NASA.gov
Побывав в космосе, обнаружив там летающие ядра бериллия и немного погрустив о кризисе космонавтики, всё-таки спустимся на Землю и посмотрим, где же тут ещё можно найти бериллий.
В чистом виде этот металл, а бериллий – это самый настоящий металл, используют в качестве материала для элементов атомных реакторов и ускорителей.
Например, на ускорительном комплексе DRIBs Лаборатории ядерных реакций в Дубне в результате бомбардировки ионами лития мишени из бериллия был получен поток необычных ядер гелия-6, у которого два дополнительных нейтрона находятся снаружи ядра.
 Шар из металлического бериллия. Aatze78/Wikimedia Commons
Шар из металлического бериллия. Aatze78/Wikimedia Commons
Из бериллия или его сплавов можно изготовить не только детали космических аппаратов и запчасти для ускорителей. К примеру, бериллиевая бронза – сплав меди и бериллия используется для производства искробезопасных инструментов.
Гаечные ключи или молотки из бериллиевой бронзы не дают искр при резком ударе, поэтому их можно использовать при работе с взрывоопасными средами.
Так что, если вы увидите, что ключ для газового баллона стоит в несколько раз дороже обычного гаечного ключа, то не стоит сразу винить в этом маркетологов.
 Переставной трубный ключ, изготовленный из бериллиевой бронзы. nicransby/Wikimedia Commons
Переставной трубный ключ, изготовленный из бериллиевой бронзы. nicransby/Wikimedia Commons
Однако если бериллий такой прекрасный материал, то почему его используют на порядок реже, чем его близкого соседа по периодической таблице – алюминий? Помните, в самом начале мы вскользь сказали о том, что очень хорошо, что герои «Волшебника Изумрудного города» не имели дел с бериллием, и это было сделано совсем не случайно.
Дело в том, что бериллий и его соединения очень токсичны для человека и животных, а вдыхание пыли, содержащей бериллий, приводит к крайне опасному заболеванию – бериллиозу.
Поэтому без дополнительной защиты бериллиевыми инструментами мог пользоваться разве что Железный Дровосек, а вот Элли, Лев и Тотошка были бы вынуждены на приёме у Волшебника решать проблемы со здоровьем.
 Респираторы, перчатки и спецодежда защищают космическую аппаратуру от биологических загрязнений, а рабочих от контакта с вредными материалами. На фото: работы с зеркалом из покрытого слоем золота бериллия, изготовленным для орбитального телескопа «Джеймс Уэбб». NASA/Chris Gunn Винить бериллий в его вредности, конечно же, не стоит – при грамотном использовании он может проявить свои лучшие качества, а они у него, безусловно, имеются. Вполне возможно, что время этого элемента ещё просто не наступило, и он, как в своё время литий, просто ждёт своего звёздного часа. И нам только предстоит узнать, будет ли это звездолёт с бериллиевым экраном или что-то совершенно иное.
Респираторы, перчатки и спецодежда защищают космическую аппаратуру от биологических загрязнений, а рабочих от контакта с вредными материалами. На фото: работы с зеркалом из покрытого слоем золота бериллия, изготовленным для орбитального телескопа «Джеймс Уэбб». NASA/Chris Gunn Винить бериллий в его вредности, конечно же, не стоит – при грамотном использовании он может проявить свои лучшие качества, а они у него, безусловно, имеются. Вполне возможно, что время этого элемента ещё просто не наступило, и он, как в своё время литий, просто ждёт своего звёздного часа. И нам только предстоит узнать, будет ли это звездолёт с бериллиевым экраном или что-то совершенно иное.
#бериллий #Менделеев #химия #периодическаясистема #элементы
Максим Абаев
Бериллий – полезные свойства, уникальность и опасность металла
Это вещество соперничает с алюминием, сталями, благородными металлами.
Бериллий приходит на Землю из Космоса. Им покрыты зеркала телескопов, он есть в Большом адронном коллайдере.

Что представляет собой
Бериллий – элемент №4 таблицы Менделеева. Сероватый металл легок, с приглушенным блеском.
Имеет в составе один стабильный изотоп Ве-9.
Его материалом служит вещество межзвездных скоплений. Доставляется на Землю лучами из глубин Космоса.
Международное обозначение и формула простого вещества – Be.
Проблемы классификации
Бериллий относится к щелочноземельным металлам. Однако с классификацией определились не сразу.
По химическим свойствам его легко отличить от остальных металлов этой группы. Он не реагирует с водой, его гидроксид – не щелочь.
Однако сегодня, согласно номенклатуре Международного союза теоретической и прикладной химии (ИЮПАК), все элементы второй группы таблицы Менделеева, а значит и бериллий, считаются щелочноземельными металлами.
Как был открыт
К открытию элемента причастны европейские химики, физик и русский ученый:
- Первооткрывателем стал французский химик Луи Николя Воклен. В 1798 он выделил из берилла оксид.
- Через тридцать лет его коллеги немец Франц Велер и француз Антуан Бюсси получили, каждый в своей лаборатории, свободный бериллий.
- Металлическая форма вещества – заслуга француза Поля Лебо. Физик применил электролиз к расплаву солей вещества.
- В России бериллий исследовал Иван Авдеев. Химик проанализировал состав бериллиевых минералов и соединений с Урала, доказав истинную валентность оксида металла.
Интересна история названия элемента. За сладкий вкус растворяемых водой соединений его окрестили глицинием. Бериллием его предложили именовать химики Мартин Клапрот (Германия) и Андерс Экеберг (Швеция).
Термин «берилл» восходит к названию индийского города Белур в окрестностях Мадраса. Здесь веками добывали ювелирную разновидность берилла – изумруд.
Формы нахождения в природе
В природе металл представлен россыпями и коренными залежами минералов.
Таких минералов три десятка, из них половина – силикаты, еще четверть – фосфаты. Самые известные – берилл, фенакит, хризоберилл.
Берилл Фенакит Хризоберилл
Тонна земной коры содержит 3,8 г бериллия (щелочные породы – до 70 г). Литр морской воды – 0,000006 мг.
Попадаются кристаллы с габаритами в несколько метров и тонн. Их добывают из пегматитов.
На особом счету драгоценные разновидности берилла – аквамарин, изумруд, гелиодор. Голубой, зеленый, желтый цвет создают примеси других элементов в составе.
Месторождения
Месторождения бериллиевых руд распределены по планете. Наибольшие запасы – в обеих Америках (США, Бразилия, Аргентина), Африке, Казахстане, России.
Источники сырья в России – Бурятия, Свердловская, Мурманская области.
Физико-химические характеристики
Бериллий – необычный металл. С изменением температуры кристаллическая структура его решетки меняется с гексагональной на кубическую.
 Бериллий, чистота более 99%, поликристаллический фрагмент
Бериллий, чистота более 99%, поликристаллический фрагмент
Ученые выявили уникальные физические и химические свойства элемента:
- Высшая среди металлов теплоемкость, звукопроницаемость.
- Высокая теплопроводность.
- Малое электрическое сопротивление.
- Порог упругости выше, чем у сталей.
Твердость средняя (5,5 по Моосу), но это больше, чем у других «легких» металлов.
| Бери́ллий / Beryllium (Be), 4 |
| 9,012182(3) а. е. м. (г/моль) |
| [ He ] 2s² |
| 112 пм |
| 90 пм |
| 35 (+2e) пм |
| 1,57 (шкала Полинга) |
| −1,69 В |
| +2 ; 0 |
| 898,8 (9,32) кДж/моль (эВ) |
| 1,848 г/см³ |
| 1551 K (1278 °C, 2332 °F) |
| 3243 K (2970 °C, 5378 °F) |
| 12,21 кДж/моль |
| 309 кДж/моль |
| 16,44 Дж/(K·моль) |
| 5,0 см³/моль |
| гексагональная |
| a=2,286 Å; c=3,584 Å |
| 1,567 |
| 1000 K |
| (300 K) 201 Вт/(м·К) |
| 7440-41-7 |
На воздухе металл покрывается оксидным щитом-пленкой. Поэтому химическая активность запускается только при высоких температурах.
Технология получения
Бериллиевую руду доставляют на обогатительную фабрику.
Здесь получают соли вещества:
- Из них извлекают металлический продукт, восстанавливая фторид магнием.
- Сырье для второго способа получения – хлориды натрия и бериллия. Смесь расплавляют, затем применяют электролиз.
- Продукт высокой чистоты создают в вакууме переплавкой и дистилляцией.
Переработка руды налажена в США, КНР, Казахстане, России.
Глобальный объем производства бериллия – 260-310 тонн ежегодно.
Обработка бериллия проблематична, опасна для здоровья, поэтому главные способы производства – точное литье и порошковая металлургия. Размолотый металл спрессовывают, создавая форму по заданным параметрам либо универсальную заготовку (труба, пруток).
Обработку затрудняет хрупкость. Этот недостаток устранили в 1970-х годах, выяснив, что пластичен чистый бериллий.
Где используется
Две трети бериллия либо соединений забирает промышленность. Каждый сегмент использует нужные для себя достоинства вещества. Самые красивые находки достаются ювелирам и коллекционерам.
Первые в цепочке потребителей руды – металлурги. Добавка микродоз бериллия к сталям и сплавам повышает их утилитарные характеристики: прочность, твердость, невосприимчивость к ржавчине.
 Шар из металлического бериллия
Шар из металлического бериллия
Особо популярна бериллиевая бронза (рандоль). Идет на диски, пружины, другие комплектующие, работающие в экстремальных условиях.
Всего 0,5% бериллия в составе сплава на порядки увеличивает количество рабочих циклов изделия, предотвращает искрение. Внешне сплав неотличим от благородного металла, за что назван «цыганским золотом».
Другие отрасли
Продукцию металлургов закупают производители оборудования для разных сфер:
- В ядерной отрасли это отражатель, замедлитель, источник нейтронов (начинка реакторов АЭС). Оксид бериллия плюс уран – ядерное топливо с высоким КПД. Фторид – компонент стекла специального назначения.
- Аэрокосмическая техника. Металл в полтора раза легче алюминия, но прочнее стали. Также жаростоек, упруг, с хорошей теплопроводностью. Поэтому нашел применение как материал корпуса и конструкций ракет, самолетов, космических аппаратов. Недорогой, с пониженной токсичностью гидрид бериллия – основа ракетного топлива.
- Металл неуязвим для рентгеновских лучей, поэтому становится «оконцами» рентгеновских аппаратов, детекторов.
- Это также детали лазеров.
- Металл – третий по теплопроводности среди химических элементов. Используется как огнеупор, изолятор, материал тиглей и специальных сортов керамики.
- Динамики с бериллием – компонент аудиосистем класса люкс.
 Оксид бериллия 99,9 % (изделие)
Оксид бериллия 99,9 % (изделие)
ФАКТ! Из бериллия сделан «трубопровод» Большого адронного коллайдера. Им покрыты зеркала телескопов Хаббла, Спитцера, Уэбба, работающих в открытом космосе.
Цены
На российском рынке представлены разные продукты из металла.
Цена определяется видом продукции (руб./ кг):
- Чистое вещество – 10,7 тыс.
- Метацирконат – 12,3 тыс.
- Алюминат – 339.
Такой же расклад на мировом рынке.
Опасность
Роль вещества для биологических систем невелика. Однако металл скапливается в почках, способен вытеснить из скелета магний.
Каждый день в организм человека с пищей поступает 0,01 мг бериллия.
Металлический бериллий нетоксичен. Опасность исходит от пыли, порошка, растворимых, летучих соединений. Они провоцируют аллергию и онкологию.
Особо ощущают вредность металла работники, занятые на добыче и обогатительных предприятиях. Их профессиональное заболевание – бериллиоз. То есть поражение дыхательной системы (особенно легких).
По стандартам РФ, кубометр воздуха не должен содержать более 0,001 мг бериллия.
Проверить совместимость мужчины и женщины по Знаку Зодиака
Бериллий, свойства атома, химические и физические свойства
Be 4 Бериллий
9,012182(3) 1s2 2s2
Бериллий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 4. Расположен во 2-й группе (по старой классификации — главной подгруппе второй группы), втором периоде периодической системы.
- Общие сведения
- Свойства атома бериллия
- Химические свойства бериллия
- Физические свойства бериллия
- Кристаллическая решётка бериллия
- Дополнительные сведения
Таблица химических элементов Д.И. Менделеева
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Бериллий |
| 102 | Прежнее название | |
| 103 | Латинское название | Beryllium |
| 104 | Английское название | Beryllium |
| 105 | Символ | Be |
| 106 | Атомный номер (номер в таблице) | 4 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, щёлочноземельный металл |
| 109 | Открыт | Луи-Николя Воклен, Франция, 1798 г. |
| 110 | Год открытия | 1798 г. |
| 111 | Внешний вид и пр. | Относительно твёрдый, хрупкий металл светло-серого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации бериллия: — α-бериллий с гексагональной плотноупакованной кристаллической решёткой, — β-бериллий с кубической объёмно-центрированной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | — α-бериллий существует при температуре ниже 1250 °C и иных стандартных условиях, — β-бериллий существует при температуре выше 1250 °C и иных стандартных условиях |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00019 % |
| 120 | Содержание в морях и океанах (по массе) | 6,0·10-11 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10-8 % |
| 123 | Содержание в метеоритах (по массе) | 2,9·10-6 % |
| 124 | Содержание в организме человека (по массе) | 4,0·10-8 % |
Свойства атома бериллия:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 9,012182(3) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 |
| 203 | Электронная оболочка | K2 L2 M0 N0 O0 P0 Q0 R0  |
| 204 | Радиус атома (вычисленный) | 112 пм |
| 205 | Эмпирический радиус атома | 105 пм |
| 206 | Ковалентный радиус* | 96 пм |
| 207 | Радиус иона (кристаллический) | Be2+
|
| 208 | Радиус Ван-дер-Ваальса | 153 пм |
| 209 | Электроны, Протоны, Нейтроны | 4 электрона, 4 протона, 5 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 2-ая группа (по старой классификации – главная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения |
Химические свойства бериллия:
Физические свойства бериллия:
| 400 | Физические свойства | |
| 401 | Плотность* | 1,85 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – кристаллы, твердое тело), 1,690 г/см3 (при температуре плавления 1287 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1287 °C (1560 K, 2348,6 °F) |
| 403 | Температура кипения* | 2742 K (2469 °C, 4476 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 12,2 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 292 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 1,56 Дж/г·K (при -23 °C), 1,98 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 16,443 Дж/(K·моль) |
| 411 | Молярный объём | 4,8767 см³/моль |
| 412 | Теплопроводность | 200 Вт/(м·К) (при стандартных условиях), 201 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 11,3 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | 4931,85 °C (5205 K, 8909,33 °F) – предположительно |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | 0,001 мм.рт.ст. (при 1091 °C), 0,1 мм.рт.ст. (при 1361 °C), 1 мм.рт.ст. (при 1548 °C), 10 мм.рт.ст. (при 1785 °C), 100 мм.рт.ст. (при 2097 °C) |
| 420 | Давление паров (Па) | 1 Па (при 1462 K),
|
| 421 | Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) |
| 422 | Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – твердое тело) |
| 423 | Стандартная энтропия вещества S | 9,54 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело) |
| 424 | Стандартная мольная теплоемкость Cp | 16,4 Дж/(моль·K) (при 298 К, для состояния вещества – твердое тело) |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | Диамагнитный материал |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | -2,328·10-5 |
| 430 | Удельная магнитная восприимчивость | -1,26·10—8 |
| 431 | Молярная магнитная восприимчивость | -9,0·10-6 см3/моль (при 298 K) |
| 432 | Электрический тип | Проводник |
| 433 | Электропроводность в твердой фазе | 25,0·106 См/м (при 20 °C) |
| 434 | Удельное электрическое сопротивление | 36,0 нОм·м (при 20 °C) |
| 435 | Сверхпроводимость при температуре | 0,0237 К |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | 5,5 |
| 440 | Твёрдость по Бринеллю | 600 МПа |
| 441 | Твёрдость по Виккерсу | 1670 МПа |
| 442 | Скорость звука | 12,890 м/с (при 20 °C) (в тонком стержне) |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | 200-550 МПа, до 400-800 МПа – после обработки давлением |
| 447 | Предел текучести | 250-600 МПа – после обработки давлением |
| 448 | Предел удлинения | 0,2-2 %, до 4-12% – после обработки давлением |
| 449 | Модуль Юнга | 287 ГПа |
| 450 | Модуль сдвига | 132 ГПа |
| 451 | Объемный модуль упругости | 130 ГПа |
| 452 | Коэффициент Пуассона | 0,032 |
| 453 | Коэффициент преломления |
Кристаллическая решётка бериллия:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-бериллий |
| 512 | Структура решётки | Гексагональная плотноупакованная 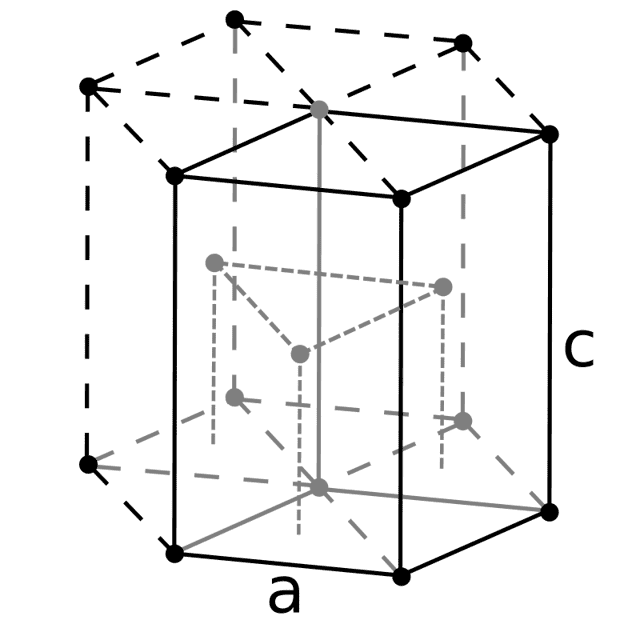 |
| 513 | Параметры решётки | a = 2,286 Å, c = 3,584 Å |
| 514 | Отношение c/a | 1,567 |
| 515 | Температура Дебая | 1000 K |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 521 | Кристаллическая решётка #2 | β-бериллий |
| 522 | Структура решётки | Кубическая объёмно-центрированная 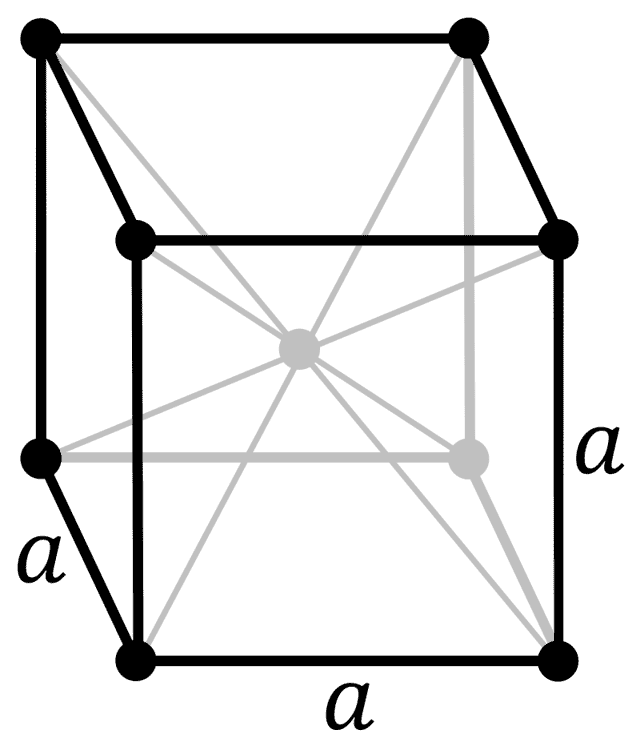 |
| 523 | Параметры решётки | 2,5515 Å |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | |
| 527 | Номер пространственной группы симметрии |
Дополнительные сведения:
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-41-7 |
Примечание:
- 206* Ковалентный радиус бериллия согласно [1] и [3] составляет 96±3 пм и 90 пм соответственно.
- 401* Плотность бериллия согласно [3] составляет 1,848 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело).
- 402* Температура плавления бериллия согласно [3] составляет 1278 °C (1551 K, 2332 °F).
- 403* Температура кипения бериллия согласно [3] составляет 2970 °C (3243 K, 5378 °F).
- 407* Удельная теплота плавления (энтальпия плавления ΔHпл) бериллия согласно [3] и [4] составляет 12,21 кДж/моль и 14,7 кДж/моль соответственно.
- 408* Удельная теплота испарения (энтальпия кипения ΔHкип) бериллия согласно [3] составляет 309 кДж/моль.
- 410* Молярная теплоемкость бериллия согласно [3] составляет 16,44 Дж/(K·моль).
Источники:
- https://en.wikipedia.org/wiki/Beryllium
- https://de.wikipedia.org/wiki/Beryllium
- https://ru.wikipedia.org/wiki/Бериллий
- http://chemister.ru/Database/properties.php?dbid=1&id=214
[know]
Таблица химических элементов Д.И. Менделеева
Бериллий
Бериллий является элементом второго периода и относится к щелочноземельным металлам, из-за чего обладает высокой токсичностью. Он находится во второй группе таблицы Менделеева, его атомный номер 4.
Латинское название Beryllium происходит от латинского обозначения берилла — основного минерала, из которого получают бериллий. В свою очередь «берилл» восходит к греческому βήρυλλος, что означает приблизительно следующее: «драгоценный цвета морской воды камень».
Бериллий редко встречается в природе, в чистом виде представляет собой хрупкий твёрдый металл светло-серебристого оттенка. Вследствие трудоемкой добычи из природных минералов, бериллий имеет высокую стоимость, сравнимую с ценами на серебро и золото.
Он также входит в состав таких драгоценных камней как зеленые изумруды и аквамарины. Минералы бериллия могут очень сильно отличаться по цвету: от розовых и красных до бледно-голубых и темно-синих оттенков.
Исторические факты
В 1798 году впервые французским фармацевтом Луи-Николя Вокленом был получен бериллий в виде оксида BeO, так называемой, берилловой земли.
Однако в виде металла, его смогли синтезировать только спустя 30 лет французский химик Антуан Бюсси и автономно от него немец Фридрих Вёлер.
По причине низкой чистоты бериллий не получалось внести в другие сплавы до тех пор, пока в 1898 году во Франции химик Пол Лебо с помощью электролиза фторидов кальция и бериллия, получил его кристаллы требуемой чистоты.
Немаловажное значение в исследовании бериллия сыграл и наш соотечественник Иван Авдеев, живший в XIX веке. Он вел исследования в области определения химического содержания минералов бериллия и других содержащих его веществ. В результате Авдеев обнаружил, что правильная формула оксида бериллия — это BeO, а не Be2O3, как думали раньше.
Ещё один интересный исторический факт связан с периодом Второй мировой войны, когда все действовавшие месторождения минералов бериллия были подконтрольны США.
Германия остро нуждалась в этом сырье для производства бронзы с добавлением бериллия, использующейся в изготовлении деталей для автоматических авиационных пулеметов.
Для этого немцы были вынуждены обратиться за помощью к нейтральной Швейцарии, с помощью которой бериллиевая бронза ввозилась контрабандно. До сегодняшнего дня США остаются неоспоримыми лидерами в добыче бериллия.
Химические свойства бериллия
Бериллий является двухвалентным элементом. Благодаря своей высокой химической активности он легко растворяется в различных кислотах. В их числе: соляная, плавиковая, разбавленная серная кислоты. Однако с разбавленной азотной и концентрированной серной кислотами реагирует слабо.
При этом он устойчив в воздухе из-за образования тонкой и устойчивой пленки оксида BeO. С водой бериллий практически никак не реагирует, пока ее температура не достигнет 100⁰C. В нормальных условиях взаимодействует со фтором, а при более высокой температуре и с другими галогенами.
Его свойства похожи на магний Mg и алюминий Al, причём к последнему бериллий намного ближе, несмотря на то, что магний находится прямо под ним в таблице Менделеева. Общие свойства бериллия и алюминия объясняются практически идентичным соотношением заряда в ядре и радиуса катиона для ионов Be2+ и Al3+.
Бериллий может вступать в реакцию также с большим числом металлов при достаточно высоких температурах, в этом случае образуются так называемые бериллиды.
Где применяется бериллий
Бериллий имеет широкую область применения. Пожалуй, одной из самых важных и старых сфер применения является изготовление рентгеновских трубок. Благодаря низкому уровню поглощения рентгеновского излучения из бериллия изготавливают специальные окошки, пропускающие излучение в детектор.
Также бериллий используется в качестве легирующей добавки к разнообразным материалам для повышения прочности и коррозионной устойчивости металлических поверхностей.
Достаточно широкое распространение получили бериллиевые бронзы, используемые в пружинах.
Добавление бериллия позволяет во много раз увеличить количество рабочих циклов, а кроме того детали из бериллиевой бронзы не искрятся при взаимодействии с камнем или металлом.
Особенное место бериллий занимает в атомной энергетике. Он используется при изготовлении нейтронных отражателей, замедляющих свободные нейтроны. Такую же функцию выполняют и его оксиды. Кроме этого, различные смеси окиси урана с бериллием используются для создания высокоэффективного ядерного топлива.
Специальные сплавы, изготовленные на основе бериллия, широко применяются в аэрокосмической отрасли при производстве обшивки для ракет и самолетов. Такие материалы обладают более надежными характеристиками по сравнению с алюминием, но при этом гораздо легче большинства конструкционных стальных сплавов.
Интересные факты
- До своего нынешнего названия элемент бериллий именовался как «глюциний», что в переводе с греческого glykys означало «сладкий». Такое наименование обусловлено тем, что растворенные соединения бериллия придавали воде сладкий привкус.
- Помимо высокой токсичности, бериллий является аллергеном, а также может вызывать рак. Вдыхание его паров приводит к несовместимым с жизнью заболеваниям органов дыхания, такими как «бериллиоз».
- Благодаря высокой твердости и чрезвычайной легкости бериллий используется как материал для профессиональных громкоговорителей. Однако его высокая цена и потенциальная токсичность при неправильной обработке не позволяют вывести такие аудиосистемы на массового потребителя.
- В своей фантастической повести «Ловушка для простаков» Айзек Азимов неоднократно упоминает бериллиевую пыль и ее влияние на человеческий организм, которое в свою очередь является важным моментом сюжета в произведении.






