- Основные группы металлов в промышленности
- Черные металлы
- Легкие цветные металлы
- Тяжелые цветные металлы
- Благородные металлы
- Редкоземельные и щелочные
- Классификация металлов по химическому составу
- Атомно — кристаллическое строение металлов
- Физические свойства металлов
- Электронное строение металлов и их особенности
- Кристаллическая решетка металлов
- Типы кристаллических решеток
- Кристаллическое строение сплавов
- Кристаллизация сплавов
- Лекция "Особенности атомно-кристаллического строения металлов"по дисциплине "Основы материаловедения"
- Атомно-кристаллическое строение металлов
- Атомно-кристаллическое строение металлов и сплавов
Металлы — один из самых распространенных веществ в материальной культуре человека.
Тысячелетиями медь, железо, серебро и золото были основным материалом для производства оружия, инструментов, ответственных частей транспорта и механизмов, деталей домашней утвари и украшений.
В XIX веке, с освоением технологии получения чугуна, металлы пришли в строительство и станкостроение. XX век был веком металлов.

Металлы
В нашу жизнь вошли алюминий, титан, бор и многие более редкие металлы. Используя их, человечество шагнуло в небо, космос и глубины океана. Металлы сделали возможным массовое производство домашней бытовой техники.
В конце XX века пластмассы и композитные вещества ощутимо потеснили металлы с лидирующих позиций.
Основные характеристики металлов — прочность, упругость и пластичность определяются их физико-химическими свойствами и атомным строением.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.
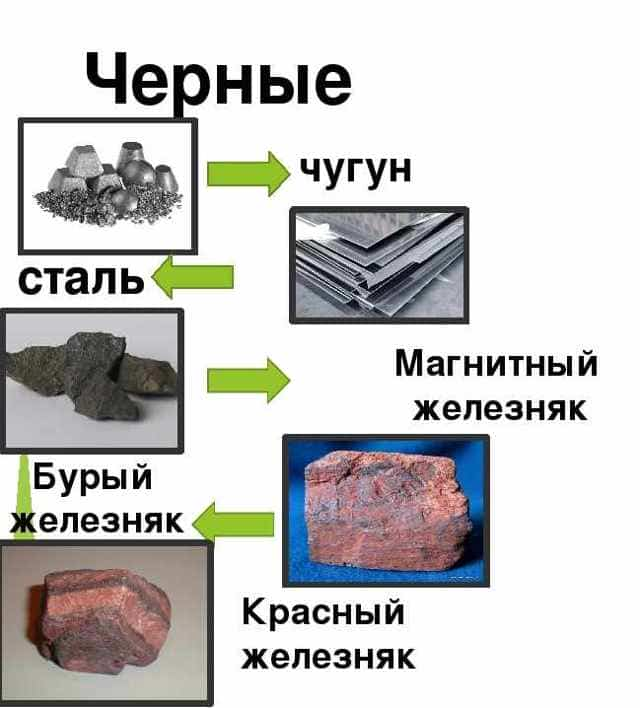
Черные металлы
Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.

Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
 Медь
Медь
 Олово
Олово
 Цинк
Цинк
 Свинец
Свинец
 Чистый никель
Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
 Золото и платина
Золото и платина
 Серебро
Серебро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
Иттрий
Сканидий
Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.
Щелочные металлы
Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой.Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д.
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.
Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным.
При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов.
Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
Главное отличие металлов от других элементов — это их электропроводность и магнитные свойства.
И хотя ученые создали неметаллические материалы, обладающие другим строением, но такими же свойствами, как у металлов и сплавов, они еще слишком дороги для массового применения. Многие химически чистые металлы обладают недостаточной прочностью для практических применений, чтобы исправить ситуацию, в технике и строительстве используют их сплавы.
Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Электронное строение металлов и их особенности
Внутреннее строение реальных металлов определяет их физико-химические параметры.
Кристаллическая решетка металлов
Все металлы в твердом фазовом состоянии имеют кристаллическое строение. Это пространственное образование из многократно повторяющихся первичных структур называют кристаллической решеткой.схема кристаллической решетки.
Кристаллическое строение металлов
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция равна по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, его параметры зависят от направления.
В реальном куске металлов, который состоит из множества кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. Усредненные параметры такого куска близки к изотропным.
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
Уникальная возможность железа заключается в том, что до 910°С оно имеет кубическую объемно-центрированную структуру, а при нагреве свыше этой температуры переходит к гранецентрированной.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода.
Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями.
Кристаллическое строение сплавов сложнее, чем металлов.
Строение сплавов
Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Физические свойства сплавов могут заметно меняться при изменении процентного соотношения составляющих.
Кристаллизация сплавов
Первичная кристаллизация — это затвердевание расплава с образованием кристаллических решеток. Пространственные атомные и молекулярные структуры, возникающие в ходе такого процесса, оказывают решающее влияние на свойства получаемого сплава.
Сначала в остывающем расплаве возникают центры кристаллизации, вокруг них в ходе процесса и нарастают кристаллы, многократно повторяя структуру центра. В качестве центров кристаллизации могут выступать:
- Первые образовавшиеся кристаллы в зонах локального охлаждения, чаще всего у стенок литейной формы.
- Частички неметаллических примесей.
- Тугоплавкие примеси, уже находящиеся в твердой форме.
Процесс кристаллизации металлов и сплавов
Кристаллы обычно растут в направлении роста градиента температуры. Если рост решеток не встречает физических препятствий, образуются ветвящиеся кристаллические структуры, напоминающие кораллы — дендриты. Если они растут из разных центров и встречаются в расплаве, то препятствуют росту друг друга и искажают свою форму.
Такие искаженные кристаллы – это кристаллиты, или зерна. Совокупность отдельных зерен срастается в поликристаллическое тело.Отдельные кристаллиты достигают размеров от одного до 10 000 микрон и по-разному развернуты в пространстве. На стыках отдельных кристаллитов образуется граничный слой, в котором кристаллические решетки разорваны.
Такие слои обладают измененными химическими и физическими свойствами.
Решетки кристаллитов могут обладать разными дефектами структуры:
- точечные;
- линейные;
- поверхностные;
Дефекты кристаллического строения металлов
Дефекты определяются отсутствием атома или группы атомов в вершинах или гранях кристаллической решетки, смещением этих атомов со своих мест или замещением атома или их группы атомами или молекулами примесей.
Лекция "Особенности атомно-кристаллического строения металлов"по дисциплине "Основы материаловедения"
- Материаловедение.
- Лекция 1
- Особенности атомно-кристаллического строения металлов.
- 1.
Металлы, особенности атомно-кристаллического строения - 2.
Понятие об изотропии и анизотропии
3.
Аллотропия или полиморфные превращения.
4.
Магнитные превращения
Материаловедение — это наука о
взаимосвязи электронного строения, структуры материалов с их составом,
физическими, химическими, технологическими и эксплуатационными свойствами.
Создание
научных основ металловедения по праву принадлежит. Чернову Д.К., который
установил критические температуры фазовых превращений в сталях и их связь с
количеством углерода в сталях. Этим были заложены основы для важнейшей в
металловедении диаграммы состояния железоуглеродистых сплавов.
Открытием
аллотропических превращений в стали, Чернов заложил фундамент термической
обработки стали. Критические точки в стали, позволили рационально выбирать
температуру ее закалки, отпуска и пластической деформации в производственных
условиях.
В
своих работах по кристаллизации стали, и строению слитка Чернов изложил
основные положения теории литья, не утратившие своего научного и практического
значения в настоящее время.
Великий
русский металлург Аносов П.П. впервые применил микроскоп для исследования
структуры металлов. Ему принадлежит приоритет в создании легированных сталей.
Разработал теорию и технологию изготовления клинков из булатной стали. Из его
работ стало ясно, что так называемый булатный узор на поверхности стали,
непосредственно зависит от ее внутренней структуры.
В
1873-1876 г.г Гиббс изложил основные законы фазового равновесия и, в частности,
правило фаз, основываясь на законах термодинамики.
Для решения практических
задач знание фазового равновесия в той или иной системе необходимо, но не
достаточно для определения состава и относительного количества фаз.
Обязательно
знать структуру сплавов, то есть атомное строение фаз, составляющих сплав, а
также распределение, размер и форму кристаллов каждой фазы.
Определение
атомного строения фаз стало возможным после открытия Лауэ (1912 г),
показавшего, что атомы в кристалле регулярно заполняют пространство, образуя
пространственную дифракционную решетку, и что рентгеновские лучи имеют волновую
природу. Дифракция рентгеновских лучей на такой решетке дает возможность
исследовать строение кристаллов.
В
последнее время для структурного анализа, кроме рентгеновских лучей, используют
электроны и нейтроны. Соответствующие методы исследования называются
электронографией и нейтронографией. Электронная оптика позволила
усовершенствовать микроскопию. В настоящее время на электронных микроскопах
полезное максимальное увеличение доведено до 100000 раз.
В
пятидесятых годах, когда началось исследование природы свойств металлических
материалов, было показано, что большинство наиболее важных свойств, в том числе
сопротивление пластической деформации и разрушению в различных условиях
нагружения, зависит от особенностей тонкого кристаллическо строения.
Этот вывод
способствовал привлечению физических теорий о строении реальных металлов для
объяснения многих непонятных явлений и для конструирования сплавов с заданными
механическими свойствами.
Благодаря теории дислокаций, удалось получить
достоверные сведения об изменениях в металлах при их пластической деформации.
Особенно
интенсивно развивается металловедение в последние десятилетия. Это объясняется
потребностью в новых материалах для исследования космоса, развития электроники,
атомной энергетики.
Основными
направлениями в развитии металловедения является разработка способов
производства чистых и сверхчистых металлов, свойства которых сильно отличаются
от свойств металлов технической чистоты, с которыми преимущественно работают.
Генеральной задачей материаловедения является создание материалов с заранее
расчитаными свойствами применительно к заданным параметрам и условиям работы.
Большое внимание уделяется изучению металлов в экстремальных условиях (низкие и
высокие температуры и давление).
До
настоящего времени основной материальной базой машиностроения служит черная
металлургия, производящая стали и чугуны. Эти материалы имеют много положительных
качеств и в первую очередь обеспечивают высокую конструкционную прочность
деталей машин.
Однако эти классические материалы имеют такие недостатки как
большая плотность, низкая коррозионная стойкость. Потери от коррозии составляют
20% годового производства стали и чугуна. Поэтому, по данным научных
исследований, через 20…40 лет все развитые страны перестроятся на массовое
использование металлических сплавов на базе титана, магния, алюминия.
Эти
легкие и прочные сплавы позволяют в 2-3раза облегчить станки и машины, в 10 раз
уменьшить расходы на ремонт.
По
данным института имени Байкова А.Н. в нашей стране есть все условия чтобы в
течении 10…15 лет машиностроение могло перейти на выпуск алюминиево-титановой
подвижной техники, которая отличается легкостью, коррозионной стойкостью и
большим безремонтным ресурсом.
- Важное
значение имеет устранение отставания нашей страны в области использования новых
материалов взамен традиционных (металлических) – пластмасс, керамики,
материалов порошковой металлургии, особенно композиционных материалов, что
экономит дефицитные металлы, снижает затраты энергии на производство
материалов, уменьшает массу изделий. - Расчетами
установлено, что замена ряда металлических деталей легкового автомобиля на
углепластики из эпоксидной смолы, армированной углеродными волокнами, позволит
уменьшить массу машины на 40%; она станет более прочной; уменьшится расход
топлива, резко возрастет стойкость против коррозии. - Металлы, особенности атомно-кристаллического строения
- В
огромном ряду материалов, с незапамятных времен известных человеку и широко
используемых им в своей жизни и деятельности, металлы всегда занимали особое
место. - Подтверждение
этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на
которые греки делили историю человечества: и в археологических находках
металлических изделий (кованые медные украшения, сельскохозяйственные орудия);
и в повсеместном использовании металлов и сплавов в современной технике. - Причина
этого — в особых свойствах металлов, выгодно отличающих их от других материалов
и делающих во многих случаях незаменимыми. - Металлы – один из
классов конструкционных материалов, характеризующийся определ¨нным набором
свойств: - ·
«металлический блеск» (хорошая отражательная способность); - ·
пластичность; - ·
высокая теплопроводность; - ·
высокая электропроводность.
Данные
свойства обусловлены особенностями строения металлов.
Согласно теории
металлического состояния, металл представляет собой вещество, состоящее из
положительных ядер, вокруг которых по орбиталям вращаются электроны.
На
последнем уровне число электронов невелико и они слабо связаны с ядром. Эти
электроны имеют возможность перемещаться по всему объ¨му металла, т.е.
принадлежать целой совокупности атомов.
Таким
образом, пластичность, теплопроводность и электропроводность обеспечиваются
наличием «электронного газа».
Все
металлы, затвердевающие в нормальных условиях, представляют собой
кристаллические вещества, то есть укладка атомов в них характеризуется
определ¨нным порядком – периодичностью, как по различным направлениям, так и по
различным плоскостям. Этот порядок определяется понятием кристаллическая реш¨тка.
- Другими
словами, кристаллическая решетка это воображаемая пространственная решетка, в
узлах которой располагаются частицы, образующие твердое тело. - Элементарная
ячейка –
элемент объ¨ма из минимального числа атомов, многократным переносом которого в
пространстве можно построить весь кристалл. - Элементарная
ячейка характеризует особенности строения кристалла. Основными параметрами
кристалла являются:
размеры
р¨бер элементарной ячейки. a, b, c – периоды реш¨тки – расстояния между
центрами ближайших атомов. В одном направлении выдерживаются строго
определ¨нными.·
- · углы между
осями (). - координационное
число (К) указывает на число атомов, расположенных на ближайшем одинаковом
расстоянии от любого атома в решетке.· - базис
решетки количество атомов, приходящихся на одну элементарную ячейку решетки.· - плотность
упаковки атомов в кристаллической решетке – объем, занятый атомами, которые
условно рассматриваются как жесткие шары. Ее определяют как отношение объема,
занятого атомами к объему ячейки (для объемно-центрированной кубической решетки
– 0,68, для гранецентрированной кубической решетки – 0,74)·
Рис.1.1. Схема кристаллической решетки
Классификация
возможных видов кристаллических решеток была проведена французским ученым О.
Браве, соответственно они получили название «решетки Браве». Всего для
кристаллических тел существует четырнадцать видов решеток, разбитых на четыре
типа;
- примитивный
– узлы решетки совпадают с вершинами элементарных ячеек;· - · базоцентрированный
– атомы занимают вершины ячеек и два места в противоположных гранях; - объемно-центрированный
– атомы занимают вершины ячеек и ее центр;· - гранецентрированный
– атомы занимают вершины ячейки и центры всех шести граней·
Рис. 1.2. Основные типы кристаллических решеток: а –
объемно-центрированная кубическая; б– гранецентрированная кубическая; в – гексагональная
плотноупакованная
Основными
типами кристаллических реш¨ток являются:
1.
Объемно — центрированная кубическая (ОЦК) (см. рис.1.2а), атомы
располагаются в вершинах куба и в его центре (V, W, Ti, )
2.
Гранецентрированная кубическая (ГЦК) (см. рис. 1.2б), атомы
рассполагаются в вершинах куба и по центру куждой из 6 граней (Ag, Au, )
- 3.
Гексагональная, в основании которой лежит шестиугольник: - o
простая – атомы располагаются в вершинах ячейки и по центру 2
оснований (углерод в виде графита); - o
плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней
плоскости (цинк). - Понятие об изотропии и анизотропии
Свойства
тела зависят от природы атомов, из которых оно состоит, и от силы
взаимодействия между этими атомами. Силы взаимодействия между атомами в
значительной степени определяются расстояниями между ними.
В аморфных телах с
хаотическим располохением атомов в пространстве расстояния между атомами в
различных направлениях равны, следовательно, свойства будут одинаковые, то есть
аморфные тела изотропны
- В
кристаллических телах атомы правильно располагаются в пространстве, причем по
разным направлениям расстояния между атомами неодинаковы, что предопределяет
существенные различия в силах взаимодействия между ними и, в конечном
результате, разные свойства. Зависимость свойств от направления называется анизотропией - Чтобы
понять явление анизотропии необходимо выделить кристаллографические плоскости и
кристаллографические направления в кристалле. - Плоскость,
проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью. - Прямая,
проходящая через узлы кристаллической решетки, называется кристаллографическим направлением.
Для
обозначения кристаллографических плоскостей и направлений пользуются индексами Миллера. Чтобы установить индексы Миллера,
элементарную ячейку вписывают в пространственную систему координат (оси X,Y, Z
– кристаллографические оси). За единицу измерения принимается период решетки.
Рис.1.3. Примеры обозначения кристаллографических плоскостей (а) и
кристаллографических направлений (б)
- Для
определения индексов кристаллографической кристаллографической плоскости
необходимо: - установить
координаты точек пересечения плоскости с осями координат в единицах периода
решетки;· - взять
обратные значения этих величин;· - привести
их к наименьшему целому кратному, каждому из полученных чисел.·
Полученные
значения простых целых чисел, не имеющие общего множителя, являются индексами
Миллера для плоскости, указываются в круглых скобках. Примеры обозначения
кристаллографических плоскостей на рис. 1.3 а.
- Другими
словами, индекс по оси показывает на сколько частей плоскость делит осевую
единицу по данной оси. Плоскости,параллельные оси, имеют по ней индекс 0 (110) - Ориентация
прямой определяется координатами двух точек. Для определения индексов
кристаллографического направления необходимо: - одну
точку направления совместить с началом координат;· - установить
координаты любой другой точки, лежащей на прямой, в единицах периода решетки· - привести
отношение этих координат к отношению трех наименьших целыж чисел.· - Индексы
кристаллографических направлений указываются в квадратных скобкаж [111] - В
кубической решетке индексы направления, перпендикулярного плоскости (hkl) имеют
теже индексы [hkl]. - Аллотропия или полиморфные превращения.
- Способность
некоторых металлов существовать в различных кристаллических формах в зависимости
от внешних условий (давление, температура) называется аллотропией или полиморфизмом. - Каждый
вид решетки представляет собой аллотропическое
видоизменение или модификацию. - Примером
аллотропического видоизменения в зависимости от температуры является железо
(Fe). - Fe: – ОЦК — ;
- – ГЦК — ;
- – ОЦК — ; (высокотемпературное )
Превращение
одной модификации в другую протекает при постоянной температуре и
сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами
греческого алфавита в виде индекса у основного обозначения металла.
- Примером
аллотропического видоизменения, обусловленного изменением давления, является
углерод: при низких давлениях образуется графит, а при высоких – алмаз. - Используя
явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи
термической обработки. - Магнитные превращения
Некоторые
металлы намагничиваются под действием магнитного поля. После удаления
магнитного поля они обладают остаточным магнетизмом. Это явление впервые
обнаружено на железе и получило название ферромагнетизма. К ферромагнетикам
относятся железо, кобальт, никель и некоторые другие металлы.
При
нагреве ферромагнитные свойства металла уменьшаются постепенно: вначале слабо,
затем резко, и при определ¨нной температуре (точка Кюри) исчезают (точка Кюри
для железа – ).
Выше этой температуры металлы
становятся парамагнетиками.
Магнитные превращения не связаны с изменением
кристаллической решетки или микроструктуры, они обусловлены изменениями в
характере межэлектронного взаимодействия.
Атомно-кристаллическое строение металлов
⇐ ПредыдущаяСтр 2 из 5Следующая ⇒
| Доверь свою работу кандидату наук! |
Под атомно-кристаллическим строением понимают взаимное расположение атомов (ионов), существующее в реальном кристалле.
В твердом состоянии металл – это структура, состоящая из положительных ионов, омываемых коллективизированными электронами или, как говорят, электронным «газом». Между ионами и коллективизированными электронами проводимости возникают электростатические силы притяжения. Такая связь называется металлической.
Силы связи в металлах определяются силами отталкивания и силами притяжения между ионами и электронами.
Ионы располагаются на таком расстоянии друг от друга, при котором энергия взаимодействия минимальна.
Сближение атомов (ионов), равно как и их удаление на расстояние, отличное от этого оптимального расстояния, осуществимо лишь при совершении определенной работы против сил отталкивания и притяжения.
| Рис. 5. Схема кристал- лической решетки |
Этот наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме, получил название элементарной кристаллической ячейки.
Большинство металлов образует одну из следующих высоко симметричных решеток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную плотноупакованную (рис. 6).
| Рис. 6. Кристаллические решетки металлов: а – объемно центрированная кубическая (ОЦК); б – гранецентрированная кубическая (ГЦК); в – гексагональная плотноупакованная (ГПУ) |
Как видно из рисунка, в кубической объемно центрированной решетке (ОЦК) атомы расположены в вершинах куба и один атом в центре объема куба. Кубическую объемно центрированную решетку имеют металлы: Pb, Na, Li, Tib, Zrb, Та, W, V, Fea, Cr, Nb, Ba и др.
В кубической гранецентрированной решетке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решетку такого типа имеют металлы: Саa, Се, Sra, Tn, Pb, Ni, Ag, Au, Pd, Pt, Rh, Jr, Feg, Сu, Соa и др.
В гексагональной (ГПУ) решетке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома – в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, Tia, Cd, Re, Os, Ru, Zn, Cob. Be, Cab и др.
Расстояние a, b, с между центрами ближайших атомов в элементарной ячейке называются периодами решетки. Период решетки выражается в нанометрах (1 нм = 10-9 м). Периоды решетки для большинства металлов находятся в пределах 0,1 – 0,7 нм.
Половину наименьшего расстояния между атомами в их кристаллической решетке называют атомным радиусом.
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решетки свойства (химические, физические, механические) каждого монокристалла зависят от направления вырезки образца по отношению к направлениям в решетке. Подобная неодинаковость свойств монокристалла в разных кристаллографических направлениях называется анизотропией.
Кристалл – тело анизотропное в отличие от аморфных тел (стекло, пластмассы и др.), свойства которых не зависят от направления.
Технические металлы являются поликристаллами, т. е. состоят из большого числа анизотропных кристаллитов. В большинстве случаев кристаллиты статистически неупорядоченно ориентированы по отношению друг к другу; поэтому во всех направлениях свойства более или менее одинаковы, т. е. поликристаллическое тело является псевдоизотропным.
Такая мнимая изотропность металла не будет наблюдаться, если кристаллиты имеют одинаковую преимущественную ориентацию в каких-то направлениях.
Эта ориентированность, или текстура, создается в известной степени, но не полностью (например, в результате значительной холодной деформации); в этом случае поликристаллический металл приобретает анизотропию свойств.
При переходе металла из жидкого состояния в твёрдое образуется кристаллическая решётка и формируются кристаллы. Такой процесс называется кристаллизацией.
Все самопроизвольно протекающие превращения, а следовательно, кристаллизация и плавление обусловлены тем, что новое состояние в новых условиях является энергетически более выгодным системе, обладает меньшим запасом энергии.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с меньшей энергией Гиббса (свободной энергией) G, т. е. когда энергия Гиббса кристалла меньше, чем энергия Гиббса жидкой фазы. Если превращение происходит с небольшим изменением объёма, то
- G = U – TS,
- где U – полная внутренняя энергия фаз,
- Т – абсолютная температура, S – энтропия.
- Следовательно, процесс кристаллизации может протекать только при переохлаждении металла ниже равновесной температуры Тп. Разность между температурами Тп и Тк, при которых может протекать процесс кристаллизации, носит название степени переохлаждения:
- DТ = Тп – Тк .
Термические кривые, характеризующие процесс кристаллизации чистых металлов при охлаждении с разной скоростью v, показаны на рис. 9.
При очень медленном охлаждении степень переохлаждения невелика и процесс кристаллизации протекает при температуре, близкой к равновесной Тп (рис. 9, кривая v1).
На термической кривой при температуре кристаллизации отмечается горизонтальная площадка (остановка в падении температуры), образование которой объясняется выделением скрытой теплоты кристаллизации, несмотря на отвод теплоты при охлаждении.
| Рис. 9. Кривые охлаждения металла при кристаллизации: v1 |
Атомно-кристаллическое строение металлов и сплавов
Атомно-кристаллическое строение имеют наиболее распространенные конструкционные материалы — металлы и сплавы на их основе. Кроме того, такое строение присуще некоторым неметаллическим веществам с ковалентным или ионным типом связи.
Атомно-кристаллическое строение характеризуется правильным, закономерным расположением атомов в пространстве.
Атомы (или положительно заряженные ионы металлов), правильно расположенные в одной плоскости и соединенные воображаемыми линиями (они символизируют силы связи), образуют кристаллографическую плоскость. В ее узлах располагаются атомы, а воображаемые линии символизируют силы связи (рис. 1.3).
Многократное повторение кристаллографических плоскостей в пространстве позволяет получить пространственную кристаллографическую решетку (рис. 1.4). Эта решетка сложна в изображении, поэтому представление об атомном строении кристаллов дается в виде элементарных кристаллических ячеек.
Под элементарной кристаллической ячейкой понимают минимальный объем, дающий представление об атомной структуре металла в целом, а его повторение в пространстве образует кристаллографическую решетку.
Кристаллические ячейки характеризуются следующими основными параметрами: периодом решетки, координационным число, атомным радиусом, базисом (атомной плотностью).
Периодом решетки называется расстояние между центрами двух соседних частиц (атомов, ионов) в элементарной ячейке решетки. Периоды решетки измеряют в ангстремах (А) или нанометрах (1 А = 10“8 см; 1 НМ = 10~9 м).
Рис. 1.3. Кристаллографическая плоскость (схема)
Под атомным радиусом понимают половину межатомного расстояния между центрами ближайших атомов в кристаллической решетке.
Базисом решетки называется количество атомов, приходящихся на одну элементарную ячейку решетки.
Простейшим типом кристаллического строения является кубическая решетка, в которой атомы расположены в углах куба (рис. 1.5). На ее примере покажем основные параметры решетки:
• период решетки а;
Рис. 1.4. Пространственная кристаллографическая решетка (схема)
• базис решетки равен 1 (1/8-8 = 1 — каждый из атомов, расположенных в углах куба, принадлежит восьми элементарным ячейкам, т. е. на одну ячейку приходится 1/8 атома).
В простой кубической решетке атомы уложены (упакованы) недостаточно плотно. Стремление атомов занять места, наиболее близкие друг к другу, приводит к образованию новых типов решеток.
Для большинства металлов характерны следующие типы кристаллических решеток: кубическая обьемно-центрированная (ОЦК, рис. 1.6, а); кубическая гранецентрированная (ГЦК, рис. 1.6, б); гексагональная плотноупакованная решетка (ГПУ, рис. 1.6, в).
Рис. 1.5. Элементарная кристаллическая ячейка(простая кубическая)
В решетке ОЦК атомы расположены в углах куба и его центре. Период решетки равен а, базис решетки равен 2 (1/8*8 +1=2; 8 — число атомов, расположенных в углах куба, 1 — атом в центре куба, принадлежащий только одной ячейке). Данный тип решетки имеют металлы К, Na, Li, Та, W, Мо, a-Fe, Cr, Nb и др.
В решетке ГЦК атомы расположены в углах куба и центрах его граней, эта решетка характеризуется периодом а, базисом, равным 4 (1/8*8 + 1/2*6 = 4; восемь атомов в углах куба и шесть атомов в центрах граней, каждый из которых принадлежит двум элементарным ячейкам). Кубическую гранецентрированную решетку имеют следующие металлы: Са, РЬ, Ni, Ag, Au, Pt, y-Fe и др.
В решетке ГПУ атомы расположены в вершинах и в центрах шестигранных оснований призмы, три атома находятся в средней плоскости призмы (см. рис. 1.6, в). Периоды решетки равны а и с, причем с/а 1 (например, с/а = 1,633 для Ru, Cd и с/а > 1,633 для Mg, Zn), базис решетки равен 6.
Рис. 1.6. Типы кристаллических решеток металлов:
а — кубическая объемно-центрированная (ОЦК); б — кубическая гранецентрированная (ГЦК); в — гексагональная плотноупакованная (ГПУ)
В кристаллических решетках атомная плотность по различным плоскостям неодинакова — на единицу площади разных атомных плоскостей приходится неодинаковое количество атомов (сравним, например, для решетки ОЦК количество атомов в плоскости, совпадающей с гранью, и диагональной). Поэтому свойства в различных плоскостях и направлениях кристаллической решетки будут разными. Неодинаковость свойств по разным кристаллографическим направлениям называется анизотропией кристалла.
Технические металлы являются по- ликристаллическими веществами. Они состоят из большого количества мелких кристаллов, различно ориентированных по отношению друг к другу. Эти кристаллы вследствие условий кристаллизации имеют неправильную форму и называются зернами или кристаллитами.
Произвольность ориентации каждого зерна приводит к тому, что в разных направлениях свойства усредняются и становятся примерно одинаковыми, т. е. поликристаплическое тело изотропно. Это явление называется квазиизотропией (ложной изотропией). Оно не наблюдается, если в каких-то направлениях кристаллы имеют одинаковую ориентировку (текстуру).
Такая ориентированность создается в результате пластической деформации. В этом случае поликристаллический металл приобретает анизотропию свойств.






