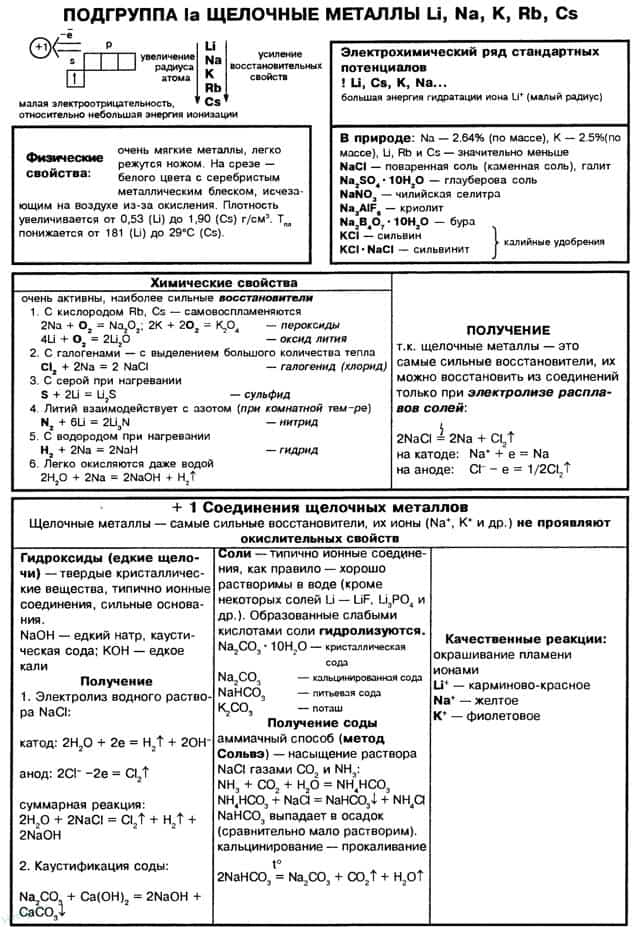
- Общая характеристика
- Природные соединения
- Получение
- Химические свойства
- Оксиды щелочных металлов
- Получение
- Химические свойства
- Гидроксиды щелочных металлов
- Получение
- Химические свойства
- Характерные химические свойства щелочных металлов
- 2. Реакция щелочных металлов с кислородом:
- 3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 4. Реакция щелочных металлов с кислотами
- 5. Взаимодействие щелочных металлов с аммиаком
- 6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
- 7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
- Получение щелочных металлов
- Особенности химических свойств s-элементов I группы и их физиологическое действие
- 2.2.1. Характерные химические свойства щелочных металлов
- Взаимодействие щелочных металлов с неметаллами
- с кислородом
- с галогенами
- с азотом
- с фосфором
- с водородом
- с серой
- с водой
- с галогенпроизводными углеводородов (реакция Вюрца):
- со спиртами и фенолами
- Неорганическая химия
- Соединения щелочных металлов
- I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
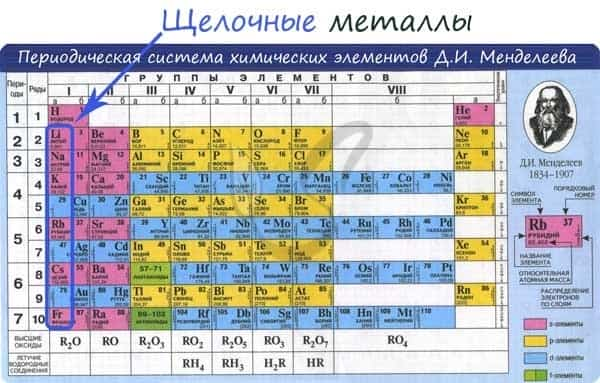
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвин
- NaCl*KCl — сильвинит

Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Li + O2 → Li2O (оксид лития)
- Na + O2 → Na2O2 (пероксид натрия)
- K + O2 → KO2 (супероксид калия)
- Реакции с неметаллами
- Li + H2 → LiH (в гидридах водород -1)
- Na + F2 → NaF (в фторидах фтор -1)
- Na + S → Na2S (в сульфидах сера -2)
- K + N2 → K3N (в нитридах азот -3)
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий — пероксид, калий, рубидий и цезий — супероксиды.
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет». Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный, цезий — синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
- Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
- Li + O2 → Li2O (оксид лития)
- В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
- Na2O2 + Na → Na2O
- KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание — реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание — мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.
Получение
- Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
- KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде — хлор)
- Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
- K + H2O → KOH + H2↑
- Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
- LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке — получается кислая соль)
- 2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке — получается средняя соль)
- KOH + SO2 → KHSO3 (соотношение 1:1 — получается кислая соль)
- 2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 — получается средняя соль)
- NaOH + MgBr2 → NaBr + Mg(OH)2↓
- С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов — смешанных оксидов (при высоких температурах — прокаливании).
- NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
- NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел — смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
- Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
- NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
- NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
- В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
- NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

- NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
- Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам — и азотной, и азотистой.
- LiOH + NO2 → LiNO2 + LiNO3 + H2O
Характерные химические свойства щелочных металлов
- •Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
- •Все соединения щелочных металлов имеют ионный характер.
- •Практически все соли растворимы в воде.
- •Низкие температуры плавления,
- •Малые значения плотностей,
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги.
Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
-

- 2Na + 2H 2 O → 2NaOH + H 2
- 2Li + 2H 2 O → 2LiOH + H 2
2. Реакция щелочных металлов с кислородом:
- 4Li + O 2 → 2Li 2 O (оксид лития)
- 2Na + O 2 → Na 2 O 2 ( пероксид натрия)
- K + O 2 → KO 2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 2Li + Cl 2 → 2LiCl (галогениды)
- 2Na + S → Na 2 S (сульфиды)
- 2Na + H 2 → 2NaH (гидриды)
- 6Li + N 2 → 2Li 3 N (нитриды)
- 2Li + 2C → Li 2 C 2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H 2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH 3 = 2LiNH 2 + H 2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2 ;
2K + 2C 6 H 5 OH = 2C 6 H 5 OK + H 2 ;
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
- Li + – карминово-красный

- Na + – желтый
- K + , Rb + и Cs + – фиолетовый
Получение щелочных металлов
- Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl 2 В небольших масштабах используется также вакуум-термическое получение натрия и калия:
- 2NaCl+CaC 2 =2Na+CaCl 2 +2C; 4KCl+4CaO+Si=4K+2CaCl 2 +Ca 2 SiO 4 .
- Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).
-
Особенности химических свойств s-элементов I группы и их физиологическое действие
Электронная конфигурация атома лития 1s 2 2s 1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li + со стабильной конфигурацией инертного газа (гелия).
Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл.
От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li + сильно сольватирован; его окружают несколько десятков молекул воды.
Литий по величине энергии сольватации — присоединения молекул растворителя, стоит ближе к протону, чем к катионам щелочных металлов.
Малый размер иона Li + , высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е — , занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s 2 2s 2 2p 6 3s 1 . Единственная степень окисления натрия +1.
Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na + значительно больше, чем Li + , и сольватация его не так велика.
Однако в растворе в свободном виде он не существует.
Физиологическое значение ионов К + и Na + связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами.
Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К + , вследствие чего внутриклеточная концентрация К + значительно выше, чем ионов Na + . В то же время в плазме крови концентрация Na + превышает содержание в ней калия. С этим обстоятельством связывают возникновение мембранного потенциала клеток.
Ионы К + и Na + ‑ одни из основных компонентов жидкой фазы организма. Их соотношение с ионами Са 2+ строго определенно, а его нарушение приводит к патологии. Введение ионов Na+ в организм не оказывает заметного вредного влияния.
Повышение же содержания ионов К + вредно, но в обычных условиях рост его концентрации никогда не достигает опасных величин. Влияние ионов Rb + , Cs + , Li + еще недостаточно изучено.
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв.
Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте.
При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов.
В соединениях калия связь более ионная, а в виде иона К + он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39 К, 40 К, 41 К. Один из них 40 К ‑ радиоактивен и определенная доля радиоактивности минералов и почвы связана с присутствием этого изотопа.
Его период полураспада велик ‑ 1,32 млрд. лет. Определить присутствие калия в образце довольно легко: пары металла и его соединения окрашивают пламя в фиолетово-красный цвет. Спектр элемента довольно прост и доказывает наличие 1е — на 4s-орбитали.
Изучение его послужило одним из оснований для нахождения общих закономерностей в строении спектров.
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р.
Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей.
Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации.
Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (39 0 C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах.
Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно.
Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах.
В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li 3 N (до 75%) и Li 2 O. Остальные щелочные металлы образуют пероксиды (Na 2 O 2 ) и надпероксиды (K 2 O 4 или KO 2 ).
- Перечисленные вещества реагируют с водой:
- Li 3 N + 3 H 2 O = 3 LiOH + NH 3 ;
- Na 2 O 2 + 2 H 2 O = 2 NaOH + H 2 O 2 ;
- K 2 O 4 + 2 H 2 O = 2 KOH + H 2 O 2 + O 2 .
- Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
- Na 2 O 2 +CO 2 =Na 2 CO 3 +0,5O 2 ;
- K 2 O 4 + CO 2 = K 2 CO 3 + 1,5 O 2 .
- В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных. Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
- 2Li+H 2 =2LiH.
- Гидрид лития используется как сильный восстановитель.
- Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
- SiO 2 +2NaOH=Na 2 SiO 3 +H 2 O.
- Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 1300 0 С). Некоторые соединения натрия называют содами :
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na 2 CO 3 ; б) кристаллическая сода – кристаллогидрат карбоната натрия Na 2 CO 3 . 10H 2 O; в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO 3 ; г) гидроксид натрия NaOH называют каустической содой или каустиком.
2.2.1. Характерные химические свойства щелочных металлов
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
- Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
- Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
- 4Li + O2 = 2Li2O
- Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
- 2Na + O2 = Na2O2,
- а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
- K + O2 = KO2
- Rb + O2 = RbO2
с галогенами
- Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
- 2Li + Br2 = 2LiBr бромид лития
- 2Na + I2 = 2NaI иодид натрия
- 2K + Cl2 = 2KCl хлорид калия
с азотом
- Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
- 6Li + N2 = 2Li3N нитрид лития
- 6K + N2 = 2K3N нитрид калия
с фосфором
- Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
- 3Na + P = Na3Р фосфид натрия
- 3K + P = K3Р фосфид калия
с водородом
- Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
- Н2 + 2K = 2KН-1 гидрид калия
- Н2 + 2Rb = 2RbН гидрид рубидия
с серой
- Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
- S + 2K = K2S сульфид калия
- S + 2Na = Na2S сульфид натрия
- Взаимодействие щелочных металлов со сложными веществами
с водой
- Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
- 2HOH + 2Na = 2NaOH + H2↑
- 2K + 2HOH = 2KOH + H2↑
- Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
- ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
- 2CH3OH + 2К = 2CH3OК + H2↑
- метилат калия
- 2C6H5OH + 2Na = 2C6H5ONa + H2
- фенолят натрия
Неорганическая химия
Общая характеристика
К щелочным металлам относятся s-элементы I-ой группы Периодической системы — литий, натрий, калий, рубидий,цезий и франций. .
Литий имеет два стабильных изотопа -6Li (мольная доля в естественном элементе 0,073) и 7Li (0,927), натрий — один изотоп 23Na, калий — 39К (0,931) и 41К (0,069).
Изотоп калия с массовым числом 40 (40К, мольная доля 0,0002) — радиоактивный, -распад. У рубидия два стабильных изотопа — 85Rb (0,7215) и 87Rb (0,2785), у цезия — один 133Cs.
Франций стабильных изотопов не имеет, массовое число наиболее долгоживущего — 223.
Все щелочные металлы — электронные аналоги, внешний уровень имеет строение ns1. По сравнению с элементами других подгрупп соответствующего периода щелочные металлы имеют наиболее низкие энергии ионизации и наибольшие радиусы атомов и ионов.
В группе энергия ионизации уменьшается от лития к цезию, а радиус атома наоборот, возрастает. В соединениях проявляют степень окисления +1 и в свободном виде на Земле не встречаются.
Мольная доля лития в земной коре 0,0002, натрия — 0,024 (один из наиболее распространенных элементов), калия 0,014, рубидия — 0,00007. Содержание цезия около 10-10, франций получен только искусственно.
Важнейшие минералы щелочных металлов — NaCl -каменная соль, или галит, Na2SO4*10H2O — глауберова соль или мирабилит, Na2B2O7*10H2O — бура, Na3AlF6 -криолит, KCl — сильвин, NaCl*KCl — сильвинит, KCl*MgCl2*6H2O — карналлит, KCl*MgSO4*3H20 — каинит.
Простые вещества.
Все щелочные металлы не имеют аллотропных и полиморфных модификаций и образуют по одному простому веществу.
Физические свойства.
В виде простых веществ — мягкие, серебристо белые металлы, цезий имеет золотисто-желтый цвет. Плотности лития, натрия и калия меньше плотности воды ( 1 г/см3), температура плавления плавно уменьшается от лития (180оС) к цезию (28оС). Так же изменятся и температура кипения — от 1337оС у лития до 668оС у цезия. Твердость щелочных металлов мала — они легко режутся ножом.
В видимой области спектра в парах щелочные металлы имеют интенсивные линии излучения: натрий — желтую, литий — карминово-красную, калий — фиолетовую, рубидий — красную, цезий — голубую. Это позволяет распозновать эти металлы с помощью пламенной фотометрии.
Щелочные металлы исключительно реакционноспособны и проявляют сильные восстановительные свойства. Уже при комнатной температуре они реагируют со многими неметаллами. С кислородом литий образует оксид:
4Li + O2 = 2Li2O
Остальные щелочные металлы образуют пероксиды и надпероксиды (супероксиды), например:
2Na + O2 = Na2O2 2K + 2O2 = K2O4
В атмосфере фтора и хлора щелочные металлы самовоспламеняются, образуя галогениды:
Na + Cl2 = 2NaCl
С жидким бромом литий и натрий реагируют замедленно, остальные — о взрывом. С иодом взаимодействие протекает спокойно.
С водородом щелочные металлы реагируют при нагревании (200-400oC), при этом образуютсяионные гидриды:
2Na + Н2 = 2NaН
разлагающиеся водой с выделением водорода:
2NaН + 2Н2О = 2NaОН + Н2
С азотом щелочные металлы реагируют при нагревании, образуя нитриды состава Ме3N. Литий реагирует с азотом воздуха уже при комнатной температуре, покрываясь слоем красноватого нитрида:
6Li + N2 = 2Li3N
Щелочные металлы реагируют с водой:
2Ме + 2Н2О = 2МеОН + Н2
литий — спокойно, натрий — энергично, калий и остальные — со взрывом — воспламеняется выделяющийся водород. Рубидий и цезий реагируют не только с жидкой водой, но и со льдом.
С кислотами щелочные металлы образуют соли, часто эти реакции сопровождаются взрывами.
Со спиртами щелочные металлы реагируют спокойно, часто для завершения реакции необходимо нагревание:
2Ме + С2Н5ОН = 2С2Н5ОМе + Н2
При взаимодействии лития и натрия с алюминие, оловом, ртутью образуются интерметаллические соединения. Широко распространена амальгама натрия NanHgm. Между собой щелочные металлы образуют сплавы, широкое применение имеет сплав натрия и калия, обладающий высокой теплоемкостью.
Получение щелочных металлов
Основным способом получения щелочных металлов является электролиз расплавов их соединений. Для получения лития электролизу подвергают расплав эвтектическуй смеси хлоридов лития и калия.
Натрий получают электролизом расплава хлорида или гидроксида, калий — электролизом расплава смеси хлоридов натрия и калия. Смеси солей используют для понижения температуры электролиза.
Реакции электролиза хлоридов и гидроксидов в общем виде выглядят так:
2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О + О2
Кромe электролиза щелочные металлы можно получить и восстановлением оксидов и гидроксидов, например оксид лития восстанавливают кремнием при нагревании:
2Li2O + Si = Li + SiO2
Расплавленный гидроксид калия восстанавливают жидким натрием:
KOH + Na = NаOH + K
Гидроксиды рубидия и цезия восстанавливают металлическим кальцием в вакууме при нагревании:
RbOH + Ca = Rb + CaO CsOH + Ca = Cs + CaO
Хранят щелочные металлы в атмосфере инертного газа, под слоем сухого керосина или обезвоженного масла. Большие количества щелочных металлов хранят в герметичной железной таре (бочке).
Применение
Щелочные металлы используют в качестве восстановителей, в качестве жидких теплоносителей, например, в ядерных реакторах, в органическом синтезе. Литий применяется производстве сплавов в качестве легирующей добавки. Пары натрия используют для наполнения газоразрядных ламп уличного освещения, которые дают свет с оранжевым оттенком.
Соединения щелочных металлов
Гидриды
Гидриды щелочных металлов — соединения с ионным типом связи, сильные восстановители. Водой разлагаются с выделением водорода
2МеН + 2Н2О = 2МеОН + Н2
При нагревании в вакууме разлагаются:
2МеН = 2Ме + Н2
пр этом устойчивость гидридов уменьшается от лития к цезию. Рaсплавы гидридов проводят электрический ток.
Гидриды лития и натрия испльзуют для получения алюмогидридов, гидрид алюминия вводится в реакцию в виде эфирного раствора:
NaН + AlН3 = Na[AlH4]
Алюмогидриды лития и натрия используются в качестве восстановителей, напримеp, в органическом синтезе.
Карбиды
Карбиды щелочных металлов имеют состав Ме2С2 . Бесцветные кристаллические вещества. Обладают высокой химической активностью. При непосредственном взаимодействии простых веществ образуется толькр карбид лития, остальные — при взаимодействии металла и ацетилена.Водой разлагаются с выделением ацетилена:
Ме2С2 + 2Н2О = 2МеОН + С2Н2 Нитриды
Из нитридов щелочных металлов наиболее устойчив гидрид лития, который медленно образуется при взаимодействии с азотом уже при комнтной температуре и быстро — при 250oC. Водой нитрид лития разлагается с выделением аммиака:
Li3N + 3Н2О = 3LiОН + NН3
Нитриды остальных щелочных металлов получают при взаимодействии паров металла с азотом в тлеющем электрическом разряде.
При взаимодействии расплавленных щелочных металлов с аммиаком образуются амиды, например:
2Na + 2NН3 = 2NaNН2 + Н2
В жидком аммиаке щелочные металлы растворяются, образуя темно-синие, хорошо проводящие электрический ток растворы.
Оксиды, пероксиды, озониды
При сгорании при атмосферном давлении литий дает только оксид Li2O , натрий — пероксид Na2O2 , остальные — надпероксиды Ме2O4 или МеO2 . Оксид натрия можно получить только косвенным путем, например:
Na2O2 + 2Na = 2Na2O 2NaОН(твердый) + 2Na = 2Na2O + Н2 5NaN3 + 2NaNО3 = 3Na2O + 8N2
Оксиды щелочных металлов обладают высокой реакионной способностью, проявляют сильно выраженные основные свойства, энергично взаимодействуют с водой, образуя гидроксиды.
Пероксиды и надпероксиды — твердые вещеста, сильные окислители. При контакте с водой разлагаются:
Na2O2 + 2Н2О = 2NaOН + Н2O2 2NaO2 + 2Н2О = 2NaOН + Н2O2 + O2
Озониды натрия, калия, рубидия и цезия получают действием озона на твердые гидроксиды:
4МеOН + 4О3 = 4МеО3 + 2Н2О + O2
Озониды еще более сильные окислители, чем пероксиды и надпероксиды. Бурно реагируют с водой и разбавленной серной кислотой:
4МеO3 + 2Н2О = 4МеOН + 5O2 4КO3 + 2Н2SО4 = 2R2SО4 + 2Н2О + 5O2 Гидроксиды
Твердые, бесцветные, гигроскопические, хорошо растворимые в воде вещества. Растворение в воде сопровождаетсявыделением большого количества теплоты. В водном растворе почти полностью диссоциированы, сильные основания. Часто гидроксиды щелочных металлов называют едкими щелочами. Термически устойчивы до температур более 1000oC
Едкие щелочи жадно поглощают из воздуха водяные пары и углекислый газ, превращаясь в сиропообразную массу.Расплавы едких щелочей разрушают стекло и платину, поэтому щелочи плавят в железных тиглях.
Получают щелочи электролизом водных растворов хлоридов:
2NaСl + 2Н2О = 2NaOН + Н2 + Cl2
или обменными реациями карбоната металла и гидроксида кальция:
Rb2CO3 + Ca(OН)2 = 2RbOН + CaCO3
Наиболее широкое применение находит гидроксид натрия — для осушения газов, в органическом синтезе, в производстве искусственного волокна.
I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
- Литий Li,
- Натрий Na,
- Калий K,
- Цезий Cs,
- Рубидий Rb
- Франций Fr
- Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
- Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Литий
- Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
- Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Na2CO3 + 2C = 2Na + 3CO
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.:
- KCl + Na = K + NaCl
- KOH + Na = K + NaOH
- В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
- Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Качественные реакции — окрашивание пламени солями щелочных металлов
Цвет пламени:
Li — карминно-красныйNa — желтыйK — фиолетовыйRb — буро-красныйCs — фиолетово-красный
С кислородом
4Li + O2 = 2Li2O
- Натрий образует пероксид:
2Na + O2 = Na2O2
- Калий образует надпероксид:
- K + O2 = KO2
- С галогенами (F, Cl, Br, I)
- Щелочные металлы образуют галогениды:
- 2Li + F2 = 2LiF
- 2Na + Cl2 = 2NaCl
- 2K + I2 = 2KI
- С водородом
- Щелочные металлы образуют гидриды:
- 2Na + H2 = 2NaH
- С серой
- Щелочные металлы образуют сульфиды:
- 2Na + S = Na2S
- С азотом
- При комнатной температуре взаимодействует только литий:
- 6Li + N2 = 2Li3N
- Остальные щелочные металлы
реагируют с азотом при
нагревании: - 6Na + N2 = 2Na3N
- С углеродом
- Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
- 2Na + 2C → Na2C2 (t = 150-200 °C)
- С фосфором
- Щелочные металлы активно
реагируют с фосфором образуя фосфиды: - 3Na + P → Na3P
- С водой
- Щелочные металлы реагируют с водой при обычных
условиях: - 2Na + 2H2O = 2NaOH + H2
- Видео Взаимодействие щелочных металлов с водой
- С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
2K + H2SO4(разб) = K2SO4 +
H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 8Na + 5H2SO4(конц) = 4Na2SO4 +
H2S + 4H2O; - с разбавленной азотной
- 8Na + 10HNO3(разб) = 8NaNO3 + NH4NO3 + 3H2O;
- с концентрированной азотной
- 8Na + 10HNO3(конц) =
8NaNO3 + N2O + 5H2O. - 2СH3COOH + 2Li → 2CH3COOOLi + H2↑
- С солями
- В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
- 3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.






