- Классификация кислот
- Сила кислот убывает в ряду:
- Кислородосодержащие кислоты и соответствующие кислотные оксиды
- Физические свойства кислот
- Получение кислот
- Химические свойства кислот
- Кислоты — классификация, свойства, получение и применение
- Таблица названий некоторых кислот и их солей
- Классификация кислот
- Свойства кислот
- Изменение цвета индикаторов в кислой среде
- Химические свойства кислот
- Получение кислот
- Применение кислот
- ЕГЭ. Химические свойства кислот
- 2. Летучесть кислот
- 3. Сила кислот (способность к диссоциации)
- 4. Растворимость кислот в воде
- 5. Термическое разложение кислот
- 6. Взаимодействие с основаниями (реакция нейтрализации)
- 7. Взаимодействие с солями
- 8. Взаимодействие кислот-неокислителей с металлами
- 9. Взаимодействие кислот-окислителей (H2SO4(к), HNO3(к) и HNO3(р)) с простыми и сложными веществами
- 2.6 Характерные химические свойства кислот
- Основные классы неорганических соединений
- Page 2
Кислоты — электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка
Общая формула кислот H n Ac, где n – число атомов водорода, равное заряду иона кислотного остатка, Ac — кислотный остаток.
Классификация кислот
Сила кислот убывает в ряду:
HI > HClO 4 > HBr > HCl > H 2 SO 4 > HNO 3 > H 2 SO 3 > H 3 PO 4 > HF > HNO 2 >H 2 CO 3 > H 2 S > H 2 SiO 3
Кислородосодержащие кислоты и соответствующие кислотные оксиды
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO 3 , борная H 3 BO 3 . Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H 2 SiO 3 .
Получение кислот
- 1) Взаимодействие простых веществ (получают бескислородные кислоты)
- H 2 + Cl 2 = 2HCl,
- H 2 + S = H 2 S.
- 2) Взаимодействие кислотных оксидов с водой (получают кислородсодержащие кислоты) SO 3 + H 2 O = H 2 SO 4 ,
- 3) Взаимодействие солей с растворами сильных кислот (получают слабые кислоты)
- Na 2 SiO 3 + 2HCl = H 2 SiO 3 + 2NaCl,
- SiO 3 2- + 2H + = H 2 SiO 3 .
- 4) Электролиз водных растворов солей
- 2CuSO 4 + 2H 2 O = 2Cu + O 2 + 2H 2 SO 4 .
Химические свойства кислот
- 1) Растворы кислот кислые на вкус, изменяют окраску индикаторов : лакмуса в красный цвет, метилового оранжевого – в розовый, цвет фенолфталеина не изменяется.
- В водном растворе растворимые кислоты диссоциируют, образуя ион водорода, и кислотный остаток:
- HCl = H + + Cl — .
- Многоосновные кислоты диссоциируют ступенчато:
- H 2 SO 4 = H + + HSO 4 — ,
- HSO 4 — = H + + SO 4 2- .
- Суммарное уравнение:
- H 2 SO 4 = 2H + + SO 4 2-
- 2) Взаимодействие с металлами
- Ca + 2HCl = CaCl 2 + H 2
- Водород из кислот-неокислителей могут вытеснять только металлы, стоящие в электрохимическом ряду напряжений металлов до водорода.
Кислоты-окислители — азотная и серная конц., реагируют с металлами по-другому, потому что в качестве окислителя выступает элемент кислотного остатка, а не водород!
- Cu + 4HNO 3 = Cu(NO 3 ) 2 + 2NO 2 ↑+2H 2 O
- Cu +2H 2 SO 4 конц = CuSO 4 +SO 2 ↑ + 2H 2 O
- 3) Взаимодействие с основными оксидами
- CaO + 2HCl = CaCl 2 + H 2 O
- (если образуется растворимая соль)
- 4) Взаимодействие с основаниями (реакция нейтрализации)
- H 2 SO 4 + 2KOH = K 2 SO 4 + 2H 2 O,
- 2H + + 2OH — = 2H 2 O
- 2HCl + Cu(OH) 2 = CuCl 2 + 2H 2 O,
- Cu(OH) 2 + 2H + = Cu 2+ + 2H 2 O.
- Многоосновные кислоты образуют кислые и средние соли:
- H 2 SO 4 + NaOH = NaHSO 4 + H 2 O,
- H 2 SO 4 + 2NaOH = Na 2 SO 4 + 2H 2 O.
- 5) Взаимодействие с солями
- Реакции с солями происходят только в том случае, если в результате химического превращения образуется малодиссоциирующее вещество, выделяется газ или выпадает осадок.
- Na 2 CO 3 + 2HCl = 2NaCl + CO 2 ↑ + H 2 O,
- CO 3 2- + 2H + = CO 2 + H 2 O.
- В этом случае выделяется углекислый газ и образуется малодиссоциирующее вещество – вода.
- Na 2 SiO 3 + H 2 SO 4 = H 2 SiO 3 ↓ + Na 2 SO 4 ,
- SiO 3 2- + 2H + = H 2 SiO 3 .
- Реакция происходит, так как образуется осадок.
- 6) Специфические свойства кислот
- Связаны с окислительно-восстановительными реакциями, бескислородные кислоты в растворе могут только окисляться (проявлять восстановительные свойства):
- 2KMn +7 O 4 + 16HCl — = Cl 2 0 + 2KCl + 2Mn +2 Cl 2 + 8H 2 O,
- H 2 S -2 + Br 2 0 = S 0 + 2HBr — .
- Кислородсодержащие кислоты могут окисляться (проявлять восстановительные свойства), только когда центральный атом в них находится в промежуточной степени окисления, как, например, в сернистой кислоте:
- H 2 S +4 O 3 + Cl 2 0 + H 2 O = H 2 S +6 O 4 + 2HCl — .
- Если центральный атом находится в максимальной степени окисления, то кислоты проявляют окислительные свойства, например, взаимодействие с металлами и неметаллами:
- C 0 + 2H 2 S +6 O 4 = C +4 O 2 + 2S +4 O 2 + 2H 2 O,
- 3P 0 + 5HN +5 O 3 + 2H 2 O = 3H 3 P +5 O 4 + 5N +2 O.
Кислоты — классификация, свойства, получение и применение
Кислоты (неорганические, минеральные) — это сложные соединения состоящие из катиона водорода (H+) и аниона кислотного остатка(SO32-, SO42-, NO3— и т.д).
Кислотам дали такое название не просто так. Большинство из них имеют кислый вкус. С некоторыми из них знаком каждый из вас. Это, например, уксусная кислота, которая есть в каждом доме, аскорбиновая кислота (она же витамин C), лимонная кислота и т.д. Но не стоит все кислоты пробовать на вкус. Кислоты являются очень едкими веществами.
Даже всем нам привычная и известная аскорбиновая кислота в большой концентрации будет вредна нашему организму. А от более сильных кислот — серной, соляной и даже уксусной — можно получить очень сильные ожоги, вплоть до летального исхода.
Поэтому при работе с кислотами нужно быть осторожными, а также соблюдать технику безопасности!!!
Таблица названий некоторых кислот и их солей
| Серная | H2SO4 | Сульфат |
| Сернистая | H2SO3 | Сульфит |
| Сероводородная | H2S | Сульфид |
| Соляная (хлористоводородная) | HCl | Хлорид |
| Фтороводородная (плавиковая) | HF | Фторид |
| Бромоводородная | HBr | Бромид |
| Йодоводородная | HI | Йодид |
| Азотная | HNO3 | Нитрат |
| Азотистая | HNO2 | Нитрит |
| Ортофософорная | H3PO4 | Фосфат |
| Угольная | H2CO3 | Карбонат |
| Кремниевая | H2SiO3 | Силикат |
| Уксусная | CH3COOH | Ацетат |
Классификация кислот
| Кислородсодержащие (H2SO4) | Бескислородные (HCl) |
| Одноосновные (HCl) | Двухосновные (H2SO4) | Трёхосновные (H3PO4) |
Понятие «одноосновная кислота» произошло по причине того, что для нейтрализации одной молекулы одноосновной кислоты нам понадобится одна молекула основания. для двухосновной — соответственно две молекулы и т. д.
| Растворимые (HCl) | Нерастворимые (H2SiO3) |
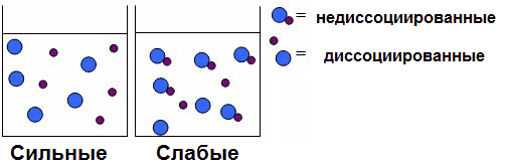
| Сильные (H2SO4) | Слабые (CH3COOH) |
| Летучие (H2S) | Нелетучие (H2SO4) |
| Устойчивые (H2SO4) | Неустойчивые (H2CO3) |
Свойства кислот
Изменение цвета индикаторов в кислой среде
| Метилоранж | оранжевый | красный |
| Лакмус | фиолетовый | красный |
| Фенолфталеин | бесцветный | бесцветный |
| Бромтимоловый синий | зеленый | желтый |
| бромкрезоловый зеленый | синий | желтый |
Химические свойства кислот
- Взаимодействие с металлами (в ряду активности находящихся до водорода), протекает с выделением газообразного водорода и образованием солей:
H2SO4 + 2Na → Na2SO4 + H2↑
Металлы, находящиеся в ряду активности после водорода, не вступают в реакцию с кислотой (кроме концентрированной серной кислоты).
Азотная и концентрированная серная кислоты проявляют свойства окислителей, и продукты реакций будут зависеть от концентрации, температуры и природы восстановителя.
- Взаимодействуют с оксидами основных и амфотерных металлов с образованием солей и воды:
H2SO4 + MgO → MgSO4 + H2O
- С основаниями, с образованием солей и воды (так называемая реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + H2O
- Кислоты могут взаимодействовать с солями, если в результате реакции будет образовываться нерастворимая соль, или выделяться газ:
H2SO4 + K2CO3 → K2SO4 + H2O + CO2↑
- Сильные кислоты могут вытеснять из солей более слабые кислоты:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Получение кислот
- Взаимодействие кислотного оксида с водой:
H2O + SO3 →H2SO4
- Взаимодействие водорода и неметалла:
H2 + Cl2 → 2HCl
- Вытеснение слабой кислоты из солей, более сильной кислотой:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Применение кислот
В настоящее время, минеральные и органические кислоты находят множество сфер применения.
Серная кислота (H2SO4), находит широкое применение в химической технологии, для производства лакокрасочных материалов, производстве минеральных удобрений, в пищевой промышленности (пищевая добавка Е513), в качестве электролита в производстве аккумуляторных батарей.
Раствор двухромовокислого калия в серной кислоте (хромовая смесь) используются в лабораториях для мытья химической посуды. Являясь сильным окислителем, хромка позволяет отмывать посуду от следов загрязнений органическими веществами. Так же, хромовая смесь используется в органическом синтезе.

Борная кислота (H3BO3) используется в медицине как антисептик, в качестве флюса при пайке металлов, как борсодержащее удобрение, в домашнем хозяйстве используется как средство от тараканов.
Широко известны в домашнем использовании при выпечке уксусная и лимонная кислоты. Также в быту их используют для удаления накипи.
Знакомая всем с детства аскорбиновая кислота, более известная в народе как витамин С, применяется при лечении простудных заболеваний.
Азотная кислота (HNO3) находит применение при производстве взрывчатых веществ, при производстве минеральных азотсодержащих удобрений (аммиачная, калиевая селитра), в производстве лекарственных средств (нитроглицерин).
ЕГЭ. Химические свойства кислот
- HI → HClO4 → HBr → HCl → H2SO4 → H2SeO4 → HNO3 → HClO3 → HIO3 →
- H2SO3 → HClO2 → H3PO4 → HF → HNO2 → CH3COOH → H2CO3 → H2S → H2SiO3.
- Некоторые реакции, подтверждающие ряд кислот:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O т.е. H2CO3 слабее, чем HCl
K2CO3 + SO2 → K2SO3 + CO2 т.е. H2CO3 слабее, чем H2SO3
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O т.е. H2CO3 слабее, чем CH3COOH
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3 т.е. H2SiO3 слабее, чем H2CO3
3H2SO4 + 2K3PO4 → 3K2SO4 + 2H3PO4 т.е. H3PO4 слабее, чем H2SO4
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т.е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
- NaCl(тв.) + H2SO4(к) → NHSO4 + HCl
- NaNO3(тв.) + H2SO4(к) → NaHSO4 + HNO3
- Аналогичным образом можно получить и слабую плавиковую кислоту:
- KF(тв.) + H2SO4(к) → KHSO4 + HF
- HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O 2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
2. Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
Сильные: HNO3, H2SO4, HCl, HBr, HI, HClO4, HClO3.
Слабые (все остальные): HF, H2CO3, H2SO3, HNO2, H3PO4, H2S, H2SiO3, все органические кислоты и другие.
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
- При нагревании разлагаются следующие кислоты:
- H2CO3 → CO2 + H2O
- H2SO3 → SO2 + H2O
- 4HNO3 → 4NO2 + O2 + 2H2O
- H2SiO3 → SiO2 + H2O
- Неустойчивыми являются H2CO3 и H2SO3.
6. Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
- H2S + Cr(OH)3 → реакция не идет по той же причине.
- Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
- H2SiO3 + 2NaOH → Na2SiO3 + 2H2O
- H2SiO3 + Cu(OH)2 → реакция не идет
- H2SiO3 + Al(OH)3 → реакция не идет.
7. Взаимодействие с солями
- Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
- CaCO3 + 2HCl → CaCl2 + CO2 + H2O
- AgNO3 + HCl → AgCl + HNO3
- K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
8. Взаимодействие кислот-неокислителей с металлами
- Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
- H2SO4(р) + Zn → ZnSO4 + H2
- 6HCl + 2Fe → 2FeCl3 + 3H2
- Cu + HCl → реакция не идет.
9. Взаимодействие кислот-окислителей (H2SO4(к), HNO3(к) и HNO3(р)) с простыми и сложными веществами
9.1) Серная кислота
9.2) Азотная кислота
2.6 Характерные химические свойства кислот
Видеоурок: Свойства кислот: взаимодействие с индикаторами и металлами
Лекция: Характерные химические свойства кислот
Классификация кислот
Кислоты — это такие химические вещества, при электролитической диссоциации которых образуются один или несколько катионов водорода Н+ и кислотный остаток.
- Кислотный остаток — это анионы, образующиеся при диссоциации кислот.
- Существует несколько классификаций кислот:
- 1. По составу кислотного остатка кислоты делятся на:
- кислородсодержащие и
- бескислородные.
Кислородсодержащие кислоты — это гидроксиды. Они относятся к этой группе, так как содержат в своем составе ОН — группу. К ним относятся кислоты:
- серная — H2SO4;
- сернистая — H2SO3;
- азотная — HNO3;
- фосфорная — H3PO4;
- угольная — H2CO3;
- кремниевая — H2SiO3.
Бескислородные кислоты, как понятно из названия, кислорода в своем составе не имеют. К ним относятся кислоты:
- фтороводородная HF;
- хлороводородная или соляная HCl;
- бромоводородная HBr;
- иодоводородная HI;
- сероводородная H2S.
2. По количеству атомов водорода в составе:
- одноосновные (HNO3,HF и др.),
- двухосновные (H2SO4,H2CO3 и др.),
- трехосновные (H3PO4).
Химические свойства кислот
1. Многие кислоты растворяются в воде, придавая ей кисловатый вкус. Если необходимо узнать присутствие кислоты в растворе применяются индикаторы: лакмус и метиловый оранжевый окрашиваются в красный цвет.
2. Со щелочами взаимодействуют сильные кислоты. Происходит уже известная вам реакция нейтрализации, из — за того, что кислая среда кислоты, а также щелочная среда щелочи в сумме образуют нейтральную среду воды. Сокращенное ионное уравнение реакции нейтрализации имеет общий вид:
Н+ + ОН- → Н2О
3. Взаимодействуют с основными и амфотерными основаниями и оксидами, образуя соли и воду. Данные реакции из-за образования электролита всегда проходят до конца. В них растворяются многие оксиды и нерастворимые основания.
4. Возможно взаимодействие кислот с солями, при условии образования малорастворимых или газообразных веществ.
Обратим особое внимание на взаимодействие кислот с металлами:
1. Соляная и разбавленная серная кислоты взаимодействуют с металлами, стоящими в электрохимическом ряду до водорода, ввиду того, что окислителем здесь является катион водорода Н+:
Mg+ 2HCl → MgCl2 + H2;
Mg + H2SO4(разб.) → MgSO4 + H2.
Соляная и разбавленная серная кислоты окисляют до низших степеней металлы переменной валентности. Например, железо окисляется до степени окисления +2:
Fe + 2HCl → FeCl2 + H2.
2. В концентрированной серной кислоте окислителем служит сульфат. В ней сера имеет степень окисления +6. При взаимодействии с металлами, серная кислота всегда восстанавливается до сероводорода (H2S), серы (S) и оксида серы IV (SO2).
Продукты восстановления представленной кислоты, напрямую зависят от активности реагирующего металла. В процессе взаимодействия концентрированной серной кислоты с активными металлами, будет образовываться соль, вода и сероводород. Малоактивные металлы восстановят серную кислоту до SO2. А металлы средней активность до S.
Металлы переменной валентности, способны окисляться до концентрированной серной кислоты, имеющей высшую степень окисления. Благородные металлы (Au, Pt и некоторые другие) с концентрированной серной кислотой не взаимодействуют.
Некоторые металлы (Al, Fe, Cr, Ni) взаимодействуют с концентрированной серной кислотой только при нагревании, например, свинец, с образованием растворимой кислой соли.
3. В азотной кислоте окислителем служит нитрат-ион, содержащий азот со степенью окисления +5, поэтому водород не выделяется, а выделяются только продукты восстановления азотной кислоты: NH4NO3, N2, N2O, NO, HNO2, NO2. Свободный аммиак так же не выделяется, потому что он реагирует с азотной кислотой, образуя нитрат аммония NH4NO3.
В случае реакции металлов с концентрированной азотной кислотой, продуктом восстановления становится преимущественно NO2, независимо от природы металла. Например, при опускании кусочка меди в концентрированную азотную кислоту, начнет выделяться бурый газ, а на дне появится голубой раствор нитрата меди(II).
Металлы переменной валентности в реакции с концентрированной азотной кислотой окислятся до высшей степени. Металлы, окисляющиеся до степени +4 и выше, будут образовывать кислоты или оксиды. В концентрированной азотной кислоте пассивируются Al, Fe, Cr, Ni, Со и некоторые другие металлы.
После обработки азотной кислотой они перестанут реагировать и с другими кислотами.
4. Чем активнее металл, взаимодействующий с разбавленной азотной кислотой, тем больше восстанавливается азотная кислота. А продуктами восстановления разбавленной азотной кислоты металлами средней активности являются азот или оксид азота(I). Малоактивные металлы восстанавливают из данной кислоты оксид азота(II).
Запомните, чем выше активность металла и ниже концентрация азотной кислоты, тем ниже степень окисления азота в соединении, образовавшимся больше других. Окисление благородных металлов происходит с образованием комплексных кислот.
Некоторые металлы, например, Nb, Ta, W не растворяются даже в таком растворе, но растворяются в смеси азотной и фтороводородной кислот:
- 3Ta + 5HNO3 + 21HF → 3H2TaF7 + 5NO + 10H2O
- W + 2HNO3 + 8HF → H2WF8 + 2NO + 4H2O.
| Предыдущий урок | Следующий урок |
Основные классы неорганических соединений
Пропустить Навигация Пропустить Специальные возможности Пропустить Контакты
Page 2
Пропустить Навигация
- В начало
- Страницы сайта
- Теги
- Календарь
- Новости сайта
-
Курсы
- Региональные ЦОР
- Детский технопарк «Кванториум»
- IT квантум
- VR/AR квантум
- Промробоквантум
- Энерджиквантум
- Наноквантум
- Хайтек
- Математика
- Английский язык
- Шахматы
-
Русский язык
-
Математика
-
Иностранный язык
- Английский язык
- Французский язык
- Немецкий язык
-
Информатика
-
История и обществознание
-
Химия
-
Физика
-
Начальная школа
- Русский язык
- Математика
- Окружающий мир
- Внеклассное чтение
- Иностранный язык
- Информатика
- Умники и умницы
-
География
-
Литература
-
Биология
-
Дополнительное образование
-
Технология
-
Основы безопасности жизнедеятельности
-
СПО
- Детский технопарк «Кванториум»
-
ЦОР ОО
- Волжский район
- МОУ «СОШ № 10
- МОУ «СОШ №11»
- МОУ «Лицей прикладных наук»
- МОУ «СОШ №8»
- МАОУ «Гимназия № 4»
-
Заводской район
- МАОУ «Лицей № 15»
- МОУ «Гимназия №58»
- МОУ «СОШ №23»
- МОУ «СОШ № 5»
- МОУ «Гимназия № 5»
- ГБУ ДО «ДПМ»
- МКУ ДО «ЦВР»
- МУДО «Центр дополнительного образования»
- ГБУ ДО «Региональный центр допризывной подготовки …
-
Кировский район
- МОУ «СОШ №71»
- МОУ «СОШ №73»
- МОУ Гимназия № 31
- МОУ «СОШ № 93»
- МОУ «Прогимназия № 237 «Семицветик»
- МОУ «СОШ № 51»
- ЛМИ
- МОУ «СОШ № 67»
- МОУ «ООШ № 14»
- МАУДО ЦДТ “СОЗВЕЗДИЕ-К”
- ПК «Восход»
- ПК «Дельта»
- КВР «Островок»
- ПК «Ромашка»
- ПК «Ровесник»
- ПК «Дружба»
- ПК «Смена»
- ПК «Факел»
- ПК «Юность»
- Краткосрочные программы
-
МКУ ДО «ЦТДиМ»
-
Лицей «Солярис»
-
ГА ПОУ СО «СТПТиАС»
-
Ленинский район
- МОУ «Гимназия №89»
- МОУ «СОШ №46»
- МОУ «СОШ №55»
- МАОУ «Лицей № 36»
- МОУ «СОШ № 76»
- МОУ «СОШ №63 с УИП»
- МОУ «СОШ №41»
- МОУ «СОШ № 103»
- МОУ «СОШ № 48»
- МОУ «СОШ №57″
- МОУ «СОШ № 49»
- МАОУ «Гимназия №108»
- МОУ «СОШ №52»
- МБЛ
- МУ ДО «Центр детского творчества»
- МОУ «Лицей 56»
- МБЛ
- Олимпиада_Физика
- Олимпиада_Информатика и ИКТ
- Олимпиада_Математика
-
Октябрьский район
- МАОУ «Лицей №62»
- МАОУ «Лицей №3»
- Гимназия № 1
- МОУ «СОШ № 45»
- МАУ ДО «Центр дополнительного образования для детей»
-
Фрунзенский район
- МОУ «СОШ №18»
- МАОУ «Гимназия № 3»
- МОУ СОШ № 1
- ГБУ СОДО «ОЦЭКИТ»
- МАУДО «ДТДиМ»
- МАДОУ «ДС № 236 Лукоморье»
- МУДО «Детско-юношеский центр»
- МУДО «Центр детского творчества»
- МОУ СОШ № 77
-
ОУ городского подчинения и ГБУ
- МАОУ «ЛГН»
- МОУ «Гимназия №2»
- Ассоциация попечителей образования
- МАОУ «Физико-технический лицей № 1»
- ЛИЕН
- МУДО «Центр туризма, краеведения и морской подгото…
- МАУ ДО «Дворец творчества детей и молодежи»
-
Саратовская область
- Александрово — Гайский район
- МБОУ СОШ с. Новоалександровка им. Героя Советско…
- МБОУ СОШ№ 1 с.Александров-Гай Саратовской области
- МБОУ ДО «ЦДТ» с. Александров-Гай Александрово-Гайс…
-
Аткарский район
- МОУ — СОШ №1 г. Аткарска
- МОУ — СОШ №3 г. Аткарска
- МОУ-СОШ села Марфино Аткарского района
- МАУ ДО «Центр детского творчества города Аткарска …
-
Балаковский район
- МАОУ Гимназия № 1
- МАОУ Гимназия №2 г.Балаково
- МАОУ «СОШ №2»
- МАОУ «ООШ № 10» г. Балаково
- МАОУ СОШ №13 г. Балаково
- МАОУ «СОШ №16»
- МОУ «СОШ №19»
- МАОУ СОШ № 26
- СОШ № 28
- МАОУ «ООШ с. Еланка»
- МАУДО ЦДО г. Балаково
- ГАПОУ СО БПТ
-
Балашовский район
- МБУДО Центр «Созвездие» г. Балашов
-
Вольский район
- МОУ «СОШ с. Черкасское»
- МОУ «СОШ с. Терса»
- МОУ «СОШ №11» г. Вольск
- Гимназия № 1
- ГАПОУ СО «Вольский педагогический колледж им. Ф.И….
- МУДО ВМР «ЦДО «Радуга»
-
Воскресенский район
- МОУ «СОШ с. Воскресенское»
- МОУ «СОШ с. Синодское»
-
Дергачевский район
- МОУ СОШ № 1
- МОУ «ООШ с. Верхазовка»
- МОУ «СОШ п. Первомайский»
- МОУ «СОШ с. Демьяс»
- МОУ «СОШ № 2»
- МУДО «Дом детского творчества»
-
Духовницкий район
- МОУ «СОШ им. Г.И. Марчука р.п. Духовницкое»
- МОУ «СОШ имени Н.В. Грибанова с. Брыковка»
-
Екатериновский район
-
Ершовский район
- МОУ «СОШ №3»
- МОУ «СОШ №5»
- МОУ «СОШ № 2»
- СОШ п.Учебный
- МБОУ «Дом детского творчества»
-
Ивантеевский район
- МОУ «СОШ с. Ивантеевка»
- Гимназия
- МУ ДО «Дом детского творчества»
-
Калининский район
- ГАПОУ СО «КТА»
- МБУ ДО «Детско-юношеская спортивная школа г. Калин…
- МБОУ «СОШ с.Симоновка Калининского района Саратовс…
- МБУ ДО «Дом детского творчества г. Калининска Сара…
- МБОУ «СОШ с. Колокольцовка»
- МБОУ «СОШ с. Озерки»
- МБОУ «СОШ с.Симоновка»
-
Красноармейский район
- МБОУ СОШ № 2
- МОУ «СОШ № 3»
- МБОУ «СОШ № 11 с. Золотое»
- МБУДО «ЦТОТД и М г.Красноармейска»
- МОУ «СОШ № 8»
-
Краснокутский район
- МОУ «СОШ №3»
- МОУ «СОШ № 1»
- МОУ «СОШ с.Логиновка»
- МОУ — СОШ с. Лебедевка
- МОУ — СОШ №2
-
Краснопартизанский район
- МУ ДО «Районный Дом детского творчества р.п. Горный «
-
Лысогорский район
- МБОУ «СОШ № 2 р.п. Лысые Горы»
- МОУ «СОШ № 1 р.п. Лысые Горы»
- МБОУ «СОШ с. Широкий Карамыш»
- МБОУ «СОШ с. Большая Рельня»
- МБУ ДО «ЦДОД» р.п. Лысые Горы
- МБОУ «ООШ с. Юнгеровка»
- МБОУ «СОШ с. Двоенки»
- МБОУ «СОШ с. Атаевка»
- МБОУ «СОШ с. Бутырки»
- МБОУ «СОШ п. Яблочный»
- МБОУ «СОШ п. Октябрьский»
- МБОУ «СОШ с. Невежкино»
-
Марксовский район
- МОУ СОШ с. Подлесное
- МОУ «СОШ с. Павловка»
- МОУ «СОШ с. Кировское»
- МБОУ-СОШ №6 г. Маркса
- МОУ — СОШ п. Осиновский
- МОУ «СОШ c. Липовка»
- МОУ — СОШ с. Баскатовка
- МОУ — Лицей г. Маркса
- МОУ «СОШ № 4» г. Маркса
- МОУ СОШ с. Звонаревка
- МОУ-СОШ с Орловское
- МОУ — СОШ №1
- МУ ДО – Центр внешкольной работы
-
Новобурасский район
- МОУ «СОШ п. Динамовский
- МОУ «СОШ с. Гремячка»
- МОУ «СОШ №1»
- с. Тепловка
-
Новоузенский район
- МОУ СОШ № 8
- МУ ДО «ДДТ г. Новоузенска»
- ГАПОУ СО «Новоузенский агротехнологический техникум»
-
Озинский район
- МОУ «СОШ р.п. Озинки»
- Метапредметный курс «Биология + Химия»
-
МОУ «СОШ п. Сланцевый рудник»
-
МОУ «Школа с. Новочерниговка»
-
МБУДО «Дом детского творчества р.п. Озинки»
- МОУ «СОШ р.п. Озинки»
-
Перелюбский район
- СОШ с. Иваниха
- МБОУ «СОШ с. Н. Покровка»
- МБОУ «СОШ с.Натальин Яр»
- МБОУ «СОШ с.Грачев Куст»
- МБОУ «СОШ имени М.М. Рудченко»
-
Петровский район
- МОУ СОШ № 8
- МБОУ СОШ № 3
- МБУ ДО «Детско-юношеский центр» г. Петровск
- МБУДО «Детско-юношеская спортивная школа имени Т.В…
- МБУДО «ДОООЦ «ДЕЛЬФИН» г. Петровск
- МБОУ «СОШ № 2»
- МБОУ «ООШ № 5»
-
Питерский район
- МУ ДО «Дом детского творчества»
-
Пугачевский район
- МОУ «СОШ №14 г. Пугачёва им. П.А.Столыпина»
- МОУ СОШ с. Старая Порубёжка
- МОУ «СОШ с. Заволжский»
- МОУ «СОШ №2 г. Пугачева»
- МОУ «СОШ № 13 г. Пугачева Саратовской области имен…
- МБУ ДО «Центр развития творчества детей и юношеств…
-
Ровенский район
- МБОУ «СОШ с. Скатовка»
- МБУ ДО «Дом детского творчества р.п.Ровное»
-
Ртищевский район
- МОУ «СОШ № 7»
- СТЮТ г. Ртищево
- МОУ «Владыкинская СОШ» Ртищевского района
-
Саратовский район
- МОУ«СОШ с. Багаевка им. Н.В. Котлова»
- МОУ «СОШ с.Березина Речка»
- МОУ «СОШ п. Дубки»
- МОУ «СОШ с. Синенькие»
- МОУ «СОШ р.п. Соколовый»
- МОУ «СОШ с.Усть-Курдюм»
-
Самойловский район
- МУ ДО «ЦДТ р.п. Самойловка»
-
Советский район
- МБОУ «СОШ №1» р.п. Степное
- МБОУ «Лицей»
- МБОУ-ООШ с. Розовое
- МБОУ «СОШ р.п. Пушкино»
- МБУ ДО-РДДиЮ Советского района.
-
Татищевский район
- МОУ «СОШ с. Сторожевка»
- МОУ «СОШ с. Мизино-Лапшиновка
- МОУ «СОШ с. Ягодная Поляна»
- МОУ «Татищевский лицей»
- МОУ «СОШ с. Вязовка»
- МОУ «СОШ с. Октябрьский Городок»;
- МОУ «СОШ п. Садовый»
- МОУ «СОШ с. Идолга»
-
Хвалынский район
- МОУ СОШ № 1 г. Хвалынска
- МОУ ДО «ДДТ «Хвалынский»
- Звуковая культура речи
- Флористика
- 3-д моделирование
- ИКТ
- Трудовое обучение(технический труд)
- Краеведение
- ИЗО
- Лепка
- Цветоводство
- Лесничество
- Брейк-данс
- Волонтерство
- Логика
- Дизайн
- Философия
- Лесничество
-
п. Возрождение
-
МОУ «СОШ с. Апалиха
-
МОУ СОШ №2
- Русский язык
- Литература
- История, обществознание
- Математика
- Информатика, физика, астрономия
- Иностранный язык
- Музыка
- Химия, биология
- Начальная школа
-
Энгельсский район
- МОУ «СОШ №1»
- МБОУ ООШ № 2
- МОУ «СОШ № 3»
- МБОУ «СОШ №4»
- МБОУ «СОШ №9»
- МБОУ «ООШ №10»
- МОУ «СОШ №12»
- МБОУ «СОШ №15»
- МБОУ «СОШ №18»
- МОУ «СОШ №19»
- МБОУ « СОШ №20»
- МОУ «СОШ № 21»
- МБОУ «СОШ №24»
- МОУ ООШ №26
- МОУ «СОШ №30 им. П. М. Коваленко»
- МБОУ «СОШ №32»
- МБОУ «СОШ№33»
- МОУ «СОШ №42»
- МАУ ДО «Дворец творчества детей и молодежи»
- МУ ДО «Центр «Позитив»
- МОУ «СОШ п. Пробуждение им. Л. А. Кассиля»
- МБОУ «СОШ с. Генеральское»
- МОУ «СОШ «Патриот» с кадетскими классами»
- МОУ «СОШ с.Заветное»
- МОУ «СОШ с. Узморье им. Ю.А.Гагарина»
- МОУ «ООШ с. Квасниковка»
- МОУ «СОШ п. им. К Маркса»
- МОУ «ООШ с. Ленинское»
- МОУ «СОШ с.Широкополье»
- МОУ «СОШ с. Зеленый Дол»
- МОУ «ООШ с. Безымянное»
- МОУ «СОШ п.Бурный»
- МОУ «ООШ с. Титоренко»
- МБОУ «СОШ с Красный Яр
- МАОУ «Образовательный центр № 1» ЭМР
- ГАПОУ СО «Энгельсский политехникум»
- МБОУ «СОШ с. Старицкое»
- МОУ «СОШ п. Коминтерн»
- МОУ «СОШ с. Липовка»
- МОУ «СОШ с. Шумейка»
- МОУ «СОШ с.Воскресенка»
-
МОУ «СОШ №12 г. Шиханы»
-
Турковский район
-
ЗАТО «Светлый»
- МУ ДО ЗАТО Светлый
- МОУ СОШ №3 им. В.Н. Щеголева
- МОУ «СОШ №2 им. В.А. Коновалова»
-
Федоровский район
-
Балтайский район
- МБУ ДО «Дом детского творчества Балтайского района
- Александрово — Гайский район
-
СОИРО
- Проект 2021
- Проект 2020
- Проект 2019
- КОНКУРС_2022
- Семинар 7.10
- Проект 2022
- Волжский район
-
Дистанционное обучение детей-инвалидов
- О проекте
- МЦДОДИ
- Мероприятия для МЦДОДИ
-
О портале
-
Нормативные документы
-
Российские цифровые образовательные платформы
-
Видеоконференция
- Создание видеоконференции
- Конкурсы
-
Семинары
- 15-16.11.2021Семинар «Дистанционные формы обучения…
- Семинар 7 октября 2021
- Региональные ЦОР
- Страницы сайта






