- Самый активный металл – это Цезий
- Самые активные металлы в мире
- Что такое цезий
- Свойства цезия
- Цезий и лечение рака
- Сравнение цезия и франция
- Сравнения цезия и лития
- Ряд активности металлов
- Активные металлы — список в химии, таблица, реакции и ряд — Природа Мира
- Подведение итогов
- Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их. — презентация
Вспомните:
• простые вещества состоят из атомов одного химического элемента, их разделяют на металлы и неметаллы;
• для металлов характерны металлический блеск, электропроводность, пластичность и т. п.
Понятие о ряде активности металлов
Во многих химических реакциях принимают участие простые вещества, в частности металлы. Металлы могут взаимодействовать почти со всеми классами неорганических соединений, которые изучаются в школьном курсе химии. Однако разные металлы проявляют разную активность в химических взаимодействиях, и от этого зависит, произойдет реакция или нет.
Чем больше активность металла, тем энергичнее он взаимодействует с другими веществами.
По активности все металлы можно расположить в ряд, который называется рядом активности металлов (вытеснительным рядом металлов, рядом напряжений металлов, электрохимическим рядом напряжений металлов).
Этот ряд впервые составил и изучил выдающийся украинский ученый Η. Н. Бекетов, поэтому у данного ряда есть еще одно название — ряд Бекетова.
Ряд активности металлов Бекетова выглядит так (более полный ряд см. на форзаце 2):
Николай Николаевич Бекетов (1827-1911)
Русский и украинский химик, основатель украинской школы физической химии, академик Петербургской академии наук с 1886 г. Родился в семье морского офицера. Закончил Казанский университет, работал в Петербурге в Медико-химической лаборатории.
Преподавал химию цесаревичу — будущему императору Николаю II. С 1855 г. профессор императорского университета в Харькове, где по предложению ученого в 1864 г. было открыто первое в Украине физикохимическое отделение.
Именно там впервые в мире он начал преподавать физическую химию как отдельную дисциплину.
Бекетов открыл способ восстановления металлов из их оксидов, который и сегодня используют в металлургии, установил зависимость сродства элементов от порядкового номера, первым получил чистые оксиды щелочных элементов (Натрия, Калия), составил ряд активности металлов, который назван его именем, был автором первого в мире учебника по физической химии.
В этом ряду металлы расположены по уменьшению их химической активности в водных растворах. Таким образом, среди приведенных металлов наиболее активным является калий, а наименее активным — золото.
С помощью этого ряда легко выяснить, какой металл активнее другого. Также в этом ряду находится водород.
Конечно, водород не является металлом, но в данном ряду его активность принята за точку отсчета (своего рода ноль).
Взаимодействие металлов с кислотами
Металлы, расположенные в ряду активности слева от водорода, способны вступать в реакции с кислотами, в которых атомы металлических элементов замещают атомы Гидрогена в кислотах. При этом образуются соль соответствующей кислоты и водород Н2 (рис. 36.1, с. 194):
Mg + 2НСl = MgCl2 + H2↑
Zn + H2SO4= ZnSO4 + H2↑
Рис. 36.1. Взаимодействие металлов с кислотами: а — алюминий; б — цинк; в — никель
Чем левее расположен металл в ряду активности, тем более бурно он взаимодействует с кислотами. Наиболее интенсивно вытесняют водород из кислот те металлы, которые расположены в самом начале ряда.
Так, магний взаимодействует очень бурно (жидкость словно закипает), цинк взаимодействует значительно спокойнее, железо реагирует совсем слабо (пузырьки водорода едва образуются), а медь вовсе не взаимодействует с кислотой (рис. 36.2).
Рис. 36.2. Взаимодействие металлов с хлоридной кислотой
Если металл расположен в ряду активности справа от водорода, то он не способен вытеснять водород из растворов кислот, и потому реакция не происходит (табл. 12, с. 197):
Сu + НСl ≠
Обратите внимание на уравнения реакций металлов с кислотами, приведенные выше: в этих реакциях атомы металлических элементов из простого вещества замещают атомы Гидрогена в кислотах. Такие реакции называют реакциями замещения.
Реакции замещения — это реакции, в которых атом элемента простого вещества вытесняет атом другого элемента из сложного вещества.
Взаимодействие нитратной и концентрированной сульфатной кислот с металлами происходит по другой схеме. В таких реакциях водород почти не выделяется, а выделяются другие продукты реакции, о чем вы узнаете в следующих классах.
Взаимодействие металлов с водой
Металлы, расположенные в ряду активности слева от водорода, способны вытеснять водород не только из растворов кислот, но и из воды. Как и в случае с кислотами, активность взаимодействия металлов с водой зависит от расположения металла в ряду активности (рис. 36.3).
Рис. 36.3. При обычных условиях натрий и кальций активно взаимодействуют с водой с выделением водорода, а цинк и железо не взаимодействуют
Металлы, расположенные в ряду активности слева от магния, взаимодействуют с водой при обычных условиях. В таких реакциях образуются щелочи и водород:
Литий взаимодействует с водой очень бурно (рис. 36.4):
2Li + 2Н2O = 2LiOH + Н2↑
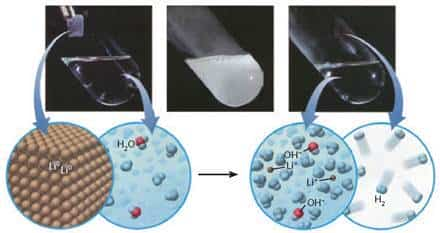
Рис. 36.4. Взаимодействие лития с водой с образованием бесцветного раствора литий гидроксида
- Калий реагирует с водой так бурно, что иногда случается взрыв: во время реакции выделяется настолько большое количество теплоты, что выделяемый водород загорается и вызывает воспламенение самого металла.
- Кальций и натрий взаимодействуют с водой так же бурно, но без взрыва:
- Са + 2Н2O = Са(ОН)2 + Н2↑
- 2Na + 2Н2O = 2NaOH + Н2↑
То, что в результате реакции активных металлов с водой образуются щелочи, можно доказать, добавив раствор фенолфталеина, который приобретает характерную малиновую окраску (рис. 36.5, с. 196).
Рис. 36.5. После взаимодействия кальция с водой добавили фенолфталеин: в растворе виден осадок кальций гидроксида, а малиновый цвет свидетельствует о наличии щелочи
Магний взаимодействует с водой по такой же схеме, что и активные металлы, но вместо щелочи образуется нерастворимое основание.
Реакция протекает настолько медленно, что сначала при добавлении магния к воде никакой реакции не наблюдается — пузырьки водорода начинают выделяться лишь спустя некоторое время (рис. 36.6).
Для инициирования реакции воду следует немного подогреть или проводить реакцию в кипящей воде.
Рис. 36.6. При комнатной температуре магний взаимодействует с водой очень медленно, раствор слегка мутнеет вследствие образования малорастворимого магний гидроксида
- Большинство других металлов, расположенных между магнием и водородом в ряду активности, также могут взаимодействовать с водой (вытеснять из нее водород), но это происходит при более «жестких» условиях: для этого через раскаленные металлические опилки пропускают перегретый водяной пар. Конечно, при таких условиях гидроксиды разлагаются (на оксид и воду), поэтому продуктами реакции являются оксид соответствующего металлического элемента и водород:
- Никель, олово и свинец пассивируются водой, поэтому ни при каких условиях с водой не реагируют.
- Таблица 12. Зависимость химических свойств металлов от положения в ряду активности
- Взаимодействие металлов с солями
- Если соль растворима в воде, то металлический элемент в ней может быть вытеснен более активным металлом:
- Например, если погрузить в раствор купрум(II) сульфата железную пластинку, через определенное время на ней выделится медь в виде красного налета:
- CuSO4 + Fe = FeSO4 + Cu↓
Со временем железная пластинка покрывается довольно плотным слоем порошка меди, а раствор светлеет, что свидетельствует об уменьшении в нем концентрации купрум(II) сульфата (рис. 36.7).
Рис. 36.7. Взаимодействие раствора купрум(II) сульфата с железной пластинкой
Железо расположено в ряду активности слева от меди, поэтому атомы Феррума могут вытеснить атомы Купрума из соли. Но если в раствор купрум(II) сульфата погрузить серебряную пластину, то реакция не происходит:
CuSO4 + Ag ≠
Медь можно вытеснить из соли любым металлом, расположенным слева от меди в ряду активности металлов. При этом медь будет вытеснять из растворов других солей любой металл, который расположен в ряду активности справа от нее (рис. 36.8):
2AgNO3 + Сu = Cu(NO3)2 + 2Ag
Рис. 36.8. Менее активное, чем медь, серебро оседает на поверхности медной проволоки. Раствор приобретает голубую окраску благодаря образованию на нем соли Купрума
Наиболее активные металлы, расположенные в самом начале ряда, — натрий, калий — не вытесняют другие металлы из растворов солей, поскольку они такие активные, что взаимодействуют не с растворенной солью, а с водой, в которой эта соль растворена.
Взаимодействие металлов с оксидами
Оксиды металлических элементов также способны взаимодействовать с металлами. Более активные металлы вытесняют менее активные из оксидов. Но, в отличие от взаимодействия металлов с солями, чтобы реакция осуществилась, оксиды необходимо расплавить:
- Для получения металла из оксида можно применять любой металл, который расположен в ряду активности левее, даже самые активные натрий и калий, ведь в расплавленном оксиде воды нет:
- ZnO + 2Na = Na2O + Zn
- CaO + 2K = K2O + Ca
- Вытеснение металлов из солей или оксидов более активными металлами иногда применяют в промышленности для получения металлов.
• Многие кислоты и другие вещества алхимики называли «спиртами» (от латин. spiritus — «дух», «запах»).
Так, был spiritus sale — соляный спирт, или хлоридная кислота, spiritus nitrate — нитратная кислота и т. д.
В современном химическом языке от этих названий остались только spiritus ammonia — нашатырный спирт, который является раствором аммиака NH3, и spiritus vini — винный, или этиловый, спирт.
• Горящие активные металлы (магний, натрий и др.) невозможно погасить водой. Причина заключается в том, что при контакте с водой горящий магний реагирует с ней, вследствие чего выделяется водород, который только усиливает горение.
• «Царской водкой» химики называют кислоту, которая является смесью концентрированных нитратной и хлоридной кислот. Такое название эта смесь получила потому, что с ней взаимодействует даже золото.
Самый активный металл – это Цезий

Наиболее активными металлами являются элементы I и II групп, находящиеся с левой стороны периодической таблицы Менделеева. Металл считается активным, когда он сильно и быстро реагирует с другими элементами.Реакционная способность металла возрастает по мере того, как мы переходим от верхней к нижней части периодической таблицы.
Исключением является водород, который не считается металлом и размещен в верхнем левом углу периодической системы химических элементов Менделеева.
Самые активные металлы в мире

- Активные металлы.
- Средней активности металлы.
- Малоактивные металлы.
Наиболее активные металлы на Земле — литий, цезий и франций.
Цезий — самым активный из нерадиоактивных элементов. Это редкий серебристо-желтый блестящий металл с атомным числом (число протонов в ядре) 55. Это очень мягкий элемент, который будет таять в ваших руках — если не взорвется раньше, так как он сильно реагирует на влагу.
 Caesium (Cs), номер – 55, атомная масса – 132,905
Caesium (Cs), номер – 55, атомная масса – 132,905
Существует также очень радиоактивный элемент, франций, который может быть более активным, чем цезий. Или не может, мы, вероятно, никогда этого не узнаем, потому что франций не только крайне радиоактивный, но и крайне редкий металл.
Последний из тройки наиболее активных металлов — литий — обладает интересным свойством. Он придает малиновый цвет языкам пламени.
Вот видео-демонстрация активности лития, натрия, калия, рубидия и цезия.
Что такое цезий
Цезий относится к щелочным металлам. Они очень реакционноспособны, и не встречаются свободно в природе. Эти металлы также очень пластичные, они хорошие тепловые и электрические проводники.
Цезий был первым элементом, который можно было обнаружить со спектроскопом. В 1860 году его открыли немецкие химики Роберт Бунзен и Густав Кирхгоф, когда анализировали спектр минеральной воды из Бад-Дюркхаймского источника.
Цезий встречается естественным образом в минералах поллуцита и лепидолита. Также он содержится во многих алюмосиликатах, таких как берилл, петалит и карналлит.
Самое богатое из известных месторождений цезия находится в Канаде, на берегу озера Берник-Лейк. Там сосредоточено около 70% всех земных запасов.
Любопытно, что это озеро является местом проведения ежегодного фестиваля цезия (24 февраля), когда в снегу сжигаются тонны этого вещества, и преобладает другое цезиевое безумие.
А еще цезий является побочным продуктом ядерного деления в реакторах.
Свойства цезия
Пусть цезий и не самый тяжелый металл в мире, зато он самый активный и обладает рядом уникальных свойств:
- Он спонтанно горит на воздухе и моментально взрывается при контакте с водой или влагой в любой форме, даже со льдом до -116 С.
- Он горит блестящим голубым пламенем. Непосвященным пламя кажется пурпурным, а не синим, однако после достаточной медитации, изучения трудов по химии и блаженных часов, проведенных в благоговении перед тем, как горит цезий, раскрывается истинная синяя природа его пламени
- Название «цезий» происходит от двух ярко-синих линий в его эмиссионном спектре. В переводе с латинского «caesius» означает «небесно-синий».
- Его гидроксид (жидкое расплавленное состояние) способен проесть плоть, стекло и многие другие вещества. Лишь металл родий и ряд его сплавов способны противостоять расплаву гидроксида цезия.
- Иодид и бромид цезия используются в качестве центральных компонентов при производстве высокоточной оптики, в том числе прицелов, очков и биноклей ночного видения. Цезий также экспериментально использовался в ионных силовых установках для космических аппаратов, из-за его низкого потенциала ионизации.
- Цезий используется при создании самых точных атомных часов. Даже лучшие наручные часы в мире могут отставать на несколько секунд или даже минуту. А вот атомные часы на основе цезия теряют всего одну секунду в пять миллиардов лет.
- Природный цезий состоит из одного стабильного изотопа, Cs 133. Известно 30 других радиоактивных изотопов, заполняющих диапазон от Cs 114 до Cs 145. Цезий-137 (он же радиоцезий) является одним из наиболее биологически опасных компонентов радиоактивных отходов и ядерных осадков. Он накапливается в живых организмах и даже в грибах, а самое высокое его содержание обнаружено в у северных оленей и водоплавающих птиц в Северной Америке.
Люди и животные постоянно подвергаются воздействию минимального количеств цезия при еде, дыхании и питье. Хотя маловероятно, что мы будем болеть только из-за цезия, его длительное воздействие может привести к неблагоприятным последствиям для здоровья, включая тошноту, рвоту, кровотечение и повреждение клеток.
Цезий и лечение рака
Еще Парацельс утверждал, что все есть яд, и все есть лекарство. Дело лишь в дозировке. И когда речь заходит о цезии, то слова Парацельса абсолютно верны.
В настоящее время исследуется эффективность цезия для лечения нескольких форм рака, включая опухоли головного мозга. Цезий-131, радиоактивный изотоп цезия, вместе с другим радиоактивным изотопом (йодом-125) помещают в брахитерапевтическую капсулу («семя»).
По данным Американского общества брахитерапии, брахитерапевтическая капсула является радиоактивным «стручком», который помещается непосредственно в раковую ткань. Такие семена эффективны при нескольких формах рака, включая рак простаты, шейки матки и эндометрия.
В одном из исследований группе из 24 пациентов с опухолями головного мозга были имплантированы в опухоль брахиотерапевтические семена с цезием-131. Были отмечены минимальные побочные эффекты, но в целом пациенты хорошо перенесли эту форму лечения.
Идея использования семян брахитерапии с цезием-131 в качестве лечения рака возникла еще в 1960-х годах и была описана в исследовании, опубликованном в журнале « Радиология». В исследовании, опубликованном в журнале Medical Physics, в 2009 году обсуждалось использование семян цезия-131 для лечения рака предстательной железы с положительными результатами.
Необходимо больше исследований, прежде чем лечение цезием прочно займет свое место в медицине. Однако пока что исследования доказывают, что использование цезия-131 для лечения раковых опухолей при помощи брахиотерапии является обнадеживающим.
Сравнение цезия и франция
 Francium (Fr), номер – 87, атомная масса – 223
Francium (Fr), номер – 87, атомная масса – 223
Как и цезий, франций (Fr) относится к щелочным металлам (только радиоактивным) и обладает крайне высокой химической активностью.
- Плотность франция составляет 1,87 грамма на кубический сантиметр, что сопоставимо с плотностью цезия — 1,879 грамма на кубический сантиметр.
- Цезий и франций — два из четырех металлов, которые становятся жидкими при комнатной температуре. Таким же свойством обладают ртуть и галлий.
- Взаимодействие цезия с водой происходит весьма эффектно — со взрывом, образованием гидроксида CsOH и водорода H2. Франций и вода тоже не особо «любят» друг друга, и при их взаимодействии образуется самая сильная щелочь — гидроксид франция.
- Как и цезий, франций накапливается в живых организмах. Поэтому изотопы данного металла нашли свое применение в медицине, для диагностики рака и различных биологических исследований.
- А вот по распространенности цезий далеко опережает франций. Ежегодно в мире добывается около 20 тонн обогащённой руды цезия. По данным PeriodicTable, цезий является 50-м наиболее распространенным элементом земной коры. Франция же во всей земной коре насчитывается около 340 грамм.
То есть по своим свойствам два самых активных металла на планете очень схожи.
Сравнения цезия и лития
 Lithium (Li), номер – 3, атомная масса – 6,94
Lithium (Li), номер – 3, атомная масса – 6,94
Литий входит в топ-3 самых активных металлов на планете. Это ключевой компонент в батареях, которые питают смартфоны, ноутбуки и электромобили. Более половины поставок лития в мире идет из «литиевого треугольника» — Боливии, Чили и Аргентины. Крупнейший источник по получению лития из соли — это чилийская пустыня Атакама.
- Подобно цезию, литий относится к щелочным металлам. И, как и цезий, встречается в природе только в виде соединений. При этом следы лития находятся почти во всех изверженных породах и во многих минеральных источниках. Это был один из трех элементов, созданных Большим взрывом, наряду с водородом и гелием.
- Лития и цезия в земной коре мало — 21 г / т и 3,7 г/т соответственно.
- Если цезий воспламеняется на воздухе, взаимодействуя с кислородом, то литий даже может некоторое время храниться на открытом воздухе. Благодаря подобной «терпимости» литий является единственным представителем щелочных металлов, не требующим хранения в керосине. Он тоже может передать «пламенный привет» при взаимодействии с кислородом, но лишь при высокой температуре.
- Литий -наименее плотный металл (0,533 г/см3). У цезия плотность намного больше — 1,879 грамма на кубический сантиметр. Легкость лития означает, что он может хранить энергию не добавляя тяжести различным устройствам.
- А вот по низкоплавкости литий дает фору цезию. Его температура плавления составляет 180,5 градуса Цельсия. А цезий плавится уже при 28,4 градуса Цельсия.
- Зато литий быстро закипает — при 134 градусах, а вот довести до кипения цезий непросто, необходима температура в 678 градусов.
- И литий и цезий легко режутся обычным ножом.
Ряд активности металлов
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления.
По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами.
Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
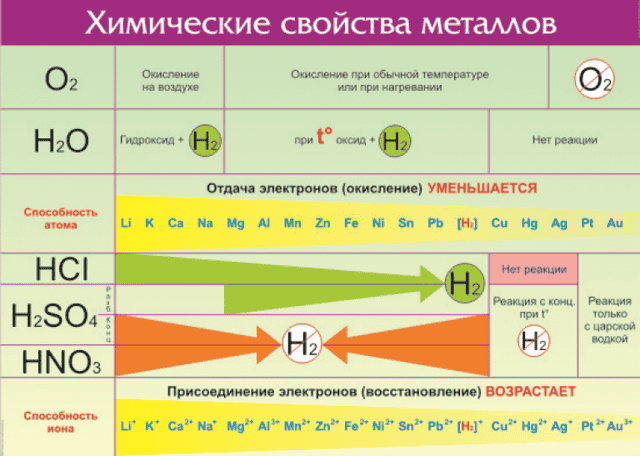
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций.
Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем.
Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
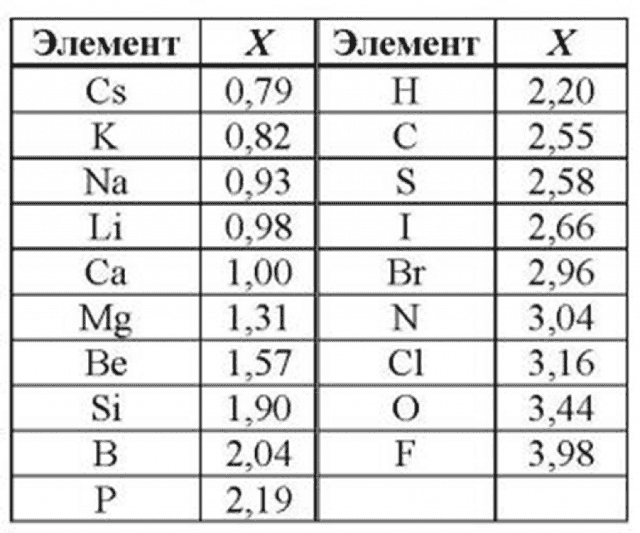
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
- Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
- Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее.
Пример реакции — Zn + Cu2+ → Zn2+ + Cu, которая протекает только в одном направлении.
Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является.
Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами.
Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
- 2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
- Fe + 2HCl = FeCl2 + H2↑
- Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью.
Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом.
Если извлечь их из керосина, то металлы практически мгновенно сгорают.
- Реакции кальция и натрия с водой при комнатной температуре выглядят так:
- 2Na + 2H2O = 2NaOH + H2↑
- Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
- 3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция.
Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла.
Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Активные металлы — список в химии, таблица, реакции и ряд — Природа Мира
Среди всех металлов некоторые отличаются тем, что они очень легко вступают в восстановительные реакции. Такие металлы имеют много схожих свойств и объединяются в класс активных металлов.
К активным металлам относятся три группы элементов:
- щелочные металлы;
- щелочноземельные металлы;
- алюминий.
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr).
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
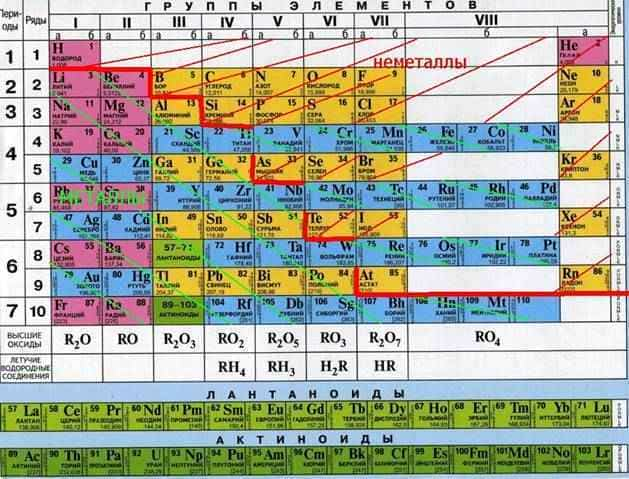 Активные металлы в таблице Менделеева
Активные металлы в таблице Менделеева
В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей.
Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий.
В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.
 Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов
Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Цвет всех щелочных металлов – белый, с серебристым оттенком. Исключением является цезий, имеющий серебристо-желтый цвет. Щелочные металлы можно резать простым скальпелем, так как у них низкая твердость. Также они имеют малую плотность – от 534 кг/м3 у лития до 1900 кг/м3 у цезия.
Литий, калий и натрий настолько легкие, что они плавают в воде, но построить корабль из них не получится, так как вода быстро окисляет и разрушает эти металлы.
Франций и цезий плавятся уже при комнатной температуре, а самый тугоплавкий щелочной металл – это литий, плавящийся при 180,6°С.
Для защиты щелочных металлов от воздуха и волы их хранят в керосине. При реагировании лития с водой выделяется водород, а натрий и особенно калий просто взрываются в воде. При взаимодействии с кислородом образуются оксиды.
Щелочноземельные металлы значительно тверже щелочных, их нельзя просто взять и разрежать ножом. Также они тяжелее – их плотность колеблется от 1550 кг/м3 у кальция до 5500 кг/м3 у радия. Цвет щелочноземельных металлов – серый. Температуры плавления этих элементов находятся в диапазоне 650-840°С. Исключение – бериллий, плавящийся лишь при 1278°С.
Чем больше порядковый номер щелочноземельного металла в таблице Менделеева, тем выше его химическая активность. Например, бериллий вообще не взаимодействует с кислородом и по своим свойствам напоминает алюминий. Наиболее активные стронций, барий и радий приходится хранить в керосине, также как и щелочные металлы.
Подведение итогов
Активные металлы отличаются тем, что имеют лишь один-два валентных электрона, которые они легко отдают. Поэтому эти элементы очень быстро вступают в химические реакции, а в природе в чистом виде не встречаются.
Не все нашли? Используйте поиск по сайту
Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их. — презентация
1
2 Щелочны́е мета́аллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти метааллы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
3 Все щелочные метааллы имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1. Поэтому щелочные метааллы являются сильными восстановителями.
4 Все метааллы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней. Поэтому хранят эти метааллы под слоем керосина или парафина. калий рубидий литий натрий цезий
5
6 1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего хлоридов, образующих природные минералы: катод: Li+ + e Li анод: 2Cl- 2e Cl2 2.
Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов : катод: Na+ + e Na анод: 4OH- 4e 2H2O + O2 Поскольку щелочные метааллы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
- 7 Реакции с неметаллами (образуются бинарные соединения): 4Li + O 2 2Li 2 O(оксид лития) 2Na + O 2 Na 2 O 2 (пероксид натрия) K + O 2 KO 2 (надпероксид калия) 2Li + Cl 2 = 2LiCl(галогениды) 2Na + S = Na 2 S(сульфиды) 2Na + H 2 = 2NaH(гидриды) 6Li + N 2 = 2Li 3 N(нитриды) 2Li + 2C = 2Li 2 C 2 (карбиды)
- 8 Активно взаимодействуют с водой: 2Na + 2H 2 O 2NaOH + H 2 2Li + 2H 2 O 2LiOH + H 2 Реакция с кислотами: 2Na + 2HCl 2NaCl + H 2
- 9 Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета: Li+ — карминово-красный Na+ — желтый K+, Rb+ и Cs+ — фиолетовый Так выглядит проба на окрашивание пламени солями натрий Карминово- красное окрашивание пламени солями лития Окрашивание пламени горелки ионами калия
- 10
11 Атомы этих элементов имеют на внешнем электронном уровне два s-электрона: ns 2. В реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2.
12 Бериллий, магний, кальций, барий и радий — метааллы серебристо-белого цвета. Стронций имеет золотистый цвет. Эти метааллы легкие, особенно низкие плотности имеют кальций, магний, бериллий. Радий является радиоактивным химическим элементом.
13 Электролизом расплавов их хлоридов или термическим восстановлением их соединений: BeF 2 + Mg = Be + MgF 2 MgO + C = Mg + CO 3CaO + 2Al = 2Ca + Al 2 O 3 3BaO + 2Al = 3Ba + Al 2 O 3
14 Щелочноземельные элементы — химически активные метааллы. Они являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки. кальций магний бериллий
15 Все легко взаимодействуют с кислородом и серой, образуя оксиды и сульфаты: 2Be + O 2 = 2BeO Ca + S = CaS Бериллий и магний реагируют с кислородом и серой при нагревании, остальные метааллы — при обычных условиях.
Все метааллы этой группы легко реагируют с галогенами: Mg + Cl 2 = MgCl 2 При нагревании все реагируют с водородом, азотом, углеродом, кремнием и другими неметаллами: Ca + H 2 = CaH 2 (гидрид кальция) 3Mg + N 2 = Mg 3 N 2 (нитрид магния) Ca + 2C = CaC 2 (карбид кальция)
16 Все взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода: Be + 2HCl = BeCl 2 + H 2 Разбавленную азотную кислоту метааллы восстанавливают главным образом до аммиака или нитрата аммония: 2Ca + 10HNO 3 (разб.) = 4Ca(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O В концентрированных азотной и серной кислотах (без нагревания) бериллий пассивирует, остальные метааллы реагируют с этими кислотами.
17 Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода: Be + 2NaOH + 2H 2 O = Na 2 [Be(OH) 4 ] + H 2 Остальные метааллы II группы с щелочами не реагируют.
18 13 Al [Ne] 3s 2 3p 1 Алюминий находится в главной п/группе III группы периодической системы. На внешнем энергетическом уровне имеются свободные р-орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью отдает три валентных электрона, проявляя степень окисления +3.
19 Металл серебристо-белого цвета, легкий, плотность 2,7 г/см³, температура плавления у технического 658 °C, у алюминия высокой чистоты 660 °C, температура кипения 2500 °C, временное сопротивление литого кг/мм², деформируемого кг/мм 2,сплавов кг/мм². Твердость по Бринеллю кгс/мм², высокая пластичность: у технического 35 %, у чистого 50 %, прокатывается в тонкий лист и даже фольгу.
- 20 С простыми веществами: 1) С кислородом: 4Al 0 + 3O 2 2Al +3 2 O 3 2) С галогенами: 2Al 0 + 3Br 2 0 2Al +3 Br 3 3) С другими неметаллами (азотом, серой, углеродом) реагирует при нагревании: 2Al 0 + 3S t° Al 2 +3 S 3 (сульфид алюминия) 2Al 0 + N 2 t° 2Al +3 N(нитрид алюминия) 4Al 0 + 3С Al 4 +3 С 3 (карбид алюминия) Сульфид и карбид алюминия полностью гидролизуются: Al 2 S 3 + 6H 2 O 2Al(OH) 3 ¯ + 3H 2 S Al 4 C H 2 O 4Al(OH) 3 ¯+ 3CH 4
- 21 Со сложными веществами: 4) С водой (после удаления защитной оксидной пленки): 2Al 0 + 6H 2 O ® 2Al +3 (OH) 3 + 3H 2 5) Со щелочами: 2Al 0 + 2NaOH + 6H 2 O ® 2Na[Al +3 (OH) 4 ] (тетрагидроксоалюминат натрия) + 3H 2 6) Легко растворяется в соляной и разбавленной серной кислотах: 2Al + 6HCl ® 2AlCl 3 + 3H 2 2Al + 3H 2 SO 4 (разб) ® Al 2 (SO 4 ) 3 + 3H 2 При нагревании растворяется в кислотах — окислителях: 2Al + 6H 2 SO 4 (конц) ® Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O Al + 6HNO 3 (конц) ® Al(NO 3 ) 3 + 3NO 2 + 3H 2 O 7) Восстанавливает метааллы из их оксидов (алюминотермия): 8Al 0 + 3Fe 3 O 4 ® 4Al 2 O 3 + 9Fe 2Al + Cr 2 O 3 ® Al 2 O 3 + 2Cr
- 22
23 в электротехнике для производства легких сплавов (дюралюмин, силумин) в самолете- и автомобилестроении для алитирования чугунных и стальных изделий с целью повышения их коррозионной стойкости для термической сварки для получения редких металлов в свободном виде в строительной промышленности для изготовления контейнеров, фольги и т.п.
24 Осуществить цепочку превращений: Аl АlСl 3 Аl(ОН) 3 Аl 2 О 3 Nа Аl О 2 Аl 2 (SО) 3 Аl(ОН) 3 АlСl 3 NаАlО 2
25 1. Активные метааллы 2. Метааллы средней активности 3. Благородные метааллы А) Au, Ag, Pt Б) Zn, Fe, Cu В) Na, K, Ca
26 Наиболее выраженные металлические свойства проявляет: ? алюминий ? натрий ? магний ? бериллий ? железо Активнее других реагирует с кислородом…. ? алюминий ? серебро ? цинк ? барий При комнатной температуре вытесняет водород из воды… ? медь ? железо ? литий ? цинк
27 Калий взаимодействует с водой с образованием…. и…. ? соли ? водорода ? щелочи ? оксида калия В химических реакциях атом алюминия -… ? окислитель ? восстановитель ? окислитель и восстановитель ? не отдает и не принимает электроны Какой металл не используют для вытеснения менее активных металлов из растворов их солей? ? железо ? магний ? натрий ? цинк
28 Задача 1 При обработке 8 г смеси магния и оксида магния соляной кислотой выделилось 5,6 л водорода(н.у.). Какова массовая доля (в %) магния в исходной смеси? Задача 2 Калий массой 3,9 г растворили в воде массой 206,2 г. Определите массовую долю полученного раствора.
29 Домашнее задание: напишите уравнения согласно схеме, составьте рассказ о свойствах алюминия О2О2 СL2СL2 N2N2 S H2OH2O NaOH+H 2 O HCl Fe 2 O 3
30 Схема ответа: Строение атома металла Нахождение в природе Открытие металла и получение Физические свойства Химические свойства Применение






