- История открытия
- Определение и физическая характеристика
- Химические свойства
- Нахождение в природе
- Получение в промышленности
- Применение вещества
- Магний в организмах
- Переизбыток и недостаток
- Магний — огненный металл
- Пейте минералку
- Каков он, «вспыльчивый металл»
- И чем же наш герой не металл?
- Химия магниевых реакций
- Как он горит!
- Минералы, месторождения
- Получение чистого металла
- Польза и вред добавок
- Магний в нашей жизни
- Где еще применяют соединения магния
- Стоимость огненного металла
- Магний
- Изотопы
- Нахождение в природе
- Природные источники магния
- Физические свойства
- Химические свойства
- Применение
- Сплавы
- Соединения
- Огнеупорные материалы
- Военное дело
- Медицина
- Фотография
- Аккумуляторы
- Производство
- Цены
- Биологическая роль и токсикология
- Токсикология
- Биологическая роль
- Таблица нормы потребления магния
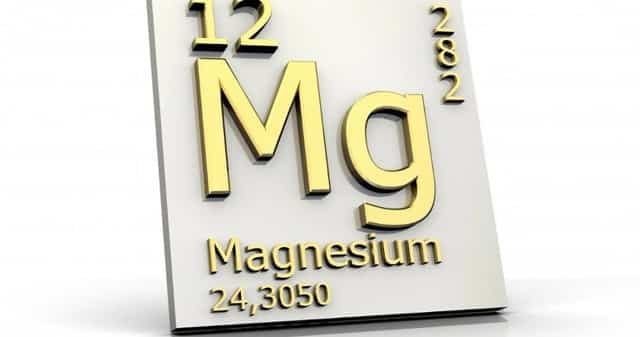
История открытия
Новая эра развития химии началась в XVII веке. В этот период химик из Англии по фамилии Гро совершил открытие, приблизившее учёных к выделению магния. В 1695 г. во время выпаривания эпсомской минеральной воды он получил горькую соль, обладавшую свойством слабительного.
Через несколько лет исследования показали, что взаимодействие вещества с содой и карбонатом калия даёт белый рыхлый порошок. Этот же результат был получен во время прокаливания минерала, который был найден рядом с городом Магнезия в Греции. Из-за этого сходства соль стали назвать белой магнезией.
Непосредственно магний впервые был получен Хэмфри Дэви в 1808 г. Учёный проводил электролиз белой магнезии, в которую он добавил небольшое количество воды и ртутной окиси. Эта реакция привела к образованию амальгамы металлического вещества. Полученный металл после выведения получил название «магний».
Следует отметить, что реактив имел различные примеси. Чистый элемент в 1829 г. вывел французский химик Антуан Александр Брутус Бюсси.
Определение и физическая характеристика
- Вещество является представителем II группы периодической системы химических элементов.
- Ему можно дать следующую характеристику:
- Магний принято обозначать Mg.
- Атомный номер вещества 12.
- Молярная масса элемента составляет 24,305 атомных единиц.
- Заряд ядра равен 12.
- В каждом атоме число электронов — 12.
- Кристаллическая решётка вещества имеет α-форму Ca гранецентрированная кубическая. Она отличается устойчивостью при обычной температуре.
- Плотность — 1,738 г/см³.
- Плавится металл при температуре 650 °C.
- Кипит вещество при 1090 °C.
- Чистый элемент отличается пластичностью. Его можно легко прессовать, прокатывать и резать.
Реагент в компактном состоянии представляет собой блестящий металл серебристо-белого цвета. Под воздействием воздуха он тускнеет, так как на поверхности образуется плёнка окиси.
Горит металлический реагент ослепительным пламенем белого цвета. Скорость, с которой вспыхивает вещество, во много раз превосходит скорость одёргивания руки.
Из-за этого физического свойства магния человеку, поджигающему элемент, необходимо соблюдать все положенные правила техники безопасности. В противном случае, он получит серьёзный ожог кожи. Для наблюдения за процессом горения следует использовать тёмные очки или стекло.
Без этих мер предосторожности повышает риск получения ожога сетчатки, который приводит к временной слепоте.
Химические свойства
Все стабильные соединения элемента имеют валентность равную двум, а электронная формула магния или схематичное строение его атома имеет вид: 1s2 2s2 2p6 3s2.

Даже при нагревании до 350 °C компактный магний подвергается незначительному окислению, поскольку он покрыт оксидной плёнкой. Горит реагент при температуре от 600 до 650 °C, при этом образуются оксид и нитрит элемента. Нитрит также можно получить, нагрев вещество до 500 °C в азотной среде.
Элемент относится к активным веществам. Кроме того, выделяют следующие химические свойства магния:

- Не вступает в реакцию с холодной водой, которая не насыщена воздухом.
- Постепенно вытесняет водород из кипятка.
- С водяным паром реагирует при температуре не ниже 400 °C.
- В жидком виде выделяет из влажного воздуха водород, поглощая его.
- Застывая, элемент практически полностью выводит водород.
- При нагревании водородной атмосферы до 400−500 °С вещество вступает в реакцию с ней, образуя гидрид магния.
- Вытесняет большую часть металлических элементов из растворов их солей, образованных на основании воды.
- В холодных условиях, соединяясь с влажным хлором, образует хлорид магния.
- В нагретом состоянии вступает в реакцию с галогенами.
- Большая часть солей элемента хорошо растворяется в воде.
- При контакте с едкими щелочами выпадает осадок, образованный из растворов солей магния.
- При пониженной температуре не вступает в реакцию с водными щелочными растворами, но подвержен растворению в гидрокарбонатах щелочных металлических реагентов и аммониевых солей.
- Не растворяется в концентрированной серной кислоте.
- От растворения в плавиковой кислоте защищён плёнкой из устойчивого фторида.
- Взаимодействует с разбавленными минеральными кислыми соединениями при низких температурах.
Реагент представляет собой сильный восстановитель. Нагретый магний вытесняет некоторые металлы и неметаллы из оксидов и галогенидов. Существует множество металлоорганических соединений вещества, которые делают его одним из важнейших элементов органического синтеза.
Реагент легко создаёт сплавы со многими металлами, а потому на нём основывается производство множества очень важных лёгких материалов.
Нахождение в природе
Земля очень богата магнием. Всего шесть химических реагентов встречаются в природе чаще, чем это вещество. Большая часть элемента находится в мантии планеты, в земной коре его меньше. Чаше всего его обнаруживают в основных породах и граните. И также элемент содержится в различных минералах, образованных магмой.
В основном чистый магний добывают из трёх минералов:
- карналлита;
- доломита;
- магнезита.

В России самые большие залежи магнезита находятся на Среднем Урале и в Оренбургской области. Карналлит добывается около города Соликамска, следует отметить, что это месторождение самое крупное в мире. Наиболее распространённый минерал доломит встречается в Московской и Ленинградской областях, а также других регионах страны.
В биологической среде планеты соединения магния постоянно перемещаются и изменяются.
Лишь малая часть элемента задерживается в круговороте веществ, происходящем на материках, большое количество реагента уносится реками в океан.
Несмотря на то что по содержанию в морской воде магний уступает только натрию, непосредственно сама жидкость не имеет насыщения элементом, а его соли в открытом океане не выпадают в осадок.
Вещество в составе различных соединений накапливается в солях, остающихся после того, как из лагун испаряется вода.
Получение в промышленности
В промышленных условиях для получения магния чаще всего применяют электролиз безводного хлорида или обезвоженного карналлита. Процесс проходит следующим образом:

- Электролиз проходит при температуре от 720 до 750 °C.
- По мере выделения элементов состав ванны корректируется, часть электролита при этом удаляется, а сырьё добавляется.
- Расплавленный искомый металл всплывает на поверхность, и его регулярно извлекают.
- Полученное вещество содержит много примесей. Для очистки элемент проходит рафинирование в специальных печах под слоем флюсов.
- Очищенный металл разливают в изложницы.
- Следующая очистка заключается в том, что реагент сублимируют несколько раз в вакууме.
Кроме этого метода, на производстве применяются металлотермический и углетермический способы получения магния.
В первом случае брикеты из раскалённого и разложившегося доломита смешивают с восстановителем и нагревают в вакууме при температуре 1300 °C.
Полученные в результате магниевые пары образуют конденсат, когда температура опускается до 400−500 °С. Чтобы очистить металл, применяют переплавку под флюсом или в вакууме. Чистый элемент разливают в изложницы.
При использовании второго метода брикеты, состоящие из угля и магниевой окиси, разогревают в электрических печах до 2100 °C. Превратившийся в пар металл отгоняют и конденсируют.
Также вещество добывают из морской воды. Для этого сырьё в очень больших баках смешивают с суспензией гидроксида кальция, который получают, перемалывая морские раковины. В результате происходящей химической реакции образуется особая суспензия, которая после высыхания становится хлоридом магния. После этого продукт подвергают электролитическим процессам.
Кроме морской воды, для выгонки магния может использоваться вода некоторых соленых озер. В Российской Федерации такие озёра находятся в Крыму, Поволжье и других регионах.
Применение вещества
Наибольшее количество металла потребляет металлургия. На его основе создаётся множество сплавов.
Часто вещество используют в металлотермических процессах, чтобы получить редкие металлы, а также те, которые трудно восстановить. Применяется реагент для раскисления и десульфурации металлических веществ.
Различные порошковые смеси на основе магния используются в качестве осветительных и зажигательных.
Соединения, содержащие реагент, нашли широкое применение в различных сферах жизнедеятельности. К примеру, в медицине, лекарства с магнием позволяют избавить пациентов от спазмов и судорог, успокоить нервы и так далее.
Магний в организмах
Магний содержится во всех растениях и животных. Вещество концентрируется в некоторых морских организмах. Максимальное количество металлического элемента содержится в известковых губках — до 4%.
Входит этот реагент и в состав хлорофилла зелёных растений. В общей сложности на их долю приходится 100 миллиардов тонн вещества. Учёные обнаружили магний во всех компонентах, необходимых клеткам живых организмов для существования.
Этот элемент запускает многие ферменты и позволяет хромосомам и коллоидным системам растений сохранять стабильность. Кроме того, реагент поддерживает в клетках тургорное давление.
Благодаря магнию растения лучше поглощают и усваивают находящийся в земле фосфор.
Люди и животные получают металлический элемент с пищей. Суточная норма потребления для человека составляет от 0,3 до 0,5 г. У детей и беременных женщин потребность в веществе несколько выше.
У здорового человека в крови должно содержаться около 4,3 мг/% магния.
В организме основным потребителем реагента является печень, но большая часть поглощённого ею металла постепенно переходит в кости и мышцы.
Переизбыток и недостаток
Магний практически безвреден для организма, хотя некоторым его соединениям и присвоен II класс опасности. В основном же металл в разных видах приносит лишь пользу. А страдают люди, животные и растения чаще всего от недостатка или переизбытка вещества.
Когда металла в организме слишком мало, увеличивается риск развития сахарного диабета, болезней почек и кишечника. У людей, страдающих от недостатка микроэлемента, часто болит голова, начинается бессонница, появляются спазмы мышц, быстро наступает утомление. При отсутствии лечения это может привести к различным более серьёзным заболеваниям, повышается возможность заболеть раком.

Прежде чем приступать к восстановлению уровня вещества в организме, необходимо проконсультироваться с врачом и установить степень потребности в веществе. После сдачи анализов доктор назначит переменный или постоянный на протяжении какого-то времени приём соответствующих лекарственных препаратов, принимать которые следует строго по инструкции.
При переизбытке микроэлемента у людей появляются следующие болезни:
- артрит;
- нарушение речи;
- тошнота;
- сонливость;
- и так далее.
Когда в почве содержится недостаточное количество вещества, у растений начинается мраморность листвы и хлороз. Отсутствие магния в рационе вызывает у крупного рогатого скота травяную тетанию.
Магний относится к жизненно необходимым микроэлементам. Сложно переоценить роль этого вещества в животных и растительных организмах. Его отсутствие в достаточном количестве способно возбудить множество заболеваний.
Магний — огненный металл
Тем, что название «магний» существует в мире химии, мы обязаны учебнику «Основания чистой химии» русского химика Гесса. Много русских химиков зубрили науку по этой книге — она была переиздана семь раз.
Пейте минералку
История открытия нашего героя начинается на английском курорте. Там скучающие химики решили исследовать, чем же их лечат. Из минеральной воды (горькой, но регулирующей пищеварение) выделили соль — горькую или английскую. Опыты продолжили, в результате почти одновременно Фарадей и Бюсси получили магний.

Этот металл серебристо-белого цвета можно добыть из почти любого булыжника под ногами, хотя для промышленного применения этот метод навряд ли пригоден.
Каков он, «вспыльчивый металл»
Магний теперь относится к щелочноземельным металлам. Однако раньше он таким не считался — его гидроксид не является щелочью, хотя раствор в присутствии фенолфталеина (индикатор) окрашивается в слабо-розовый цвет. Полноценные щелочи с фенолфталеином окрашиваются в густой малиновый цвет.
У чистого магния плотноупакованная гексагональная кристаллическая структура.
Строение атома указывает на принадлежность к металлам. Электронная формула элемента — 1s 2 2s 2 2p 6 3s 2. То есть, на внешнем энергетическом уровне у магния болтается пара электронов, в любой момент готовая «свалить налево» — вступить в реакцию с другим элементом. Кое-кто еще помнит, что свойство металлов на внешнем уровне иметь от 1 до 3 электронов.
И чем же наш герой не металл?
Некоторые характеристики магния:
| Свойство металла | Данные |
| Атомная масса | 24,304 г/моль |
| Степени окисления | 0; +2 |
| Плотность | 1,74 г/см3 |
| Температура плавления | 650оС |
| Теплопроводность | (300 K) 156 Вт/(м·К) |
| Температура кипения | 1090 оС |
| 136 пм | |
| 66 (+2e) пм | |
| 1,31 (шкала Полинга) | |
| −2,37 В | |
| 0; +2 | |
| 737,3 (7,64) кДж/моль (эВ) |
Химия магниевых реакций
Вспомним школьные годы. Немного химии во время карантина не повредит.
Итак, химические свойства нашего героя:
- К щелочам огненный металл равнодушен (сами такие, к щелочноземельным металлам относимся). В реакции со щелочами не вступает.
- Зато во взаимодействие с кислотами вступает охотно, даже бурно, с выделением водорода.
- На воздухе магний реагирует с кислородом воздуха, покрывается оксидной пленкой. Эта «одежка» защищает металл от дальнейшего окисления. Но влажная атмосфера разрушает нашего «горячего» героя. Потому его и не хранят во влажных помещениях.
Рекомендуем: БЕРИЛЛИЙ — металл настоящего и будущего
Как он горит!
Немного найдется металлов, горящих на воздухе, и наш герой — один из них. Подожгите магниевую стружку, и вспыхнет яркий, жгучий огонь. Еще бы не жгучий, его температура более 3000 градусов. Только не зажигайте магний на песке. Металл прореагирует с диоксидом кремния в песке, и будет гореть веселее. Потому затушить «магниевый» пожар песочком не получится.

Горящий магний можно использовать как факел в темноте. Пара грамм магния — и даже в самую черную ночь все будет видно в радиусе 5-7 метров.
Подожгите металл в луже, и увидите мощную вспышку. Здесь образуется гидроксид магния (Mg(OH)2) и водород, который многократно усилит мощность огня.
Кстати, головная боль пожарных — магний нельзя тушить водой. От этого огонь разгорится еще больше. Углекислотный огнетушитель тоже не вариант, ведь наш необыкновенный герой в присутствии углекислого газа хорошо горит, образуя уголь и оксид магния:
2Мg + CO2 = C + 2MgO
Минералы, месторождения
Наш герой настолько активен в химическом отношении (просто-таки «неразборчив в связях»), что его нахождение в природе в чистом виде практически невозможно.
Природные источники магния — минералы:
- брусит;
- кизерит;
- доломит;
- магнезит;
- бишофит;
- эпсомит;
- карналлит.
Даже из морской воды можно добывать огненный металл. Самосадочные озера (вода в них называется рапой), содержат большое количество минеральных солей, в том числе магния.
Крупнейшая российская группа месторождений — Саткинское — (разведано 14 штук) находится в Челябинской области, рядом с городом Сатка. Тут сосредоточены магнезиальные руды высокой чистоты.
Рекомендуем: СЕРЕБРО — лунный металл от любой нечисти
Получение чистого металла
Промышленное получение металла возможно двумя способами:
- Электролитическим.
- Термическим.
В первом способе необходимы обезвоженные хлориды магния, натрия, калия. Их смешивают в электролитической ванне, в расплаве происходит восстановления магния.
Чистый металл сливают, добавляя в ванну сырье. В черновом металле содержится до 2% примесей. При необходимости еще не остывший магний рафинируют, доводя чистоту почти до идеальной — 99,999%.
Во втором способе в качестве сырья предпочтительно использовать доломит с добавлением кокса. Возможно использование морской воды. Смесь разогревают до 2100 градусов, пары магния отгоняются и конденсируются.
Польза и вред добавок
Чистый магний ковкий, легкий металл. Только есть у металла свойство — подверженность коррозии. Потому чистый металл используют редко, в отличие от его сплавов. Для сплавов магния очень важны добавки алюминия, циркония, цинка.
Алюминий делает сплав прочнее и удобнее для литейных работ.
Количество лигатуры важно для качеств сплава:
- 3% алюминия придадут наибольшую пластичность;
- 6% лигатуры — даст лучшие прочность и пластичность;
- 9% алюминия подарит сплаву максимальную прочность.
Свойства цинка в сплавах подобны алюминиевым:
- 3% добавка максимально увеличивает пластичность;
- 5% цинка даст гармоничное сочетание пластичности и прочности сплава;
- Если в сплаве есть вредные примеси (никель, железо), то лигатура цинка повысит коррозионную стойкость.
- Кремний повысит способность к литью, но в присутствии железа уменьшит устойчивость к ржавчине.
- Никель и железо примеси вредные, они делают сплав подверженным ржавчине.
Сплавы магния делят на деформируемые (МА) и литейные (МЛ); последние применяются значительно чаще. В сплав МЦИ добавляют медь, железо, цинк, никель. Эта смесь металлов хороша при вибронагрузках.
Магний в нашей жизни
Металл и его сплавы нашли широкое применение в разных сферах жизни.
- Способность металла давать яркий огонь использовали на заре фотографии.
- Легкость металла открыла ему путь в авиацию. Наши ноутбуки, многие фотокамеры содержат магниевые детали — не таскать же тяжелый прибор, если можно сделать легкий.
- В химических источниках тока энергия химических реакций напрямую превращается в электрическую. Чистый металл и его соединения в электрических батареях сообщают им высокие ЭДС и отменные энергетические характеристики.

Анодом в таких батареях служит магний. В качестве катода применяют:
- марганец;
- висмут;
- серу;
- хлористое серебро;
- хлористый свинец в смеси с графитом;
- диоксид марганца с графитом.
Рекомендуем: ИРИДИЙ — подарок из космоса
Огнеупорные материалы необходимы для футеровки металлургических печей, тиглей.
Дешевым и качественным сырьем для этого могут быть минералы магния:
- бишофит;
- магнезит;
- доломит.
В военном деле магний «освещает темные места». А проще, из него делают светозвуковые и светошумовые боеприпасы (патроны, гранаты, снаряды). До конца не убьет, но оглушит и дезориентирует.
Применяют в антитеррористических операциях, при освобождении заложников, разгоне противозаконных сборищ (при массовых беспорядках).
Зажигательные бомбы, трассирующие пули, ракеты сигнальные и осветительные — везде используется яркое горение металла.
Препараты магния необходимы в медицине. Недостаток макроэлемента губителен для сердечно-сосудистой системы. Ишемическая болезнь, артериальная гипертония, аритмии — каждая из этих болезней усугубляется дефицитом магния.
Недостаток нескольких граммов металла плохо отражается на наших нервах (депрессии, мигрени, головокружения, тревога, раздражительность).
Специалисты фирмы Тойота разработали аккумуляторную батарею (на основе серно-магниевых элементов). Показатели у аккумулятора завидные. Загвоздка в том, что в батарее происходит саморазряд (катод электрохимически восстанавливается, образуются полисульфидные анионы, переходящие в раствор). Пока эта проблема не будет решена, серно-магниевые аккумуляторы специалистам только снятся.
Магний металлический обладает сильными восстановительными свойствами. Его используют для получения бериллия, ванадия, хрома. Металл используют как лигатуру в сталях и чугуне.
Все шире применяют магнийорганические соединения в химическом синтезе галогенопроизводных, спиртов, углеводородов.
Где еще применяют соединения магния
Бесцветные кристаллы фторида магния используют в специальной оптике (вещество прозрачно в диапазонах от ультрафиолетового до инфракрасного.
Стеарат магния — пищевая добавка Е470. Используют в косметической, пищевой промышленности, в фармации.
Магниевые сплавы применяют в изготовлении отбойных молотков, в атомной и нефтяной промышленности.
Стоимость огненного металла
Цена первичного магния (МГ90):
- 3980 USD;
- 199000 (рублей).
Лом металла и магнийсодержащих элементов будет стоить от 35 до 50 рублей за килограмм.
Магний
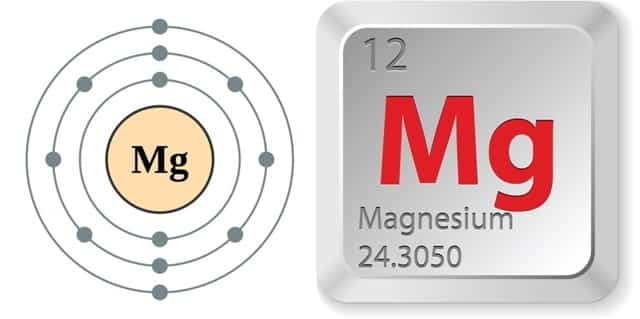
Магний — элемент второй группы (по старой классификации — главной подгруппы второй группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний — лёгкий, ковкий металл серебристо-белого цвета.
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари назвали её «горькой солью», а также «английской» или «эпсомской солью».
Минерал эпсомит представляет собой кристаллогидрат сульфата магния и имеет химическую формулу MgSO4 · 7H2O.
Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
В 1792 году Антон фон Рупрехт выделил из белой магнезии восстановлением углём неизвестный металл, названный им австрием. Позже было установлено, что «австрий» представляет собой магний крайне низкой степени чистоты, поскольку исходное вещество было сильно загрязнено железом.
В 1808 г. английский химик Гемфри Дэви с помощью электролиза увлажнённой смеси магнезии и оксида ртути получил амальгаму неизвестного металла, которому дал название «магнезиум», сохранившееся до сих пор во многих странах.
В России с 1831 года принято название «магний». В 1829 г. французский химик А. Бюсси получил магний, восстанавливая его расплавленный хлорид металлическим калием. В 1830 г. М.
Фарадей получил магний электролизом расплавленного хлорида магния.
Изотопы
- Основная статья: Изотопы магния
- Природный магний состоит из смеси 3 стабильных изотопов 24Mg, 25Mg и 26Mg с молярной концентрацией в смеси 78,6 %, 10,1 % и 11,3 % соответственно.
- Все остальные 19 изотопов нестабильны, самый долгоживущий из них 28Mg с периодом полураспада 20,915 часов.
Нахождение в природе
Кларк магния — 1,95 % (19,5 кг/т). Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде в виде раствора солей. Основные минералы с высоким массовым содержанием магния:
- морская вода — (0,12—0,13 %),
- карналлит — MgCl2 • KCl • 6H2O (8,7 %),
- бишофит — MgCl2 • 6H2O (11,9 %),
- кизерит — MgSO4 • H2O (17,6 %),
- эпсомит — MgSO4 • 7H2O (9,9 %),
- каинит — KCl • MgSO4 • 3H2O (9,8 %),
- магнезит — MgCO3 (28,7 %),
- доломит — CaCO3·MgCO3 (13,1 %),
- брусит — Mg(OH)2 (41,6 %).
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения карналлита осадочного происхождения имеются во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относящихся к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны.
Они генетически связаны с карбонатными осадочными слоями и большинство из них имеет докембрийский или пермский геологический возраст.
Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
Чрезвычайно редким минералом является самородный магний, образующийся в потоках восстановительных газов и впервые обнаруженный в 1991 году в береговых отложениях Чоны (Восточная Сибирь), а затем в лавах в Южном Гиссаре (Таджикистан).
Природные источники магния
- Ископаемые минеральные отложения (магнезиальные и калийно-магнезиальные карбонаты: доломит, магнезит).
- Морская вода.
- Рассолы (рапа соляных озёр).
В 1995 г. бо́льшая часть мирового производства магния была сосредоточена в США (43 %), странах СНГ (26 %) и Норвегии (17 %), на рынке возрастает доля Китая.
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
MgCl2 → Mg + Cl2
Расплавленный металл периодически отбирают из электролизной ванны, а в неё добавляют новые порции магнийсодержащего сырья.
Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке.
С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые удаляют примеси из магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
MgO + C → Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции, вначале производят обжиг доломита:
CaCO3 ⋅ MgCO3 → CaO + MgO + 2CO2
Затем сильный нагрев с кремнием:
2MgO + CaO + Si → CaSiO3 + 2Mg
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Физические свойства
Магний — металл серебристо-белого цвета с гексагональной решёткой, обладает металлическим блеском; пространственная группа P 63/mmc, параметры решётки a = 0,32029 нм, c = 0,52000 нм, Z = 2.
При обычных условиях поверхность магния покрыта довольно прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2.
Скорость воспламенения магния намного выше скорости одёргивания руки, поэтому при поджоге магния человек не успевает одёрнуть руку и получает ожог.
На горящий магний желательно смотреть только через темные очки или стекло, так как в противном случае есть риск получить световой ожог сетчатки и на время ослепнуть.
Плотность магния при 20 °C — 1,738 г/см³, температура плавления 650 °C, температура кипения 1090 °C, теплопроводность при 20 °C — 156 Вт/(м·К).
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
При температуре Тс= 0,0005 К магний (Mg) переходит в сверхпроводящее состояние.
Химические свойства
При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и света:
2Mg + O2 → 2MgO + 1203 кДж 3Mg + N2 → Mg3N2
Магний хорошо горит даже в углекислом газе:
2Mg + CO2 → 2MgO + C
Раскаленный магний энергично реагирует с водой, вследствие чего горящий магний нельзя тушить водой:
Mg + H2O → MgO + H2 + 75 kcal
Возможна также реакция:
Mg + 2H2O → Mg(OH)2 + H2↑ + 80,52 kcal
Щелочи на магний не действуют, в кислотах он растворяется с бурным выделением водорода:
Mg + 2HCl → MgCl2 + H2↑
Смесь порошка магния со взрывом реагирует с сильными окислителями, например с сухим перманганатом калия.
Также следует упомянуть реактивы Гриньяра, то есть алкил- или арилмагнийгалогениды:
RHal + Mg →(C2H5)2O RMgHal
Где Hal = I, Br, реже Cl.
Металлический магний — сильный восстановитель, применяется в промышленности для восстановления титана до металла из тетрахлорида титана и металлического урана из его тетрафторида
TiCl4 + 2Mg → Ti + 2MgCl2 UF4 + 2Mg → U + 2MgF2
Применение
Используется для получения лёгких и сверхлёгких литейных сплавов (самолётостроение, производство автомобилей), а также в пиротехнике и военном деле для изготовления осветительных и зажигательных ракет.
Со второй половины XX века магний в чистом виде и в составе сплава кремния с железом — ферросиликомагния, стал широко применяться в чугунолитейном производстве благодаря открытию его свойства влиять на форму графита в чугуне, что позволило создать новые уникальные конструкционные материалы для машиностроения — высокопрочный чугун (чугун с шаровидным графитом — ЧШГ и чугун с вермикулярной формой графита — ЧВГ), сочетающие в себе свойства чугуна и стали.
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в космической, авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Из магниевого сплава изготавливались картеры двигателей бензопилы «Дружба» и автомобиля «Запорожец», ряда других машин. Сейчас из этого сплава производятся легкосплавные колёсные диски.
Магний в виде чистого металла, а также его химические соединения (бромид, перхлорат) применяются для производства энергоёмких резервных электрических батарей (например, магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др.) и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др.). Химические источники тока на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высокой ЭДС.
Соединения
Гидрид магния — один из наиболее ёмких аккумуляторов водорода, применяемых для его компактного хранения и получения.
Огнеупорные материалы
- Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
- Перхлорат магния, Mg(ClO 4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с применением магния.
- Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
- Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Военное дело
Свойство магния гореть белым ослепительным пламенем широко используется в военной технике для изготовления осветительных и сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб. В смеси с соответствующими окислителями он также является основным компонентом заряда светошумовых боеприпасов.
Медицина
Магний является жизненно-важным элементом, который находится во всех тканях организма и необходим для нормального функционирования клеток.
Участвует в большинстве реакций обмена веществ, в регуляции передачи нервных импульсов и в сокращении мышц, оказывает спазмолитическое и антиагрегантное действие.
Оксид и соли магния традиционно применяются в медицине в кардиологии, неврологии и гастроэнтерологии (аспаркам, сульфат магния, цитрат магния). В то же время, использование солей магния в кардиологии при нормальном уровне ионов магния в крови является недостаточно обоснованным.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Аккумуляторы
Магниево-серные батареи являются одними из самых перспективных, теоретически превосходя ёмкость ионно-литиевых, однако пока эта технология находится на стадии лабораторных исследований в силу непреодолимости некоторых технических препятствий.
Производство
Производство в России сосредоточено на двух предприятиях: г. Соликамск (СМЗ) и г. Березники (АВИСМА). Общая производительность составляет, примерно, 35 тыс. тонн в год.
| — | Весь мир | 6,970 |
| 1 | Китай | 4,900 |
| 2 | Россия | 400 |
| 3 | Турция | 300 |
| 4 | Испания | 280 |
| 5 | Австрия | 200 |
| 6 | Словакия | 200 |
| 7 | Бразилия | 150 |
| 8 | Австралия | 130 |
| 9 | Греция | 115 |
| 10 | КНДР | 80 |
| 11 | Индия | 60 |
| — | Другие страны | 150 |
Цены
Цены на магний в слитках в 2006 году составили в среднем 3 долл./кг. В 2012 году цены на магний составляли порядка 2,8—2,9 долл./кг.
Биологическая роль и токсикология
Токсикология
Соединения магния малотоксичны (за исключением солей таких ядовитых кислот, как синильная, азотистоводородная, плавиковая, хромовая).
Биологическая роль
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений (хлорофиллы). Его биологическая роль сформировалась исторически в период зарождения и развития протожизни на нашей планете в связи с тем, что солевой состав морской воды древней Земли был преимущественно хлоридно-магниевый, в отличие от нынешнего — хлоридно-натриевого.
Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатинфосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Магний необходим на всех этапах синтеза белка.
Он участвует в поддержании нормальной функции нервной системы и мышцы сердца, оказывает сосудорасширяющее действие, стимулирует желчеотделение, повышает двигательную активность кишечника, что способствует выведению из организма холестерина.
Усвоению магния мешают наличие фитина и избыток жиров и кальция в пище.
Недостаток магния в организме может проявляться по-разному: бессонница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС).
При потливости, частом употреблении слабительных и мочегонных, алкоголя, больших психических и физических нагрузках (в первую очередь при стрессах и у спортсменов) потребность в магнии увеличивается.
Более всего магния содержится в пшеничных отрубях, тыквенных семечках, какао-порошке. К пище, богатой магнием относят также кунжут, отруби, орехи.
Однако обилие фитина в этих продуктах делает его малодоступным для усвоения, поэтому только зелёные овощи могут служить надёжным источником магния. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека.
Суточная норма магния — порядка 300 мг для женщин и 400 мг для мужчин (предполагается, что всасывается около 30 % магния).
При употреблении витаминно-минеральных комплексов, содержащих магний, необходимо помнить, что при чрезмерном его потреблении возможна передозировка, сопровождающаяся снижением артериального давления, тошнотой, рвотой, угнетением центральной нервной системы, снижением рефлексов, изменениями на электрокардиограмме, угнетением дыхания, комой, остановкой сердца, параличом дыхания, анурическим синдромом.
Также следует соблюдать осторожность при приеме магния людям с почечной недостаточностью.
Таблица нормы потребления магния
| от 0 до 6 месяцев | 30 | Не определён |
| от 7 до 12 месяцев | 75 | Не определён |
| от 1 до 3 лет | 80 | 145 |
| от 4 до 8 лет | 130 | 240 |
| от 9 до 13 лет | 240 | 590 |
| от 14 до 18 лет | 360 | 710 |
| от 14 до 18 лет | 410 | 760 |
| от 19 до 30 лет | 400 | 750 |
| 31 год и старше | 420 | 770 |
| от 19 до 30 лет | 310 | 660 |
| 31 год и старше | 320 | 670 |
| от 14 до 18 лет | 400 | 750 |
| от 19 до 30 лет | 350 | 700 |
| 31 год и старше | 360 | 710 |
| от 14 до 18 лет | 360 | 710 |
| от 19 до 30 лет | 310 | 660 |
| 31 год и старше | 320 | 670 |