- Основы теории сплавов
- Металлические сплавы
- Что такое сплав понятным языком
- Что представляет из себя сплав
- Как получают сплав
- Физика процесса кристаллизации в сплаве
- Что такое твердый раствор
- Что такое химическое соединение
- Что такое механическая смесь
- Как получают сплавы
- Пару слов о том, от чего зависят свойства сплава
Металлы и их сплавы – основной материал в машиностроении.
Они обладают многими ценными свойствами, обусловленными в основном их внутренним строением. Мягкий и пластичный металл или сплав можно сделать твердым, хрупким, и наоборот. Для того чтобы сознательно изменять свойства металлов, необходимо знать основы их кристаллического строения.
Как известно, все тела состоят из большого количества атомов, которые удерживаются силами сцепления, совершая колебания большой частоты возле точек равновесия. Поскольку атомы разных металлов различны, каждый металл имеет свои определенные свойства. Эти свойства зависят от расположения атомов между собой, характера их связей, от расстояния между ними.
Если изменить расстояние между атомами или порядок их расположения, изменятся и свойства металла. В аморфных телах – смоле, стекле, канифоли и т. п. – атомы расположены беспорядочно. В металлах они находятся в определенном геометрическом порядке, образуя кристаллы, поэтому металлы являются кристаллическими телами.
Металлы различаются не только порядком расположения атомов, но и кристаллической решеткой, которая представляет собой воображаемую пространственную сетку, состоящую из элементарных ячеек, в узлах которой находятся атомы.
Различают следующие кристаллические решетки металлов с плотной упаковкой атомов: кубическую объемно—центрированную, кубическую гранецентрированную и гексагональную.
В ячейке кубической объемно—центрированной решетки атомы расположены в вершинах и центре куба.
Такая ячейка содержит девять атомов (хром, вольфрам, ванадий, молибден, литий, а при определенных температурах – железо и другие металлы).
В ячейке кубической гранецентрированной решетки атомы находятся в вершинах куба и на пересечении диагоналей каждой плоскости. Такая ячейка имеет 14 атомов (свинец, никель, медь, золото, серебро, пластина, железо при определенных температурах и другие металлы).
В ячейке гексагональной кристаллической решетки атомы располагаются в вершинах и в центре шестигранных оснований призмы, а три атома – в средней ее плоскости, при этом такая ячейка содержит 17 атомов (магний, цинк, кадмий, осмий, бериллий и другие металлы).
При определенных условиях некоторые металлы – железо, титан, цирконий, стронций, кобальт, кальций и другие могут перестраиваться из одного вида кристаллической решетки в другой, например из кубической объемно—центрированной – в гранецентрированную и даже гексагональную. Элементарная ячейка отображает только один элемент, или одну ячейку, кристаллической решетки.
Вся кристаллическая решетка в реальном металле состоит из большого числа многократно повторяющихся элементарных ячеек.
Большое значение имеет расстояние между атомами ячейки кристаллической решетки или между параллельными атомными плоскостями, образующими элементарную ячейку. Чем больше это расстояние, тем менее прочен металл.
Расстояние между ними измеряется в ангстремах – 1 А = = 10 –8 см или в нанометрах – 1 А = 0,1 нм.
Из практики известно, что железо прочнее меди, а медь прочнее алюминия.
Порядок расположения атомов – тип кристаллической решетки – природное свойство металла, форма кристаллов и их размеры зависят от процесса перехода металла из жидкого состояния в твердое.
Процесс образования кристаллов при затвердевании металлов называется кристаллизацией. При кристаллизации металлов выделяется тепло, а при переходе металлов из твердого состояния в жидкое происходит поглощение тепла.
Наблюдения с помощью измеряющих температуру проборов за процессом понижения температуры
при переходе металла из жидкого состояния в твердое позволили установить определенную закономерность. Сначала температура понижается равномерно. В начальный период образования кристаллов вследствие выделения скрытой теплоты при формировании кристаллической решетки падение температуры прекращается, и она остается неизменной до полного затвердения металла.
После того как весь металл затвердеет, температура снова начинает понижаться. Температура, соответствующая горизонтальной площадке, называется критической. Кристаллизация металлов подобна кристаллизации солей, и этот процесс состоит из двух элементарных процессов, протекающих одновременно.
Первый заключается в образовании центров кристаллизации, или зародышей кристаллов, второй – в росте кристаллов из этих центров.
Первый этап – появление зародышей кристаллов металла.
Второй этап – по мере остывания металла к зародышам присоединяются все новые и новые атомы жидкого металла, которые группируются в определенном порядке один возле другого, образуя элементарные ячейки кристаллической решетки.
Этот процесс продолжается до тех пор, пока не закончится кристаллизация. Причем кристаллы затвердевшего металла имеют неправильную и весьма разнообразную форму, что объясняется условиями кристаллизации.
В процессе кристаллизации увеличивается количество кристаллов – в 1 мм 3 может образоваться свыше 1000 кристаллов. Кристаллы, имеющие неправильную внешнюю форму, называются кристаллитами, или зернами.
Чистые металлы относительно редко применяются в машиностроении и других отраслях хозяйственного комплекса. Более широко используются сплавы, состоящие из двух и более элементов (из двух металлов, например меди и цинка, или из металла и неметалла, например железа и углерода).
Элементы, входящие в сплав, называются компонентами. В зависимости от расположения атомов в кристаллической решетке различают твердые растворы замещения и твердые растворы внедрения.
В твердом растворе замещения атомы растворимого компонента замещаются атомами растворителя, а в твердом растворе внедрения атомы растворителя размещаются между атомами растворимого компонента в наиболее слабых местах элементов кристаллической решетки.
Сплавы, представляющие собой твердые растворы, отличаются ценными свойствами. Они тверже и прочнее, чем входящие в него компоненты.
Компоненты некоторых сплавов при кристаллизации могут входить в химическую связь, образуя химическое соединение. Химические соединения обладают очень высокой твердостью и хорошим электросопротивлением.
Под диффузией понимают перемещение атомов в кристаллическом теле на расстояния, превышающие средние межатомные расстояния данного металла. Если перемещения атомов не связаны с изменением концентрации в отдельных объемах, то такой процесс называется самодиффузией.
Диффузия, сопровождающаяся изменением концентрации, называется гетеродиффузией. В тех случаях, когда гетеродиффу—зия сопровождается образованием новых фаз, что наиболее часто имеет место при химико—технической обработке, она называется реактивной диффузией.
В основе процесса диффузии лежит атомный механизм, при котором каждый атом совершает более или менее случайные блуждания. Диффузионные превращения в металлах происходят при различных химико—термических обработках – хромировании, цементации, алютировании (алюминирование) и т. д.
Хромирование обеспечивает повышенную жаростойкость стали до 800 °C, высокую коррозионную стойкость в таких средах, как пресная и морская вода, уксусная и фосфорная кислоты, и эрозионную стойкость при низкой и высокой температурах.
Хромирование сталей, содержащих более 0,3–0,4 % углерода, повышает также твердость и износостойкость. При хромировании диффузионный слой состоит из раствора хрома в? – железе, а содержание хрома на поверхности составляет 25–50 %.
При этом процессе в случае применения CrCl 2 протекает следующая реакция:
CrCl 2 + Fe > FeCl 2 + Cr.
При термической обработке стали наблюдаются бездиффузные, или аллотропические, превращения в процессе вторичной кристаллизации. В частности, при температуре +775 °C в стали, содержащей 0,6 % углерода, начинаются аллотропические превращения, т. е. выделение феррита из аустенита (твердого раствора углерода (до 2,14 %)) и других примесей в объеме железа.
Феррит – твердый раствор небольшого количества углерода (до 0,04 %) и других примесей в? – железе – мягкая, пластичная и недостаточно прочная структурная составляющая.
Так как в феррите содержится ничтожное количество углерода, оставшийся аустенит будет постепенно, по мере выделения феррита, обогащаться углеродом.
Когда концентрация углерода в оставшемся аустените достигнет 0,8 %, при температуре +727 °C сталь, содержащая 0,6 % углерода, будет иметь в своем составе феррит и аустенит, а при температурах ниже +727 °C – феррит и перлит, причем структура феррит – перлит сохранится без значительных изменений и при дальнейшем охлаждении стали вплоть до комнатной температуры. Аналогичные превращения характерны для всех доэвтек—тоидных сталей (содержащих менее 0,8 % углерода). Разница будет лишь в температурах начала выделения феррита. Причем, если сталь содержит 0,8 % углерода, ее вторичная кристаллизация будет протекать при постоянной температуре (+727 °C) и сопровождаться только одним процессом – образованием перлита. Это объясняется тем, что в данном случае содержание углерода в стали соответствует эвтектоидному составу – механической смеси кристаллов, выделяющихся из жидкого сплава одновременно. При этом создается мелкозернистая структура сплава.
Сталь и чугун – основные материалы в машиностроении. Они составляют 95 % всех используемых в технике сплавов.
Сталь – это сплав железа с углеродом и другими элементами, содержащий до 2,14 % углерода. Углерод – важнейшая примесь стали. От его содержания зависят прочность, твердость и пластичность стали. Кроме железа и углерода, в состав стали входят кремний, марганец, сера и фосфор. Эти примеси попадают в сталь в процессе выплавки и являются ее неизбежными спутниками.
Чугун – сплав на железной основе. Отличие чугуна от стали заключается в более высоком содержании в нем углерода – более 2,14 %. Наибольшее распространение получили чугуны, содержащие 3–3,5 % углерода. В состав чугунов входят те же примеси, что и в стали, т. е. кремний, марганец, сера и фосфор.
Чугуны, у которых весь углерод находится в химическом соединении с железом, называют белыми (по виду излома), а чугуны, весь углерод которых или большая его часть представляет графит, получили название серых. В белых чугунах всегда имеется еще одна структурная составляющая – ледебурит. Это эвтектика, т. е.
равномерная механическая смесь зерен аустенита и цементита, получающаяся в процессе кристаллизации, в ней 4,3 % углерода. Ледебурит образуется при температуре +1147 °C.
Феррит – твердый раствор небольшого количества углерода (до 0,04 %) и других примесей в? – железе. Практически это чистое железо. Цементит – химическое соединение железа с углеродом – карбид железа.
Перлит – равномерная механическая смесь в сплаве феррита и цементита. Такое название эта смесь получила потому, что шлиф при ее травлении имеет перламутровый оттенок. Так как перлит образуется в результате процессов вторичной кристаллизации, его называют эвтектоидом. Он образуется при температуре +727 °C. В нем содержится 0,8 % углерода.
Перлит имеет две разновидности. Если цементит в нем расположен в виде пластинок, его называют пластинчатым, если же цементит расположен в виде зерен, перлит называют зернистым. Под микроскопом пластинки цементита кажутся блестящими, потому что обладают большой твердостью, хорошо полируются и при травлении кислотами разъедаются меньше, чем пластинки мягкого феррита.
Если железоуглеродистые сплавы нагреть до определенных температур, произойдет аллотропическое превращение ? —железа в ? —железо и образуется структурная составляющая, которая называется аустенитом.
Аустенит представляет собой твердый раствор углерода (до 2,14 %) и других примесей в ? —железе. Способность углерода
растворяться в железе неодинакова при различных температурах. При температуре +727 °C ? —железо может растворять не более 0,8 % углерода. При этой же температуре происходит распад аустенита с образованием перлита. Аустенит – мягкая структурная составляющая. Он отличается большой пластичностью, не обладает магнитными свойствами.
При изучении структурных составляющих железоуглеродистых сплавов установлено, что они при комнатной температуре всегда состоят из двух структурных элементов: мягкого пластичного феррита и твердого цементита, упрочняющего сплав.
Сплавы можно получать при соединении большинства металлов друг с другом, а также с неметаллами. Диаграммы состояния сплавов дают наглядное представление о протекающих в сплавах превращениях в зависимости от их химического состава и температуры.
При построении диаграмм состояния сплавов на оси абсцисс указывают химический состав или концентрацию сплава в процентах. Для этого горизонтальную линию определенной длины делят на сто одинаковых частей и каждое деление принимают за 1 % одного из компонентов сплава.
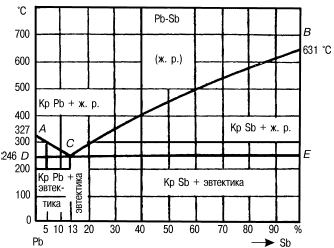
Рис. 5. Диаграмма состояния сплавов системы свинец—сурьма (Pb—Sb)
Точка А соответствует чистому свинцу, а точка В – чистой сурьме. По оси ординат в определенном масштабе указывают температуру. Для того чтобы построить диаграмму состояния сплавов, сначала строят ряд кривых охлаждения сплавов одних и тех же элементов с различной концентрацией.
На основе этих кривых строят диаграмму. Сплавы, компоненты которых при затвердевании образуют только механические смеси, относятся к первой группе.
Диаграмма этих сплавов условно называется диаграммой состояния первого рода. Диаграмма сплавов, образующих при затвердевании только твердые растворы, называется диаграммой состояния второго рода.
Наиболее типичными для диаграмм первого рода являются сплавы свинца с сурьмой.
- Построение диаграммы (первого рода) состояния сплавов Pb—Sb:
- 1) кривые охлаждения доэвтектических сплавов;
- 2) диаграмма состояния сплавов Pb—Sb;
- 3) кривые охлаждения заэвтектических сплавов. Диаграмма построена для пяти видов сплава свинца с сурьмой:
- 1) 5 % сурьмы и 95 % свинца;
- 2) 10 % сурьмы и 90 % свинца;
- 3) 20 % сурьмы и 80 % свинца;
- 4) 40 % сурьмы и 60 % свинца;
- 5) 80 % сурьмы и 20 % свинца.
Все они имеют две критические температуры: верхнюю и нижнюю.
Изучение процессов кристаллизации этих сплавов показывает, что верхняя критическая температура соответствует началу, а нижняя – концу затвердевания сплава.
Таким образом, процесс кристаллизации сплавов Pb—Sb резко отличается от кристаллизации чистых металлов. Сплавы кристаллизуются в интервале температур, а чистые металлы – при постоянной температуре.
Механическая смесь кристаллов, выделяющихся из жидкого сплава одновременно, называется эвтектикой (в переводе с греческого – «хорошо сложенный»). Сплавы указанной концентрации называют эвтектическими.
Линия АСВ на диаграмме называется линией ликвидуса (в переводе с греческого – «жидкий»). Выше этой линии любой сплав свинца с сурьмой находится в жидком состоянии.
Линия ДСВЕ получила название линии солидуса (в переводе с греческого – «твердый»), или эвтектической линии. Точка С показывает состав эвтектики. Сплавы, расположенные левее этой точки, называют доэвтектическими, правее ее – заэвтектическими.
В структуре доэвтектических сплавов, кроме эвтектики, всегда есть некоторое количество свинца, а в заэвтектических, кроме эвтектики, – сурьмы.
Основы теории сплавов
Чистые металлы находят довольно ограниченное применение в качестве конструкционных материалов. Основными конструкционными материалами являются сплавы. Они обладают более ценными комплексами механических, физических и технологических свойств, чем чистые металлы.
Сплавом называют вещество, полученное сплавлением двух или более элементов (компонентов).
Сплав, приготовленный преимущественно из металлических элементов и обладающий металлическими свойствами, называют металлическим сплавом. Металлические сплавы можно также получать методами порошковой металлургии (спеканием), диффузией, осаждением нескольких элементов на катоде при электролизе водных растворов.
К основным понятиям в теории сплавов относятся система, компонент, фаза.
Система — группа тел, выделяемых для наблюдений и изучения. В металловедении системами являются металлы и металлические сплавы.
Компонентами называют вещества, образующие систему, взятые в наименьшем количестве. В металлических сплавах компонентами могут быть элементы (металлы и неметаллы) и химические соединения (не диссоциирующие при нагревании). Чистые компоненты обозначаются прописными буквами латинского алфавита А, В, С, Д.
- Фазой называется однородная часть системы, отделенная от другой части системы поверхностью раздела, при переходе через которую состав, строение и свойства изменяются скачком.
- Сплавы могут быть однофазными, двухфазными, трехфазными.
- В зависимости от физико-химического взаимодействия компонентов могут образовываться следующие фазы: жидкие растворы, твердые растворы и химические соединения.
Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. В результате образуется однородный жидкий раствор с равномерным распределением атомов одного металла среди атомов другого металла.
- Твердые растворы — это фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других (или другого) компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры.
- Таким образом, твердый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу.
- В зависимости от характера распределения атомов элемента различают твердые растворы внедрения, замещения и вычитания.
В твердых растворах внедрения атомы растворимого элемента распределяются в кристаллической решетке металла-растворителя, занимая места между его атомами. Разместиться в таких пустотах могут только атомы с очень малыми размерами. Наименьшие размеры атомов имеют некоторые металлоиды и водород, азот, углерод, бор, которые и образуют с металлами твердые растворы внедрения.
В твердых растворах замещения атомы растворимого элемента занимают места атомов основного металла. Посторонние атомы могут замещать атомы растворителя в любых местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
Твердые растворы замещения могут быть ограниченной и неограниченной растворимости. Так, в алюминии может растворяться до 5,5 % меди, в меди — до 39% цинка. Неограниченной растворимостью обладают, например, компоненты систем: Сu-Ni, Cu-Au, Ag-Au, Cu-Pt, Fe-Cr, Fe-Ni.
Для образования твердых растворов неограниченной растворимости должны выполняться следующие условия: компоненты должны иметь одинаковые по типу кристаллические решетки; различие в атомных размерах компонентов должно быть незначительным и не превышать 8…15 % (например, Аg и Cu — DR = 0,2%, Сu и Ni — DR = 2,7 %); компоненты должны принадлежать к одной и той же группе периодичной системы или смежной родственной группе и иметь в атомах близкое строение валентной оболочки электронов.
В некоторых сплавах с понижением температуры в твердых растворах замещения может произойти процесс перераспределения атомов, в результате которого атомы растворенного элемента займут строго определенные места в решетке растворителя. Такие твердые растворы называют упорядоченными, а их структуру — сверхструктурой.
Температуру перехода в упорядоченное состояние называют ”точкой Курнакова”. Полностью упорядоченные растворы образуются, когда отношение компонентов в сплаве равно целому числу: 1:1, 1:2, 1:3 и т.д. В этом случае сплаву можно приписать формулу химического соединения, например, CuAu, Cu3Au.
Их можно рассматривать как промежуточные фазы между твердыми растворами и химическими соединениями. В отличие от химического соединения сохраняется решетка растворителя, и при нагреве выше точки Курнакова степень упорядочения постепенно уменьшается и они становятся неупорядоченными.
Упорядоченные твердые растворы характеризуются большей твердостью, прочностью, меньшей пластичностью и электросопротивлением.
Твердые растворы вычитания образуются на основе некоторых химических соединений, когда к этому химическому соединению добавляется один из входящих в его формулу элементов.
Атомы этого элемента занимают нормальные положения в решетке соединения, а места, где должны были бы находиться атомы второго компонента, оказываются незаполненными, пустыми.
Такие твердые растворы образуются, например, при сплавлении химического соединения NiAl с Аl, карбида титана ТiС с Тi, когда FeО растворяет кислород.
Твердые растворы принято обозначать строчными буквами греческого алфавита a, b, g, d.
Химические соединения и родственные им по природе фазы в металлических сплавах многообразны. Они обычно образуются элементами, имеющими большое различие в электронном строении атомов и кристаллических решетках.
Характерные особенности химических соединений:
- кристаллическая решетка отличается от решеток компонентов, образующих соединение;
- сохраняется простое кратное соотношение компонентов в виде АnВm;
- свойства соединения резко отличаются от свойств образующих его компонентов;
- температура плавления (диссоциации) постоянная.
Образование химического соединения сопровождается значительным тепловым эффектом.
Соединения одних металлов с другими называются интерметаллидами. Связь между атомами в интерметаллидах чаще металлическая. Примером являются соединения Мg2Sn, Мg2Pb.
При образовании химического соединения металла с неметаллом возникает ионная связь, например, в соединении NaCl.
Переходные металлы (Fe, Mn, Cr, Mo, W, V и др.) образуют с углеродом карбиды, с азотом нитриды, с бором бориды, с водородом гидриды (железо гидридов не образует) Они имеют общность строения и свойств и называются фазами внедрения. Они имеют формулы: МХ (WC, VC, TiC, NbC, TiN, VN, и др.); М2Х (W2C, Mo2C, Fe2N и др.); М4 Х (Fe4N, Mn4N и др.).
Кристаллическая структура фаз внедрения определяется соотношением атомных радиусов неметалла (Rx) и металла (Rм). Если Rx/Rм < 0,59, то атомы металла в этих фазах расположены по типу одной из простых кристаллических решеток: кубической (К8, К12) или гексагональной (Г12), в которую внедряются атомы неметалла, занимая в ней определенные поры.
- Если это условие не выполняется, как это наблюдается для карбида железа, марганца и хрома, то образуются соединения с более сложными решетками, и такие соединения нельзя считать фазами внедрения.
- Многие фазы внедрения обладают высокой прочностью, твердостью и их часто применяют в сталях для получения повышенной прочности (стали с дисперсионным упрочнением).
- Кроме того, к химическим соединениям относятся электронные соединения и фазы Лавеса (АВ2),например, MgZn2, MgCu2, CaAl2.
Электронные соединения чаще образуются между одновалентными (Сu, Ag, Au, Li, Na) металлами или металлами переходных групп (Fe, Mn, Co и др.) с одной стороны и простыми с валентностью от 2 до 5 (Вe, Mg, Zn, Cd, Al и др.).
Металлические сплавы
Металлическими сплавами называют сложные по составу вещества, образовавшиеся в результате взаимодействия двух или нескольких металлов либо металлов с некоторыми неметаллами. Химические элементы или их устойчивые соединения, входящие в
сплав, принято называть компонентами. Сплавы могут состоять из двух, трех и более компонентов.
Компонент, преобладающий в сплаве количественно, называется основным. Компоненты, вводимые в сплав для придания ему нужных свойств, называются легирующими. Совокупность компонентов сплава называется системой.
Сплавы классифицируют по числу компонентов — на двойные (бинарные), тройные, четвертные и многокомпонентные; по основному элементу — железные, алюминиевые, магниевые, титановые, медные и т.д.; по применению — конструкционные, инструментальные, жаропрочные, антифрикционные, пружинные, шарикоподшипниковые и т.д.
; по плотности — тяжелые (на основе вольфрама, рения, свинца и др.), легкие (алюминиевые, магниевые, берил- лиевые и др.); по температуре плавления — тугоплавкие (сплавы на основе ниобия, молибдена, тантала, вольфрама и др.), легкоплавкие (припои, баббиты, типографские сплавы и т.д.
); по технологии изготовления полуфабрикатов и изделий — литейные, деформируемые, спеченные, гранулированные, композиционные и т.д.
Способность различных металлов образовывать сплавы далеко не одинакова; структура сплавов после их затвердения также может быть самой разнообразной.
Металлические сплавы в жидком состоянии, как правило, однородны и представляют одну фазу.
Фазой называют однородную часть неоднородной системы, отделенную от других ее частей поверхностями раздела. При переходе сплавов из жидкого состояния в твердое в них может образоваться несколько фаз.
После затвердевания в зависимости от природы компонентов сплавы могут состоять из одной, двух и более твердых фаз.
Возможно образование твердых растворов, химических соединений и механических смесей, состоящих из двух или нескольких фаз.
Твердыми растворами называют сплавы (из двух или более компонентов), в которых атомы растворимого компонента располагаются в кристаллической решетке компонента растворителя.
При образовании твердого раствора растворителем называют тот металл, кристаллическая решетка которого сохраняется как основа.
Если оба металла обладают одинаковыми по типу кристаллическими решетками и вследствие этого неограниченной взаимной растворимостью в твердом состоянии (образуют непрерывный ряд твердых растворов), то растворителем является тот из них, концентрация которого в сплаве превышает 50% (атомных).
Для образования непрерывного ряда твердых растворов необходимы одинаковый тип кристаллических решеток компонентов и небольшая разность периодов кристаллических решеток.
Твердый раствор замещения образуется путем замены части атомов растворителя в его кристаллической решетке атомами растворяемого компонента (рис. 1.6, а). Эти растворы могут быть ограниченными и неограниченными.
В твердых растворах могут происходить диффузионные переходы компонентов из мест с большей их концентрацией в места с меньшей концентрацией до тех пор, пока концентрация не станет одинаковой во всем объеме. Однако диффузия в твердых растворах протекает значительно медленнее, чем в жидких, и скорость ее уменьшается с понижением температуры.
Различают три типа твердых растворов: замещения, внедрения и вычитания. Рассмотрим только первые два типа твердых растворов, так как твердые растворы вычитания встречаются сравнительно редко.
Рис. 1.6. Схема образования твердых растворов: о — атом основного металла (растворителя); • — атом растворенного металла
Обычно компоненты, у которых атомные периоды решетки отличаются не более чем на 8%, образуют неограниченный ряд твердых растворов замещения; на 8—15% — твердые растворы замещения с ограниченной взаимной растворимостью; более чем на 15% — не образуют твердых растворов[1].
Твердые растворы внедрения образуются путем размещения атомов растворенного компонента в свободных промежутках между атомами кристаллической решетки растворителя (рис. 1.6, б).
Химические соединения образуются при строго определенном количественном соотношении компонентов сплава и характеризуются кристаллической решеткой, отличающейся от решеток исходных компонентов. Химические соединения, как правило, обладают характерными физико-механическими свойствами: высокой твердостью, повышенной хрупкостью, высоким электросопротивлением.
Химические соединения в сплавах образуются между металлами (интерметаллические соединения), а также между металлами и неметаллами. Некоторые соединения металлов с неметаллами (карбиды, нитриды, оксиды, фосфиды и др.) получили в технике самостоятельное применение.
Механические смеси формируются при одновременном выпадении из жидкого расплава при его охлаждении кристаллов составляющих его компонентов (эвтектические смеси). В кристаллах, которые входят в состав механической смеси, сохраняется кристаллическая решетка исходных компонентов сплава. Механические смеси могут состоять из чистых компонентов, твердых растворов, химических соединений и т.д.
Правило фаз (закон Гиббса) устанавливает количественную зависимость между числом степеней свободы, числом фаз и числом компонентов. Под числом степеней свободы системы понимают число независимых внешних (температура, давление) и внутренних (концентрация) переменных, которые можно произвольно менять без изменения числа фаз в системе.
Для металлических сплавов, находящихся под постоянным давлением, переменными величинами являются температура и концентрация. В этом случае правило фаз принимает следующий вид:
где С— число степеней свободы; К— число компонентов системы;
Ф — число фаз.
При кристаллизации чистого металла система состоит из одного компонента (К= 1), твердой и жидкой фаз (Ф = 2). При неизменном давлении такая система нонвариантна (число степеней свободы равно нулю) и в ней нельзя произвольно изменять температуру, не изменяя числа фаз.
Для чистого расплавленного металла (К = 1, Ф= 1, С= 1) система одновариантна, т.е. при изменении температуры равновесие системы не нарушится.
Что такое сплав понятным языком
Сплавы металлов встречаются нам повсеместно, даже в условиях внедрения пластиков и прочих инновационных заменителей. В этом материале попробуем разобраться, что такое сплав и как всё это себе представить для понимания физики процесса.
Металлы в чистом виде используются крайне редко. Обычно металл обладает худшими значениями свойств (чаще механических свойств), по сравнению со сплавами. Правда говорить о том, что чистые металлы не используют — это совсем неправильно. В некоторых случаях нужен именно чистый материал, например для достижения нужных показателей электропроводности.
Давным-давно было случайно обнаружено, что если при переплавке меди добавить к ней ещё и олово, то получаемый состав (или сплав) имеет гораздо более высокие прочностные свойства. История не уточняет, кто именно и когда первый придумал использовать этот новый материал, который, по своей сути, является бронзой.
Сплав — это материал, образуемый объединением двух или более компонентов и обладающий рядом специфических свойств. Сплав может содержать как металлические (пример — дюраль Al + Cu), так и неметаллические компоненты (самый яркий пример — сталь Fe + C).
В основе создания логики сплавов лежит логика композитных материалов. Несколько материалов в группе работают порой лучше, чем один чистый. Но называть сплавы композитами неправильно.
Также важно отметить, что появились сплавы металлов гораздо раньше, чем первые композиты. Бронзы использовались ещё до нашей эры для самых различных целей.
Интересно знать, что инженеры-материаловеды часто разрабатывали сплав для решения какой-то определенной задачи. Формулировалось техническое задание и обозначались условия работы будущего изделия, а специалисты старались «выжать» максимум.
Сплавов существует огромное количество. Именно поэтому была разработана специальная классификация всех имеющихся сплавов. Не будем сейчас останавливаться на этом вопросе, а поговорим о физике самого сплава и его строении.
Что представляет из себя сплав
Нужно осознать процесс появления сплава на физическом уровне. Именно это даст глубокое понимание вопроса.
Представьте себе, что вы взяли две жидкости и слили друг с другом. Получили что-то. Это что-то и можно считать будущим сплавом. Это расплав двух (или более) компонентов. Два расплавленных компонента в одной емкости выглядят также. Ещё больше путаницы, верно? Пример демонстрирует хаос системы в расплавленном состоянии.
Пока в емкости две перемешанных жидкости, мы видим что-то такое в её структуре:
Рисунок 1
Если взять жидкость и какое-нибудь нерастворимое желе, мы получим совсем иной результат. Компоненты могут расслоиться. Условно это выглядит так.
Рисунок 2
В итоге компоненты всё же могут раствориться друг в друге (вернемся к рисунку 1), а могут и не растворится — выйдет смесь. Очевидно, что если такую структуру (рисунок 2) зафиксировать (или кристаллизовать), то получится черти что. Поэтому, для получения сплава нужно добиться определенного состояния расплава.
Всё сказанное справедливо и для расплава. Сплав — это система из двух (или более) компонентов. Значит для того, чтобы их объединить, нужно как-то смешать их друг с другом.
На практике мы имеем один компонент будущего сплава в виде металлического куска и другой кусок второго компонента в виде куска.
Как их объединить? Логично! Нужно их переплавить в одной бочке и перемешать для достижения структуры на рисунке 1. Но это ещё не значит получить готовый сплав.
Как получают сплав
Для получения сплава нужно описанный выше расплав охладить, чтобы произошла кристаллизация и выстроились новые кристаллические решетки.
Но система может вести себя по-разному.
Материалы могут образовать гомогенную (однородную) смесь или сохранять гетерогенность (разнородность). Могут оказаться и вовсе несмешиваемыми.
- Это справедливо как для их совместного расплавленного состояния, так и для уже застывшего кристаллизованного состояния.
- Каким образом определить, что будет с теми или иными компонентами, объединенными в единую систему при разных температурах и условиях?
- Тут нужны экспериментальные данные.
- Некоторые основные тенденции можно предсказать по химическому составу и типу решеток исходных компонентов, а некоторые только изучить и зафиксировать.
- Все знания об этом отражаются на так называемых диаграммах состояния — графиках, демонстрирующих характер взаимодействия компонентов при разных температурах и взаимных концентрациях.
На диаграмме можно увидеть образование неограниченной растворимости компонентов, механическую смесь или химическое соединение. Выбрали нужное соотношение и температуру, и вуа-ля, все сведения есть. Видим критические точки и фазовый состав. Это как график, только запутанный.
Есть и более сложные состояния, о которых мы в этом выпуске говорить не будем.
Физика процесса кристаллизации в сплаве
Мы переплавляем два компонента в одной емкости с целью изготовить металлический сплав. Погрузили туда компонент один и компонент два. Расплавили. Довели до жидкого состояния. Что такое жидкость с точки зрения физики?
- Это неупорядоченный набор частиц — атомы в хаотичном состоянии, находящиеся на определенном расстоянии друг от друга.
- Если в таком состоянии встретятся разные жидкости, то их атомы перемещаются в одну единую смесь (опять смотрим на рисунок 1 чуть выше).
- Пока оно остается жидким, всё просто и понятно.
- Теперь начнем охлаждать эту адовую смесь.
- Поидее, все вещества должны вернуться к своей конфигурации.
Но мы устроили дестрой и растопили все решетки твердых тел исходных компонентов, которые поместили в чашу для плавления. Получили рисунок 1. Теперь это каша.
При охлаждении такой каши каждое из веществ будет стараться проявить свои свойства.
Будет пытаться образоваться кристаллическая решетка каждого из компонентов.
Одна решетка начнет формироваться, а другая — ещё нет. Свободные частички в расплаве начнут взаимодействовать с уже сформированной структурой. Делать они могут это по-разному — куда-то приклеиться, где-то зафиксироваться.
Мы получим или растворимость одного в другом (так называемый твердый раствор), или механическую смесь, или химическое соединение одного компонента с другим.
Что такое твердый раствор
Название ужасное, но всё просто. Мы имеем факт пересечения одной кристаллической решетки компонента 1 с частицами от другой компонента 2.
В жидком состоянии всё растворилось и частицы компонентов перемешались друг с другом.
Когда система начнет остывать, постепенно начнут формироваться и новые решетки. Начнет формироваться решетка первого компонента, а частички второго компонента начнут занимать место в её узлах, как люди в автобусе. По принципу кто быстрее. На деле всё, конечно же, посложнее.
- Выходит, что атомы одного элемента залезут в решетку другого элемента и образуется новая решетка, содержащая как частицы одного компонента, так и другого.
- Таким образом, твердыми растворами называют сплавы, в которых атомы растворимого компонента располагаются в кристаллической решетке компонента растворителя.
- При этом возможны следующие варианты:
- твёрдые растворы внедрения
- замещения
- вычитания
Внедрение — это когда в имеющуюся решетку одного компонента проникла частица другого компонента. Между всеми частицами появилось взаимодействие и образовался новый материал с новыми свойствами.
Твёрдый раствор замещения образуется в том случае, когда частички при затвердевании обмениваются с частичками в других решетках своим местоположением.
Более редкий случай — твердый раствор вычитания. Когда частички ушли со своих позиций, а на смену им ничего не пришло и сохранилась вакантная позиция.
Что такое химическое соединение
Более интересный случай — образование химического соединения. Возможен этот случай при соблюдении стехиометрии. Или одного и второго компонентов в жидком виде было ровно столько, что они способны создать химическое соединение, или прореагировать. Помимо количества, конечно же, важна и способность к реакции.
Как это представить на практике?
Как смешивание двух вариантов раствора для желе в жидком виде. Смешали апельсиновую основу и яблочную основу, дали образоваться желе и получили новый вкус.
Образовалось новое стойкое вещество с определенными ярко выраженными свойства, если желаете.
В итоге получим новый материал, или новый сплав, содержащий (иногда) интерметаллиды, карбиды, нитриды и другие стойкие соединения.
Что такое механическая смесь
Это один из самых не очевидных вариантов. По логике такая штука должна развалиться на куски в руках или рассыпаться, как сахар после намокания.
Такая штука образуется, если компоненты не могут образовать твёрдый раствор (нет растворимости) и не могут стать совместным новым химическим соединением.
При охлаждении такого расплава выпадают кристаллы одного компонента и кристаллы второго компонента. Ключевое слово ОДНОВРЕМЕННО. Затем они слепляются в общую структуру, но чем-то общим не являются. Нет (как вариант) такой прочности, как у хим.соединения.
Казалось бы, схема никуда не годная и сравнивать свойства такого сплава со сплавом, имеющим химическое соединение, бесполезно. Но мы никогда не говорим слово «плохо». Мы всегда говорим подходит или нет.
Так, тот же чугун, имеющий в своей структуре чистый графит, имеет отличные антифрикционные свойства, смазывая сам себя графитом при истирании.
Как получают сплавы
Теперь остается ещё один вопрос.
Как можно получить сплав? Ну один способ мы уже рассмотрели. Нужно переплавить всё в одной емкости и получить новый сплав литейным способом. Сделать отливку, в процессе кристаллизации которой и образуется новый материал.
Но можно ещё использовать методы порошковой металлургии. Смешать порошки исходных компонентов друг с другом, спрессовать, а затем обработать высокой температурой. В процессе спекания образуется новый сплав.
Есть и другие более сложные и менее распространенные способы — например, осаждение из растворов или напыление. Так или иначе, каждый из способов должен обеспечивать обозначенный выше принцип — дать перемешаться компонентам как следует и образовать собственно то, что мы называем сплавом.
Пару слов о том, от чего зависят свойства сплава
Свойства готового сплава зависят не только от химического состава, но и от условий их получения. Например, однородность готового сплава зависит от скорости охлаждения застывающего расплава.
На этом, наверное всё.
Обязательно подпишитесь на наш канал, чтобы не пропустить новые интересные статьи!






