- Классификация аминов
- Номенклатура и изомерия аминов
- Получение
- Химические свойства аминов
- АМИНЫ
- Номенклатура аминов
- Физические свойства аминов
- Химические свойства аминов
- Получение аминов
- Экология СПРАВОЧНИК
- 3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот
- Общие особенности строения аминов
- Химические свойства предельных аминов
- Взаимодействие с кислотами
- Взаимодействие с галогеналканами
- Химические свойства анилина
- Взаимодействие анилина с кислотами
- Взаимодействие анилина с галогенами
- Взаимодействие анилина с азотистой кислотой
- Реакции алкилирования анилина
- Химические свойства аминокислот
- Кислотные свойства аминокислот
- Образование солей с щелочами и карбонатами щелочных металлов
- Этерификация аминокислот
- Основные свойства аминокислот
- Образование внутренних солей аминокислот в водном растворе
- Урок 12: Амины
- Строение аминов
- Классификация аминов
- Номенклатура аминов
- Изомерия аминов
- Способы получения аминов
- Реакции нитросоединений
- Алкилирование (взаимодействие с галогеналканами) аммиака
- Гидрирование нитрилов
- Физические свойства аминов
- Химические свойства аминов
- Основные свойства
- Окисление
- Реакция с азотистой кислотой
- Алкилирование аминов
- Анилин
- Основные свойства анилина
- Аминокислоты
- Применение аминов
- Вредное воздействие аминов
Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная группой аминов является аминогруппа — NH2.
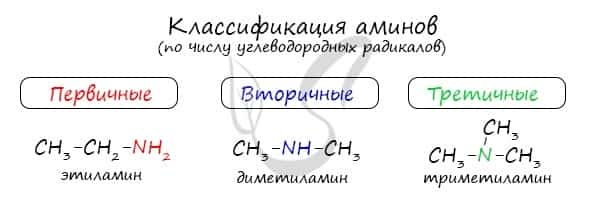
Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
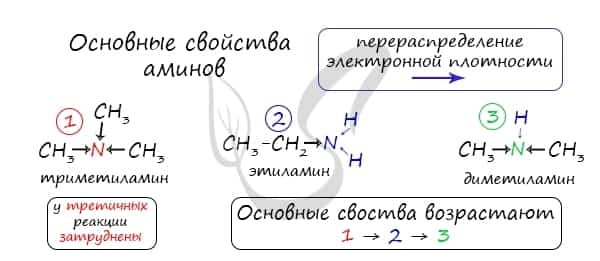
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
Номенклатура и изомерия аминов
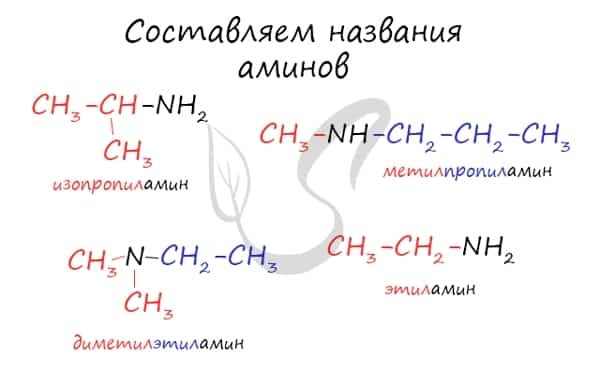
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
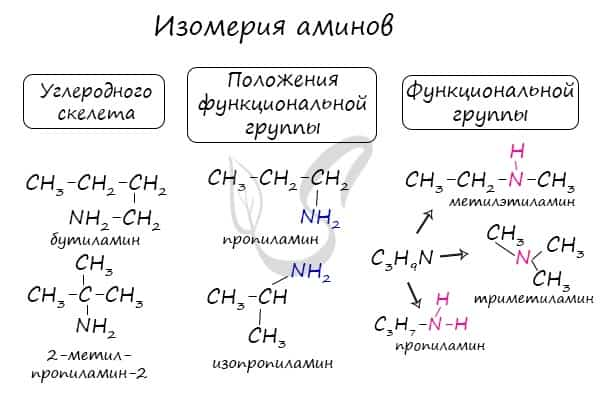
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония. 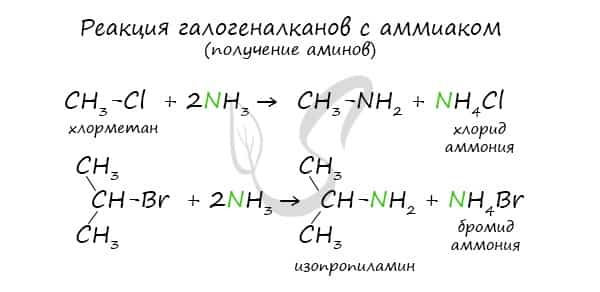
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода. 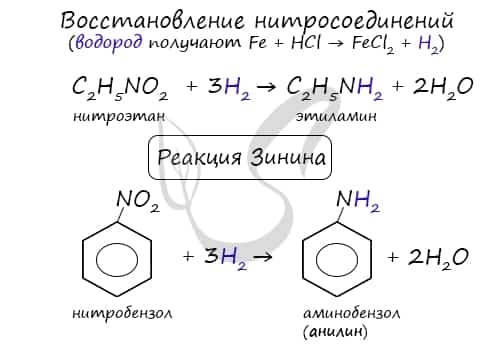 Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород. 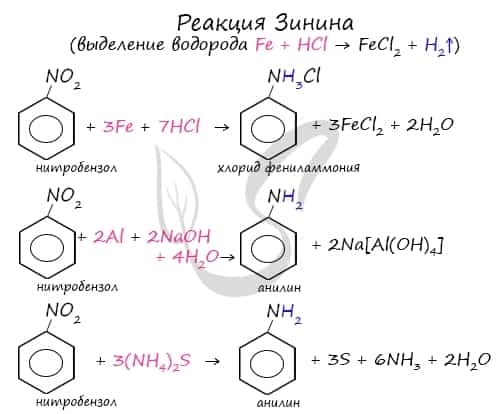
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды. 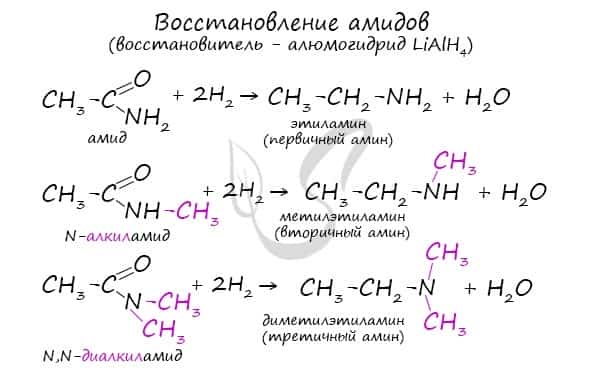
Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон. 
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет. В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием. Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ. 4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
АМИНЫ
- Классификация аминов разнообразна и определяется тем, какой признак строения взят за основу.
- В зависимости от числа органических групп, связанных с атомом азота, различают:
- первичные амины – одна органическая группа у азота RNH2
- вторичные амины – две органических группы у азота R2NH, органические группы могут быть различными R'R»NH
- третичные амины – три органических группы у азота R3N или R'R»R»'N
- По типу органической группы, связанной с азотом, различают алифатические СH3 – N< и ароматические С6H5 – N< амины, возможны и смешанные варианты.
По числу аминогрупп в молекуле амины делят на моноамины СH3 – NН2, диамины H2N(СH2)2NН2, триамины и т.д.
Номенклатура аминов
к названию органических групп, связанных с азотом, добавляют слово «амин», при этом группы упоминают в алфавитном порядке, например, СН3NHС3Н7 – метилпропиламин, СН3N(С6Н5)2 – метилдифениламин.
Правила допускают также составлять название, взяв за основу углеводород, в котором аминогруппу рассматривают как заместитель. В таком случае ее положение указывают с помощью числового индекса: С5Н3С4Н2С3Н(NН2)С2Н2С1Н3 – 3-аминопентан (верхние числовые индексы синего цвета указывают порядок нумерации атомов С).
Для некоторых аминов сохранились тривиальные (упрощенные) названия: С6Н5NH2 – анилин (название по правилам номенклатуры – фениламин).
В некоторых случаях применяют устоявшиеся названия, которые представляют собой искаженные правильные названия: Н2NСН2СН2ОН – моноэтаноламин (правильно – 2-аминоэтанол); (ОНСН2СН2)2NH – диэтаноламин, правильное название – бис(2-гидроксиэтил)амин. Тривиальные, искаженные и систематические (составленные по правилам номенклатуры) названия довольно часто сосуществуют в химии.
Физические свойства аминов
Первые представители ряда аминов – метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N и этиламин C2H5NH2 – при комнатной температуре газообразные, далее при увеличении числа атомов в R амины становятся жидкостями, а при увеличении длины цепи R до 10 атомов С – кристаллическими веществами. Растворимость аминов в воде убывает по мере увеличения длины цепи R и при возрастании числа органических групп, связанных с азотом (переход к вторичным и третичным аминам). Запах аминов напоминает запах аммиака, высшие (с большими R) амины практически лишены запаха.
Химические свойства аминов
Отличительная способность аминов – присоединять нейтральные молекулы (например, галогеноводороды HHal, с образованием органоаммониевых солей, подобных аммонийным солям в неорганической химии.
Для образования новой связи азот предоставляет неподеленную электронную пару, исполняя роль донора. Участвующий в образовании связи протон Н+ (от галогеноводорода) играет роль акцептора (приемника), такую связь называют донорно-акцепторной (рис. 1).
Возникшая ковалентная связь N–H полностью эквивалентна имеющимся в амине связям N–H.
- Третичные амины также присоединяют HCl, но при нагревании полученной соли в растворе кислоты она распадается, при этом R отщепляется от атома N:
- (C2H5)3N + HCl ® [(C2H5)3NH]Сl
- [(C2H5)3NH]Сl ® (C2H5)2NH + C2H5Сl
- При сравнении этих двух реакций видно, что C2H5-группа и Н, как бы меняются местами, в итоге из третичного амина образуется вторичный.
- Растворяясь в воде, амины по такой же схеме захватывают протон, в результате в растворе появляются ионы ОН–, что соответствует образованию щелочной среды, ее можно обнаружить с помощью обычных индикаторов.
- C2H5NH2 + H2O ® [C2H5NH3]+ + OH–
- С образованием донорно-акцепторной связи амины могут присоединять не только HCl, но и галогеналкилы RCl, при этом образуется новая связь N–R, которая также эквивалентна уже имеющимся. Если в качестве исходного взять третичный амин, то получается соль тетраалкиламмония (четыре группы R у одного атома N):
- (C2H5)3N + C2H5I ® [(C2H5)4N]I
- Эти соли, растворяясь в воде и некоторых органических растворителях, диссоциируют (распадаются), образуя ионы:
- [(C2H5)4N]I ® [(C2H5)4N]+ + I–
- Такие растворы, как и все растворы, содержащие ионы, проводят электрический ток. В тетраалкиламмониевых солях можно заменить галоген НО-группой:
- [(CH3)4N]Cl + AgOH ® [(CH3)4N]OH + AgCl
- Получающийся гидроксид тетраметиламмония представляет собой сильное основание, по свойствам близкое к щелочам.
- Первичные и вторичные амины взаимодействуют с азотистой кислотой HON=O, однако реагируют они различным образом. Из первичных аминов образуются первичные спирты:
- C2H5NH2 + HNO2® C2H5OH + N2 +H2O
- В отличие от первичных, вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины – соединения, содержащие фрагмент >N–N = O:
- (C2H5)2NH + HNO2® (C2H5)2N–N=O + H2O
- Третичные амины при обычной температуре с азотистой кислотой не реагируют, таким образом, азотистая кислота является реагентом, позволяющим различить первичные, вторичные и третичные амины.
При конденсации аминов с карбоновыми кислотами образуются амиды кислот – соединения с фрагментом –С(О)N< (рис. 2А).
Если в качестве исходных соединений взять диамин и дикарбоновую кислоту (соединения, содержащие соответственно две амино- и две карбоксильные группы, соответственно), то они взаимодействуют по такой же схеме, но поскольку каждое соединение содержит две реагирующие группы, то образуется полимерная цепь, содержащая амидные группы (рис. 2Б). Такие полимеры называют полиамидами.
Конденсация аминов с альдегидами и кетонами приводит к образованию так называемых оснований Шиффа – соединений, содержащих фрагмент –N=C< (рис. 2В). На схеме В видно, что для образования двойной связи между N и С азот должен предоставить два атома Н (для образования конденсационной воды), следовательно, в такой реакции могут участвовать только первичные амины RNH2.
При взаимодействии первичных аминов с фосгеном Cl2С=O образуются соединения с группировкой –N=C=O, называемые изоцианатами (рис. 2Г, получение соединения с двумя изоцианатными группами).
Среди ароматических аминов наиболее известен анилин (фениламин) С6Н5NH2. По свойствам он близок к алифатическим аминам, но его основность выражена слабее – в водных растворах он не образует щелочную среду. Как и алифатические амины, с сильными минеральными кислотами он может образовывать аммониевые соли [С6Н5NH3]+Сl–.
При взаимодействии анилина с азотистой кислотой (в присутствии HCl) образуется диазосоединение, содержащее фрагмент R–N=N, оно получается в виде ионной соли, называемой солью диазония (рис. 3А). Таким образом, взаимодействие с азотистой кислотой идет не так, как в случае алифатических аминов.
Бензольное ядро в анилине обладает реакционной способностью, характерной для ароматических соединений (см. АРОМАТИЧНОСТЬ), при галогенировании атомы водорода в орто— и пара-положениях к аминогруппе замещаются, получаются хлоранилины с различной степенью замещения (рис. 3Б).
Действие серной кислоты приводит к сульфированию в пара-положение к аминогруппе, образуется так называемая сульфаниловая кислота (рис. 3В).
Получение аминов
При взаимодействии аммиака с галогеналкилами, например RCl, образуется смесь первичных, вторичных и третичных аминов. Образующийся побочный продукт HCl присоединяется к аминам, образуя аммониевую соль, но при избытке аммиака соль разлагается, что позволяет проводить процесс вплоть до образования четвертичных аммониевых солей (рис. 4А).
В отличие от алифатических галогеналкилов, арилгалогениды, например, С6Н5Cl, реагируют с аммиаком с большим трудом, синтез возможен только при катализаторах, содержащих медь.
В промышленности алифатические амины получают каталитическим взаимодействием спиртов с NH3 при 300–500° С и давлении 1–20 МПа, в результате получают смесь первичных, вторичных и третичных аминов(рис. 4Б).
При взаимодействии альдегидов и кетонов с аммонийной солью муравьиной кислоты HCOONH4 образуются первичные амины (рис. 4В), а реакция альдегидов и кетонов с первичными аминами (в присутствии муравьиной кислоты НСООН) приводит к вторичным аминам (рис. 4Г).
Нитросоединения (содержащие группу –NO2) при восстановлении образуют первичные амины. Этот метод, предложенный Н.Н.Зининым, мало применяется для алифатических соединений, но важен для получения ароматических аминов и лег в основу промышленного производства анилина (рис. 4Д).
Как отдельные соединения амины применяются мало, например, в быту используется полиэтиленполиамин [-C2H4NH-]n (торговое название ПЭПА) как отвердитель эпоксидных смол. Основное применение аминов – как промежуточные продукты при получении различных органических веществ.
Ведущая роль принадлежит анилину, на основе которого производится широкий спектр анилиновых красителей, причем цветовая «специализация» закладывается уже на стадии получения самого анилина. Сверхчистый анилин без примеси гомологов называют в промышленности «анилин для синего» (имеется в виду цвет будущего красителя).
«Анилин для красного» должен содержать, помимо анилина, смесь орто— и пара-толуидина (СН3С6Н4NH2).
Алифатические диамины – исходные соединения для получения полиамидов, например, найлона (рис. 2), широко применяемого для изготовления волокон, полимерных пленок, а также узлов и деталей в машиностроении (полиамидные зубчатые передачи).
Из алифатических диизоцианатов (рис. 2) получают полиуретаны, которые обладают комплексом технически важных свойств: высокой прочностью в сочетании с эластичностью и очень высоким сопротивлением истиранию (полиуретановые обувные подошвы), а также хорошей адгезией к широкому кругу материалов (полиуретановые клеи). Широко их применяют и во вспененной форме (пенополиуретаны).
На основе сульфаниловой кислоты (рис. 3) синтезируют противовоспалительные лекарственные препараты сульфаниламиды.
Соли диазония (рис. 2) применяют в фоточувствительных материалах для светокопирования, которое позволяет получать изображение, минуя обычную галоидосеребряную фотографию (см. СВЕТОКОПИРОВАНИЕ).
Михаил Левицкий
Экология СПРАВОЧНИК
В этом растворе растворяется до 6,85 вес. % вискозной целлюлозы со средней степенью полимеризации (СП) 650. Получающийся при этом раствор целлюлозы обладает высокой вязкостью, что позволяет сделать вывод об отсутствии деструкции целлюлозы при ее растворении.[ …]
Следует указать, что для растворения целлюлозы необходима высокая концентрация кобальта в растворе, доходящая почти до 70 г/кг раствора, тогда как при получении медноаммиачных растворов достаточно содержания меди всего лишь 15—30 г/л.
Возможная структура образующегося водорастворимого целлю-лозусодержащего комплекса рассматривается ниже вместе с соответствующим никелевым комплексом.
Этот кобальтовый комплекс не нашел практического применения ввиду трудности его приготовления; однако его получение открыло путь к изучению других растворяющих целлюлозу растворов комплексов металлов.[ …]
Джейм и Нейшеффер [4, 5] обнаружили другой растворитель для целлюлозы, содержащий амин и металл, в котором центральным атомом является цинк. Этот комплекс, называемый цинкоксе-ном, имеет состав Zn(en)3(OH)j.[ …]
Растворяющая способность растворов цинкоксена по отношению к целлюлозе возрастает с увеличением концентрации этилендиамина в растворе, в то же время концентрация цинка может быть уменьшена. Соответствующие данные приведены в табл. 11.1.[ …]
Из этих данных видно, что для получения раствора цинкоксена с достаточно высокой растворяющей способностью по отношению к целлюлозе требуется определенная концентрация этилендиамина в растворе.[ …]
Почти не вызывает сомнения, что в процессе растворения происходит реакция между целлюлозой и цинковым комплексом. Если раствор цинкоксена, полученный при 0°С, выдерживать при комнатной температуре, из него осаждается гидроокись цинка.[ …]
Однако, если целлюлоза растворяется в том же растворе при 0°С, раствор остается стабильным при20сС в течение нескольких месяцев, и высаживания гидроокиси цинка из раствора не происходит.[ …]
Для измерения вязкости в вискозиметре Оствальда удобно использовать растворы цинкоксена с относительно высокой концентрацией этилендиамина, поскольку только такие растворы достаточно устойчивы при 20°С. Из-за высокой вязкости растворов цинкоксена наблюдаются большие времена истечения.[ …]
Рисунки к данной главе:
| ПЛ. Зависимость концентрации |
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
| первичные | вторичные | третичные |
| R-NH2 |
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота.
Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом.
В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н+.
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком.
Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается.
В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак.
Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных.
Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H+.
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных.
Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты.
При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
- Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
- Получение аминов:
- 1) Алкилирование аммиака галогеналканами:
- В случае недостатка аммиака вместо амина получается его соль:
- 2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
- с последующей обработкой раствора щелочью для высвобождения свободного амина:
- 3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре.
Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы.
Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
- 1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
- C6H5-NO2 + 3Fe + 7HCl = [C6H5-NH3]+Cl- + 3FeCl2 + 2H2O
- 2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
- [C6H5-NH3]+Cl— + NaOH = C6H5-NH2 + NaCl + H2O
- В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
- Реакция хлорбензола с аммиаком:
- С6H5−Cl + 2NH3 → C6H5NH2 + NH4Cl
Химические свойства аминокислот
- Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
- Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
- Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
- Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
NH2CH2COOH + CH3OH → NH2CH2COOCH3+ H2O
Основные свойства аминокислот
- 1. Образование солей при взаимодействии с кислотами
- NH2CH2COOH + HCl → [NH3CH2COOH]+Cl—
- 2. Взаимодействие с азотистой кислотой
- NH2-CH2-COOH + HNO2 → НО-CH2-COOH + N2↑ + H2O
- Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
- 3.
Алкилирование
- NH2CH2COOH + CH3I → [CH3NH2CH2COOH]+I—
- 4.
Взаимодействие аминокислот друг с другом
- Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
- При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
- Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
- И аланина:
- Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
- Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
- Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
- 1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
- Cl-CH2-COOH + 2NH3 = NH2-CH2-COOH + NH4Cl
- 2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
Урок 12: Амины
- План урока:
- Строение аминов
- Классификация аминов
- Номенклатура аминов
- Изомерия аминов
- Способы получения аминов
- Физические свойства аминов
- Химические свойства аминов
- Особенности анилина
- Особенности аминокислот
- Применение аминов
- Вредное воздействие аминов
Серотонин улучшает аппетит, повышает настроение и контролирует эмоции человека. Адреналин стимулирует центральную нервную систему. Все эти соединения – амины. Без них невозможно представить жизнь человека.
Амины – углеводородные производные аммиака, в которых вместо водородных атомов располагаются радикалы. Функциональная группа аминов: аминогруппа (-NH2).
Строение аминов
Аммиак и амины схожи по многим параметрам. Для азота в этих соединениях свойственна sp3-гибридизация.
Строение аминов определяет свойства. Для представителей этого класса соединений свойственна основность. Это связано с расположением неподеленной электронной пары на азоте.
Классификация аминов
Группировка по количеству радикалов
Основные свойства соотносятся с количеством электронной плотности на азоте. Чем плотность выше, тем основность выше. Но у третичных аминов обилие радикалов создает пространственные затруднения, поэтому их основные свойства ослаблены.
Группировка по строению органического радикала
Номенклатура аминов
Согласно международной номенклатуре название представителей этого класса соединений формируется из радикала и суффикса«-амин». Если в соединении несколько радикалов, то они располагаются в названии согласно алфавиту.
Амины также можно назвать как производные аммиака. Для этого к радикалу прибавляется приставка «амино-».
Например, молекула CH3-CH2-СН2-CH2-CH2-CH2-NH2называется 1-аминогексан (гексамин).
Изомерия аминов
Для аминов свойственно несколько видов изомерии.
Способы получения аминов
Существует несколько методов получения аминов.
Реакции нитросоединений
С помощью восстановления нитросоединений синтезируются амины.
- Гидрирование (взаимодействие с молекулами водорода) при нагревании
СН3-СН2-СН2-СН2-NO2 + 3H2 →СН3-СН2-СН2-СН2-NH2 + 2 H2O
- Реакция с сульфидом аммония
СН3-СН2-NO2 +3 (NH4)2S → СН3-СН2-NH2 + 3 S + 6 NH3 + 2 H2O
- Взаимодействие с алюминием в щелочи
СН3-СН2-NO2 +2 Al + 2 KOH + 4 H2O → СН3-СН2-NH2 +2 K[Al(OH)4]
- Реакции с металлами (железом, оловом, цинком) и кислотой
СН3-СН2-NO2 + 3 Fe + 7 HCl → [СН3-СН2-NH3]Cl + 2 H2O + 3 FeCl3
В результате образуется соль. При ее взаимодействии с щелочью образуется амин.
[СН3-СН2-NH3]Cl + KOH → СН3-СН2-NH2 + H2O + KCl
Алкилирование (взаимодействие с галогеналканами) аммиака
При недостатке аммиака образуется соль. При ее взаимодействии с щелочью получается амин.
- СН3-СН2-СН2-СН2-Br + NH3 → [СН3-СН2-СН2-СН2-NH3]Br
- [СН3-СН2-СН2-NH3]Br + KOH → СН3-СН2-СН2 -NH2 + H2O + KBr
- При избытке аммиака амин образуется сразу.
- R-Br + 2 NH3 → R-NH2 + NH4Br
Гидрирование нитрилов
Данная реакция протекает при наличии никеля.
Физические свойства аминов
Первые представители всех типов аминов существуют в виде газов с аммиачным ароматом, средние представители гомологического ряда– жидкостей с запахом рыбы, а высшие существуют в твердом агрегатном состоянии. Ароматические амины – это прозрачные жидкости с большими температурами кипения или твердые соединения.
Первичным и вторичным аминам свойственны высокие температуры плавления и кипения. Это связано с тем, что амины формируют свободные связи между молекулами.
Растворимость аминов обусловлена тем, что они создают связи с молекулами воды. Чем выше молекулярная масса соединения, тем ниже растворимость. Молекулы ароматических аминов не растворяются в воде.
Химические свойства аминов
Основные свойства
- Из-за неподеленной электронной пары на азоте амины выражают основные свойства. Основность возрастает в следующем ряду:
- Ароматические амины>аммиак>алифатические амины
- По мере увеличения электронной плотности на азоте основность увеличивается.
- Гидратация (взаимодействие с водой)
- Взаимодействие с кислотами
Амины взаимодействуют с органическими, минеральными кислотами, аминокислотами. В результате образуются соли.
СН3-СН2-СН2—СН2-NH2 + HCl → [СН3-СН2-СН2-СН2-NH3]+Cl-
2СН3-СН2-СН2-СН2-NH2 + FeCl2 + 2 H2O → 2 [СН3-СН2-СН2-СН2-NH3]+Cl- + Fe(OH)3
Окисление
Амины при взаимодействии с кислородом (горении) образуют свободный азот.
4 CH3-CH2-NH2 + 15 O2→ 8 CO2 + 2 N2 + 14 H2O
Реакция с азотистой кислотой
- Из первичных спиртов синтезируются спирты.
- R-NH2 + NaNO2 + HCl → R-OH + N2 + NaCl + H2O
- Из вторичных спиртов синтезируются нитрозосоединения (вещества желтого цвета).
Алкилирование аминов
В результате реакции первичных аминов и галогеналканов синтезируются соли вторичных аминов, а из вторичных – соли третичных аминов.
Анилин
Анилин – прозрачная жидкость с особенным запахом. При взаимодействии с кислородом (окислении) анилин становится красно-бурым. Анилин токсичен и не растворим в воде.
Реакции могут идти как по боковой цепи, так и по ароматическому кольцу.
Основные свойства анилина
У ароматических аминов самые низкие основные свойства. Они также не реагируют с водой, но взаимодействуют с кислотами.
Для анилина характерны реакции замещения. В эти реакции он вступает легче, чем бензол. Реакция идет без катализаторов. Бром замещается в орто- и параположениях. В результате образуется белый осадок.
Аминокислоты
Аминокислоты – элементарная структура белков, из которых состоят все тела животных. Аминокислоты включают две функциональные группы – аминогруппу (-NH2) и карбоксильную группу (-СООН). Эти две группы не соединены между собой непосредственно.
Общая формула аминокислот
Для аминокислот характерна оптическая изомерия. Белки включают только α-аминокислоты. На нашей планете существует только 20 аминокислот, из которых строится все живое.
Аминокислоты – амфотерные соединения, которые могут реагировать как по карбоксильной группе, так и по аминогруппе.
Аминокислоты. Источник
Применение аминов
Амины в свободном виде в природе встречаются редко. Они образуются при гниении органических остатков. В этом процессе синтезируются такие соединения как путресцин и кадаверин.
Путресцин и кадаверин
Для средних представителей гомологического ряда аминов характерен рыбный запах. Запах селедочного рассола определяется триметиламином.
Амины используются также в промышленности. Например, как:
- отвердитель эпоксидной смолы,
- ускоритель реакции в металлургической промышленности,
- исходное вещество для производства полиамидных волокон,
- вещество для синтеза анилина,
- сырье для получения фенолформальдегидных смол,
- вещество для получения пестицидов, инсекцидов, фунгицидов,
- добавка к машинным топливам и маслам и др.
Метиламин – первичный амин. Он применяется в производстве лекарственных препаратов, красителей, пестицидов.
Метиламин
Диэтиламин – вторичный амин. С его помощью получают пестициды, красители, лекарственные препараты, добавки к машинным маслам и т.д. Также он служит сырьем для изготовления веществ от коррозии металлов. Он может отвердевать эпоксидные смолы и играть роль катализатора при вулканизации.
Диэтиламин
Триэтиламин – третичный алифатический амин. Он применяется при получении резин, эпоксидных смол и пенополиуретанов. Из него также производят лекарственные препараты, минеральные удобрения, краски и т.д.
Триэтиламин
Анилин – ароматический амин. Он широко применяется в качестве сырья для получения красителей, лекарственных препаратов, взрывчаток и т.д.
Анилин
Амины образуются в растениях и животных в результате биохимического распада аминокислот под действием ферментов. Они обладают высокой биологической активности.
Амины животного происхождения – серотонин, адреналин, мелатонин, тирамин и др. Амины растительного происхождения – кофеин, кокаин, никотин, хинин и др.
Вредное воздействие аминов
Практически все амины ядовиты. Ароматический амин анилин проникает через кожу, окисляет гемоглобин, угнетает работу центральной нервной системы. Его действие может привести к гибели.
Отравление можно выявить по следующим признакам:
- трудности при дыхании,
- посинение носа, губ, кончиков пальцев,
- сильное сердцебиение,
- обмороки.
Первая помощь:
- смыть анилин спиртом,
- дать возможность дышать чистым воздухом,
- вызвать медицинских специалистов.
Алифатические амины оказывают негативное влияние на нервную систему, нарушают работу печени, развивают дистрофию. Некоторые ароматические амины — канцерогены, способные вызвать рак мочевого пузыря. Опасны даже пары аминов.






