- 3 способа анодирования металла
- Откуда появился сам термин
- Что дает анодирование
- Устройства, оборудование, реактивы
- Способы анодирования
- Тёплый метод
- Холодный метод
- Твёрдое анодирование
- Преимущества анодированных поверхностей
- Анодирование разных металлов
- Нержавеющая сталь
- Медь
- Титан
- Серебро
- Анодирование алюминия
- Заключение
- Основы ЭХО
- Большая Рнциклопедия Нефти Рё Газа
- Анодное растворение и пассивность металлов
- Аноды и анодный процесс


 А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
Анодное растворение металла, электрохим. окисление металла в р-ре или расплаве электролита с образованием р-римых продуктов и отводом освобождающихся электронов во внеш. цепь. В общем виде этот процесс можно записать след. образом:
где М-атом металла, n-число освобождающихся электронов. В соответствии с законами Фарадея, в отсутствие др. электродных р-ций зависимость между скоростью окисления металла V [г/(см2*с)] и плотностью анодного тока i имеет вид:
где F- постоянная Фарадея, Nэ-xим. эквивалент металла.
Анодное растворение лежит в основе размерной электрохим. обработки металлов и сплавов и их электрополировки, анодного упрочнения металлич. материалов путем удаления с повети тонких механически деформиров.
слоев, использования р-римых анодов при электрохим. рафинировании металлов и в гальванотехнике. От анодного растворения в значит. мере зависят эксп-луатац. характеристики гальванич.
элементов и аккумуляторов, а также коррозионное поведение конструкц. металлич. материалов.
Важнейшие характеристики анодного растворения-зависимость i от электродного потенциала Е и частная производная обратной зависимости , наз. поляризуемостью и являющаяся техн. характеристикой растворяющихся анодов. Указанные зависимости могут иметь концентрац. или кинетич. (активационную) природу. Какой из случаев реализуется на практике, зависит от соотношения между i при данном Е и током обмена iо, т.е. плотностью тока при равновесном потенциале, когда она в точности равна плотности тока обратного процесса — катодного осаждения металла. При i < iо скорость анодного растворения лимитируется скоростью отвода продуктов окисления от пов-сти электрода в объем р-ра; потенциал металла сохраняет равновесное значение по отношению к его ионам в приповерхностном слое р-ра и выражается ур-нием Нернста:
где Ео- стандартный электродный потенциал, [Мп+]- при-поверхностная концентрация ионов металла, Т-абс. т-ра, R-газовая постоянная. Однако, оставаясь равновесным, потенциал меняется, т.к.
[Мn+] у пов-сти возрастает пропорционально скорости анодного растворения (т.е. плотности тока i). Соотв. зависимость Е от i описывается ур-нием:
где К — эмпирич. коэффициент. Это ур-ние м.б. нарушено, когда будет достигнут предел р-римости соли, образуемой металлом с одним из анионов электролита, и [М ] перестанет расти.
Если образующийся при этом осадок рыхлый и заметно не препятствует прохождению тока, то далее металл становится практически неполяризуемым. Такова, напр., природа неполяризуемости отрицат.
пластины свинцового аккумулятора.
В водных р-рах электролитов поляризуемость описанного концентрац. типа характерна для переходных металлов I и II групп (Ag, Cu, Zn, Cd), к-рым свойственны высокие значения iо. Ее важнейшая особенность — зависимость Е не только от i, но и от интенсивности перемешивания р-ра.
При i > iо растворение протекает с кинетич. контролем, т.е. лимитируется собственно электрохим. стадией — переносом заряженной частицы через границу металл-р-р, и его скорость изменяется с потенциалом Е по закону:
где-т. наз. коэф. переноса. Этот тип поляризуемости особенно характерен для переходных металлов VIII группы (Fe, Ni, Co и др.), к-рые отличаются низкими значениями iо.
На лимитирующую стадию, а значит, и на весь процесс может сильно влиять предшествующая ей стадия адсорбционного и хим. взаимод. поверхностных атомов металла с компонентами р-ра (молекулами р-рителя, анионами электролита). С учетом этой стадии механизм и скорость анодного растворения можно выразить таким образом:
где А — адсорбирующийся компонент р-ра, т- число его молекул, участвующих в процессе, К1- константа. В зависимости от условий адсорбция может стимулировать или ингибировать анодное растворение (т м. б. положительным или отрицательным). Соотв.
введение в р-р или удаление из него адсорбирующихся компонентов — один из эффективных методов регулирования скорости анодного растворения в технике. Стимуляторы широко используют в технологии размерной электрохим. обработки металлов, а также для снижения поляризуемости растворяющихся анодов.
Использование ингибиторов анодного растворения — один из важных методов защиты металлов от коррозии (см. Ингибиторы коррозии).
Анодное растворение, конечными продуктами к-рого являются многовалентные катионы или их комплексы, протекает, как правило, через ряд одноэлектронных стадий (п — 1), каждая из к-рых в зависимости от условий может оказаться лимитирующей. При этом промежут.
ионы металла низких степеней окисления нередко доокисляются до устойчивого состояния не только (а иногда не столько) электрохимически, но и в результате непосредственного взаимод. с окислит. компонентой р-ра (молекулы растворенного кислорода, ионы Н+ ), напр.
по р-ции:
В подобных случаях итоговая скорость анодного растворения может существенно превосходить величину, рассчитанную только по току.
Нередко анодное растворение осложняется вторичными явлениями. Так, образование на пов-сти растворяющегося металла фазовых или адсорбционных солевых или оксидных слоев приводит к пассивации анодного растворения (см.
Пассивность металлов), к-рая проявляется в ослаблении зависимости его скорости от потенциала, в достижении предельной плотности тока растворения, а иногда и в изменении типа зависимости. В водных средах повыш. склонностью к пассивации отличаются мн. переходные металлы (Mo, Cr, Ni, Fe и др.). Для них характерен критич.
потенциал Екр, зависящий от природы металла и рН р-ра. При достижении Екр обычное увеличение скорости анодного растворения сменяется ее резким снижением, иногда до неск. порядков величины.
После этого в большом интервале значений потенциала скорость анодного растворения сохраняется постоянной, а затем снова начинает экспоненциально расти с потенциалом (см. рис.).
Последнее явление, известное как перепассивация, обусловлено новым анодным процессом (окислением металла до ионов высшей валентности), к-рый лежит в основе электрохим. технологии получения высших кислородных соед. ряда металлов, напр. Mn, Cr. При анодном растворении сплава возможен неравномерный переход его компонентов в р-р, т.е. избирательное растворение одних компонентов и обогащение поверхностного слоя сплава другими.
Зависимость логарифма скорости анодного растворения ог электродного потенциала.
===
Исп. литература для статьи «Анодное растворение»: Колотыркин Я. М., «Природа», 1979, № 11, с. 2-13: его же, «.Защита металлов», 1983, т. 19, № 5, с. 675-85; Основы теории и практики электрохимической обработки металлов и сплавов, М., 1981. Я.М. Колотыркин.
Страница «Анодное растворение» подготовлена по материалам химической энциклопедии.
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
3 способа анодирования металла
Защищать металлические изделия от агрессивного воздействия внешней среды можно по-разному.
В том числе покрытием красками на масляной, глифталевой, пентафталевой, полиэфирной и эпоксидной основе – с разной степенью адгезии и разной долговечностью.
Но ничто не сравнится с анодированием — таким методом защиты, как создании с помощью электрохимического процесса защитной оксидной плёнки. Анодирование также называют — анодным оксидированием.

Оксидировать можно практически все металлы и сплавы, кроме чистых железа и меди. Связано это с тем, что эти два металла образуют сразу два оксидных соединения на своей поверхности. Как бы конкурирующих друг с другом, и потому это плохо сказывается и на прочности самой оксидной плёнки, и на её адгезии (то есть связанностью) с поверхностью.
Откуда появился сам термин
При электрохимическом создание оксидной плёнки на поверхности металлов деталь/изделие опускают в ванну с электролитом. Чаще всего это раствор кислоты. Электролиты электропроводны (что ясно из самого названия).
Когда через раствор пропускают постоянный ток (это важно, чтобы ток постоянно шёл в одном направлении!), на катоде выделяется водород, а на аноде – кислород, с помощью которого образуется оксидный, то есть окисленный целенаправленно, слой с заранее заданными свойствами, зависящими от силы тока и концентрации раствора кислоты.
А так как эта деталь в системе «катод-электролит-деталь» является анодом, то и создание защитной плёнки назвали «анодированием». Или «оксидированием».
Варьируя силу тока и использование специальных добавок-присадок, можно добиться практически любой окраски анодированного покрытия.
Что дает анодирование
Чем-то анодирование похоже на гальванические процессы, возникающие во время хромирования или оцинковки стали. Но есть существенная разница: исключено использование посторонних веществ, пусть даже похожих по свойствам и химическому составу. Оксидирование ведётся на основе самого металла, подвергаемого электрохимическому воздействию.
При анодировании процесс поддаётся регуляции, оксидному слою придаются заранее заданные свойства, а результатом служит прочность оксидируемого участка.
Лучше всего защитный слой в результате анодирования образуется на таких металлах, как алюминий, титан, сталь, тантал. Главное же требование к технологии, чтобы металл имел только один оксид с высокими адгезивными свойствами.

Но для обеспечения адгезии нужна пористая структура, которая обеспечит соприкосновение рабочей смеси с чистым металлом поверхности, что значительно ускоряет процесс оксидирования.
Получается, что при электрохимическом процессе могут образовываться два типа оксидных защитных покрытий, отличающиеся как назначением, так и строением.
- Первый тип – пористая поверхность оксидной плёнки. Получается при воздействии на металл кислых электролитов. Структурированная порами поверхность служит отличной основой для того, чтобы на неё легли лакокрасочные материалы, которые своей структурой, образующейся в процессе полимеризации основы, закрепляется во фракталах пор. То есть анодированная поверхность способствует повышенной адгезии.
- Барьерная. Относится ко второму типу. Это самостоятельное защитное покрытие, которое защищает металл от контактов с внешней агрессивной средой.
Впрочем, созданием защитных слоёв процесс анодирования не ограничивается. Применяя разные материалы и меняя уровень напряжения, можно получить разные оттенки анодированной плёнки. Чем активно пользуются дизайнеры при оформлении интерьеров, когда облицовочным материалом служит алюминий.

Устройства, оборудование, реактивы
В промышленных масштабах анодирование делается в растворах серной кислоты разной концентрации. Они обеспечивают как большую скорость процесса, так и заданную глубину оксидной плёнки. Применение автоматики позволило полностью автоматизировать этот достаточно вредный для здоровья процесс.
Оборудование для анодирования бывает трех типов:
- Базовое, или основное. Тут всё просто: ванна с электролитом из инертного, не вступающего в реакцию, материала, притом обладающего свойствами теплоизолятора для предотвращения перегрева электролита. И катод, материал которого находится в прямой зависимости от того материала, который нужно анодировать.
- Обслуживающее оборудование. К нему относятся агрегаты, обеспечивающие работоспособность установки для оксидирования. Это узлы подачи напряжения, предохранительные и приводные механизмы.
- Вспомогательное. Это оборудование для работ по обработке и подготовке изделий к анодированию. В него входят и средства доставки деталей к ваннам. И средства упаковки и перемещения к местам, где готовые изделия складируются.
Самыми трудными, экологически опасными операциями при обработке металлов анодированием являются процессы загрузки и выгрузки деталей в ванны. Поэтому на качество работы приводных механизмов для этого всегда обращается особое внимание.
Исторически сложилось так, что все производственные процессы связаны с потреблением переменного тока – который совершенно не годится для процессов анодирования.
Для того, чтобы ток был постоянным (то есть текущий в проводниках только в одном направлении, применяют выпрямители с достаточным запасом мощности. Оптимальная мощность для промышленных выпрямителей, связанных с процессами оксидирования – 2,5 киловатта.
А для обеспечения получения анодированной плёнки разных цветов и оттенков для таких выпрямителей монтируют бесступенчатую систему подачи мощности.

Способы анодирования
Образование на металлах оксидной плёнки зависит от выбранной технологии со всеми её факторами вроде типа электролита, мощности подаваемого тока, поверхности детали-анода.
Универсальность раз и навсегда отработанных методов позволяет проделывать процесс анодирования даже в домашних условиях – нужно только владеть технологиями, от которых будет зависеть цвет получаемой оксидной плёнки.
Минимизировать вред для здоровья от испарений кислот вряд ли получится, вряд ли в условиях домашней мастерской можно обеспечить герметичность ванны, эффективную систему вытяжки и фильтрации воздуха..
Среди разных видов анодирования популярен процесс нанесения цветной оксидной плёнки. Популярность его связывается не только с декоративностью получаемого покрытия, но и с разной степенью его прочности, которая зависит от цвета.
Теперь о методах, вынесенных в заголовок материала, а именно:
- Тёплый метод
- Холодный метод
- Твёрдое анодирование.
Тёплый метод
В большинстве случаев используется как промежуточный, ибо получаемые на его основе оксидные плёнки не стойки к воздействиям.

Холодный метод
При холодном методе скорость образования анодированной плёнки выше скорости растворения металла на катоде, что обеспечивает высокую прочность получаемого защитного слоя.
Но обязательно требование поддержания температуры раствора электролита на уровне не выше 5⁰С, что и дало название методу.
Так как температура раствора в ванне в её середине всегда выше, чем у бортов, необходимо обеспечить циркуляцию раствора.
Твёрдое анодирование
Самая лучшая для высокого качества покрытия на стали. Такой способ анодирования применяют в аэрокосмической промышленности, где часто требуются запредельные нагрузки на узлы и агрегаты. Особенность метода — применение сложных по составу электролитов, а рецептура таких составов защищена патентами с международной регистрацией.
Преимущества анодированных поверхностей
- Выдающиеся антикоррозийные свойства. Оксидная плёнка надёжно защищает от обычной влаги и от большинства агрессивных сред.
- Прочность оксидной плёнки. Оксиды по своим прочностным физическим характеристикам в большинстве случаев прочнее металла, на котором они образованы.
- Непроводимость тока. Парадоксальным образом образованная на металле и из металла оксидная плёнка практически является диэлектриком – что находит своё применение в создании электролитических (оксидных) конденсаторов.
- Экологический аспект: при производстве посуды нанесённая на неё оксидная плёнка не даёт ионам металла переходить в пищу, не даёт ей подгорать, стенки и дно посуды приобретают устойчивость к большим перепадам температуры.
- Широкое использование анодированных поверхностей металла в дизайне. Применение в растворах электролита некоторых солей позволяет получать глубокие и насыщенные оттенки.

Анодирование разных металлов
Нержавеющая сталь
Самый трудный для анодирования объект из-за своей химической инертности. Чтобы получить на ней оксидированную поверхность, нержавейку предварительно подвергают процедуре никелирования. Хотя сейчас ведется активная разработка специальных диффузионных паст, на которых оксид будет образовываться без никелевой «подушки».
Медь
Оксидированию поддаётся плохо, а там, где это требуется, применяют дорогие соли в качестве присадок к электролитам или используют не экологичные фосфатные или оксалатные растворы. На практике этот процесс применяют крайне редко.
Титан
Металлические изделия из титана проходят обязательную процедуру оксидирования, из-за того, что нанесение оксидной плёнки на 15-28% увеличивает износостойкость верхнего слоя изделий из титана. А также дополнительно придаёт изделиям декоративность, кардинально меняя цвет. Титан очень нетребователен к составу кислот для электролитических реакций – подойдёт практически любая.
Серебро
Для создания оксидной плёнки на серебре, применяют серную печень – сплав порошкообразной серы с поташом при сильном нагревании без присутствия воды.
Впрочем, такой метод нанесения оксидных плёнок применяют и для бронзы, где получаемая плёнка называется искусственной патиной. На серебре обработка таким реактивом способна дать синий и фиолетовый цвета.
Но без изменения свойств серебра как металла.

Анодирование алюминия
Оксидирование этого металл даёт самые широкие возможности с широчайшей сферой применения. Есть много способов образования на поверхности этого металла оксидов, более половины из них связаны с получением цветных ярко окрашенных, поверхностей.
Заключение
Анодное оксидирование — универсальный метод защиты многих металлов, а также технологией, позволяющей приготовить металлы к прочной окраске, когда оксидные плёнки бывают пористыми.
Анодирование также придает поверхностям дополнительные декоративные свойства.
А доступность многих материалов и оборудования позволяет, при обеспечении минимальных мер безопасности, делать анодирование металлов в кустарных условиях.
Основы ЭХО
| Оглавление статьи Страницы статьи: 1 2 3 … 20 21 22 … 40 41 42 |
1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ ЭЛЕКТРОХИМИЧЕСКОЙ ОБРАБОТКЕ
1.1. Основы процессов ЭХО
Явление анодного растворения. Электрохимическая обработка металлов основана на способности их растворяться в результате оксидных реакций, происходящих в среде электропроводного раствора — электролита — под действием на него постоянного электрического тока.
Такой химический процесс растворения металлов называют электролизом.
Электролиз протекает при наличии источника питания электрическим током, электролита и двух металлических проводников, называемых электродами, каждый из которых находится в электролитической ванне с электролитом.
В электролите свободными электрическими зарядами являются ионы, образующиеся при растворении, например в воде солей, кислот или щелочей.
Молекулы таких веществ, взаимодействуя с молекулами растворителя — воды, распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. При этом движение ионов в электролите неупорядоченное.
Под действием электрического поля, создаваемого источником питания, между электродом, соединенным с положительным полюсом и называемым анодом, и электродом-катодом, соединенным с отрицательным полюсом, возникает направленное движение ионов — отрицательно заряженные ионы (анионы) движутся к аноду, а положительно заряженные ионы (катионы) — к катоду. В электролите, таким образом, возникает электрический ток, представляющий упорядоченное движение положительно и отрицательно заряженных ионов.
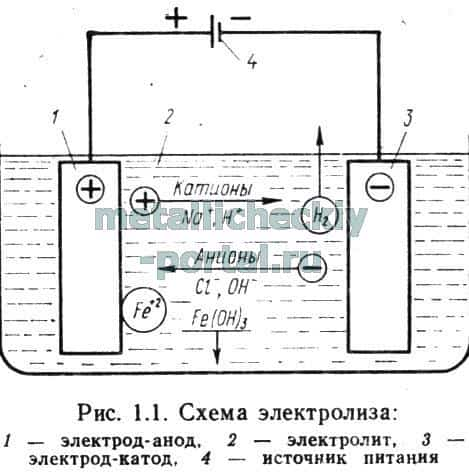
Схема движения ионов в наиболее часто применяемом для ЭХО электролите — водном растворе хлористого натрия NaCl — приведена на рис. 1.1. При растворении хлористого натрия в воде его молекула распадается на катион натрия Na+ и анион хлора С1-.
Вода Н20 при этом также частично диссоциирует на катионы водорода Н+ и анионы гидроксила ОН-.
При подаче на электроды напряжения от источника питания анионы гидроксила и катионы водорода вместе с анионами хлора и катионами натрия вынуждены под действием сил электрического поля перемещаться соответственно к катоду и аноду.
Атомы поверхностного слоя электрода-анода 1, получая от движущихся к нему анионов хлора и гидроксила дополнительные отрицательные заряды, превращаются в положительные ионы железа.
Последние под действием сложных катодных и анодных реакций взаимодействуют с ионами гидроксила и образуют гидрат оксида железа Fe(OH)3, который в виде нерастворимого химического соединения выпадает в осадок. Таким образом происходит электрохимическое анодное растворение железа. Одновременно с этим на катоде выделяется водород, выходящий из электролита в виде пузырьков. Реакции, протекающие на катоде, как правило, не разрушают его, т. е. катод при ЭХО не изнашивается.
Параметры анодного растворения. Из приведенной на рис. 1.1 схемы видно, что электролиз протекает в межэлектродном промежутке (МЭП), под которым принято понимать пространство между поверхностями катода и анода. Следовательно, электрохимическое анодное растворение происходит без непосредственного механического контакта поверхностей катода и анода.
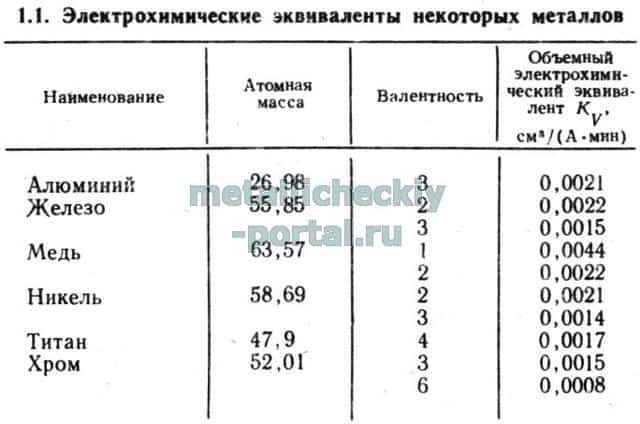
В соответствии с объединенным законом Фарадея объем V (см3) растворенного металла при электролизе прямо пропорционален объемному электрохимическому эквиваленту Kv данного металла, силе тока I и времени t:V=KvIt. Объемный электрохимический эквивалент Kv металла зависит от его валентности и атомной массы; эти величины для определенного металла (табл. 1.1) имеют постоянные значения.
На практике объем растворенного металла не всегда соответствует объему, рассчитанному по этой формуле.
При определенном сочетании параметров процесса (плотности тока i на аноде, определяемой отношением силы тока I к площади анода S, вида обрабатываемого металла, состава и скорости обновления электролита в межэлектродном промежутке) объем растворенного металла относительно расчетного его значения может уменьшаться, а в некоторых случаях процесс анодного растворения полностью прекращается. Это объясняется образованием на поверхностях анода труднорастворимых оксидных пленок.
При наличии в электролите достаточного количества активирующих анионов, например анионов хлора С1-, происходит вытеснение из оксидной пленки кислорода и разрушение ее без дополнительных затрат электрической энергии.
В таких процессах, называемых активными, электрическая энергия расходуется непосредственно на электрохимическое растворение металла анода. Если в электролите недостает активирующих анионов, то на электрохимическое анодное растворение этих пленок затрачивается дополнительная электрическая энергия.
При этом эффективность процессов ЭХО существенно снижается. Такой процесс электрохимического анодного растворения металла называют пассивным.
Активное анодное растворение отличается от пассивного особенностями реакций, происходящих на аноде. Активное растворение характеризуется хорошей растворимостью металла анода, так как при этом побочные реакции, кроме основной — анодного растворения, не протекают.
Активное растворение металла происходит, например, при электрохимическом травлении. При пассивном растворении часть электрической энергии расходуется на побочные реакции, обеспечивающие удаление с поверхностей анода труднорастворимых оксидных пленок.
Пассивное растворение металла происходит, например, при электрохимическом абразивном полировании.
Повышение плотности тока i относительно оптимального ее значения может привести при определенных условиях к образованию оксидных пленок сложного состава, которые не растворяются при электролизе.
При этом наступает полная пассивация, т. е. переход поверхностного слоя металла из активного состояния в пассивное, при котором процесс анодного растворения прекращается.
Подобные пленки удаляют с поверхностей анода механически, например абразивной обработкой.
Эффективность процессов ЭХО оценивают так называемым коэффициентом выхода металла по току: п = Vф/V, где Vф — фактический объем растворенного металла при пропускании определенного количества электричества, см3; V — расчетный объем металла, который должен раствориться при пропускании того же количества электричества, см3.
С учетом коэффициента п уравнение, характеризующее объем (см3) растворенного металла, приобретает следующий вид: Vф = Kv1tп). Vф, как правило, всегда меньше расчетного V, т. е. п>1. Значение этого коэффициента п отражает характер анодного растворения: активное или пассивное. При активном растворении коэффициент выхода металла по току составляет обычно 0,5—1,0; при пассивном растворении п
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Анодное растворение металла под напряжением на локальных, экстремальных его участках, имеющее термодинамическую возможность протекать до или одновременно с водородным охрупчиванием, с точки зрения электрохимии имеет много общего с питтингом. [1]
Анодное растворение металлов должно происходить при потенциалах, лишь немного более положительных, чем равновесный потенциал в данных условиях.
Рто РІ действительности Рё наблюдается РїСЂРё растворении, например, серебра, свинца, ртути. Цинк, медь, кадмий растворяются также РїСЂРё потенциалах, близких Рє равновесному.
Но некоторые металлы, в особенности из группы железа, растворяются при значительно более положительных потенциалах. [2]
Анодное растворение металла включает те же стадии, которые имеют место при его катодном восстановлении, только эти стадии протекают в обратном порядке. На кинетику процесса оказывают влияние те же факторы, что уже были рассмотрены выше при описании катодных реакций. [3]
| Диаграмма Пурбе для цинка. [4] |
Анодное растворение металла с переходом его в раствор в виде простых гидратированных или в виде комплексных ионов во многом представляет собой обращение процесса катодного выделения металлов. [5]
Анодное растворение металлов является разновидностью электродных процессов и характеризуется свойственными этим процессам кинетическими зависимостями.
Для протекания анодного растворения металла с заданной скоростью необходимо достаточно большое смещение его стационарного ( равновесного) потенциала в положительную сторону, а также обеспечение интенсивного транспортирования реагирующих частиц в приэлектродной зоне. [6]
| Гальванический элемент. [7] |
Анодное растворение металла в результате действия гальванопары является одним из главных факторов, ускоряющих процесс коррозии, поэтому в конструкциях приборов, машин и различных сооружениях недопустимо сопряжение металлов, обладающих значительной разностью потенциалов. [8]
Анодное растворение металлов значительно ускоряется, если в растворе присутствуют некоторые анионы, например ионы хлора. [9]
Анодное растворение металла включает те же стадии, которые имеют место при его катодном восстановлении, только эти стадии протекают в обратном порядке. На кинетику процесса оказывают влияние те же факторы, что уже были рассмотрены выше при описании катодных реакций. [10]
Анодное растворение металлов не всегда является равномерным по всей поверхности электрода.
Р’ активной Рё пассивной областях растворение, как правило, равномерно, РЅРѕ РЅР° границе этих областей разрушение локализируется РЅР° ограниченных площадях, занимающих большую или меньшую поверхности электрода. Рто локальное растворение РЅРµ является единственным. Р’ присутствии некоторых специфических анионов характер анодного растворения металла РІ области потенциалов, РїСЂРё которых металл обычно находится РІ пассивном состоянии, приобретает весьма своеобразный РІРёРґ. Разрушение локализируется РІ отдельных точках поверхности электрода. Так как скорость анодного процесса РїСЂРё этом резко возрастает, Р° площадь питтингов мала, то разрушение электрода, становится чрезвычайно локализованным. [11]
Анодное растворение металлов зависит не только от режима электролиза, но главным образом от состава анодного сплава.
Р’СЃРµ РІ большем количестве для рафинирования поступает, например, медь, содержащая РґРѕ 0 3 — 0 5 % Ni.
Высокая концентрация никеля РІ электролите ( 24 — 35 Рі / Р») существенно влияет РЅР° технико-экономические показатели электролиза, РЅР° электропроводность Рё вязкость растворов РІ особенности. [12]
Активное беспрепятственное анодное растворение металла может при известных условиях нарушиться.
Если повышать величину анодного потенциала, обеспечивая его постоянство при каждом измерении ( потенциостатические условия), то кривая зависимости i от е будет выглядеть так, как это представлено на рисунке 86, а.
Вначале с ростом анодного потенциала возрастает плотность анодного тока ( участок АВ) и скорость растворения металла. [13]
Анодному растворению металлов второй группы посвящено значительное количество работ [ 162, 443, 441, 487, 488, 373, 1230, 748, 909, 910, 473, 161, 500, 501, 280, 911, 682, 683, 76, 895, 607, 608, 1091 ], наиболее изучены цинковый и кадмиевый электроды. [14]
Если анодное растворение металла проводить направленно и размерно, то можно этому металлу придать ту или другую конфигурацию. Таким образом, размерное анодное растворение может заменить механическую обработку металлов. [15]
Страницы: 1 2 3 4
Анодное растворение и пассивность металлов
Электрохимическое растворение металлов включает в себя две группы процессов : растворение за счет внешнего тока (анодное растворение) и в результате взаимодействия с компонентами среды (коррозия).
Анодное растворение металла с переходом его в раствор в виде простых гидратированных (или в виде комплексных) ионов во многом представляет собой обращение процесса катодного выделения металлов.
Анодный процесс начинается с разрушения кристаллической решётки и заканчивается образованием ионов металла в растворе; вместо стадий формирования кристаллической решётки появляются стадии её разрушения, вместо разряда ионов — ионизация атомов металла и т. д.
Общую реакцию анодного растворения металла, если образуются простые гидратированные ионы, можно записать в виде уравнения :
[М] + х Н2О = Мn+ × х Н2О + ne-
Металлы растворяются анодно обычно при потенциалах более положительных, чем соответствующие равновесные потенциалы, т. е. их растворение сопровождается анодной поляризацией. Её значение можно определить из уравнения :
Djа = ji — jp
Появление анодной поляризации можно связать с замедленностью одной из стадий : транспортировки, разрушения твёрдой фазы или ионизации. При катодном выделении металлов замедленность транспортировки, т. е. недостаточная начальная скорость доставки разряжающихся ионов к электроду, смещает его потенциал в отрицательную сторону.
При анодном растворении металла замедленность стадии отвода приводит к накоплению перешедших в раствор ионов вблизи электрода и, соответственно, смещает его потенциал в положительную сторону. Аналогичная картина должна наблюдаться и при замедленном протекании других стадий.
В связи с этим при не слишком больших удалениях от состояния равновесия обнаруживается некоторая симметрия в протекании процессов катодного выделения металлов и их анодного растворения.
Поведение металлов в процессе анодного растворения исследовано не так полно, как при их катодном осаждении. Всё же полученные опытные данные подтверждают применимость основных положений теории электрохимического перенапряжения к металлам группы железа. Так, кинетика анодного растворения железа и никеля описывается формулой Тафеля :
- ha = a + b lg ia.
- Помимо стадий переноса электрона суммарная реакция анодного растворения металлов группы железа включает чисто химические стадии, протекающие с участием анионов, прежде всего ионов гидроксила, каталитически ускоряющих анодный процесс. Растворение железа в концентрированных растворах серной кислоты можно описать, например, следующей схемой :
- Fe + OH- = FeOHадс + e-
- FeOHадс = FeOH+адс + e-
- FeOH+адс + n H2O = Fe2+ × n H2O + OH-
где вторая стадия определяет скорость всего процесса. В настоящее время имеется много данных, указывающих на участие ионов OH- в процессе анодного растворения и других металлов. Кинетика анодного растворения металлов зависит не только от концентрации гидроксильных ионов, но и вообще от анионного состава раствора.
Металл, растворяющийся под действием анодной поляризации, может при изменении условий потерять эту способность и превратиться в нерастворимый анод. Такое превращение растворимого анода в нерастворимый представляет собой частный случай пассивности металлов. Явление пассивности металлов было открыто М.В.Ломоносовым (1738).
Перевод металла в пассивное состояние достигается не только при действии соответствующих окислителей (например, пассивация железа концентрированной азотной кислотой), но и др. способами, в частности, анодной поляризацией. Наиболее отчетливо это явление обнаруживается на потенциостатических кривых потенциал анода — плотность тока (типичная потенциостатическая кривая — см. рис.).
В области потенциалов, не очень удалённых от равновесного или стационарного потенциала металла в данных условиях, при смещении его в положительную сторону наблюдается увеличение скорости растворения металла в виде обычных для него ионов. Эта область потенциалов отвечает активному состоянию металла, когда он ведёт себя как растворимый анод.
При достижении некоторого значения потенциала (более положительного, чем исходная величина) плотность тока резко падает, что указывает на внезапное замедление процесса растворения. В довольно широких пределах потенциалов плотность тока , а следовательно, и скорость растворения почти не изменяются, оставаясь очень малыми.
Эта область потенциалов отвечает пассивному состоянию. Участок потенциостатической поляризационной кривой, соединяющей область активного состояния с областью пассивности, называется переходной областью.
Дальнейшее смещение потенциала в положительную сторону может привести к новому подъёму плотности тока и к увеличению скорости растворения. Эта зона потенциалов называется областью перепассивации или транспассивности.
Для неё характерно растворение металла в виде ионов более высокой валентности, чем при его растворении в активном состоянии. Таким образом, при изменении потенциала в сторону более положительных значений металл последовательно проходит через активное, переходное (или предпассивное), пассивное и транспассивное состояния.
Смещая потенциал от положительных значений к отрицательным, можно заставить металл пройти через те же состояния, но в обратном порядке. Для характеристики потенциостатической кривой наиболее важны точки перехода из одного состояния в другое.
Потенциал jп,при котором начинается переход металла из активного состояния в пассивное, называется потенциалом начала пассивации или потенциалом пассивации. При потенциале jакт металл уже пассивен.
Однако даже его незначительное отклонение в отрицательную сторону нарушает пассивное состояние, и металл начинает активироваться.
Потенциал jактназывают обычно потенциалом активации или Фладе-потенциалом (по имени немецкого учёного, обнаружившего его существование), причём последний термин часто употребляют и для потенциала пассивации jп .
Следующим характеристическим потенциалом является потенциал депассивации jдп, при котором металл из области пассивного состояния вступает в область транспассивности. Для каждой из областей потенциостатической кривой, разграниченных критическими точками, характерен свой закон измененияскорости растворения (изменения анодной плотности тока) с потенциалом. Область активного состояния отличается тем, что смещение потенциала в положительную сторону вызывает увеличение скорости растворения, т. е. наклон прямой di/dj > 0. В переходном состоянии скорость растворения уменьшается с ростом потенциала и di/dj < 0. В пассивном состоянии скорость растворения практически не зависит от потенциала и di/dj » 0. В транспассивном состоянии, так же как и в активном, di/dj > 0, но наклон оказывается обычно иным.
Область перепассивации (переход металла в новое активное состояние) наблюдается не всегда.
Тем не менее и в этих случаях после достижения некоторого значения потенциала обнаруживается подъем плотности тока, однако здесь он отвечает не возобновлению растворения металла, а началу выделения кислорода.
Известны также случаи, когда после перепассивации наступает вторая область пассивности, которая может затем смениться новым подъемом тока, связанным с растворением металла (в виде других ионов) или с выделением кислорода.
Детальное разграничение областей, отвечающих различным состояниям металла, сделалось возможным благодаря применению потенциостатического метода снятия поляризационных кривых.
Пока пользовались обычным гальваностатическим методом, удавалось обнаружить только внезапные изменения потенциала, которые при прямом (от малых плотностей тока к большим) и обратном (от больших плотностей тока к малым) снятии поляризационных кривых наступали не при одних и тех же плотностях тока, что указывало на существование каких-то гистерезисных явлений.
Основные закономерности перехода металла в разные состояния были исследованы многими авторами; следует указать на работы Г.А.Акимова, В.П.Батракова, Я.М.Колотыркина, Н.Д.Томашева, Пражека, Бонгофера, Франка, Штерна, Эделану, Окамото и др.
Явление перепассивации металлов было впервые количественно обосновано Батраковым (1953) и Томашевым (1954).
Колотыркин (1958) впервые снял полную потенциостатическую кривую и экспериментально доказал, что все переходы металла из одного состояния в другое можно получить как его поляризацией, так и введением в раствор различных окислителей, обеспечивающих создание соответствующих потенциалов. Он сделал весьма важный для теории пассивности вывод о том, что решающим фактором в установлении того или иного состояния металла является не природа окисляющего агента, а потенциал металла.
Для объяснения явления пассивности были предложены две теории — пленочная и адсорбционная.
В пленочной, или фильмовой теории пассивности (Кистяковский) предполагается, что переход металла из активного состояния в пассивное вызван образованием на его поверхности тонкого, обычно оксидного, слоя, отделяющего металл от окружающей среды и препятствующего его растворению.
Образующийся оксидный слой имеет толщину в несколько молекулярных слоев, и его можно рассматривать как фазовый оксид. Чем совершеннее структура оксидного слоя, чем меньше в нем разрывов и дефектов, тем полнее пассивация и тем меньше скорость растворения металла в пассивном состоянии.
Кистяковский, Изгарышев, Акимов экспериментально доказали существование поверхностных пленок фазового характера. Эвансу (1930) удалось, подбирая специальные растворы, отделить пленку от металла и сделать ее видимой.
Перепассивация по пленочной теории объясняется изменением состава и структуры поверхностного оксида в результате образования ионов более высокой валентности, что может привести к нарушению сплошности пленки. Защитное действие пленки при этом уменьшается, и снова становится возможным растворение металла, но уже при более положительных потенциалах и в виде ионов с большей валентностью.
Согласно адсорбционной теории наступление пассивного состояния не обязательно связано с образованием полимолекулярной оксидной пленки.
Оно может быть также достигнуто за счет торможения процесса растворения, вызванного адсорбированными атомами кислорода.
Адсорбированные атомы кислорода пассивируют металл, или создавая на его поверхности сплошной мономолекулярный слой, или блокируя наиболее активные участки поверхности, или изменяя величину скачка потенциала на границе металл — раствор.
Независимо от того, какую из этих теорий считать более справедливой, пассивное состояние должно быть связано с уменьшением скорости анодной реакции. Поэтому предложено определять пассивность как состояние повышенной устойчивости металла (сплава), обусловленное торможением анодного процесса (Н.Д.Томашев).
Следует упомянуть о питтинге и о потенциале питтингообразования jпит.
При потенциале jпит наблюдается резкий подъем тока, обусловленный крайне локализованным процессом растворения, при котором практически вся поверхность металла остается пассивной, а переход его ионов в раствор происходит при очень высоких плотностях тока в отдельных точках — питтингах (от англ. pit — булавочный укол). Обычно появление питтинга происходит в растворах, содержащих ионы хлора.
Аноды и анодный процесс
Применять растворимые аноды в хромировочных ваннах оказалось практически неудобным. Хромовые аноды нецелесообразно применять потому, что хром с них в несравненно большей степени переходит в раствор, чем осаждается на покрываемых предметах.
Кроме того, в зависимости от условий электролиза — температуры и плотности тока — хром переходит в раствор в виде ионов различной валентности; наконец, вследствие хрупкости самого металла аноды трудно поддаются механической обработке, в связи с чем не всегда возможно им придать должную форму.
Материалом для нерастворимых анодов могут служить платина, железо Армко и свинец. В полном смысле нерастворимой является только платина, но говорить о широком применении такого дорогого металла не приходится.
Железо и свинец частично растворяются в хромовой кислоте, но свинец выпадает в осадок в виде хромовокислого свинца (растворимость последнего незначительна), в то время как железо остается в растворе в виде феррихромата и, как было указано выше, является вредной примесью.
О растворимости железных анодов в хромировочной ванне можно судить по следующим данным: при пользовании для хромирования железными сосудами в качестве анодов концентрация железа в ванне после 1242 А-ч дошла в четырех случаях до 50 г/л и в пятом случае до 96,2 г/л. Правда, в этих опытах в раствор перешло такое большое количество железа вследствие большой анодной поверхности (малой анодной плотности тока), но и в других случаях растворение железа происходит в заметных количествах.
Если даже не учитывать растворения железа, то с точки зрения поддерживания выгодного равновесия между шести- и трехвалентным хромом в ванне предпочтительно применять свинцовые аноды.
Как известно, наряду с выделением металлического хрома на катоде происходит выделение водорода и частичное восстановление хромовой кислоты до низших степеней окисления.
На аноде же выделяется кислород и происходит окисление восстановленных продуктов. Многими исследованиями доказано, что окисление последних идет энергичнее именно на свинцовых анодах.
Это объясняется большим перенапряжением кислорода на свинце по сравнению с железом.
На окислительно-восстановительные процессы оказывает влияние также и площадь анодов или анодная плотность тока.
С точки зрения окислительной способности анодов лучше поддерживать на них низкую плотность тока, поэтому многие ученые рекомендуют применять аноды максимально допустимой поверхности. В табл.
46 приводятся результаты параллельного испытания при одинаковых условиях железных и свинцовых анодов разной площади.
Из данных табл. 46 видно, что по сравнению с материалом площадь анодов незначительно влияет на конечное равновесие.
Высокая температура и частые перерывы в процессе электролиза повышают содержание в ванне трехвалентного хрома. В случае накопления в ванне большого количества трехвалентного хрома его нетрудно окислить. Это обычно достигается завешиванием большого количества свинцовых анодов и случайных катодов (железных или медных листов) и пропусканием тока в течение нескольких часов.
В некоторых случаях, однако, свинцовые аноды неприемлемы вследствие высоких механических свойств свинца. Главным образом с этим приходится сталкиваться при хромировании внутренних поверхностей трубок небольшого диаметра.
Известно, что тонкую свинцовую проволоку нельзя сильно натягивать, следовательно, и центрировать ее трудно.
Лучшим металлом в таких случаях является платина, но по указанным уже выше соображениям широко пользоваться ею нельзя, почему и прибегают к стальной освинцованной проволоке.
На свинцовых анодах, особенно при частых и продолжительных перерывах в работе, образуется твердая корка хромовокислого свинца; эта корка оказывает значительное сопротивление прохождению тока и этим обусловливает повышенное рабочее напряжение. Во избежание образования такой корки рекомендуется на ночь оставлять аноды в воде, а для снятия уже образовавшейся корки — чистка стальной щеткой или травление в растворе слабой соляной кислоты.
Большое распространение получили аноды из сплава свинца с 6—8% Sb. Стойкость таких анодов в хромовой кислоте выше, чем чистого свинца.
Для хромирования больших поверхностей применяют свинцовые листы, просверленные в нескольких местах для свободной циркуляции электролита. Толщина анодов, в зависимости от остальных размеров, бывает 3—6 мм.






