- Бром
- Бром: история, структура, электронная конфигурация, свойства, применение
- Содержание:
- История
- Карл Лёвиг
- Работа Антуана Балара
- Строение и электронная конфигурация брома
- Молекула
- Кристаллы
- Химический элемент бром (Br) — характеристика, строение и свойства неметалла » ГДЗ онлайн
- Определение и физическая характеристика
- Химическое строение и свойства
- Нахождение в природе
- Промышленное получение
- Применение вещества
- Бром в организме
- Опасность и вред
- Признаки избытка и нехватки
Успокаивает и спасает от пожара.
Обычно первооткрыватели называли новый химический элемент в честь какого-нибудь мифического персонажа или же в его названии старались отразить некоторое характерное свойство элемента и его соединений, например, цвет или запах.
Но часто ли вам попадались случаи, когда кого-то или что-то называли в честь химического элемента? Да, можно привести примеры, когда элемент и чьё-то имя имеют один и тот же общий корень, например: элемент селен и женское имя Селена, имя Арсений и латинское название мышьяка – арсеникум.
Но вот случаи, чтобы кто-то назвал, скажем, своего любимого котика молибденом или гадолинием, весьма и весьма редки.
Тем удивительнее, что имя химического элемента из группы галогенов гордо носила одна из любимых такс Антона Павловича Чехова – Бром, а точнее Бром Исаевич, как уважительно величал её великий русский писатель, драматург и немного врач.

Памятник любимым таксам Антона Павловича Чехова: Брому Исаевичу и Хине Марковне. Чеховский район, село Мелихово. Alex Boss57/Wikimedia Commons CC BY SA 3.0
Кстати, вторую таксу звали Хина Марковна – в честь известного лекарства против малярии, содержащего хинин, а в обиходе называвшегося просто хиной.
Учитывая долгие и непростые отношения Чехова с медициной, в такой кличке для собаки нет ничего удивительного.
Но почему тогда Бром? Особенно если вспомнить, что в переводе с греческого бром – означает «зловоние». Неужели Бром Исаевич источал настолько дурной дух?
Конечно, мы не можем доподлинно знать, как и почему четвероногим друзьям Чехова были даны такие имена, но учитывая, насколько тепло относился Антон Павлович к своим таксам, позволяя им носиться по комнатам зданий мелиховской усадьбы, вряд ли Брома Исаевича объединяли с бромом греческие корни. А вот отсылка к названию лекарств вполне могла иметь место, тем более что в то время были широко распространены седативные препараты, содержащие бром.
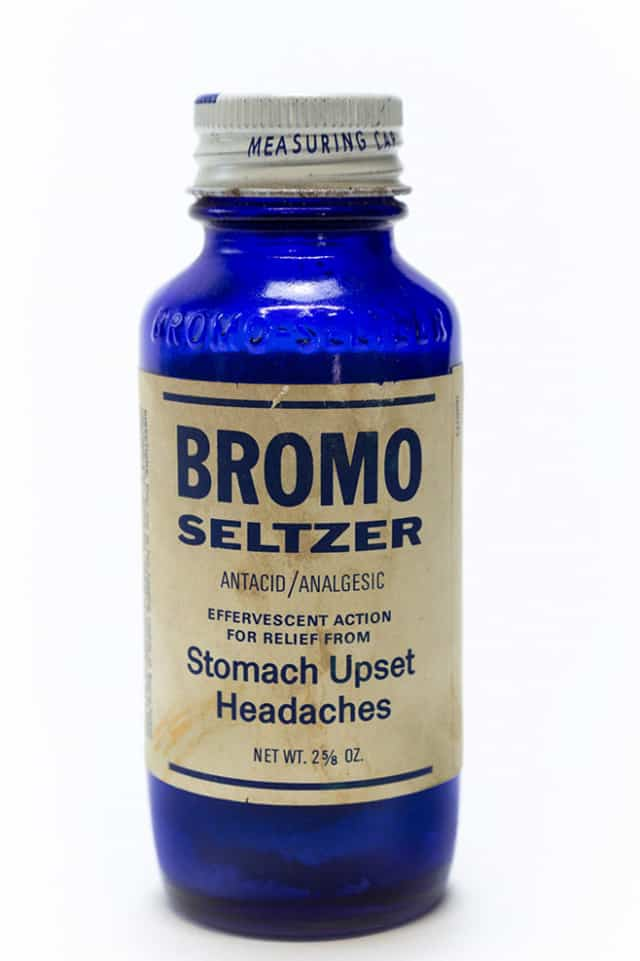
В состав обезболивающих препаратов, выпускавшихся под маркой Bromo-Seltzer, на ранних этапах входил бромид натрия. Cindy ShebleyFlickr.com CC BY 2.0
Бромиды натрия и калия с середины XIX века и вплоть до века двадцатого использовались в качестве противосудорожных и седативных средств. До изобретения фенобарбитала бромид калия был фактически единственным эффективным препаратом для лечения эпилептических припадков. Однако у бромидов есть один неприятный побочный эффект.
При бесконтрольном потреблении они способны накапливаться в организме и уже сами становятся причиной болезненного состояния, получившего название «бромизм». Из-за этого бромиды постепенно были вытеснены более эффективными и менее опасными веществами, хотя кое-где их и продолжают использовать до сих пор, например, в ветеринарии.
Но если в современной аптечке соединений брома уже не встретишь, то это совсем не означает, что бром ушёл от нас насовсем. Конец двадцатого и уж тем более двадцать первый век ознаменовался обширной экспансией пластика в нашу жизнь – полимеры окружили нас со всех сторон, заметно потеснив привычные нам уже на протяжении столетий материалы вроде металлов, бумаги или тканей.
Но кроме прекрасных технологических свойств, есть у полимеров и своя тёмная сторона, и это не только сотни миллионов тонн пластиковых отходов в мировом океане.
Большинство полимеров – это весьма горючие вещества, особенно это касается так называемых «пенопластов», которые широко используются в качестве утеплительных материалов.
В результате время от времени мы становимся свидетелями страшных кадров, когда современное вроде бы бетонное здание с утеплёнными навесными фасадами вспыхивает как спичка. Но в таких трагических случаях виноват не только пластик.

Некачественные пластики при пожаре горят и выделяют токсичные вещества. Alan Levine/Flickr.com
Дело в том, что даже горючий материал можно сделать пожаробезопасным, если добавить в него определённые соединения. Их роль состоит в том, чтобы гасить зарождающееся пламя – не в том смысле, что заливать его водой и лишать доступа кислорода, а на «химическом» уровне, связывая активные частицы, способствующие горению. Такие вещества получили название антипирены.
Если в состав полимерного материала добавить антипиренов, то можно не только снизить горючесть, но и вовсе сделать материал неподвластным огню. По крайней мере, вы уж точно не сможете поджечь его спичками. Одни из распространённых антипиренов – это как раз таки соединения брома.
Добавки этих веществ делают пластики менее горючими, давая тем самым спасительные секунды, а то и минуты, в случае пожара. Хотя у бром-содержащих антипиренов тоже есть свои недостатки.
Многие из этих соединений совсем не полезны для здоровья, и от долгого контакта или при неправильном использовании могут нанести вред.
Поэтому исследователи стремятся разрабатывать новые композиции, которые сочетают и эффективность в борьбе с огнём, и не представляют опасности для здоровья людей.

Детские автомобильные кресла должны одновременно не гореть и не выделять вредных веществ, поэтому к выбору антипиренов для них нужно подходить очень ответственно. Chris Scheufele/Flickr.com CC BY-NC-SA 2.0
У брома и некоторых его органических соединений есть ещё одно интересное свойство, на этот раз относящееся больше к физике, чем к химии. Самый обычный бром при комнатной температуре представляет собой бурую жидкость.
Что тут необычного, спросите вы? Но из всей Периодической системы, лишь только два элемента в виде простых веществ могут находиться в жидком состоянии при комнатной температуре.
Все остальные – либо твёрдые вещества, либо газы.
На всякий случай напомним, что простым называется такое вещество, в состав которого входят атомы только одного типа.
Например, газы водород и кислород – это простые вещества, а вот вода, молекулы которой состоят из атомов водорода и кислорода, уже нет.
Но кроме того, что бром – жидкость, это ещё очень тяжёлая жидкость или, другими словами, это жидкость с высокой плотностью. Жидкий бром в три раза тяжелее обычной воды, а это значит, что в нём, к примеру, не утонет обычный кирпич.
Высокая плотность у жидкости – весьма ценное свойство, которое используется при переработке добытых минералов. Но чистый бром не подходит для таких целей, потому что он не только химически активен, но ещё и очень ядовит. А вот целый ряд соединений брома с простыми углеводородами хоть и обладает чуть меньшей плотностью, зато намного более безопасны в плане применения.

Бром – одно из двух простых веществ, жидкое при комнатной температуре, а ртуть – второе. methodshop/Flickr.com CC BY-SA 2.0
А в завершение расскажем, как бром и ещё одно вещество могут помочь нам с хранением электроэнергии. За последние лет двадцать производительность компьютеров сделала просто колоссальный рывок вперёд, сравнимый с переходом от гужевой повозки к космической ракете.
Но если мы посмотрим, как эволюционировали литиевые аккумуляторы, рабочие лошадки всех мобильных и не очень устройств, то разница будет примерно как между телегой и каретой: отличия, конечно, есть, но это всё те же четыре колеса на конной тяге. Поэтому не удивительно, что исследователи всего мира уже давно ищут альтернативные способы хранения и генерации электрической энергии.
Один вариант выхода из «литиевого тупика» – это проточный аккумулятор. Его принцип действия основан на электрохимическом взаимодействии двух разных жидкостей, разделённых мембраной. Через мембрану жидкости обмениваются ионами, например, ионами водорода. А через погружённые в них электроды – электронами.
У этих батарей есть два больших плюса: во-первых, они очень долговечны и могут выдерживать число циклов зарядки и разрядки, недоступное пока большинству других типов аккумуляторов. А во-вторых, быстро «перезарядить» такой аккумулятор можно просто подключив к нему резервуары со свежими реагентами, таким же образом можно и увеличить их суммарную мощность, добавив побольше баков.
Недостатки логичным образом вытекают из достоинств – такие конструкции занимают много места, поэтому мобильными их пока не назовёшь. Но для накопления энергии от солнечных панелей или ветряков подходят самым лучшим образом.

Цинк-бромные проточные аккумуляторы. Simonhackett/Wikimedia Commons CC BY-SA 4.0
Исследователи из Гарвардского университета несколько лет назад сделали проточный аккумулятор, который работает не на дорогостоящем ванадии, а на более дешёвых броме и хиноне.
Наш бром, конечно, экологичным материалом не назовёшь, а вот целый ряд хинонов (это не одно вещество, а целый класс) уже можно выделять из растений, например, из обычного ревеня. Поэтому, если найти безопасный аналог брома, то «зелёный» проточный аккумулятор – не такая уж и фантастика.
Вот такой вот интересный путь от Брома с Хиной в чеховской усадьбе, до брома с хиноном в проточном аккумуляторе.

Лабораторный проточный аккумулятор на основе раствора хинона и жидкого брома. M.J. Aziz/Harvard University.
#периодическая система элементов #бром #галогены
Максим Абаев
Бром
БРОМ, Br, атомный вес 79,92, химический элемент галоидной подгруппы VII группы периодической системы (порядковый номер 35); отличается от остальных галоидов отсутствием соединения типа R2О5 и свойствами промежуточными между хлором и йодом.
Бром — тяжелая черно-бурая, прозрачная лишь в тонких слоях жидкость, дающая оранжево-бурые пары с крайне удушливым запахом, откуда произошло название: по-гречески: — зловонный. D04 = 3,188, D420= 3,12, температура плавления -7,25°, температура кипения 58,7°.
Упругость пара:
Бром растворим в воде и дает с ней два слоя:
Присутствие хлора и растворенных солей (натриевых, аммонийных и особенно бромистых) повышает растворимость брома. Бром растворим в целом ряде органических галоидопроизводных, в минеральных галоидангидридах, в жидком сернистом ангидриде и т. д.
Бром очень легко соединяется с другими элементами и соединениями, в особенности с калием, фосфором, оловом, причем происходит вспышка и бром разбрызгивается; более или менее медленно он действует на все металлы и органические соединения, но особенно легко присоединяется к ненасыщенным.
Он сильно разъедает кожу, и пораженные места трудно залечиваются; в смеси с воздухом (даже 1 : 100000) бром очень вредно действует на слизистые оболочки. Основные запасы природных соединений брома находятся в морской воде, где на 1 м3 приходится 54 г брома в виде бромистых солей. Бромом всегда сопровождается хлор в соляных источниках.
Бром содержится в морских растениях и животных, особенно в красящем веществе пурпурных улиток (Purpura, Muricidae) (бром-индиго с 40% брома).
Бром идет преимущественно на приготовление бромистых солей для фотографии, для изготовления многих органических соединений, особенно красящих веществ (например, эозина), имеет применение в лабораторной практике; и т. д.
При добыче брома приходится считаться с весьма малым содержанием его в растворах; например, в Стассфурте в «конечном растворе» содержится лишь 2—4,5 г брома при содержании почти 400 г хлористых солей в 1 л.
Поэтому при выделении свободного брома приходится пользоваться действием хлора, который или готовят в том же сосуде, где находятся бромистые щелока, или в отдельных приборах, или же, наконец, пользуются готовыми бомбами с хлором.
В Германии приняты следующие сорта брома: 1) «сырой», с 2—5% хлора, 2) «очищенный» (рафинированный), не больше чем с 0,3%: хлора, 3) химически чистый бром, иногда содержащий небольшое количество органических бромопроизводных.
Месторождения и промышленная обработка брома. Бром содержится гл. обр. в морской воде (в 1 м3 воды до 54 г брома). В Мертвом море (Палестина) содержится в 1 м3 воды (удельный вес 1,2) около 4,8 кг брома.
Равным образом значительное количество брома находится в соленых озерах, наземных и подземных, образовавшихся вследствие испарения воды из отделившихся от моря мелководных бассейнов (озера в штатах Мичиган, Огайо, Пенсильвания и Виргиния США, подземное озеро Sebka-el-Melah около Larzis в 600 км к югу от Туниса).
К такому же типу озер относятся те соленые озера в СССР, которые являются или могут являться источниками для добывания брома (Сакское озеро близ Евпатории, разрабатываемое ныне в промышленном масштабе, расположенное близ него Сасык-Сивашское озеро и некоторые озера близ Баку).
Но наиболее богатым источником для добывания брома являются калиевые месторождения: Стассфуртские в Германии и в особенности Соликамские в СССР. Кроме того, можно рассчитывать на получение брома из калиевых месторождений в Эльзасе, в которых обнаружен сильванит с содержанием до 0,3% брома. Впервые с промышленной целью стали разрабатываться Стассфуртские месторождения брома.
Германское общество «Deutsche Bromkonvention», конкурируя с возникшими позднее американскими предприятиями «Associated American Producers», понизило цену на бром с 95 марок до 0,70 марок за 1 кг в 1909 г. Эта цена, однако, поднялась в 1913г. до 2 марок за 1 кг.
Испытывая острую нужду в броме во время войны французская промышленность обратилась к использованию тунисских месторождений брома: в 1916 г. близ озера Sebka был выстроен завод с производством до 850 т брома. При тех же условиях был организован бромный завод в Саках, добыча которого, возрастая с каждым годом, в последний год приблизилась к удовлетворению потребности брома во всесоюзном масштабе (80—100 т в год) как для медицинских, так и для промышленных целей, а на предстоящий операционный год сможет даже с избытком покрыть эту потребность.
Однако рост производства кинопленок и фотографических пластинок и бумаги, требующих для эмульсии соединений брома, вызывает необходимость увеличения выработки брома в СССР, что является вполне возможным как путем эксплуатации соседнего с Сакским озером Сасык-Сивашского озера (устройство «солепровода»), так и в особенности организацией извлечения брома из колоссальных по своей мощности залежей Соликамского карналлита, содержащего около 0,25—0,30% брома в виде магнезиальной соли (MgBr2∙6Н2О).
Производство брома в промышленном масштабе основано на следующих двух принципах: 1) вытеснение брома при помощи газообразного (или, вернее, жидкого) хлора с последующей отгонкой брома водяным паром в виду его крайне легкой летучести (температура кипения 58,7°); 2) получение брома с помощью электролиза бромистых соединений.
Очевидно, что рентабельность первого способа находится в зависимости от цены жидкого хлора, а рентабельность второго способа — от стоимости гидроэлектрической энергии. Электролитический бром (метод Kossuth’а – электролиз без диафрагмы) чище и содержит весьма незначительную примесь хлора, но настолько дорог, что не выдерживает конкуренции с бромом, полученным методом вытеснения при помощи хлора.
Последний метод, разработанный Кубиршским, принят в Германии и у нас на Сакском заводе. В колонну из кварцита или лавы впускают сверху подогретый раствор, содержащий бромистые соли, снизу — водяной пар, а в середине колонны — хлор. Последний выделяет из бромистых соединений бром, который с водяными парами и небольшим количеством хлора выходит из верхней трети колонны.
Возможность падения тяжелых паров брома внутри колонны исключена благодаря устройству промежуточных пластин Лунге-Бормана, из которых сложена колонна. Выходящие пары сгущаются в змеевике и собираются в делительном сосуде в виде нижнего слоя брома и верхнего — «кислотного» слоя. По цвету последнего можно следить за правильностью хода процесса.
Полученный бром содержит немного хлора и направляется в очистную (рафинировочную) башню, устроенную почти так же, как предыдущая, но меньшего размера и с подогревом снизу, откуда и вытекает бром, почти лишенный хлора. Розлив брома должен производиться осторожно, т. к. пары его очень вредны.
Бром обычно сохраняют в синих стеклянных бутылях с хорошо притертыми пробками, причем в бутыли помещается около 2,5—3,5 кг; бутыли ставят в хорошо вентилируемом помещении. При пересылке притертые пробки залепляются глиной и обертываются растительным пергаментом.
Американские методы получения брома скрыты, но они немногим отличаются от стассфуртского. Кроме того в Америке (Мичиган) применяется также и электролитический метод («Dow Chemical Company», Midland). Русский инженер Б. Г. Пантелеймонов предложил метод извлечения брома углеводородами (такой же метод был предложен в Англии Велярди).
В своей статье Пантелеймонов приводит интересный факт экспедиции американского судна-завода фирмы «Ethyl Gasolin Corporation» для извлечения экстракционным методом бром непосредственно из морской воды, причем в случае удачи имелся в виду охват всего мирового рынка по снабжению бромом.
Перегонные колонны и аппаратура изготовлены из вулканической лавы, весьма стойкой по отношению к действию брома. Имеются Ам. патенты «Dow Chemical Company» извлечения брома из смеси брома и хлора (Ам. П. 1 376 610, 1921 и Ам. П. 1 386 117, 1921).
Транспортирование брома в больших сосудах было чрезвычайно опасно, ибо бром невозможно было, подобно хлору, наливать в железные сосуды (бром, в противоположность хлору, хотя и медленно, но все же разъедает железо при отсутствии даже следов влаги). Лишь с 1917—18 гг. найден способ применения металлической тары для брома.
В виду изложенного, бром обычно транспортируется не в свободном виде, а в виде железной бромисто-бромной соли (Fe3Br8) с содержанием 80% брома и 20% железа. Из этой соли на фармацевтическом заводе вырабатывают бромистый натрий, бромистый калий, бромистый аммоний и другие бромистые соединения, применяемые для фотографии и медицины.
В продаже существуют следующие препараты брома: 1) Бром свободный (разной степени чистоты), 2) бромистое железо (вернее, бромисто-бромное железо Fe3Br8 = Fe2Br6 + FeBr2), 3) смесь бромистых солей (приблизительно следующего состава: 2NaBr + 1 NaBrО3); последняя смесь применяется при экстрагировании золота в золотопромышленности.
Источник: Мартенс. Техническая энциклопедия. Том 2 — 1928 г.
Бром: история, структура, электронная конфигурация, свойства, применение
Бром: история, структура, электронная конфигурация, свойства, применение — Наука
Содержание:
В бром Это неметаллический элемент, который принадлежит к группе галогенов 17-й группы (VIIA) Периодической таблицы. Его химический символ — Br. Он выглядит как двухатомная молекула, атомы которой связаны ковалентной связью, для которой ему присвоена молекулярная формула Br.2.
В отличие от фтора и хлора, в земных условиях бром представляет собой не газ, а красновато-коричневую жидкость (изображение ниже). Он дымится и вместе с ртутью — единственные жидкие элементы. Под ним йод, хотя он становится более ярким и пурпурным, может кристаллизоваться в летучее твердое вещество.
Бром был открыт независимо в 1825 году Карлом Лёвигом, который учился под руководством немецкого химика Леопольда Гмелина; а в 1826 году французским химиком Антуаном-Жеромом Баларом. Однако публикация экспериментальных результатов Баларда предшествовала публикации Лёвига.
Бром — 62-й по величине элемент на Земле, в низких концентрациях он распространяется по всей земной коре. В море средняя концентрация составляет 65 промилле. В организме человека содержится 0,0004% брома, его функция точно не известна.
Этот элемент коммерчески используется в рассолах или местах, которые в силу особых условий являются местами с высокой концентрацией солей; например, Мертвое море, к которому сходятся воды соседних территорий, насыщенное солями.
Это коррозионный элемент, способный разъедать такие металлы, как платина и палладий. Растворенный в воде бром также может оказывать разъедающее действие на ткани человека, усугубляя ситуацию, поскольку может образовываться бромистоводородная кислота. Что касается его токсичности, он может нанести значительный ущерб органам, таким как печень, почки, легкие и желудок.
Бром очень вреден для атмосферы, он в 40-100 раз более разрушителен для озонового слоя, чем хлор. Половина потери озонового слоя в Антарктиде происходит в результате реакций, связанных с бромметилом, соединением, используемым в качестве фумиганта.
Он имеет множество применений, таких как: антипирен, отбеливающий агент, средство для дезинфекции поверхностей, добавка к топливу, промежуточный продукт при производстве седативных средств, при производстве органических химикатов и т. Д.
История
Карл Лёвиг
Бром был открыт независимо и почти одновременно немецким химиком Карлом Якобом Лёвигом в 1825 году и французским химиком Антуаном Баларом в 1826 году.
Карл Лёвиг, ученик немецкого химика Леопольда Гмелина, собрал воду из источника в Бад-Кройцнах и добавил в нее хлор; После добавления эфира жидкую смесь перемешивали.
Затем эфир отгоняли и концентрировали упариванием. В результате он получил красновато-коричневое вещество, которым был бром.
Работа Антуана Балара
Балард, со своей стороны, использовал золу бурых водорослей, известных как фукус, и смешал их с рассолом, добытым из солончаков Монпелье. Таким образом, он высвободил бром, заставив хлор пройти через водный материал, подвергнутый экстракции, в котором присутствовал бромид магния, MgBr.2.
Впоследствии материал перегоняли в присутствии диоксида марганца и серной кислоты, в результате чего выделялись красные пары, которые конденсировались в темную жидкость. Балард подумал, что это новый элемент, и назвал его муридом, производным от латинского слова muria, которое использовалось для обозначения рассола.
Было отмечено, что Балард изменил название с мурида на бром по предложению Англада или Гей-Люссака, основываясь на том факте, что бром означает фол, что определяет запах обнаруженного элемента.
Результаты были опубликованы Белардом в Annales of Chemie and Physique до того, как Лёвиг опубликовал свои.
Только с 1858 г. стало возможным производить бром в значительных количествах; Год открытия и эксплуатации солевых месторождений Штасфурт, в которых в качестве побочного продукта получения поташа был получен бром.
Строение и электронная конфигурация брома
Молекула
На верхнем изображении показана молекула брома Br2, с компактной моделью наполнения. На самом деле между двумя атомами брома существует одинарная ковалентная связь, Br-Br.
Будучи гомогенной и двухатомной молекулой, она не имеет постоянного дипольного момента и может взаимодействовать с другими молекулами того же типа только с помощью лондонских дисперсионных сил.
Это причина того, что его красноватая жидкость дымится; в молекулах Br2Хотя они относительно тяжелые, их межмолекулярные силы свободно удерживают их вместе.
Бром менее электроотрицателен, чем хлор, и поэтому менее привлекательно влияет на электроны в валентных оболочках. В результате ему требуется меньше энергии для прохождения более высоких энергетических уровней, поглощения зеленых фотонов и отражения красноватого цвета.
Кристаллы
В газовой фазе молекулы Br2 они значительно расходятся, пока между ними не происходит эффективного взаимодействия. Однако при температуре ниже точки плавления бром может замерзнуть с образованием красноватых кристаллов ромбической формы (верхнее изображение).
Обратите внимание, как молекулы Br2 они аккуратно расположены таким образом, что выглядят как «бромные черви». Здесь и при этих температурах (T
Химический элемент бром (Br) — характеристика, строение и свойства неметалла » ГДЗ онлайн
В 1826 году химик из Франции Антуан Жером Балар открыл новый химический элемент бром (Br). Это случилось при изучении рассолов соляных промыслов Средиземноморья.
Жидкость обладала крайне неприятным запахом, за что и получила своё название, происходящее от греческого слова bromos — зловоние.
Открытие сделало преподавателя колледжа всемирно известным, а вещество было внесено в периодическую таблицу Менделеева.
Определение и физическая характеристика
Бром, обозначаемый символом Вг, является галогеном и входит в VII группу периодической таблицы химических элементов. Вещество имеет атомный номер 35, а его атомная масса составляет 79,904 дальтонов.
Молярная масса составляет 79,904 г/моль. Относительная молекулярная масса молекулы равна 159,808, а её молярная масса — 160 г/моль.
Бром, встречающийся в природе, состоит из двух нуклидов с массовыми числами 79 и 81.
Существует множество искусственных радиоактивных изотопов. Среди них самым интересным считается 80Вr, поскольку на его примере советский физик И. В. Курчатов открыл изомерию атомных ядер.
Вещество представляет собой жидкость красно-бурого оттенка, отличающуюся сильным неприятным запахом. Температура застывания брома составляет -7,2°С. Замёрзший элемент имеет форму красно-коричневых игольчатых кристаллов, блестящих как металл. Кипит элемент при температуре 58,78 °С, превращаясь в пар жёлто-бурого цвета. Плотность вещества в жидком виде — 3,1 г/см3.
Бром плохо растворяется в воде. Так, если её температура не превышает 5,84 °С, то вещество образует тёмно-красные кристаллы. Лучше всего для его растворения подходят органические составы. Извлекать элемент из различных водных соединений позволяет именно это физическое свойство.
Бром в любом физическом виде состоит из двухатомных молекул. Распад на атомы становится хорошо заметен при температуре 800 °C. Но также его можно наблюдать при действии света.
Химическое строение и свойства
Внешние электроны атома имеют конфигурацию 4s24p5. Необходимо отметить, что такое химическое свойство брома, как степень окисления, разнится в зависимости от соединения, к примеру, у гипобромитов этот показатель равен +1, а у броматов он составляет +5.
В соединениях валентность брома переменна. Атом вещества имеет заряд только тогда, когда является ионом, заряд ядра атома составляет 35. Представить электронную формулу брома можно следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5. Структурная же формула имеет вид: Br-Br.
Неметалл является химически активным, а потому по способности к реакции располагается между хлором и йодом. Сильное разогревание, иногда сопровождающееся горением, возникает, когда вещество взаимодействует со следующими реагентами:
- сера;
- селен;
- теллур;
- фосфор;
- мышьяк;
- сурьма.
Так же протекает реакция вещества с некоторыми металлами, к примеру, калием и алюминием. Но большинство металлических элементов плохо реагирует с безводным бромом, потому что на их поверхности образуется защитная плёнка бромида, который не растворяется в этом реагенте.
Самыми устойчивыми к такой реакции, даже при высокой температуре и наличии воды, считаются следующие металлы:
- платина;
- свинец;
- серебро;
- тантал.
У золота с бромом взаимодействие проходит довольно активно. Кислород, азот и углерод не создают с элементом прямых соединений даже при повышенной температуре.
Чтобы эти вещества соединились, химики применяют различные косвенные методы. К примеру, очень непрочный оксид Вr3О8 получают посредством воздействия озона на бром при 80 °C.
Реагировать непосредственно с элементом способны галогены, в результате их взаимодействия образуются BrF3, BrCl и другие соединения.
Бром относится к сильным окислителям. Элемент способен вытеснить из химических соединений йод. Само же вещество подвергается вытеснению хлором и фтором.
Выделить чистый неметалл из бромидов на основе воды можно посредством использования сильных окислителей, поместив все реагенты в кислую среду. Растворяясь в воде, вещество вступает с нею в слабую реакцию, результатом которой становится образование бромистоводородной и бромноватистой кислот. Водный раствор элемента называется бромной водой.
Неметалл растворяется в щелочах:
- При низких температурах соединение брома и гидроксидов даёт бромиды и гипобромиты.
- При температуре около 100 °C получаются бромиды и броматы.
Взаимодействие брома и органических соединений чаще всего проходит с характерным присоединением углерода по двойной связи и замещением водорода. Обычно это происходит при воздействии различных катализаторов или света.
Ещё одной распространённой химической реакций является бромирование, суть которого заключается во введении атома реагента в соединение посредством химической реакции вещества с ненасыщенной молекулой или замещения водорода.
Нахождение в природе
Основная часть природного брома рассеяна в земной коре. Больше всего вещества содержится в породах, сформированных магмой. Этот элемент можно обнаружить рядом с хлором. Так, соли элемента встречаются в солевых хлорных отложениях, в морской воде, насыщенном растворе соляных озёр и рассолах, находящихся под землёй, которые зачастую связаны с месторождениями соли и нефти. Так как вещество хорошо растворяется в воде, его соли скапливаются в рассолах, оставшихся на месте озёр и заливов.
Неметалл перемещается в форме хорошо растворимых соединений, а потому его довольно сложно встретить в твёрдой минеральной форме. Минералами становятся бромирит AgBr, эмболит Ag (Cl, Вг) и йодэмболит Ag (Cl, Вr, I), которые образуются в зонах окисления сульфидных месторождений серебра, сформировавшихся в областях пустынь и полупустынь.
Промышленное получение
В промышленности для получения брома используют морскую воду, озёрные и подземные рассолы, а также калийные щёлоки. Для выделения вещества применяют хлор. Процедура состоит из следующих этапов:
Метод с применением воздуха позволяет получать бром из рассолов даже с небольшим количеством вещества. Применять к таким смесям паровой способ экономически невыгодно, поскольку на выделение малого количества реагента тратится значительное количество пара.
Применение вещества
Прежде всего, вещество является основой для создания бромистых солей и различных производных на основе органики. Но и сам реактив, и его соединения довольно широко используются во многих областях жизнедеятельности человека:
- Органические бромиды — синтезирование красителей и лекарств.
- Бромиды щелочных металлов — успокоительные препараты, используемые для лечения неврозов, повышенной раздражительности, гипертонии, эпилепсии.
- Бромид серебра — фотография.
- Бром — изготовление бромистого этила и дибромэтана, участвующих в производстве этиловой жидкости, которую добавляют к бензинам, чтобы снизить их способность к детонации.
- Бромистый метил — инсектициды.
- Органические соединения вещества — производство эффективных огнетушителей.
- Бромная вода — химические анализы, позволяющие определять многие вещества.
Бром в организме
Вещество содержится в тканях всех животных и растений. Его обнаружили практически во всех жидкостях тела. Если человек здоров, то в его организме уровень брома составляет от 0,11 до 2,00 мг/%. Для поддержания этого показателя в сутки необходимо получать не больше 0,8−1 г реактива.
Радиоактивный бром позволил выявить, что вещество поглощается щитовидной железой, почками и мозгом. Бромиды, которые были введены в животные организмы, увеличили концентрацию процессов торможения, проходящих в головном мозге. Они способствовали приведению в норму нервной системы, которая пострадала от чрезмерного напряжения, возникшего в результате подобного процесса.
Но следует учитывать, что химический элемент задерживается в щитовидной железе, вступая в конкуренцию с йодом. Это влияет на работу органа, что отражается на обмене веществ.
Бром плохо усваивается, если в реакции будут участвовать хлор, алюминий, йод и фтор. Чтобы избежать такой ситуации, перед началом лечения препаратами, содержащими бромные соли, необходимо проконсультироваться с врачом.
Опасность и вред
Элементарный бром представляет собой сильнодействующий яд, отнесённый ко второму классу опасности. Его ни в коем случае нельзя принимать внутрь.
Очень опасны пары вещества:
- При концентрации 1 мг/м3 и более газ вызывает кашель, насморк, кровотечение из носа, головокружение и головную боль.
- При концентрациях, превышающих указанный порог, у человека может начаться отёк лёгких, удушье, бронхит, в некоторых случаях возможен смертельный исход.
- Максимальное допустимое значение — 2 мг/м3.
Во избежание отравления все работы с реагентом необходимо осуществлять в специальных шкафах, оборудованных хорошей вытяжной системой.
Если же защититься от паров не удалось, то следует подышать сильно разбавленным водным раствором аммиака, возможно применение раствора на этиловом спирте.
Для устранения боли в горле, возникшей из-за воздействия отравляющего газа, нужно выпить хорошо нагретое молоко.
В жидком виде попавшее на кожу вещество вызывает ожоги, которые плохо заживают. В случае поражения кожи реагент необходимо тщательно смыть большим количеством воды или сдуть мощной воздушной струёй. Место ожога следует смазать ланолином.
Представителям профессий, требующих постоянной концентрации внимания, к примеру, водителям и альпинистам, применять лекарства на основе брома не рекомендуется. Это обусловлено свойством вещества снимать возбуждённое состояние нервной системы, расслаблять её.
Признаки избытка и нехватки
Чаще всего переизбыток вещества в организме возникает при неправильном употреблении бромосодержащих препаратов. Это состояние может привести к серьёзным проблемам со здоровьем. Признаки избытка микроэлемента:
- Кожные воспаления и высыпания.
- Нарушения в работе пищеварительной системы.
- Ощущение усталости, вялости и подавленности.
- Частые бронхиты и риниты при отсутствии простудных и вирусных заболеваний.
Нехватка брома не менее серьёзная проблема. Из-за отсутствия в организме необходимого количества вещества у беременных женщин повышается вероятность выкидыша на разных сроках.
Проявляться недостаток микроэлемента может в виде таких симптомов:
- бессонница;
- замедление роста у детей;
- понижение уровня гемоглобина.
Эти проблемы редко ассоциируются именно с нехваткой брома, но всё же лучше обратиться к врачу и сдать необходимые анализы. Такая мера позволит установить причину недомогания и исключить возможность развития более серьёзных заболеваний.
Бром является важным химическим элементом. Он необходим для нормальной жизнедеятельности растений и животных. Недостаток этого неметалла, как и его избыток, может привести к развитию заболеваний. Кроме того, вещество активно применяется в различных сферах деятельности человека. На его основе создаются лекарственные препараты, химические реагенты и инсектициды.






